recursos paraProfesionales
Últimas publicaciones comités científicos
INMUNOTERAPIA CON VENENO DE HIMENÓPTEROS: TIPOS DE EXTRACTOS ALERGÉNICOS
| EXTRACTOS ACUOSOS (NATIVOS) | EXTRACTOS DEPOT
(ADSORBIDOS) |
|
| Composición | Veneno liofilizado reconstituido en solución salina. | Veneno adsorbido en adyuvantes (hidróxido de aluminio) |
| Liberación | Rápida. | Lenta y sostenida. |
| Seguridad | Mayor tasa de reacciones locales*. | Menor tasa de reacciones locales*. |
| Pauta de administración | Convencionales o rápidas. | Agrupadas o rápidas. |
| Forma de aplicación | Subcutánea | Subcutánea |
Tipos de extractos utilizados en inmunoterapia frente a veneno de himenópteros.
Evolución de la inmunoterapia con alérgenos
Desde la publicación de Leonard Noon en 1911, en la que describió el efecto beneficioso de las inyecciones subcutáneas con extracto de polen de gramíneas sobre sí mismo, se utilizan los extractos nativos. Estos extractos inicialmente contenían partículas no alergénicas junto con las proteínas alergénicas. En la UE, se establecen procesos de estandarización que consisten en la purificación de los extractos nativos para que únicamente se mantengan las proteinas alergénicas de la fuente alergénica madre, eliminando así contaminantes y asegurando que el contenido proteico sea consistente entre diferentes lotes de inmunoterapia.
Así empezó el inicio de la inmunoterapia con alérgenos específicos utilizando extractos acuosos de fuentes alergénicas hasta 1930, que con la intención de mejorar la seguridad se introdujo una primera modificación física (extractos Depot) como el hidróxido de alumunio y otros adyuvantes que además de mejorar la seguridad, aumentaban tambien la inmunogenicidad del contenido alergénico sin necesidad de aumentar la cantidad de alérgeno.
Sin embargo, estos extractos Depot continuaron asociando reacciones sistémicas. Para superar esta desventaja, en la década de 1960 se desarrollaron extractos alergénicos modificados químicamente con glutaraldehído y otras con formaldehído con el objetivo de disminuir aún más la alergenicidad de la inmunoterapia con alérgenos mientras mantienen su eficacia clínica o inmunogenicidad, conocidos como extractos alergoides. Los extractos alergoides permitían aumentar el contenido de alérgeno para mejorar la dosis eficaz, manteniendo un muy buen perfil de seguridad con un porcentaje muy bajo de reacciones sistémicas.
Recientemente, se han desarrollado las inmunoterapias moleculares que debido a la alta sensibilizacion de pacientes alérgicos a uno o más alérgenos mayores específicos. La inmunoterapia molecular es una purificación de alérgeno(s) clínicamente relevantes del extracto completo. Contiene únicamente este alérgeno(s) en una cantidad determinada y estandarizada que permiten que la dosis eficaz de mantenimiento con ese único alérgeno o mezcla de alérgenos específica sea capaz de inducir la modificacion de la enfermedad alérgica.
Bibliografía
- Pfaar O, Bousquet J, Durham SR, et al. One hundred and ten years of Allergen Immunotherapy: A journey from empiric observation to evidence. Allergy. 2022. PMID: 34315190
- Casanovas M, et al. Double-blind study of tolerability and antibody production of unmodified and chemically modified allergen vaccines of Phleum pratense. Clin Exp Allergy. 2005. PMID: 16238799.
-
State–of–the-art in marketed adjuvants and formulations in Allergen Immunotherapy: A position paper of the European Academy of Allergy and Clinical Immunology (EAACI). Allergy. 2020. PMID: 31774179
- https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-development-products-specific-immunotherapy-treatment-allergic-diseases_en.pdf
- Pechsrichuang P, Jacquet A. Molecular approaches to allergen-specific immunotherapy: Are we so far from clinical implementation? Clin Exp Allergy. 2020 May;50(5):543-557. Epub 2020 Mar 9. PMID: 32078207
VESPA VELUTINA
La Vespa velutina, conocida comúnmente como avispa asiática, es una especie invasora originaria del sudeste asiático. En los últimos años se ha extendido por diferentes regiones de la península ibérica (sobre todo la cornisa norte) y gran parte del territorio francés, que es por donde se cree que entró por primera vez. Se trata de un insecto de mayor tamaño que las avispas comunes en nuestro ámbito geográfico (Vespula vulgaris/Vespula germanica) e incluso más grande que el avispón europeo (Vespa crabro). La Vespa velutina, con un abdomen casi negro, presenta además una banda anaranjada y las puntas de las patas de color amarillo, lo que permite reconocerla más fácilmente.
Aunque puede confundirse con otras avispas, su aspecto oscuro y uniforme la distingue parcialmente de especies como la avispa europea (Vespa crabro), que presenta colores más amarillos y rojizos.
Imagen 2 Extraído de Vespa velutina. (s.f.). [Fotografía]. Xunta de Galicia – 012. Recuperado el 3 de diciembre de 2025, de https://012.xunta.gal/es/vespa-velutina
Su presencia supone un impacto ecológico relevante, ya que se alimenta de abejas, avispas y otros insectos, afectando al equilibrio de los ecosistemas. No olvidemos, que se trata de una especie invasora, detectada por primera vez en Galicia en el año 2013.
Además, su expansión en entornos urbanos y rurales hace que cada vez sea más frecuente encontrar nidos cerca de viviendas, jardines o edificios públicos. Aunque la mayoría de las picaduras de avispas de todas las especies pueden producir reacciones locales y dolorosas, la Vespa velutina puede originar molestias importantes y, en personas alérgicas al veneno de himenópteros (abejas y avispas) reacciones graves que requieren atención médica urgente.
La Vespa velutina construye nidos grandes y generalmente situados en árboles altos, aunque también pueden encontrarse en fachadas o estructuras próximas a zonas habitadas. En cualquier caso, es importante recordar que la manipulación de estos nidos debe quedar exclusivamente en manos de servicios especializados en control de plagas. En caso de detectar un nido, debe comunicarlo a los servicios municipales, protección civil o empresas autorizadas de control de plagas. Tampoco se debe intentar espantar a las avispas ni emplear métodos caseros para eliminar los nidos, como fuego, agua o productos químicos domésticos.
En caso de picadura, lo más habitual es que aparezcan dolor, enrojecimiento (eritema) e inflamación local (angioedema), síntomas que suelen resolverse en pocas horas o días. Sin embargo, es fundamental buscar atención médica urgente si se presentan signos como dificultad para respirar, mareo, hinchazón en labios u ojos, o aparición de lesiones cutáneas generalizadas, especialmente en personas con alergia conocida al veneno de estos insectos. Las personas alérgicas deben disponer siempre de su medicación de emergencia tal como la adrenalina autoinyectable y seguir las indicaciones de su alergólogo.
Si previamente le ha picado una abeja o una avispa debe ponerse en contacto con su centro de Atención Primaria para que se le derive a hacer el correspondiente estudio alergológico.
La prevención es clave para reducir el riesgo de picaduras. Resulta útil evitar dejar alimentos o residuos al aire libre y revisar envases antes de beber. Mantener la calma si se observa una avispa cercana y evitar movimientos bruscos es fundamental. También es importante no manipular nidos ni avispas muertas, ya que cerca de un nido pueden desencadenar reacciones defensivas de la colonia.
Javier Pereira
Miembro del Comité de Alergia a Himenópteros
*Imagen destacada: Pereira J. (2025, agosto 20). “Vespa velutina”. Archivo personal, Pontevedra, España.
POBLACIONES DE RIESGO EN LA ALERGIA A VENENOS DE HIMENÓPTEROS
Las reacciones tras picaduras de himenópteros, tales como abejas y avispas, son uno de los habituales motivos de consulta en los servicios de alergología. Estas reacciones pueden variar en cuanto a gravedad, pudiendo ir desde una reacción local hasta una anafilaxia con desenlace fatal. En Europa, las anafilaxias por picaduras de himenópteros suponen el 48,2% de las anafilaxias sufridas en pacientes adultos y el 20,2% de las que padecen los niños.
Existen unos grupos de pacientes que se consideran población de riesgo tanto por hacerse alérgicos a los venenos de los himenópteros como por presentar reacciones de mayor gravedad. Uno de estos principales grupos son los apicultores. Estos profesionales tienen un mayor riesgo de hacerse alérgico al veneno de los himenópteros debido a su alta exposición a las picaduras. Suelen presentar numerosas picaduras anuales y también en muchas ocasiones suelen sufrir múltiples picaduras simultáneas. Está ampliamente reconocido que el grado de sensibilización de estas personas frente al veneno de abeja se encuentra en relación con el número de picaduras anuales que reciben. Más de 200 picaduras anuales suelen conferir tolerancia y, por lo tanto, protección, disminuyendo el riesgo de reacción alérgica; en cambio, 50 picaduras anuales aportan una mínima protección y menos de 25 picaduras al año, ninguna.
Igualmente, incluimos en este grupo a aquellas personas que residen o tienen trabajos en zonas rurales, aunque no sean apicultores, debido a que presentan una alta exposición a los himenópteros.
Otro de los grupos de riesgo para la alergia a venenos de himenópteros son los pacientes con mastocitosis sistémicas. Este grupo de enfermedades raras presenta una mayor prevalencia para sufrir anafilaxias; y en concreto, por alergia a venenos de himenópteros. Se estima que la prevalencia de estas reacciones oscila entre el 5% y 19% aproximadamente. Por ello, ante cualquier paciente que ha sufrido una reacción tras picadura de himenóptero y, sobre todo, si cursa con tensiones bajas y sin lesiones cutáneas, hay que sospechar la presencia de una mastocitosis. En el estudio y diagnóstico de estos pacientes, siempre hay que valorar la presencia de sensibilización a venenos de himenópteros. En caso de que se confirme, hay que indicar tratamiento de inmunoterapia para generar protección en caso de que sufrieran una picadura.
Por lo tanto, los apicultores (e incluimos junto a ellos a las personas que desarrollan su trabajo en zonas rurales como jardineros, agricultores, ganaderos…) y los enfermos de mastocitosis son los principales grupos de riesgo para sufrir anafilaxias con las picaduras de himenópteros. En ambos grupos hay que tener una especial precaución a la hora de diagnosticar dicha alergia a venenos de himenópteros y de indicar las recomendaciones terapéuticas correspondientes. Entre estas últimas hay que incidir, por un lado, en la importancia de tener una medicación de rescate para podérsela administrar en caso de una reacción por picadura de himenóptero; y, por otro lado, valorar de forma individualizada la necesidad de administrar inmunoterapia.
María Dolores Rodríguez Bote
Médico Especialista en Alergología. Miembro del Comité de alergia a himenópteros.
BIBLIOGRAFIA:
1. Reisman RE. Natural history of insect sting allergy: relationship of severity of symptoms of initial sting anaphylaxis to re-sting reactions. J Allergy Clin Immunol. septiembre de 1992;90(3 Pt 1):335-9.2. Schuberth KC, Lichtenstein LM, Kagey-Sobotka A, Szklo M, Kwiterovich KA, Valentine MD. Epidemiologic study of insect allergy in children. II. Effect of accidental stings in allergic children. J Pediatr. marzo de 1983;102(3):361-5.
3. Müller UR. Bee venom allergy in beekeepers and their family members. Curr Opin Allergy Clin Immunol. agosto de 2005;5(4):343-7.
4. Golden DB, Kagey-Sobotka A, Norman PS, Hamilton RG, Lichtenstein LM. Insect sting allergy with negative venom skin test responses. J Allergy Clin Immunol. mayo de 2001;107(5):897-901.
5. Dávila González IJ, Jáuregui Presa I, Olaguibel Rivera JM, Zubeldia Ortuño JM. Tratado de alergología. 2o. Ergon; 2016.
6. Brockow K, Jofer C, Behrendt H, Ring J. Anaphylaxis in patients with mastocytosis: a study on history, clinical features and risk factors in 120 patients. Allergy. febrero de 2008;63(2):226-32.
7. Bonadonna P, Perbellini O, Passalacqua G, Caruso B, Colarossi S, Dal Fior D, et al. Clonal mast cell disorders in patients with systemic reactions to Hymenoptera stings an increased serum tryptase levels. J Allergy Clin Immunol. marzo de 2009;123(3):680-6.
8. González-de-Olano D, Alvarez-Twose I, Vega A, Orfao A, Escribano L. Venom immunotherapy in patients with mastocytosis and hymenoptera venom anaphylaxis. Immunotherapy. mayo de 2011;3(5):637-51.
Vacunarte si tienes asma o asma grave puede cambiar tu salud
La vacunación como herramienta esencial
La vacunación es una de las medidas de salud pública con más impacto, más eficaces y coste-efectivas para prevenir enfermedades que representan una causa importante de hospitalización y muerte a nivel mundial.
Las campañas de vacunación masiva suponen una estrategia de prevención que incluye no sólo a los individuos vacunados, contribuyendo a la inmunidad colectiva, reduciendo la propagación de patógenos y protegiendo a los grupos más vulnerables (niños, ancianos y personas con comorbilidades)
En las personas con asma —y en especial en quienes tienen asma grave— las infecciones respiratorias (gripe, neumonía, COVID-19, Virus respiratorio sincitial (VRS), etc.) pueden provocar exacerbaciones, o crisis de asma, que empeoran la función pulmonar, reducen la calidad de vida y pueden requerir ingreso hospitalario o incluso representar riesgo vital. Protegerse mediante las vacunas recomendadas es una estrategia simple, segura y poderosa para reducir ese riesgo.
¿Por qué las personas con asma y asma grave son más vulnerables?
El asma grave suele cursar con inflamación bronquial sostenida, niveles de medicación más altos y, en algunos casos, tratamiento con corticoides sistémicos o terapias biológicas. Estos factores pueden alterar las defensas respiratorias frente a virus y bacterias, facilitando infecciones más severas y aumentando la probabilidad de exacerbaciones. Las guías actuales (Guía Española para el Manejo del Asma (GEMA), y la Iniciativa Global para el Asma (GINA) subrayan la importancia de prevenir infecciones en asmáticos como parte del manejo integral.
Impacto de las infecciones respiratoria en el control del asma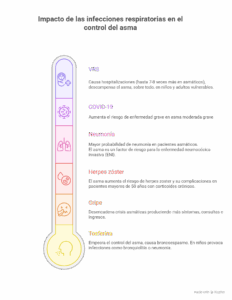
Qué vacunas se recomiendan para personas con asma o asma grave (tabla resumen)
A continuación, se expone una tabla resumen clara y práctica para pacientes, según indicaciones habituales en España:
| Vacuna | Recomendación | Motivo / Beneficio | Fuente |
| Gripe estacional | Anual — recomendada en asmáticos (especialmente moderado/grave) | Evita gripe que puede desencadenar exacerbaciones y hospitalizaciones. Es una estrategia coste-efectiva | Ministerio de Sanidad / Calendario 2025. (Ministerio de Sanidad) |
| Neumocócica (PCV20 / PCV13 + PPSV23 según caso) | Recomendada en asma grave; valorar en asma con tratamiento corticoideo. En España se suele emplear la vacuna conjugada de 20 serotipos (PCV20) en adultos con asma grave, siguiendo las indicaciones de Pediatría y Salud Pública. | Protege frente a neumonía y ENI; reduce riesgo de complicaciones respiratorias | Documentos técnicos y GEMA 5.5. (separ.es) |
| COVID-19 | Completar pauta y refuerzos según indicación (grupos de riesgo) | Reduce hospitalización, UCI y mortalidad por SARS-CoV-2 | Recomendaciones SNS / campañas 2024–25. (Ministerio de Sanidad) |
| VRS (vacuna para adultos / profilaxis en lactantes) | Indicada en mayores de 60 años, con comorbilidades; profilaxis (nirsevimab) en lactantes de riesgo | Previene hospitalizaciones por VRS, protege a bebés y a adultos vulnerables | AEP / calendario infantil / novedades VRS. (vacunasaep.org) |
| Herpes zóster (HZ/su, 2 dosis) | Recomendado en adultos ≥50 con condiciones de riesgo (incluido asma corticodependiente) | Evita zóster y neuralgia postherpética que empeoran la calidad de vida | Recomendaciones clínicas y documentación técnica. (Ministerio de Sanidad) |
| Tosferina (dTpa) | Una dosis de recuerdo en adultos no vacunados en la adolescencia o según historia vacunal | Evita tosferina que puede desencadenar broncoespasmos y empeorar el asma
Reduce el riesgo de enfermedad grave relacionada con esta enfermedad |
Calendario / recomendaciones de vacunación. (Ministerio de Sanidad) |
| Otras vacunas del calendario vacunal | Mantener al día según edad y situación clínica | Protección general que evita enfermedades que podrían complicar el asma | Calendario de vacunaciones SNS 2025. (Ministerio de Sanidad) |
*Elaboración propia
Nota: la elección del tipo de vacuna y el momento de la vacunación deben decidirse con el profesional sanitario (medicina de familia, neumología o alergología, medicina preventiva) según edad, tratamiento (corticoides, biológicos), historial vacunal y comorbilidades.
Consideraciones especiales en asma grave
- Asma grave no controlada: las personas con asma grave no controlada (tratamientos escalón 5–6, uso prolongado de corticoides orales o frecuentes exacerbaciones) tienen una vulnerabilidad mayor y son prioridad para las vacunas indicadas. GEMA 5.5 y GINA instan a integrar la vacunación en el plan de cuidados del asmático grave. (separ.es)
- Tratamientos biológicos (mAbs): en general no están contraindicadas las vacunas actualmente, con excepción de los virus vivos atenuados (varicela, triple vírica, fiebre amarilla…) a los cuales se debe vacunar el paciente previo al inicio del tratamiento biológico. Consulta las recomendaciones clínicas con tu enfermera de referencia ya que algunas precisan gestionar tiempos (p. ej. espaciar 5–7 días entre vacunación y administración de los biológicos)
- Corticoides orales crónicos: aumentan el riesgo de algunas infecciones (p. ej. herpes zóster), por lo que la vacunación frente a HZ y otras infecciones es especialmente importante.
- Niños con asma grave: en lactantes/menores de 2 años existen estrategias de protección frente al VRS (profilaxis con nirsevimab en grupos de riesgo) y la vacunación infantil del calendario debe mantenerse estrictamente. (vacunasaep.org)
En el caso de la vacunación frente al neumococo en niños la Asociación Española de Pediatría (AEP) recomienda en asma ampliar la cobertura a la vacuna polisacárida 23 valente (en vacunados previamente con 13 o 15 valente)
En niños con asma grave no controlado la infección por SARS-CoV-2 podría ser más grave, por lo que se debe valorar su inmunización en este casos.
Qué dicen las guías y autoridades
- GEMA 5.5 (Guía Española para el Manejo del Asma, 2025): destaca la prevención de exacerbaciones como objetivo clave y apoya integrar la vacunación en el manejo del asmático. (separ.es)
- GINA (Global Initiative for Asthma): la guía internacional recalca la importancia de prevenir factores precipitantes de exacerbaciones, incluyendo infecciones prevenibles por vacuna; su estrategia 2024–2025 actualiza el enfoque del manejo integral. (Global Initiative for Asthma – GINA)
- Consejo Interterritorial / Ministerio de Sanidad (Calendario 2025): define los grupos de riesgo y el calendario común de vacunación (gripe, neumococo, COVID, etc.) aplicable a personas con enfermedades respiratorias crónicas. (Ministerio de Sanidad)
Vacúnate y cuida tu asma
Vacunarte es una decisión activa para proteger tu respiración y tu vida diaria. Las vacunas recomendadas reducen exacerbaciones, evitan ingresos y te ayudan a mantener un mejor control del asma. Su uso generalizado puede reducir la carga de enfermedad y mejorar tu calidad de vida. Consulta con tu médico o enfermera cuáles son las vacunas que te corresponden, revisa tu historial vacunal y aprovecha cada temporada (por ejemplo, la campaña de gripe) para actualizar tu protección. Vacunarte no solo te protege a ti, sino también a los que te rodean.
¡Vacúnate hoy y respira con más tranquilidad mañana!
Bibliografía
- De Miguel-Díez J, Torres-Castro R, Sanz Herrero F, Menéndez Villanueva R, Solís Gómez B, Quirós Fernández S, Pérez Rojo R, Mora Cuesta VM, Entrenas Castillo M, Serrano Fernández L, Cabrera Martínez MM, Mediano O, García-Ortega A, García Rivero JL, de la Rosa-Carrillo D. SEPAR. Recomendaciones de la SEPAR sobre la vacunación de pacientes respiratorios crónicos. Arch Bronconeumol. 2025 Jun 17: S0300-2896(25)00218-2. Doi: 10.1016/j.arbres.2025.06.005.
- Álvarez-Gutiérrez FJ, Blanco Aparicio M, Casas Maldonado F, Plaza V, Soto Campos G, González-Barcala FJ, et al. Documento de consenso de asma grave. Actualización 2025. Open Respiratory Archives. 2025; 7:100486. Doi: 10.1016/j.opresp.2025.100486.
- GEMA 5.5. Guía Española para el Manejo del Asma. 2025. Sociedad Española de Alergología/SEPAR (actualización GEMA 5.5). Disponible en: https://www.separ.es/gema-5.5-asma.
- Global Initiative for Asthma (GINA). GINA Strategy Report 2024/2025. 2024–2025. Disponible en: www.ginasthma.org. (Global Initiative for Asthma – GINA)
- Ministerio de Sanidad. Calendario de vacunación e inmunizaciones a lo largo de toda la vida. Calendario recomendado 2025. Madrid: Ministerio de Sanidad; 2025. Disponible en: Ministerio de Sanidad
- AEP / Vacunas AEP. Recomendaciones y calendario 2025 (incluye recomendaciones sobre nirsevimab y VRS en lactantes). 2025.Disponible en: vacunasaep.org
- Cates CJ, Rowe BH. Vaccines for preventing influenza in people with asthma. Cochrane Database Syst Rev. 2013;(2):CD000364. DOI: 10.1002/14651858.CD000364.pub4-
- Walters JAE, Tang JN, Poole P, Wood-Baker R. Pneumococcal vaccines for preventing pneumonia in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017;(1):CD001390. DOI: 10.1002/14651858.CD001390.pub4
- Villar-Álvarez F, Rosa-Carrillo D, Fariñas-Guerrero F. Vacunación en el paciente respiratorio adulto, ¿bailamos? Vacunas. 2023;24(2):150–157. Disponible en: https://doi.org/10.1016/j.vacun.2023.04.005
- Desvaux-García M, Martínez-Calvo FF, López-Campos M, Viñas V. Observational study of the first month of the influenza vaccination campaign in patients followed up for asthma in 2019 and 2020. Rev Pediatr Aten Primaria. 2022;24:e81–e85. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1139-76322022000100012&lng=es&tlng=es.
Autoras:
Mónica Martín Gómez (enfermera Servicio de Alergología, Hospital Universitario Puerta de Hierro Majadahonda, Madrid)
- Carmen Sánchez Fernández (enfermera, Servicio de Alergología, Hospital Clínic Barcelona)
En colaboración con el Grupo de Respiratorio del Comité de Enfermería de la Sociedad Española de Alergología e Inmunología Clínica)
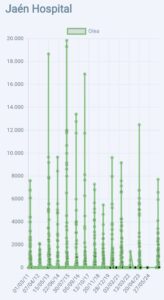
Captador de la semana: Jaén

Toca presentar al Dr. Juan Luis Anguita Carazo, responsable del captador de la red SEAIC localizado en el Hospital Universitario de Jaén, donde el Dr. Anguita junto con el resto de compañeros del servicio realizamos los contajes de pólenes desde el 2011.

Jaén, mar de olivos, alcanzó el record histórico de conteo de polen de olivo diario en mayo del 2015 con 19.840 granos por metro cúbico de aire.
El Dr. Anguita ha realizado para esta ocasión dos interesantes videos donde podréis conocer la historia de este captador así como a todos los compañeros que actualmente colaboran con los contajes.
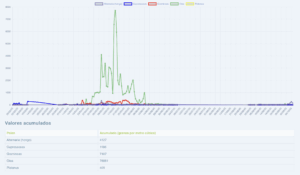
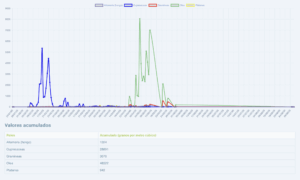
Captador de la semana: Córdoba
Hoy toca presentar el captador de Córdoba, pertenece a la red de captadores de pólenes de la SEAIC.
La Dra Cristina De Castro Gómez, alergóloga en el Hospital San Juan De Dios, así como actual secretaria del comité de Aerobiología, nos aporta los datos en www.pólenes.com desde 2019.
¿Debo suspender algún tratamiento para poder realizarme el estudio de alergia a medicamentos?
Ésta es una pregunta muy frecuente en las consultas de Alergología previa a la realización del estudio de alergia a medicamentos. Es importante conocer qué medicación podemos mantener el día de la prueba y cuál tendríamos que evitar. Esto es lo que se denomina período de lavado y es fundamental para eliminar el tratamiento en cuestión y que no produzca efectos que pudieran alterar o invalidar el resultado del estudio de medicamentos.
Lo primero es informar al alergólogo sobre el tratamiento que tomamos de forma habitual, la posología, motivo de prescripción y frecuencia de administración.
De forma general, podemos diferenciar entre dos tipos de tratamientos:
1. Medicamentos utilizados para patologías crónicas no alérgicas: entre ellos se incluirían medicamentos para controlar la tensión arterial, el colesterol o los triglicéridos, diabetes, coagulación, antiinflamatorios, protectores gástricos, entre otros. Todos estos medicamentos se deben mantener el día de la prueba con su pauta habitual, excepto los betabloqueantes (atenolol, bisoprolol, carvedilol, etc), que deben suspenderse el mismo día previo a la prueba, ya que pueden interferir en la respuesta de tratamientos específicos, como la adrenalina, necesarios en caso de reacción durante el estudio de alergia a medicamentos.
2. Medicamentos utilizados para patologías alérgicas: entre ellos se incluirían medicamentos como los inhaladores, antihistamínicos, corticoides orales, colirios antihistamínicos, sprays nasales, etc. En líneas generales, tanto los antihistamínicos como los corticoides sí necesitarán un período de lavado (no tomarlos) para no interferir en los resultados. Generalmente, se recomienda suspender los antihistamínicos orales o los corticoides orales o intramusculares de 5 a 7 días antes del estudio de alergia para evitar que falseen los resultados, aunque para algunos antihistamínicos de primera generación el plazo puede ser de hasta 10 días. Sin embargo, en la mayoría de los casos se recomienda un mínimo de 5 días, y siempre se debe seguir la pauta específica indicada por el alergólogo, ya que el tiempo puede variar según el tipo de antihistamínico o corticoide. En relación con sprays nasales o inhaladores, generalmente, no es necesario suspenderlos antes de realizar una prueba de alergia a medicamentos.
En resumen, es muy importante informar al alergólogo de toda la medicación que tomamos habitualmente, incluyendo pautas y dosis, de cara a obtener un resultado correcto en las pruebas de alergia a medicamentos, reduciendo, además, los riesgos para el paciente.
Ignacio García Núñez
Especialista en Alergología
Hospitales Quironsalud Córdoba y Quironsalud Campo de Gibraltar
Dermatitis atópica en niños: lo último en tratamientos y futuro del manejo en 2025
La dermatitis atópica (DA) es la enfermedad inflamatoria cutánea más frecuente en la infancia y representa un verdadero desafío clínico por su curso crónico-recidivante y el importante impacto que genera en la calidad de vida de los niños y sus familias. En los últimos cinco años, las opciones terapéuticas se han ampliado de manera notable gracias al desarrollo de nuevos fármacos biológicos e inhibidores de JAK. La guía EuroGuiDerm 2025 (segunda actualización de la guía europea) incorpora en su última versión las novedades más relevantes para el manejo de la DA en población pediátrica.
La principal novedad del documento europeo radica en las terapias sistémicas avanzadas para la DA grave. En este escenario, cuando la enfermedad no se controla con un tratamiento tópico optimizado, la EuroGuiDerm 2025 recomienda como primera opción los biológicos. Actualmente existen tres aprobados en población pediátrica: dupilumab, autorizado desde los 6 meses de edad; y lebrikizumab y tralokinumab, indicados a partir de los 12 años. Dupilumab sigue siendo el fármaco de referencia por su amplio rango de edad y su perfil de seguridad favorable. Los anti-IL-13 selectivos ofrecen una eficacia comparable y, en el caso de lebrikizumab, la ventaja de una administración mensual en fase de mantenimiento, lo que mejora la adherencia.
Junto a ellos, los inhibidores orales de JAK se consolidan como una alternativa eficaz. La guía incluye baricitinib, aprobado desde los 2 años, así como abrocitinib y upadacitinib, autorizados a partir de los 12 años. Estos fármacos destacan por su inicio de acción rápido y su alta eficacia en la reducción del prurito y las lesiones. Sin embargo, requieren un seguimiento analítico estrecho debido a potenciales efectos adversos (hematológicos, metabólicos, cardiovasculares e infecciosos), por lo que se reservan a pacientes seleccionados, especialmente cuando no hay acceso o respuesta a biológicos.
Cuando los biológicos y los inhibidores de JAK no están disponibles, la ciclosporina A se mantiene como una opción válida en ciclos cortos bajo supervisión especializada, siendo el único inmunosupresor aprobado en pediatría. Otros inmunosupresores, como metotrexato, azatioprina o micofenolato mofetilo, se utilizan de forma off-label, aunque con evidencia limitada.
A pesar de estos avances, los pilares básicos del tratamiento permanecen inalterables. La restauración de la barrera cutánea mediante el uso sistemático de emolientes continúa siendo el fundamento de toda estrategia terapéutica. Se recomienda su aplicación al menos dos veces al día en toda la superficie corporal, incluso en áreas sin lesiones visibles. La llamada “regla del minuto”, que consiste en aplicar el emoliente en el primer minuto tras el baño, mejora la hidratación y previene la pérdida transepidérmica de agua. Los baños, lejos de estar contraindicados, forman parte del tratamiento si se realizan de forma breve, con agua tibia y limpiadores syndet, seguidos de un secado suave sin fricción.
De forma paralela, el control de factores ambientales —evitar fibras irritantes, reducir la exposición a alérgenos en pacientes sensibilizados, mantener una humedad ambiental estable y limitar irritantes como detergentes o humo de tabaco— contribuye a disminuir los brotes y la severidad. Los programas educativos para pacientes y familias son también un componente esencial, ya que mejoran la adherencia, el manejo diario de la enfermedad y el bienestar psicológico de los afectados.
En el abordaje de los brotes agudos, la primera línea continua siendo el tratamiento tópico. Los corticoides tópicos se recomiendan de manera individualizada según la edad, la localización y la intensidad de las lesiones, en pautas de 1–2 aplicaciones diarias durante un máximo de dos semanas. En zonas sensibles o en casos que requieren mantenimiento prolongado, los inhibidores de la calcineurina (tacrolimus 0,03% y pimecrolimus) son una alternativa no esteroidea clave, indicados desde los 2 años y, en algunos países, desde los 3 meses en el caso de pimecrolimus. Su uso intermitente, dos veces por semana en fases de mantenimiento (“estrategia proactiva”), reduce de forma significativa las recaídas. La guía también contempla el empleo de vendajes húmedos con corticoides de baja o media potencia en brotes extensos y refractarios, así como la fototerapia en adolescentes cuando el tratamiento tópico resulta insuficiente, aunque con un grado de recomendación menor. El uso de corticoides orales no se aconseja de manera rutinaria y debe reservarse únicamente como terapia puente en brotes graves, en ciclos cortos y siempre con monitorización estrecha.
Finalmente, las estrategias de modulación del microbioma se han consolidado como un campo clave en la investigación de la dermatitis atópica. Los probióticos —sobre todo combinaciones de Lactobacillus y Bifidobacterium— han mostrado cierto beneficio en formas moderadas-graves, mientras que los prebióticos (como FOS y GOS) favorecen el crecimiento de bacterias protectoras y refuerzan la barrera cutánea. Su combinación en simbióticos parece especialmente útil en niños a partir del primer año de vida. Además, se están desarrollando terapias innovadoras como los probióticos tópicos con cepas como Roseomonas mucosa o Staphylococcus hominis, capaces de reducir la inflamación y limitar la colonización por S. aureus. Aunque aún faltan estudios que definan qué cepas, dosis y duración son más eficaces, todo apunta a que el microbioma jugará un papel decisivo en el futuro de la dermatitis atópica pediátrica.
En conclusión, la EuroGuiDerm 2025 refleja el cambio de paradigma en la dermatitis atópica pediátrica. Los biológicos y los inhibidores de JAK se consolidan como pilares en los casos graves, sin perder de vista que la base del tratamiento sigue siendo la restauración de la barrera cutánea, el control ambiental y la educación familiar. El f uturo apunta hacia una medicina cada vez más personalizada, en la que la elección del tratamiento dependerá del fenotipo y endotipo clínico, la edad y las comorbilidades de cada paciente con el objetivo último de mejorar la calidad de vida de los niños y los adolescentes afectados.
Autora: Dra. Ana Láinez Nuez. Servicio de alergología, Hospital Vithas Turia, Valencia, Comité de Alergia Infantil SEAIC
- Wollenberg A, Kinberger M, Arents B, Aszodi N, Barbarot S, Bieber T, et al. European Guideline (EuroGuiDerm) on atopic eczema: Living update. J Eur Acad Dermatol Venereol. 2025;39(7):1537–66. doi:10.1111/jdv.20639.
“Nuevos horizontes en el tratamiento de las alergias alimentarias”
Durante décadas, el tratamiento de las alergias alimentarias se basaba exclusivamente en la evitación rigurosa del alimento causante y en la intervención de emergencia en caso de exposición accidental. Aunque este enfoque preventivo ha sido útil, conlleva importantes limitaciones, tanto por su impacto en la calidad de vida como por el riesgo constante de reacciones graves. Afortunadamente, en los últimos años, la medicina ha comenzado a ofrecer alternativas más avanzadas, efectivas y personalizadas dando pasos importantes hacia tratamientos más eficaces y seguros. Actualmente, ya no se trata solo de evitar los alérgenos, sino de ayudar al organismo a tolerarlos mejor y reducir el riesgo de reacciones severas.
Una de ellas es la inmunoterapia oral (OIT), que consiste en dar al paciente pequeñas cantidades del alimento al que es alérgico, aumentando la dosis poco a poco, con el objetivo de que el cuerpo se acostumbre y no reaccione con tanta intensidad. Si bien puede ayudar a reducir la gravedad de las reacciones, la OIT no está exenta de efectos adversos, por lo que debe llevarse a cabo bajo estricta supervisión del alergólogo.
Otro avance importante ha sido el uso de medicamentos biológicos, como omalizumab, un anticuerpo monoclonal que bloquea la inmunoglobulina E (IgE), una molécula clave en las reacciones alérgicas. Recientemente aprobado por la FDA para personas con múltiples alergias alimentarias, ha demostrado que puede aumentar la cantidad de alimento tolerada sin provocar síntomas, mejorando así la seguridad y la calidad de vida.
La combinación de este tratamiento biológico con inmunoterapia oral ha mostrado beneficios adicionales: reduce la frecuencia e intensidad de las reacciones durante el tratamiento, lo que facilita su seguimiento y mejora la adherencia. Este enfoque combinado representa un cambio de paradigma, al pasar de la simple evitación a una intervención activa sobre el sistema inmune.
La investigación continúa avanzando. Se están estudiando nuevos biológicos como: Ligelizumab y UB-221, Dupilumab, Etokimab y Tezepelumab.
Estos tratamientos prometen ser más específicos y seguros, abriendo la puerta a una medicina personalizada, adaptada a las características inmunológicas de cada paciente.
Estamos viviendo un momento esperanzador. Las nuevas terapias no solo buscan prevenir las reacciones alérgicas, sino mejorar la vida diaria de quienes conviven con estas condiciones. Tanto pacientes como familias y profesionales sanitarios tienen ahora a su disposición opciones más eficaces, seguras y ajustadas a las necesidades individuales.
Dra. Guacimara Lucia Hernandez Santana. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife. Comité de Alergia Infantil
Bibliografía:
- Wood RA, Togias A, Sicherer SH, Shreffler WG, Kim EH, Jones SM, et al. Omalizumab for the treatment of multiple food allergies. N Engl J Med [Internet]. 2024;390(10):889–99. Disponible en: http://dx.doi.org/10.1056/NEJMoa2312382
- Ghelli C, Costanzo G, Canonica GW, Heffler E, Paoletti G. New evidence in food allergies treatment. Curr Opin Allergy Clin Immunol [Internet]. 2024;24(4):251–6. Disponible en: http://dx.doi.org/10.1097/ACI.0000000000000999
- Schuetz JP, Anderson B, Sindher SB. New biologics for food allergy. Curr Opin Allergy Clin Immunol [Internet]. 2024;24(3):147–52. Disponible en: http://dx.doi.org/10.1097/ACI.0000000000000981
¿Cómo influyen las infecciones por virus en las reacciones a antibióticos en niños?
Aunque las infecciones más conocidas en la infancia y potencialmente graves son el sarampión, las paperas, la varicela y la rubeola, gracias a las vacunaciones periódicas mediante el calendario vacunal, están prácticamente erradicadas en los países que de forma regular siguen estas recomendaciones. Habitualmente, las infecciones más comunes por virus suelen ser leves y se resuelven satisfactoriamente en la mayoría de los casos.
El sistema inmunológico de los niños está en desarrollo durante la infancia y, debido a la alta exposición en guarderías y colegios, frecuentemente desarrollan infecciones que pueden durar más de los periodos típicos que suelen ser otoño e invierno, e incluso pueden aparecer varias veces al año.
Entre estas está la gripe, también conocida como influenza estacional, el resfriado común, la gastroenteritis, la enfermedad boca-mano-pie, conjuntivitis, faringoamigdalitis, y en algunos casos, particularmente en niños menores de dos años, la bronquiolitis. Los síntomas típicos que pueden aparecer en estos cuadros infecciosos son tos, dolor de garganta, congestión nasal, malestar general, fiebre que puede llegar a ser alta, y menos frecuentemente manifestaciones gastrointestinales.
Generalmente el tratamiento es paracetamol y/o ibuprofeno que alivian el dolor y el malestar general y controlan la fiebre. Para la mayoría de los casos no hay tratamientos antivirales específicos, aunque a veces se prescriben o auto consumen antibióticos, a pesar de que estos solo están indicados en infecciones bacterianas.
En el curso del tratamiento con antibióticos durante una infección viral pueden aparecer manifestaciones cutáneas como eritema o enrojecimiento generalizado, exantema o urticaria (ronchas), que puede estar acompañadas de edema (hinchazón), y más raramente manifestaciones en las mucosas. Generalmente estos síntomas aparecen tras varios días de haber iniciado el tratamiento antibiótico, aunque a veces pueden suceder tras un periodo más corto de tiempo, incluso en menos de 24 horas. En la mayoría de estos casos se interrumpe el tratamiento con antibióticos y las manifestaciones cutáneas desaparecen en poco tiempo. En la mayoría de los casos, una vez que se ha resuelto la infección viral, los niños que toman de nuevo el antibiótico por alguna otra indicación lo toleran sin problema.
En cualquier caso, toda manifestación cutánea o de otro tipo que aparezca cuando se toman antibióticos en el curso de una infección viral, una vez resuelta, debería ser evaluada por un alergólogo para verificar que realmente el niño afectado no es alérgico. En muchos casos, de no realizarse esta valoración, se considera erróneamente el caso como alérgico con los consiguientes perjuicios que esto puede tener.
Natalia Blanca
Servicio de Alergia
Hospital Universitario Infanta Leonor, Madrid
¿Pueden los probióticos durante el embarazo ayudar a prevenir la alergia en nuestros bebés?
¿Pueden los probióticos durante el embarazo ayudar a Prevenir la alergia en nuestros bebés?
Desde el Comité de Alergia Infantil de la SEAIC, sabemos que muchos padres, sobre todo los que ya tienen otros hijos con alergia, se hacen esta pregunta cuando esperan un nuevo bebé. ¿Y si hubiera algo que pudiera hacerse durante el embarazo para reducir el riesgo de alergia en el futuro?
Entre las posibles estrategias preventivas, una que ha generado especial interés en los últimos años es el uso de probióticos. Se ha estudiado su impacto en el desarrollo de diabetes gestacional, en el desarrollo del síndrome metabólico y en otras patologías. Pero ¿y en la prevención de alergia? ¿Qué dice la ciencia al respecto? ¿Sirven realmente? Aquí te lo contamos de forma clara y sencilla.
¿Qué son los probióticos y por qué se habla tanto de ellos?
Los probióticos son microorganismos vivos, como algunas bacterias, que, cuando se consumen en cantidades adecuadas, pueden tener efectos beneficiosos para la salud. Se encuentran de forma natural en algunos alimentos (como yogures o productos fermentados) y también en forma de suplementos alimenticios.
Ya desde el embarazo, el sistema inmunitario de nuestro bebé se está desarrollando. Se sabe que la microbiota intestinal (los microorganismos que habitan en nuestro intestino) juega un papel importante en la maduración del sistema inmune del neonato. Por eso, los científicos se han planteado si los probióticos podrían ayudar a “entrenar” ese sistema inmunitario y reducir el riesgo de desarrollar alergias más adelante.
¿Qué dice la ciencia? Vamos a analizarlo en los diferentes tipos de alergia posible: la cutánea, alimentaria y la alergia respiratoria.
🧴 1. Dermatitis atópica: la evidencia más prometedora
Este es el campo donde los estudios han mostrado resultados más esperanzadores. Algunas investigaciones han encontrado que tomar probióticos en el embarazo, y a veces también durante la lactancia o dárselos al bebé tras el nacimiento, podría reducir el riesgo de que el niño desarrolle dermatitis atópica, sobre todo si tiene antecedentes familiares de alergia.
Determinadas cepas de microorganismos y determinadas combinaciones de varias cepas parecen funcionar mejor que usar una sola cepa de forma aislada.
Cepas como Lactobacillus rhamnosus y algunas bifidobacterias han sido las más estudiadas.
La Organización Mundial de Alergia (WAO) ha hecho una recomendación condicional para usarlos con este fin pero advierte que la calidad de la evidencia aún es baja.
Es decir: hay indicios positivos, pero no es una solución mágica ni garantizada.
🍳 2. Alergias alimentarias: ¿una posible ayuda?
Aquí la evidencia científica es más limitada. Algunos estudios sugieren que el uso de algunos probióticos podría ayudar a reducir el riesgo de desarrollar alergia alimentaria en el futuro (como a la alergia a la leche o al huevo), pero los resultados no son consistentes.
Las principales guías científicas, como las de la Academia Europea de Alergia e Inmunología Clínica (EAACI), aún no recomiendan su uso generalizado con este objetivo.
Se necesitan más estudios para poder considerar el empleo de probióticos como una herramienta preventiva de la alergia alimentaria.
🌬️ 3. Asma bronquial y sibilancias: sin pruebas sólidas de beneficio
En el caso del asma infantil o los episodios de sibilancias (pitos en el pecho), los estudios hasta ahora no han demostrado beneficios claros del uso de probióticos durante el embarazo para prevenir su aparición tras el nacimiento.
Incluso, algunos trabajos han observado un posible (aunque no confirmado) aumento de infecciones respiratorias en bebés que recibieron probióticos. Esto subraya la importancia de seguir investigando.
Cosas importantes que debes saber antes de lanzarte a comprar probióticos:
✅ No todos los probióticos son iguales: cada cepa tiene efectos distintos. Que uno funcione no significa que todos lo hagan.
🕒 El “cuándo” también importa: no está claro si es mejor empezar antes del parto, después, o si continuar durante la lactancia, tampoco cuánto tiempo deben tomarse.
👶 ¿Tu bebé es de “alto riesgo”? Muchos estudios se han hecho con bebés con antecedentes familiares de alergia. Para la población general, los beneficios podrían ser menores.
📊 La evidencia es aún limitada: aunque se han hecho muchos estudios, no todos tienen la misma calidad. Las conclusiones deben tomarse con cautela.
Entonces… ¿debería tomar probióticos en el embarazo para prevenir la aparición de enfermedades alérgicas en mi bebé?
La respuesta corta es: depende.
Para bebés con alto riesgo de eccema, algunas organizaciones internacionales consideran que podría ser útil… pero no es una recomendación firme.
Para prevenir otras alergias (como la alergia alimentaria o el asma bronquial), aún no hay suficiente evidencia.
Lo más importante: consulta siempre con tu médico o especialista antes de empezar cualquier suplemento probiótico durante el embarazo.
- En resumen:
El uso de probióticos durante el embarazo es una línea de investigación interesante, especialmente en relación con la dermatitis atópica. Pero aún no hay una receta única para prevenir las enfermedades alérgicas y son necesarios más estudios para saber qué cepas, dosis y duración son las más eficaces.
Desde el Grupo de Trabajo de Microbiota del Comité de Alergia Infantil de la SEAIC, seguiremos atentos a las novedades científicas para poder informar con la mayor claridad y rigor posible. Mientras tanto, la mejor estrategia sigue siendo el acompañamiento médico personalizado y la información basada en evidencia.
Isabel Fernández de Alba. Hospital HLA Inmaculada. Comité de Alergia Infantil de la SEAIC
Bibliografía:
Recomendaciones generales y dermatitis atópica:
- Yepes-Nuñez, J. J., Fiocchi, A., Pawankar, R., Cuello-Garcia, C. A., Zhang, Y., & Brożek, J. L. (2023). World Allergy Organization (WAO) guideline for the use of probiotics in the management of allergic diseases. World Allergy Organization Journal, 16(1), 100738. (Esta es una actualización que podría reemplazar o complementar la de 2015 si cubre la prevención).
- Fiocchi, A., Pawankar, R., Cuello-Garcia, C., Ahn, K., Al-Hammadi, S., Agarwal, A., … & Yepes-Nuñez, J. J. (2015). World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Organization Journal, 8(1), 4. (Aunque de 2015, fue una guía influyente. Es importante verificar si hay actualizaciones más recientes que la suplanten o la complementen directamente para la prevención, como la mencionada anteriormente o guías específicas de probióticos).
- Cuello-Garcia, C. A., Brożek, J. L., Fiocchi, A., Pawankar, R., Yepes-Nuñez, J. J., Terracciano, L., … & Schünemann, H. J. (2015). Probiotics for the prevention of allergy: A systematic review and meta-analysis of randomized controlled trials. The Journal of Allergy and Clinical Immunology, 136(4), 952-961.
Alergias alimentarias:
- Halken, S., Muraro, A., de Silva, D., Khaleva, E., Angier, E., Arasi, S., … & Roberts, G. (2021). EAACI guideline: Preventing the development of food allergy in infants and young children (2021 update). Pediatric Allergy and Immunology, 32(5), 843-858. (Esta guía de la EAACI aborda la prevención de la alergia alimentaria y discute el papel de los probióticos).
- Garcia-Larsen, V., Ierodiakonou, D., Jarrold, K., Cunha, S., Chivinge, J., Robinson, Z., … & Boyle, R. J. (2018). Diet during pregnancy and infancy and risk of allergic or autoimmune disease: A systematic review and meta-analysis. PLoS medicine, 15(2), e1002507. (Un meta-análisis amplio que incluye probióticos).
Asma bronquial y sibilancias:
- Azad, M. B., Coneys, J. G., Kozyrskyj, A. L., Field, C. J., Ramsey, C. D., Becker, A. B., … & Mandhane, P. J. (2018). Probiotic supplementation and asthma in childhood: a randomized controlled trial. Thorax, 73(6), 527-535. (Ejemplo de un ensayo controlado aleatorizado, aunque las revisiones sistemáticas serían más globales).
- Strachan, D. P. (1989). Hay fever, hygiene, and household size. BMJ, 299(6710), 1259-1260. (Aunque no es sobre probióticos directamente, es el artículo seminal sobre la hipótesis de la higiene, relevante para el contexto de la microbiota y la alergia). Es importante complementarlo con revisiones sistemáticas más recientes sobre probióticos y asma, como:
- Wei, X., Jiang, P., Liu, J., Sun, R., & Lu, W. (2020). Association between probiotic supplementation and asthma incidence in infants: a meta-analysis of randomized controlled trials. Journal of Asthma, 57(6), 647-657.
Revisiones sistemáticas y metaanálisis generales sobre probióticos en embarazo y prevención de alergia
- Pelucchi, C., Chatenoud, L., Turati, F., Galeone, C., Moja, L., Bach, J. F., & La Vecchia, C. (2012). Probiotics supplementation during pregnancy or infancy for the prevention of atopic dermatitis: a meta-analysis. Epidemiology (Cambridge, Mass.), 23(3), 402. (Aunque de 2012, es un meta-análisis citado con frecuencia; buscar también versiones más actualizadas).
- Zuccotti, G., Meneghin, F., Aceti, A., Barone, G., Callegari, M. L., Di Mauro, A., … & Corvaglia, L. (2015). Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis. Allergy, 70(11), 1356-1371.
- Tan-Lim, C. S. C., Esteban-Ipac, N. A. R., Recto, M. S. T., Castor, M. A. R., Casis-Hao, R. J., & Nano, A. L. M. (2021). Comparative effectiveness of probiotic strains for antiallergy outcomes: A systematic review and network meta-analysis. Pediatric Allergy and Immunology, 32(6), 1255-1270.
¿Puedo hacerme el estudio de alergia a fármacos si estoy embarazada?
El estudio de alergia a medicamentos incluye además de una historia clínica detallada en la que se recoge el nombre del fármaco implicado, el tipo de reacción, el tiempo transcurrido desde el episodio, etc., la realización de pruebas diagnósticas específicas:
- Pruebas cutáneas: consisten en aplicar pequeñas cantidades del fármaco en la piel, mediante punción o inyección superficial, para observar si se produce una reacción local compatible con alergia.
- Pruebas de exposición controlada: implican administrar el medicamento sospechoso en dosis progresivas, bajo estricta supervisión médica, para confirmar o descartar la alergia.
Aunque las pruebas cutáneas conllevan poco riesgo, por sí solas no suelen ser concluyentes, y deben ir acompañadas de una prueba de exposición. En caso de que exista una verdadera alergia, la paciente embarazada podría presentar una reacción grave, con riesgo vital tanto para ella como para el feto
Además del riesgo de la prueba, durante el embarazo existen cambios en el sistema inmunológico de la gestante. Se modula y adapta la respuesta protectora del organismo, cambian las células defensivas, y se reduce la inflamación, todo ello para proteger la viabilidad del feto. Estos cambios pueden alterar la fiabilidad de algunas pruebas diagnósticas, entre ellas las mencionadas en el punto anterior, tanto las cutáneas como las pruebas de exposición.
Por todo esto no se recomienda realizarlas si el fármaco sospechoso no es necesario durante la gestación. Sin embargo, existen situaciones en las que el medicamento es imprescindible y no puede sustituirse por otro sin comprometer la salud materna o fetal. Algunos ejemplos podrían ser la Penicilina en la sífilis gestacional, el Ácido acetilsalicílico (AAS) en mujeres con riesgo de preeclampsia, o la Heparina de bajo peso molecular en casos de trombofilia o síndrome antifosfolípido.
Años atrás las pecientes con estas circunstancias debían someterse a los estudios mencionados, asumiendo el riesgo de presentar una reacción alérgica y de recibir medicación para tratar la reacción contraindicada durante el embarazo. Pero, desde hace más de una década, existe una alternativa segura y eficaz, la desensibilización. Este procedimiento permite administrar el fármaco al que el paciente es alérgico. Consiste en dar el medicamento a dosis y velocidades crecientes, lo que modifica temporalmente la respuesta inmunológica del sujeto permitiendo la tolerancia. Aunque la tasa de éxito de la desensibilización es extraordinariamente alta debe realizarse en entornos hospitalarios controlados, bajo estricta monitorización y supervisión, y por personal altamente cualificado. En el caso de las gestantes, suele realizarse en UCI (unidad de cuidados intensivos) con monitorización materna y fetal.
En conclusión, no se recomienda realizar el estudio de alergia a medicamentos durante el embarazo porque :
- Las pruebas pueden inducir reacciones alérgicas graves.
- Los cambios inmunológicos del embarazo pueden alterar la fiabilidad de los resultados.
- En casos de precisar el fármaco la administración en forma de desensibilización es una alternativa segura y eficaz.
Sònia Gelis, MD, PhD.
Hospital Clínic de Barcelona
Actualización en criterios diagnósticos de anafilaxia para niños pequeños (primera infancia).
La anafilaxia es una emergencia médica que requiere establecer su diagnóstico de forma precoz, dada la rapidez de instauración y la gravedad de sus síntomas.
Identificar una anafilaxia puede ser difícil porque los síntomas de la anafilaxia pueden ser muy variables: no siempre hay una erupción cutánea acompañante; en ocasiones se presenta con síntomas digestivos, ginecológicos, neurológicos y cardiovasculares (mareo, hipotensión), sin signos cutáneos visibles. Esta sintomatología puede comenzar de forma leve y progresar en minutos, en ocasiones los síntomas desaparecen y reaparecen varias horas después, dando lugar a una reacción bifásica.
Todo esto nos lleva a confundirla a veces con otras patologías comunes, como un síncope vasovagal o una crisis asmática, complicando su diagnóstico y tratamiento.
En los niños, es aún más d ifícil, ya que no siempre tenemos la posibilidad de comunicación con ellos, sobre todo en pacientes de corta edad que no siempre pueden contar claramente síntomas internos, ya sea porque aún no hablan o porque no saben describirlo.
ifícil, ya que no siempre tenemos la posibilidad de comunicación con ellos, sobre todo en pacientes de corta edad que no siempre pueden contar claramente síntomas internos, ya sea porque aún no hablan o porque no saben describirlo.
El estudio publicado por Handorf et al (1) propone una serie de modificaciones en los criterios diagnósticos actuales para mejorar la identificación de anafilaxia en lactantes y niños en edad preescolar. Estas modificaciones consideran manifestaciones clínicas específicas de la edad, que a menudo se pasan por alto, mejorando así la precisión diagnóstica de este grupo etario.
Los criterios clínicos más utilizados en Estados Unidos actualmente para el diagnóstico de la anafilaxia son los National Institute of Allergy and Infectious Diseases/Food Allergy and Anaphylaxis Network (NIAID/FAAN) , publicados en 2006(2). Estos criterios no han sido validados en niños de menos de dos años y no tienen en cuenta las diferencias específicas que pueden aparecer en esta población.
El grupo de Handorf incluyó una revisión retrospectiva de 337 casos de reacciones alérgicas atendidos en su servicio de urgencias (1). En su artículo, implementan las modificaciones a los criterios NIAID/FAAN que tienen en cuenta diferencias específicas de cada edad, incluyendo el uso de signos equivalentes para remplazar síntomas subjetivos en esta población en ocasiones no verbal. También se añadieron señales del shock anafiláctico compensado (taquicardia, cianosis, cambios en el estado mental) y se incluyeron otros signos de distrés fisiopatológico específico de esta población como taquipnea, tiraje intercostal, llanto ronco, tos etc. La dificultad para tragar o la falta de aire puede manifestarse como llanto o irritabilidad.
Estas diferencias se sintetizan en la tabla:
| Tipo de manifestación | Síntomas incluidos en los criterios NIAID/FAAN | Síntomas propuestos en la modificación de Handorf et al.(1) |
|
Mucocutáneos
|
Habones/urticaria, prurito, flushing, angioedema de labios, de lengua, de úvula o de paladar blando. | Habones/urticaria, prurito, flushing, angioedema de labios, de orejas, párpados, facial, extremidades, picor oral, lingual, faríngeo, protrusión lingual, lamidos* |
|
Respiratorios
|
Disnea, sibilancias, broncoespasmo, estridor, descenso del PEF, hipoxemia. | Disnea, sibilancias, broncoespasmo, estridor, hipoxemia, cianosis, tos, babeo, taquipnea, aumento del trabajo respiratorio, voz o lloro ronco. |
|
Gastrointestinales
|
Dolor abdominal tipo cólico, vómitos. | Dolor abdominal, vómitos, náuseas, esputos, diarrea, arqueo de la espalda o hipertonicidad. |
|
Cardiovasculares/ otros
|
Hipotensión, hipotonía, síncope, incontinencia. | Hipotensión, hipotonía, síncope, incontinencia, taquicardia, cianosis, palidez, moteado cutáneo, letargia, alteración del estado mental#. |
* lamer los labios, las manos u otros objetos.
# Irritable, retraído, inconsolable, menos activo sin otra explicación.
Modificado de Handorf et al (1).
Los casos que cumplieron los criterios de inclusión fueron 175 pacientes, de los que el 33% tenían menos de un año, el 39% entre 12- 36 meses y el 29% eran niños entre 3- 6 años. Según los criterios NIAID/FAAN, se identificaban el 85% de todos los casos, mientras que con los criterios modificados se alcanzó el 98% (p<0.001). Los criterios modificados identificaron un 23% más de casos en lactantes (p<0.001) y un 10% más de en niños de entre 12-36 meses (p=0.04).
Algunos de los síntomas que son frecuentemente pasados por alto fueron: taquicardia, taquipnea, alteración del estado mental y cianosis. Estos no se mencionan en las guías actuales, aunque representan síntomas de shock compensado o de otras formas de compromiso cardiovascular.
Algunos de los síntomas respiratorios que observaron fueron tos (12%), sibilancias (14%), disnea (11%), salivación excesiva o babeo (11%) y aumento del trabajo respiratorio (14%). El síntoma cutáneo más común fue la aparición de habones (74%), pero también se observó con frecuencia inflamación de la cara, ojos o pabellones auriculares (30%), inflamación de labio (30%), flushing facial (30%) y prurito (25%). Los síntomas gastrointestinales incluyeron vómitos (50%), y diarrea (9%).
El uso de estos criterios modificados puede mejorar la identificación de la anafilaxia en niños pequeños comparando con los criterios actuales. Los resultados de este estudio ponen el foco en los diferentes síntomas que puede aparecer en los pacientes pediátricos y ayudan a sensibilizar sobre el manejo de la anafilaxia, especialmente con lactantes o niños pequeños.
Sería conveniente realizar más estudios con mayor número de pacientes y centros participantes para evaluar y validar estos criterios de identificación de anafilaxia.
Olaya Álvarez García. Servicio de Alergia del HUCA, Oviedo. Comité de Alergia Infantil, grupo de trabajo de anafilaxia.
Bibliografía
1.-Handorf A, Roy IR, Cohen A, Camargo CA Jr, Dribin TE, Pistiner M. Development and Evaluation of Modified Criteria for Infant and Toddler Anaphylaxis. J Allergy Clin Immunol Pract. 2024 Aug;12(8):2026-2034.e2
2.-Sampson HA, Munoz-Furlong A, Campbell RL, et al. Second symposium on the definition and management of anaphylaxis: Summary report—Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol. 2006;117(2):391–397.doi: 10.1016/j.jaci.2005.12.1303
Cuestionarios de Calidad de Vida e inmunoterapia específica con alérgenos
Los cuestionarios de calidad de vida como el Cuestionario de Calidad de Vida en Asma (AQLQ, por sus siglas en inglés) y Cuestionario de Calidad de Vida en Rinoconjuntivitis y Rinitis Alérgica (RQLQ, por sus siglas en inglés) son herramientas valiosas para comprender el impacto del asma y la rinitis en la calidad de vida de los pacientes afectados y sirven como herramienta de comparación validado para evaluar el efecto de tratamientos como la inmunoterapia (1,2).
Estos cuestionarios evalúan varios dominios o campos donde figuran los síntomas respiratorios o naso-oculares, la limitación de la actividad diaria, el sueño, la esfera psicológica y la exposición ambiental. Dan más información al profesional del impacto de la enfermedad en la vida cotidiana del paciente (2).
El AQLQ consta de 32 ítems, agrupados en 4 dominios y cada pregunta se puntúa según una escala de Likert de 7 puntos. Puntuaciones más altas indican una mejor calidad de vida.
El RQLQ consta de 28 preguntas agrupadas en 7 dominios, también se puntúan según escala de Likert de 7 puntos. En este caso, las puntuaciones más altas significan peor calidad.
Se han utilizado en investigación para evaluar los cambios en la severidad de la enfermedad y en la esfera de la vida del paciente que es capaz de lograr la inmunoterapia especifica con alérgenos. Son una herramienta muy usada en trabajos para evaluar el impacto de la inmunoterapia sublingual y subcutánea demostrándose mejoras en la calidad de vida en diferentes grupos de edad. En resumen, son una herramienta adicional para determinar el impacto de la eficacia de la inmunoterapia con alérgenos en el día a día del paciente (2,3,4).
¿Podría ser una herramienta en la consulta de alergia en vida real o práctica clínica habitual?, ¿Nos ayudarían a saber en nuestra consulta si una inmunoterapia es eficaz?:
Expertos han coincidido que su uso rutinario en todas las consultas puede estar limitado debido al tiempo que requieren para su aplicación y análisis especialmente cuando hay un gran volumen de pacientes y pocos profesionales. El tiempo promedio de duración de estas pruebas es de 10 minutos. Sin embargo, debido a la importancia de la información que se obtiene se han hecho versiones validadas más pequeñas, el mini AQLQ y el mini RQLQ que se pueden realizar en 3 a 5 minutos. De esta manera se hace más factible de realizar en la consulta para la toma de decisiones terapéuticas.
Estos cuestionarios pueden ayudarnos a hacer más objetiva y medible la mejoría sintomatológica y el impacto en la calidad de vida del paciente que recibe inmunoterapia especifica con alérgenos, sobre todo si estas mejoras preceden a cambios en los biomarcadores o estos últimos no experimentan cambios a pesar de observar progresos en los síntomas (5).
- Juniper, E.F., Thompson, A. K., Ferrie, P.J., & Roberts, JN. (1999). Validation of the Rinoconjuntivitis Quality of Life Questionnaire: RQLQ. Journal of Allergy and Clinical Immunology, 103(2), 309-319.
- Bousquet, P.J., et al. (2011) Sublingual immunotherapy improves quality of life in perennial allergic rinitis: a randomized, double-blind, placebo-controlled trial. Journal of Allergy and Clinical Immunology, 127(6), 14011407.
- Durham, S.R., et al (2007). Long-lasting effects of Grass pollen immunotherapy: 10-year follow-up from a randomised cpntrolled trial. Allergy, 62(6), 717-720.
- Kleine-Tebbe, J., et al. (2009). AERO-SLIT study: efficacy and safety of 2 years of allergen immunotherapy with a 5-grass pollen Tablet in adults with allergic rhinoconjunctivitis. Allergy, 64(10), 1507-1515.
- RIAIT (Italian Registry of Allergen Immunotherapy): Protocol for a New Tool in a New Vision of Disease-Modifying Therapy for Allergist. Pers. Med 2024, 14, 854.
Práctica clínica de olfatometría: evaluación e interpretación 2025
Primer curso de formación en Práctica clínica de olfatometría: evaluación e interpretación.
- Se celebrará los días 6 y 7 de junio en la sede de la SEAIC en Madrid.
- Dirigido a miembros del Comité de Rinología y Conjuntivitis Alérgica.
- Patrocinado por GSK.
![]() Programa solo para miembros del Comité de Rinología y Conjuntivitis Alérgica.
Programa solo para miembros del Comité de Rinología y Conjuntivitis Alérgica.
Si no lo ha hecho, identifíquese aquí.
Protocolo de actuación ante una reacción alérgica en la infancia (modificado de AEPNAA)
Desde el Comité de Enfermería os acercamos el Protocolo de Actuación ante una reacción alérgica en la infancia:
 Cargando...
Cargando...
Dermatitis Alérgica de Contacto en niños: Una realidad cada vez más frecuente
Situación actual y epidemiología
Durante mucho tiempo se pensó que la dermatitis alérgica de contacto (DAC) era una enfermedad exclusiva del adulto. Sin embargo, estudios recientes revelan una prevalencia similar a la de adultos, con casos descritos incluso en lactantes (1). Se estima que hasta un 16–20% de la población pediátrica está sensibilizada a algún alérgeno, aunque muchos casos no se diagnostican porque los síntomas se confunden con otras afecciones más comunes, como la dermatitis atópica (DA) (1,2). De hecho, menos del 10% de las pruebas epicutáneas se realizan en niños, lo que contribuye a este infradiagnóstico (1).
Dermatitis atópica y dermatitis alérgica: ¿cómo se relacionan?
La DAC y la DA pueden coexistir y a menudo se solapan, ya que ambas provocan inflamación y picor. Más de un tercio de los niños con DAC tienen también DA (1), y en muchos casos, los productos utilizados para tratar la piel atópica contienen ingredientes sensibilizantes que agravan los síntomas (1). Esta superposición puede dificultar el diagnóstico y retrasar el tratamiento adecuado.
En niños con DA, debe sospecharse una DAC cuando la dermatitis es recalcitrante al tratamiento convencional, presenta una distribución atípica (como afectación localizada de párpados, labios, manos, pies o zona del pañal), o empeora con el uso de productos destinados al cuidado de la piel atópica, los cuales pueden contener alérgenos como fragancias, lanolina o conservantes. También debe considerarse la DAC si las lesiones se localizan en áreas en contacto con cosméticos, cremas, ropa, joyas, materiales escolares o deportivos. En estos casos, la realización de pruebas epicutáneas permite identificar alérgenos relevantes y guiar el tratamiento (1,3).
¿Cómo se diagnostica?
El diagnóstico de la DAC en niños se basa en la historia clínica detallada y en la realización de pruebas epicutáneas, que son el método de referencia para identificar alérgenos causantes. Estas pruebas consisten en aplicar parches con alérgenos sobre la espalda del niño, retirarlos a las 48 horas, y realizar segunda lectura a las 72-96 horas. También se puede complementar con pruebas como el ROAT (Repeat Open Application Test), una prueba sencilla, no invasiva, que se utiliza para evaluar si un producto concreto (como una crema, cosmético o medicamento tópico) está causando una DAC. Es especialmente útil en niños o cuando no es posible realizar pruebas epicutáneas estándar (3,4).
En 2015, la EAACI (European Academy of Allergy and Clinical Immunology) propuso una batería reducida de alérgenos como herramienta práctica y segura para facilitar el diagnóstico en población pediátrica (5). Con el tiempo, la experiencia clínica y nuevas evidencias han puesto de manifiesto la necesidad de considerar también alérgenos emergentes, cada vez más presentes en productos infantiles como la metilisotiazolinona aislada, hidroperóxidos de limoneno y linalol, benzofenonas, 3-dimetilaminopropilamina (DMAPA), isobornil acrilato y clorhexidina. Además, se recomienda adaptar las pruebas a la exposición individual de cada paciente y complementarlas con productos propios y alérgenos actuales, con el objetivo de optimizar la precisión diagnóstica en niños (6-8).
¿Cuáles son los alérgenos más frecuentes?
En los niños, los alérgenos más comunes que pueden causar DAC incluyen (8-13):
- Metales: como el níquel, cloruro de cobalto y dicromato potásico, presentes en objetos de uso cotidiano como bisutería, gafas, relojes, calzado, ropa, juguetes, videoconsolas, teléfonos móviles, tablets, aparatos de ortodoncia, botas, sandalias o material deportivo.
- Conservantes: destacan la metilisotiazolinona (MI) y la metilcloroisotiazolinona (MCI), que se encuentran en productos como el slime, pinturas, productos de limpieza y equipamiento deportivo. Otro conservante importante es el formaldehído, que puede estar presente en algunas toallitas infantiles.
- Fragancias: como las mezclas de fragancias I y II, el bálsamo del Perú, y los hidroperóxidos de linalol y limoneno, que se utilizan en cosméticos, medicamentos tópicos y productos de limpieza.
- Emolientes: como la lanolina y el propilenglicol, habituales en cosméticos, bálsamos labiales y medicamentos de aplicación tópica.
- Tensoactivos: derivados del aceite de coco como la cocamidopropil betaína (CAPB) y su principal fracción alergénica, la 3-dimetilaminopropilamina (DMAPA), presentes en champús, acondicionadores y detergentes.
- Parafenilendiamina (PPDA): sustancia empleada en tatuajes de henna y tintes capilares.
- Colofonia: una resina procedente de la savia del pino, utilizada en adhesivos, apósitos, tintas, cosméticos, productos farmacéuticos y material escolar.
- Antibióticos tópicos: como la neomicina y la bacitracina, ampliamente utilizados en cremas y pomadas.
Además de los alérgenos clásicos, en los últimos años se han identificado alérgenos emergentes en la población pediátrica. Entre ellos destacan la benzisotiazolinona, presente en ropa, calzado y detergentes (5); la acetofenona azina, un derivado de la goma EVA presente en espinilleras y calzado infantil (6); el isobornil acrilato (IBOA), utilizado en dispositivos médicos como las bombas de insulina (4); la benzofenona-4, presente en algunos protectores solares; y la clorhexidina, cuyo uso cada vez más frecuente en antisépticos se ha relacionado con un aumento de casos de sensibilización (8–13).
Estrategias de prevención
Una de las estrategias más prometedoras es el enfoque PEAS (Pre-Emptive Avoidance Strategy), que propone evitar desde el inicio los alérgenos más comunes en productos infantiles. Esta medida preventiva puede aplicarse incluso sin diagnóstico previo, especialmente en niños con piel sensible o antecedentes de dermatitis, para prevenir sensibilizaciones en la población pediátrica (14).
Manejo y tratamiento
El tratamiento principal es la evitación del alérgeno, una vez identificado mediante pruebas epicutáneas. Para controlar los brotes, se utilizan corticoides tópicos suaves, inmunomoduladores y emolientes para restaurar la barrera cutánea. En casos más graves, puede ser necesaria la fototerapia o tratamiento sistémico (3,4). El seguimiento debe incluir educación continua a las familias, revisión de productos y apoyo emocional, ya que un manejo adecuado mejora significativamente la calidad de vida del niño y su entorno (1,14).
Autora: Dra. Ana Láinez Nuez. Servicio de alergología, Hospital IMED Valencia. Comité de Alergia Infantil SEAIC
Bibliografía
- Neale H, Garza-Mayers AC, Tam I, Yu J. Pediatric allergic contact dermatitis. Part I. Clinical features and common contact allergens in children. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.002
- Ortiz Salvador JM, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017. doi:10.1016/j.ad.2016.12.018
- Neale H, et al. Pediatric allergic contact dermatitis. Part II. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.001
- Young K, et al. Pediatric allergic contact dermatitis registry patch testing results from 2016–2022. J Am Acad Dermatol. 2023. doi:10.1016/j.jaad.2023.01.016
- de Waard-van der Spek FB, Darsow U, Mortz CG, et al. EAACI position paper for practical patch testing in allergic contact dermatitis in children. Pediatr Allergy Immunol. 2015;26(7):598–606. doi:10.1111/pai.12463
- Ortiz Salvador JM, Esteve Martínez A, Subiabre Ferrer D, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017;108(6):571–578. doi:10.1016/j.ad.2016.12.018
- Felmingham C, Davenport R, Bala H. Allergic contact dermatitis in children and proposal for an Australian Paediatric Baseline Series. Australas J Dermatol. 2019;60(4):308–313. doi:10.1111/ajd.13169
- Yu J, Atwater AR, Brod B, et al. Pediatric Baseline Patch Test Series: Initial Findings of the Pediatric Contact Dermatitis Workgroup. Dermatitis. 2018;29(4):206–212. doi:10.1097/DER.0000000000000353
- Lidén C, White I. Increasing non-cosmetic exposure and sensitization to isothiazolinones. Contact Dermatitis. 2024. doi:10.1111/cod.14433
- Manière I, et al. Sensitization properties of acetophenone azine: a new skin sensitizer identified in textiles. Contact Dermatitis. 2023. doi:10.1111/cod.14284
- Magdaleno-Tapial J, et al. Allergic contact dermatitis to chlorhexidine in pediatric patients. Pediatr Dermatol. 2019. doi:10.1111/pde.13808
- Heurung AR, Raju SI, Warshaw EM. Dermatitis. 2014;25(1):3–10. doi:10.1097/DER.0000000000000025
- Moral L, et al. Allergic contact dermatitis to chlorhexidine in children. Allergol Immunopathol (Madr). 2024;52(6):33–39. doi:10.15586/aei.v52i6.1171
- Hill H, et al. Pre-emptive avoidance strategy (PEAS). Expert Rev Clin Immunol. 2016. doi:10.1586/1744666X.2016.1142373
¿Qué es la repicadura intrahospitalaria controlada y por qué es clave en el tratamiento de la alergia a picaduras de abejas y avispas?
Las picaduras de abejas y avispas son muy comunes, y en algunas personas pueden desencadenar reacciones alérgicas graves, como la anafilaxia. Para estos casos, el tratamiento más efectivo es la inmunoterapia con veneno (también conocida como “la vacuna para la alergia al veneno”), que ofrece una alta protección y reduce de forma significativa el riesgo de una reacción grave en futuras picaduras.
Sin embargo, no existen análisis que permitan saber con certeza si una persona está completamente protegida. Aquí es donde entra en juego una herramienta fundamental: la repicadura intrahospitalaria controlada, que es una forma de prueba de exposición como en los casos del estudio del alergia a los fármacos.
Esta técnica se realiza en el hospital, en condiciones totalmente seguras, por parte de personal sanitario especializado del servicio de Alergia. Consiste en exponer de forma controlada al paciente al veneno del insecto (abeja o avispa) al que es alérgico, con el objetivo de comprobar si ya tolera la picadura gracias a la inmunoterapia. Todo se lleva a cabo en el hospital de día, que es un entorno preparado para actuar rápidamente en caso de que ocurra una reacción adversa.
La repicadura intrahospitalaria controlada se hace solo a pacientes seleccionados cuidadosamente, que han recibido tratamiento con inmunoterapia durante al menos seis meses y han mostrado una buena evolución clínica. También es fundamental elegir correctamente el himenóptero adecuado (abeja o avispa), ya que la inmunoterapia es específica para cada tipo de veneno.
La repicadura intrahospitalaria controlada sigue siendo la herramienta más fiable que tenemos para comprobar si el tratamiento está funcionando y garantizar que el paciente pueda enfrentarse con seguridad a una picadura espontánea en el futuro. El resultado negativo o la ausencia de reacción ante la picadura no solo confirma la protección, sino que también disminuye el miedo y mejora significativamente la calidad de vida de aquellos pacientes que temen futuras picaduras.
Javier Pereira
Miembro del Comité de Alergia a Himenópteros