recursos paraProfesionales
Últimas publicaciones comités científicos
HISTORIA DE LOS INHALADORES
La administración o aplicación de los tratamientos inhalados se conoce desde hace 4000 años en China, India y Egipto. En aquella época se administraban plantas ricas en escopolamina y en atropina (como Datura stramonium o Atropa belladona) en forma de vahos, fumigaciones, pipas de agua e incluso “cigarrillos terapéuticos” por su efecto relajante en el músculo bronquial.
La terapia inhalada comienza en los balnearios en el s.XIX cuando empiezan a utilizar las nebulizaciones para tratar la tuberculosis. En 1856, el médico Sales-Girons desarrolló el primer inhalador portátil lo que permitió la administración en domicilio. Aunque estos aparatos tuvieron detractores que los consideraban ineficaces, se siguieron desarrollando nuevos modelos. Si bien, en la farmacología el interés de la vía respiratoria fue en aumento sobre todo cuando se aisló la molécula de adrenalina en 1901 por Thomas Aldrich y Jokichi Takamine y cuando Bullying desarrolló un nebulizador con motor eléctrico. Los siguientes avances se dieron en conseguir broncodilatadores con menos efectos adversos y aparatos más pequeños que generaran partículas inferiores a 5 micras.
De esta forma, gracias a los avances en farmacología se consiguió identificar los receptores α y β adrenérgicos en 1947 y posteriormente, los β1 y β2 lo que dio lugar al descubrimiento en 1969 de un broncodilatador específico con mínimos efectos cardiovasculares y musculares, el salbutamol.
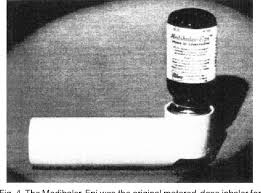
En 1948 se comercializó una primera versión de los futuros dispositivos de inhalación Aerohaler®. Era un vial de vidrio donde se colocaba el principio activo en forma de polvo seco la cantidad que en cada situación se consideraba adecuada y el paciente aspiraba a través de una pieza desmontable, por la boca o por la nariz. Este dispositivo fracasó ya que las dosis administradas eran variables, cada persona utilizaba la dosis que le parecía bien, además los asmáticos que lo utilizaban no eran capaces de generar el flujo suficiente para mover el fármaco y quedaba casi todo en el vial. Cuando se inhalaba por la nariz, la función de filtro de las fosas nasales hacía que no llegara el fármaco hasta el árbol bronquial, por lo que desde entonces se desechó la aplicación nasal.
El primer inhalador de cartucho presurizado surgió en el año 1956, a raíz de la insistencia de la hija asmática del doctor George Maison que le solicitaba un inhalador cómodo y portátil. Éste tenía un mecanismo valvular para dispensación de fluidos por medio de un propelente. Con el tiempo sería empleado en medicina pero también en cosmética (desodorantes, espuma de afeitar, etc) le denominaron Medihaler. Su éxito fue inmediato. Era un aparato ligero, portátil y que siempre administraba dosis fijas que venían medidas de fábrica. Su inicio de acción era rápido y cómodo de usar en cualquier lugar. Su principal desventaja era la coordinación de la inspiración con la activación del aparato.
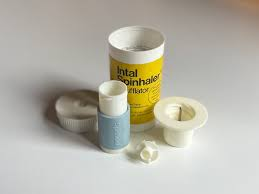
El origen de los inhaladores de polvo seco va unido al descubrimiento, por el médico Roger Altounyan, del cromoglicato disódico como protector del broncoespasmo por su acción relajante sobre el músculo liso. Debido a ello, en 1967 se lanzó al mercado el primer inhalador de polvo seco, Spinhaler® diseñado específicamente para administrar el cromoglicato disódico. Este dispositivo aportó dos grandes avances:a) administración de dosis fijas, por medio de una cápsula que se introducía en el dispositivo y se perforaba para liberar el polvo al inhalar; y b) no se planteaba como una medicación de rescate sino como una “profilaxis”. Spinhaler® ha dado lugar a toda la familia de inhaladores de polvo seco. Y además aportaba la ventaja frente al inhalador de cartucho presurizado de no tener que coordinar la inhalación con la función del aparato. Sus desventajas es que precisan mayor flujo inspiratorio y su uso puede ser complejo en personas mayores o con deformidad en las manos.
En los años 70 llegaron las cámaras espaciadoras/inhalatorias, permitiendo llevar los beneficios del cartucho presurizado a pacientes con dificultad para coordinar la maniobra.
En los años 80 aparecieron los inhaladores de polvo seco multidosis, Diskhaler®. Esto reducía la complejidad y dificultad de la maniobra ya que las cápsulas con el polvo seco vienen integradas en el dispositivo y sólo hace falta cargarlas e inhalar. Aunque siguen precisando de alto flujo inspiratorio por parte del paciente y no se pueden acoplar a una cámara espaciadora al igual que los dispositivos de polvo seco unidosis.
A partir de estas familias de inhaladores, (cartuchos presurizados, inhaladores de polvo seco unidosis y multidosis) han ido surgiendo diferentes sistemas modernos que reutilizan la idea original y añaden mejoras como contadores de dosis, sistemas de feedback para que el paciente realice correctamente la técnica inhalatoria, etc.
Desde 1997 se conocen los inhaladores de vapor suave (Respimat®), en el que el fármaco en disolución es propulsado por un efecto de muelle, sin propelentes. Esto permite una maniobra inhalatoria sencilla, con una capacidad inspiratoria baja o muy baja, que unido a su producción de partículas muy pequeñas alcanza un gran depósito pulmonar. De todas maneras este sistema no llegó a España hasta 2010.
Otras variantes del cartucho presurizado clásico que han aparecido después han sido los sistemas Alvesco® y Modulite® donde el fármaco está disuelto, en vez de en suspensión, produciendo partículas muy finas y permitiendo una penetración pulmonar mayor. A su vez los sistemas accionados por la inspiración, Autohaler®, Easy Breath ® perciben el momento en que el paciente realiza la inspiración y se activan para propulsar el fármaco. Aunque este sistema no se ha comercializado en España.
BIBLIOGRAFÍA
- Las 4 reglas de la terapia inhalada.
- https://www.agefec.org/web/wp-content/uploads/2013/03/INFORMACI%C3%93N-ESCRITA-TALLER.pdf
- GEMA inhaladores. Terapia inhalada: fundamentos, dispositivos y aplicaciones prácticas. 2018
Si soy alérgico al huevo, ¿puedo vacunarme frente a la COVID-19 y la gripe?
Los pacientes alérgicos al huevo y las vacunas cultivadas en embrión de pollo, huevo embrionario o fibroblastos de embrión de pollo que pueden contener trazas de proteína de huevo han sido motivo de preocupación a la hora de aconsejar la vacunación. Mientras que la vacuna del COVID no contiene huevo ni sus proteínas, la vacuna de la gripe sí contiene ovoalbúmina en cantidades residuales (<1mcg/dosis). Aunque en la ficha técnica de la mayoría de vacunas de la gripe aún se contraindica su administración en alérgicos al huevo, las guías médicas ya recomiendan no tomar precauciones especiales para la vacunación contra la gripe en pacientes alérgicos al huevo dado que no se ha demostrado ningún aumento en la notificación de reacciones alérgicas, incluida la anafilaxia, en personas alérgicas al huevo después de vacunarse contra la gripe en comparación con la población general.
La anafilaxia es un evento raro tras la administración de cualquier vacuna. En los casos en los que se ha objetivado una reacción alérgica o anafiláctica tras la administración de la vacuna de la gripe, ésta suele deberse a otros componentes de la vacuna y no al huevo. Por lo que, en caso de que un paciente, independientemente de que sea alérgico o no al huevo, presentase una reacción alérgica o anafiláctica tras la administración de la vacuna de la gripe, debería ser remitido al servicio de Alergología para realizar los estudios competentes que aclaren la causa de esta reacción.
En conclusión, existe suficiente evidencia médica que constata que los pacientes alérgicos al huevo no sólo pueden recibir la vacuna del COVID sino también la vacuna de la gripe de manera segura sin mayor riesgo de sufrir una reacción alérgica que las personas sin alergia al huevo. En caso de sufrir una reacción alérgica con la vacuna de la gripe es cuando estaría indicada la derivación al servicio de Alergología y la toma de precauciones especiales si lo requiriese. No obstante, estas vacunas deben administrarse en un centro de vacunación correctamente equipado bajo la supervisión de personal sanitario.
Soledad Sánchez Sánchez
Especialista en Alergología
Complexo Hospitalario Universitario A Coruña
LAS PLAQUETAS Y SUS VESÍCULAS EXTRACELULARES EN LA INFLAMACIÓN ALÉRGICA
La alergia respiratoria es una enfermedad heterogénea y difícil de tratar, con un fuerte impacto en la calidad de vida del paciente y un elevado coste para los sistemas sanitarios. Estos pacientes suelen sufrir exacerbaciones que llevan a un estado inflamatorio crónico que inducedaños irreversibles en la barrera epitelial.1–4
Los pacientes alérgicos respiratorios especialmente graves representan un reto clínico, ya que en generalno responden a los tratamientos terapéuticos disponibles. Conocer los procesos moleculares y celulares que tienen lugar en estos pacientes podría ayudar a diseñar nuevas intervenciones personalizadasy encontrar biomarcadores para su adecuadaestratificación.
La implicación de células inmunitarias innatas como los basófilos, los mastocitos, los monocitos y los eosinófilosen las enfermedades inflamatorias ha sido ampliamente descrita. Sin embargo, no ha sido hasta hace poco cuando se ha descubierto el papel de las plaquetas dentro del sistema inmunitario innato. En concreto, se han detectado alteraciones plaquetarias en trastornos inflamatorios como la artritis reumatoide, la esclerosis múltiple, la enfermedad de Crohn y la sepsis.5-8
En 2018, Obeso et al. realizaron un análisis multi-ómico con muestras de pacientes alérgicos estratificados por gravedad y encontraron evidencias que apuntaban a la asociación de la inflamación alérgica grave con la alteración de las funciones plaquetarias9. Como células anucleadas, las plaquetas pueden sintetizar un número limitado de proteínas a partir de su ARNm precargadopero la inflamación puede alterar el panorama transcripcional de las plaquetas, como se ha observado en las plaquetas humanas durante la sepsis10.Conjuntamente, la activación plaquetaria se asocia a fuertes cambios metabólicos, especialmente en el metabolismo lipídico11. La señalización lipídica plaquetaria es clave en trastornos inflamatorios como la sepsis. Sin embargo, el contenido lipídico de las plaquetas y su implicación en la inflamación alérgica era un campo inexplorado.
Recientemente, se ha demostrado que las plaquetas son una fuente de mediadores proinflamatorios que diferencian a los pacientes alérgicos graves de los leves y que revelan tanto nuevos mecanismos de regulación inmunitaria como posibles biomarcadores novedosos12.En este estudio, se realizó un fenotipado multi-ómico del plasma rico en plaquetas (PRP) de pacientes alérgicos respiratorios estratificados en graves y leves, y de un grupo de sujetos no alérgicos. Los resultados de la lipidómica mostraron que las plaquetas de pacientes alérgicos graves presentaban niveles elevados de ceramidas, fosfoinositoles, fosfocolinas y esfingomielinas. Por el contrario, mostraban nivelesdismunidos de precursores de eicosanoides. Los resultados de transcriptómica mediante RNAseq confirmaron la sobreexpresión de ARNm de genes relacionados con la activación plaquetaria y el metabolismo del ácido araquidónico en los fenotipos graves. El análisis de las rutas biológicas indicó la alteración de las vías inflamatorias NOD, MAPK, TLR, TNF e IL-17 en el fenotipo grave. Además, las proteínas P-Selectina e IL-17AF estaban aumentadas en el fenotipo grave. Los resultados mostraron que las plaquetas de pacientes alérgicos graves son fuente de lípidos proinflamatorios y presentan marcadores genéticos y proteicos relacionados con una alta activación plaquetaria.
Por otro lado, las plaquetas activadas liberan vesículas extracelulares (EVs) que a diferencia de las plaquetas pueden atravesar las barreras endoteliales y extender su alcance y potencial impacto a otros fluidos y tejidos13. Las EVs son partículas con membrana lipídica con un papel crucial en la comunicación intercelular. Estas partículas transportan proteínas, metabolitos y ácidos nucleicos que son transportados desde la sangre a diferentes tejidos, lo que puede impactar en la respuesta inmunitaria14.
El contenido metabólico de las EVs de plaquetas (PL-EVs) de pacientes con alergia respiratoria grave ha sido recientemente estudiado15. En este trabajo se aislaronPL-EVs de PRP de pacientes con alergia respiratoria grave, leve y de sujetos no alérgicos. Se demostró que las PL-EVs de todos los grupos experimentales eran similares en cuanto a concentración y tamaño de las PL-EVs, y la concentración de proteínas y ARN que contenían. Posteriormente se realizó un análisis metabolómico de su contenido mediante cromatografía de líquidos y cromatografía de gases, ambas acopladas a espectrometría de masas. Los resultados del estudio mostraron que los grupos de PL-EVs que más se diferenciaban entre si eran el de sujetos no alérgicos y el de pacientes alérgicos graves, siendo la mayoría de los metabolitos diferenciales encontrados fosfolípidos y lisofosfolípidos. También se encontraron metabolitos como la L-carnitina, los triglicéridos y una ceramida que estaban disminuidos en las PL-EVs de los pacientes graves a comparación de leves. Estos metabolitos están relacionados con rutas biológicas como transporte de vesículas, señalización celular y respuesta inmune, lo que sugiere que la carga metabólica diferencial de las PL-EVs de los pacientes alérgicos podría tener un papel en la inflamación.
En conjunto, las plaquetas y las PL-EVs de los pacientes alérgicos transportan lípidos y metabolitos específicos según el grado de inflamación de los pacientes alérgicos, lo que abre nuevas vías deinvestigación para caracterizar la progresión de la inflamación alérgica.
Bibliografía
Alergia a las carnes
El valor nutricional de la carne se debe a que está formada por proteínas de alto valor biológico como fuente de aminoácidos esenciales, vitamina B y hierro, muy aprovechables por nuestro organismo.
La alergia a las carnes es una alergia alimentaria poco frecuente en los países desarrollados, a pesar de su elevado consumo. En la infancia, suele asociarse con dermatitis atópica y tiende a desaparecer en los primeros años de vida. No obstante, la alergia a la carne también puede aparecer “de novo” en la edad adulta.
En la actualidad, se desconoce la incidencia general y la prevalencia de la alergia a las carnes en la población general. Entre los pacientes con alergia alimentaria, se ha informado de alergia a la carne en el 3-15% de casos pediátricos y en el 3% de casos adultos.
Su baja prevalencia puede atribuirse, en parte, al hecho de que la mayoría de las carnes se consumen cocidas, y cocinarlas, normalmente aunque no siempre, reduce su alergenicidad.
Las reacciones pueden ser muy variables, desde un cuadro leve de picor en la boca y garganta o algunos habones aislados, pasando por angioedema (inflamación) de labios, párpados… hasta urticaria más extensa, rinoconjuntivitis, asma, síntomas digestivos, y/o cuadros muy graves de anafilaxia.
El tipo de carne que causa la alergia, presenta variabilidad geográfica, en relación con los diferentes hábitos de consumo. En nuestro medio, la alergia a las carnes de mamíferos es más frecuente que la alergia a las aves de corral. De acuerdo con esto, se ha descrito alergia a carne de canguro en Australia y a carne foca y ballena en Alaska.
La alergia a carne de vaca es la más comúnmente reportada, con una prevalencia que oscila entre el 1,5 y el 6,5% entre los niños con dermatitis atópica o con alergia alimentaria. Sin embargo, la alergia a carne de ternera, puede llegar al 20% en niños con alergia a leche de vaca. También se han informado casos de alergia a carne de cerdo, cordero, conejo, pollo y pavo, pudiendo ser alérgico a la carne de una especie o de varias.
- Alergia a carne de vacuno: frecuentemente debida a una proteína (albúmina sérica bovina), que se inactiva con el calor, pudiendo producir reacciones si la carne está cruda o poco cocinada, tolerándose perfectamente cuando la carne está bien cocinada. Se ha demostrado que la homogeneización y liofilización (empleadas en la producción de alimentos para bebés) disminuyen el contenido de albúminas e inmunoglobulinas en la carne, al igual que la digestión con pepsina. Algunos niños con alergia a proteínas de leche de vaca pueden presentar también reacciones con ternera e incluso con otras carnes, pero esto solo ocurre en un pequeño número de casos, generalmente cuando el alérgeno responsable de su alergia es la albúmina sérica bovina.
- Alergia a carne de cerdo: se pueden producir sensibilizaciones primarias a la albúmina sérica y a las inmunoglobulinas por vía inhalada o cutánea, que en primer lugar ocasionan alergia respiratoria y, de forma secundaria, y por reactividad cruzada, reacciones alérgicas tras la ingestión de carne de cerdo poco cocinada. El denominado “síndrome gato-cerdo” es la asociación de alergia respiratoria a gato y alergia alimentaria a la carne de cerdo. Característicamente, estos pacientes pueden no tener síntomas de rinitis al contacto con gatos, ya que la mayoría de los pacientes con síntomas alérgicos a la caspa de gato están sensibilizados a un alérgeno diferente. Se ha descrito también una asociación entre la alergia respiratoria a gato y la carne de cordero o de caballo, y una alergia respiratoria a hámster y alergia a carne de caballo.
- Alergia a carne de cordero: es la más infrecuente aunque, en ocasiones, se asocia a alergia a carne de ternera y cerdo.
- Alergia a carne de pollo: aunque la alergia a huevo es muy frecuente en la infancia, casi todos los niños alérgicos a huevo toleran la carne de pollo. Por otro lado, se han descrito adultos alérgicos a la carne de ave, con tolerancia de huevo y sin alergia a plumas o caspa de ave, cuyos alérgenos responsables, no han sido identificados. Por otra parte existe un síndrome poco frecuente, el “síndrome pescado-pollo”, donde las personas presentan síntomas alérgicos tanto con carne de pollo como pescado y en el que los alérgenos principalmente responsables son las parvalbúminas.
- Síndrome ave-huevo: debido al contacto frecuente con pájaros en el domicilio o en criaderos, hay un grupo minoritario de alérgicos que se sensibilizan por vía inhalada a proteínas de las plumas y/o excrementos de las aves y posteriormente desarrollan alergia al huevo y a la carne de pollo u otras aves (loros, periquitos, canarios, palomas, aves de corral, etc.). Afecta a personas adultas que presentan síntomas con la yema de huevo cruda o poco cocinada, a diferencia de lo que ocurre con la forma de alergia más habitual al huevo que se produce en la infancia y es por sensibilización a proteínas de la clara.
- Síndrome Alfa-gal: en general, las reacciones alérgicas a las carnes suelen ser reacciones de hipersensibilidad inmediata, que ocurren en la primera hora tras la ingesta. En este síndrome, las reacciones tras ingerir carnes de mamíferos (ternera, cerdo, cordero) tienen lugar más tarde de lo habitual, entre 3, 6 y hasta 8 horas después de haberlas ingerido, debido a la unión del alérgeno alfa-gal a los lípidos, que se absorben más lentamente y mediante mecanismos diferentes en comparación con las proteínas. Pueden producirse desde urticarias más o menos extensas hasta cuadros graves de anafilaxia. Estas personas reaccionan a un carbohidrato presente en las carnes de mamíferos no primates llamado galactosa alfa 1-3 galactosa (alfa-gal), al que se han sensibilizado. La sensibilización se ha producido en algún momento, tras la picadura de garrapatas que llevan alfa-gal en su saliva y la inoculan con la picadura. Además de reaccionar a los alimentos, los pacientes sensibilizados a alfa-gal también pueden tener reacciones al anticuerpo monoclonal cetuximab, gelatinas, coloides intravenosos, heparina, válvulas cardiacas de origen bovino o porcino y otros agentes hemostáticos derivados de productos animales.
En la alergia a las carnes, a diferencia de lo que sucede con otros alimentos, se han identificado alérgenos tanto de proteínas como de carbohidratos. Las albúminas séricas y las inmunoglobulinas parecen ser las principales proteínas alergénicas en la carne de ternera y otras carnes de mamíferos (cerdo, cordero, conejo), con una gran homología entre sí, lo que explicaría la alta reactividad cruzada entre carnes de mamíferos. Estas proteínas también podemos encontrarlas en aves como el pollo, aunque con una menor homología con las de los mamíferos, lo que explicaría que los individuos tiendan a reaccionar a carnes de mamíferos o aves pero rara vez a ambas.
El diagnóstico general de alergia a las carnes se realizará en base a la historia clínica y mediante la realización de pruebas cutáneas (prick-test) con extractos de las distintas carnes y la medición en sangre de los niveles de anticuerpos IgE específicos para cada uno de ellos. En ocasiones es necesaria la realización de una prueba cutánea con el alimento en freso (prick-prick) y si hay dudas, también puede ser necesario realizar un test de exposición oral controlada, siempre bajo supervisión del especialista.
En las reacciones con preparados cárnicos, como embutidos o salchichas, habrá que descartar una alergia a algún alimento o compuesto añadido o en el proceso de elaboración, como las proteínas de la leche, el huevo o los hongos.
Ante un diagnóstico confirmado, hoy por hoy, el tratamiento es evitar la ingesta de la carne responsable y los productos elaborados con ella (embutidos, salchichas, gelatinas,…). No obstante, conocer los alérgenos responsables, puede permitir una dieta más flexible, de manera que hay pacientes, cuya alergia depende de las albúminas séricas, que toleran la carne bien cocinada, y otros, presentan síntomas o no dependiendo del grado de cocinado y otro grupo no la tolera de ninguna forma. En algunos casos, se deberán eliminar de la dieta varios tipos de carnes, en cuyo caso, podría ser necesario aportar a la dieta suplementos de hierro y vitamina B.
Dra. Angélica Feliú Vila. Hospital Universitario del Tajo, Madrid. Comité de Alergia Infantil. SEAIC
Bibliografía
- Scott P Commins, MD, PhD. Allergy to meats. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed),Up To Date, Anna M Feldweg, MD. (Accessed on april of 2024).
- Scott H Sicherer, MD, FAAAAI. Food allergens: Clinical aspects of cross-reactivity. In: UpToDate, Robert A Wood, MD (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april of 2024).
- Julie Wang, MD. Component testing for animal-derived food allergies. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april 2024).
- García Figueroa, B.E, Mateo Borrega, M.B, 2021. Alergia a las carnes. Zubeldia, J.M, Baeza, M.L, Chivato, T, Jáuregui, I, Senent, C.J. Libro de las enfermedades alérgicas (287-292).
¿En qué consisten las pruebas cutáneas a medicamentos?
Las pruebas cutáneas son útiles para el diagnóstico de la alergia a medicamentos. Existen tres tipos de pruebas cutáneas para el diagnóstico alergológico: prick-test (pruebas intraepidérmicas), pruebas intradérmicas y las pruebas epicutáneas (parches). En el prick test se aplica una gota del medicamento a estudiar en la cara anterior del antebrazo y se hace una ligera punción con una lanceta a través de la gota de dicho medicamento y la capa más externa de la piel conocida como epidermis. De esta forma, se permite que el medicamento penetre y contacte directamente con las células responsables de las reacciones alérgicas, los mastocitos.
Si el paciente presenta un resultado positivo, los mastocitos reaccionan, liberando unas sustancias que producen inflamación, lo que se traduce en la aparición de una roncha o habón, rodeada de un eritema (piel roja). Esta respuesta se inicia en pocos minutos y es máxima a los 15 o 20 minutos y va cediendo a lo largo de las horas.
Si el resultado es negativo, es decir, no se produce la aparición de la roncha, se procede a la prueba cutánea intradérmica. Estas pruebas son más sensibles que las anteriores y consisten en la inyección directa del medicamento en la segunda capa de la piel del paciente (dermis), con una aguja muy fina y se procede a la lectura de forma similar al prick. Está técnica tiene la ventaja de poder investigar la alergia de tipo tardío, que consiste en hacer una lectura a las 24, 48 e incluso 96 horas.
Las pruebas epicutáneas, llamadas también pruebas de parche, consisten en la aplicación sobre la piel, sin punzar, del medicamento sospechoso. Se utilizan generalmente para el diagnóstico de dermatitis de contacto y reacciones tardías, aquellas que aparecen más de 6 horas entre la administración del fármaco y la aparición de la reacción. Se mantiene el alérgeno en la piel, tapado con una tira adhesiva, que se retirará a las 48 horas. La lectura inicial de estas pruebas se realiza a las 48 horas y la respuesta se observa aproximadamente 2 días después de la retirada del parche.
Para realizar las pruebas cutáneas, no se debe de dejar de tomar la medicación habitual. Es importante evitar el tratamiento con antihistamínicos (cetirizina, ebastina, loratadina…) 5-7 días antes de las pruebas y los corticoides orales entre 7 a 21 días antes de las pruebas.
Dra. Giovanna Araujo Sánchez, M.D. PhD.
Servicio de Alergología (ICR).
Hospital Clínic Barcelona. IRCE-IDIBAPS.
LA INVESTIGACIÓN ENFERMERA
La enfermera, profesional que proporciona los cuidados de excelencia a la persona, forma parte de la historia de la Salud/Enfermedad y, por tanto, es imprescindible el análisis de la evolución de los cuidados, de la profesión y de la relación con la sociedad. Esto se obtiene a través de la investigación que, en Enfermería es muy reciente, debido a que tiene que haber un interés de las enfermeras por investigar y un reconocimiento de la labor investigadora enfermera. Realmente, si tenemos en cuenta las cuatro etapas de la historia de la Enfermería (doméstica, vocacional, técnica y profesional) aunque haya habido interés por la investigación
desde las etapas iniciales, no es hasta la etapa profesional donde se reconoce la investigación enfermera.
Florence Nightingale (1820-1910) está considerada la primera enfermera investigadora y con sus observaciones se reconoció el valor del cuidado. Fue pionera en el uso de la estadística y la visualización de datos y la primera mujer admitida en la Royal Statistical Society.
Gracias al estudio de enfermeras teoristas (Hildegard Peplau y Virginia Henderson) se empieza a publicar en revistas y libros sus aportaciones y se comienza a hablar del proceso de Enfermería. Además, surgen grupos de estudios importantes como North American Nursing Diagnosis Association (NANDA).
Con la formación universitaria de la enfermera, pasando de ATS a Diplomada Universitaria en 1977, comienza la etapa profesional y la investigación enfermera, aunque con escaso reconocimiento o valor. Por ello, las enfermeras comienzan a realizar sus Tesis ligadas a otras Licenciaturas realizadas.
Un punto de inflexión fue la Ley General de Sanidad (Ley 14/1986) que posibilita la investigación a todos los profesionales sanitarios y se crea el Instituto de Salud Carlos III como órgano de apoyo científico-técnico. En 1987, el Fondo de Investigación Sanitaria (FIS) reconoció la capacidad investigadora de las enfermeras que podían solicitar sus ayudas e introdujo enfermeras en las Comisiones Técnicas de Evaluación.
A partir de la década de los 90, la investigación enfermera tiene un gran desarrollo. En 1996, se crea la Unidad de Investigación en Cuidados y Servicios de Salud (Investén-isciii) para fomentar la investigación en cuidados de enfermería y otras disciplinas relacionadas. Posteriormente, la Asociación de Enfermeras Registradas de Ontario (RNAO) elabora, publica y actualiza Guías de Buenas Prácticas (GBP), basadas en la evidencia científica para mejorar el cuidado de la salud y de los ambientes laborales. Con la conversión de la formación a Grado de Enfermería en 2010, se impulsa la investigación con la realización de master y el Doctorado en la profesión. Además, tanto los colegios profesionales como el Consejo General de Enfermería, fomentan la formación en este campo, ofrecen premios y ayudas para impulsar proyectos de investigación y se crea el Instituto Español de Enfermería con cobertura nacional que promociona la investigación para garantizar la salud y seguridad en los cuidados.
Más recientemente, la Asociación Nacional de Directivos de Enfermería (ANDE) desarrolla Nursing Research Council (NRC), un proyecto de innovación y gestión que tiene como objetivo general impulsar la investigación enfermera dentro de las organizaciones sanitarias y sociosanitarias.
Lo primero que surge cuando se inicia un estudio de investigación es una “pregunta”. Esta pregunta ha de ser Factible, Interesante, Novedosa, Ética y Relevante (criterios FINER). Una vez que tenemos nuestra pregunta debemos plantearnos si su resolución contribuirá a formular o modificar prácticas o políticas asistenciales o si sus resultados permitirán aceptar o rechazar conjeturas que no han sido probadas.
El segundo paso es formular nuestra pregunta. El enunciado debe contener el objetivo del estudio y la hipótesis. Esta hipótesis ha de ser consistente, coherente y comprobable, y el objetivo debe hacer referencia al resultado que se pretende obtener tras la investigación.
Una vez establecida nuestra pregunta, toca elegir el diseño del estudio y llevar a cabo el proyecto de investigación considerando posibilidades de financiación y disponibilidad de recursos. Y finalmente, implementar y difundir los resultados obtenidos.
Todo ello, en un proceso científico que valida y mejora el conocimiento existente generando otros nuevos con la finalidad de avanzar hacia una profesión más autónoma con un rol independiente, responsable, competente y con un cuerpo de conocimientos científicos basados en la evidencia para ofrecer cuidados de excelencia que mejoran la salud y el bienestar de los usuarios. Esto fomenta el reconocimiento y el valor de la enfermera dentro de los equipos multidisciplinares y en la sociedad que contribuye a dar valor a nuestra profesión.
Para más información:
https://grupoinvesten.es/quienes-somos/
https://www.consejogeneralenfermeria.org/profesion/premios-y-becas
BIBLIOGRAFÍA
- García García I, Gozalbes Cravioto E. Investigación en Enfermería y en Historia de la Enfermería en España. Index Enferm [Internet]. 2012. [citado 14 Jun 2024]; 21(1-2):100-104.Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1132-12962012000100023&lng=es.https://dx.doi.org/10.4321/S1132-12962012000100023.
- Arratia, F. Investigación y documentación histórica en enfermería.Texto & Contexto-Enfermagem. [Internet]. 2005[citado 14 Jun 2024];14: 567-574. Disponible en: https://doi.org/10.1590/S0104-07072005000400014
- Vélez Vélez E. Investigación en enfermería, fundamento de la disciplina. Rev Adm Sanit. [Internet]. 2009. [citado 14 Jun 2024];7 (2):341-56. Disponible en: https://www.elsevier.es/es-revista-revista-administracion-sanitaria-siglo-xxi-261-articulo-investigacion-enfermeria-fundamento-disciplina-13139769
- Varela Curto MD, Sanjurjo Gómez ML, Blanco García FJ. La investigación en Enfermería. Rol de la enfermera. Enfuro. [Internet]. 2012. [citado 14 Jun 2024];121. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=4093900-
- FLORENCE NIGHTINGALE LA HEROINA DE LOS HOSPITALES. CECIL WOODHAM SMITH. Edit Losada. 2020
- María Luisa Martínez Martín, Elena Chamorro Rebollo. Historia de la enfermería, Evolución histórica del cuidado enfermero. Elsevier 2023
Imágenes:
- Canva.com
- https://pixabay.com/es/images/search/enfermeros
HIMENÓPTEROS Y SU RELACIÓN CON LA COMIDA. ¿QUÉ ME HA PICADO?
Los pacientes alérgicos a veneno de himenópteros que se vacunan pueden alcanzar una eficacia del 98% de protección frente a nuevas picaduras. Para obtener esta eficacia, uno de los puntos claves es el correcto diagnóstico, lo que incluye la identificación del insecto responsable de la reacción. Pero en muchos casos el paciente es incapaz de distinguir lo que le ha picado, hasta un 42% de ellos lo hacen erróneamente y en hasta un 61,5% de los casos hay pruebas positivas a Vespula-Polistes.
El entorno donde nos ha picado puede dar luz a esta situación. Por ello, el comité de alergia a himenópteros de SEAIC en un reciente estudio ha analizado los hábitos alimentarios de estos insectos y su presencia alrededor de nuestros alimentos, a través de la identificación de fotografías enviadas por los socios.
Por lo que aquellas picaduras ocurridas mientras comemos o cocinamos pueden
esclarecerse conociendo estos hábitos, ya que varían de unas especies a otras.
La mayoría de las observaciones se han realizado entre junio y noviembre y no en primavera, debido a que hacia final del verano empiezan a escasear sus fuentes naturales de alimentación y buscan alternativas en nuestra comida, volviéndose más agresivas.
El 89% de observaciones fueron véspidos (Vespula y Vespa), frente a 5% de Polistes y el resto observación de ejemplares aislados de ápidos y Cerceris. Y el 64% de ellas se realizó en restaurantes y terrazas de casas.
¿Qué les gusta a los himenópteros?
En el 48% de los casos había carne asociada, en el 15% marisco, los dulces estaban presentes en el 14%, mientras que había bebidas alcohólicas en el 8%, frutas y verduras en el 6% y otros en el 4% restante.
Los carbohidratos están relacionados tanto con la presencia de vespula como polistes, mientras que las proteínas están relacionadas con vespula y es casi testimonial encontrar polistes o abejas.
No se observa asociación con comidas grasas (mantequilla, aceite…) de ninguna especie.
¿Por qué buscan alimentos fuera?
Las colonias de vespidos no almacenan comida en sus nidos y necesitan buscar proteínas y carbohidratos. Las proteínas proveen de nutrientes a las larvas para su crecimiento por lo que tienen mayor valor que otros alimentos. Los carbohidratos a nivel individual les dan energía para volar y ayudan a la termorregulación. Sin embargo, estas necesidades varían de unos a otros:
Los miembros de la subfamilia Vespinae buscan alimentos en multitud de sitios, ya pueden apresar a otros insectos, que alimentarse de miel de Apidos, frutas, carroña,basura o comida presente en actividades humanas. Y como sus requerimientos aumentan durante el verano, momento en el que se llega al pico de desarrollo de las larvas, esto explica su alta presencia en comidas ricas en proteínas detectadas en el estudio.
Mientras que Polistes apresa otros insectos y recolecta néctar para su propia demanda y la de sus crías, predominando en alimentos ricos en carbohidratos. Su presencia en el estudio fue baja, a pesar de que, entre el 30-50% de la inmunoterapia en el centro y sur de España es frente a este. Por lo que hace pensar que no pica en ambientes con alimentos, si no cerca de sus nidos.
Como conclusión, Vespula fue el principal himenóptero asociado a ambientes alimentarios en nuestro país (78,87%), y en la mayoría de los casos (71%), el alimento involucrado es una fuente de proteína, como carne o mariscos. En ese ambiente, la probabilidad de que el insecto sea una Vespula sería del 89%, por lo que nos ayudaría a la identificación del insecto preguntar a los pacientes si han sido picados mientras comían y el tipo de alimentos involucrados.
Referencia
Vega-Castro A et al. Hymenoptera allergy diagnosis through their presence on human food.Toxins 2023, 15, 680.
Teresa Posadas
Especialista en alergologia
Miembro del comité de alergia a himenópteros
Alergia a frutos secos. Información divulgativa
LA SEAIC OFRECE INFORMACIÓN DIVULGATIVA SOBRE ALERGIA A FRUTOS SECOS
Cualquier fruto seco puede dar alergia.
Los cacahuetes ocupan el primer puesto en el contexto mundial dado su gran consumo en el continente americano y países anglosajones. En España, observamos con más frecuencia, reacciones por nueces y avellanas, esta diferencia está condicionada por los hábitos de alimentación de diferentes zonas geográficas.
La edad de presentación de alergia a frutos secos puede ser cualquiera. Lo más frecuente es que comience en la infancia, en torno a los 3-4 años, aunque sabemos que depende de la zona geográfica, costumbres, dieta, edad de introducción temprana o tardía, carga genética etc.
La causa concreta por la que aparece la alergia a alimentos es multifactorial y desconocida. Existen diferentes teorías sobre por qué la alergia alimentaria es cada vez más frecuente. Los estudios apuntan hacia una mayor prevalencia con el estilo de vida en países industrializados que conlleva un aumento de pacientes con dermatitis atópica, rinitis alérgica y asma.
La “forma de ser alérgico” a los frutos secos y su pronóstico lo marca el análisis molecular que tenemos accesible desde hace pocos años. Se puede hacer aproximaciones mediante las pruebas cutáneas, pero es en los análisis de sangre como podemos determinar “a qué proteína de los frutos secos soy alérgico”.
Los niños que son alérgicos a las proteínas de almacenamiento de los frutos secos, suelen debutar con reacciones más severas, aunque la cantidad del alimento sea pequeña. Es decir, tienen un menor umbral de tolerancia. Estas proteínas son muy estables a la temperatura (cocción), pH ácido (digestión) y mantienen su estructura a pesar de cocinar los alimentos. Incluso se ha visto que la forma de procesar los cacahuetes (tostados) puede provocar mayor alergenicidad. Estos pacientes alérgicos a proteínas de almacenamiento llegan a la edad adulta y mantienen síntomas graves con la ingesta de frutos secos, incluso con trazas.
Los pacientes alérgicos a LTP (por sus siglas en inglés proteína transportadora de lípidos), pueden debutar con alergia a frutos secos en la edad adulta y sus síntomas pueden ser más leves como picor de boca con muchos alimentos, o más graves como urticaria, broncoespasmo o anafilaxia. Estos pacientes suelen asociar alergia con cofactores (ejercicio físico intenso, alcohol, toma de antiinflamatorios, fiebre, mal estar general, menstruación, falta de sueño). Son pacientes que se sensibilizan a la familia de las rosáceas como son las frutas de hueso central como melocotón, nectarina, ciruela, cereza, manzana y, por similitud, a los frutos secos.
La LTP es muy ubicua en el reino vegetal. Los pacientes pueden presentar, por reactividad cruzada, síntomas con distintos alimentos vegetales (frutas, frutos secos, legumbres, cereales, hortalizas). Son pacientes complejos y heterogéneos. A veces, estos pacientes pueden tolerar de nuevo los alimentos que les dieron reacción, si retiramos los cofactores. Los síntomas pueden ser graves, persisten en el tiempo y presentan gran restricción dietética lo que afecta a su calidad de vida.
El paciente alérgico a frutos secos debe conocer el “perfil de su alergia” y conocer qué tipo de alimentos no puede comer. Acudir a su alergólogo para conocer en detalle su alergia y mantenerse informado es fundamental. Es importante portar siempre su medicación de rescate y estar alerta a los alimentos que consumen, especialmente fuera del domicilio, e informar siempre de su alergia a los anfitriones.
PASOS A SEGUIR EN LA TÉCNICA DE INHALACIÓN. PARTE I
La terapia inhalada es utilizada por la gran mayoría de pacientes con problemas
respiratorios, y es la vía de elección para la administración de fármacos, habitualmente
empleados, en el tratamiento de enfermedades respiratorias, por lo que resulta
imprescindible que el paciente adquiera los conocimientos y habilidades necesarios
para realizar la técnica inhalatoria de forma adecuada y efectiva.
VENTAJAS de la terapia inhalada:
- Menor dosis de fármaco necesaria y por tanto menos efectos secundarios.
- El fármaco actúa en el lugar donde se precisa, directamente sobre el órgano diana.
- Mayor rapidez de acción.
- Disponibilidad de aparatos ligeros y portátiles.
DESVENTAJAS que presenta la vía inhalada;
- Técnica de administración bastante más compleja que la vía oral, el paciente debe
recibir indicaciones claras antes de iniciar un tratamiento inhalado, y el personal
sanitario debe estar entrenado en el manejo de la amplia gama de dispositivos
existentes en la actualidad.
La adhesión al tratamiento junto a la correcta utilización de los dispositivos de
inhalación, son dos pilares fundamentales para conseguir un buen control de las
enfermedades respiratorias crónicas.
Para conseguir una técnica de inhalación correcta es esencial la educación sanitaria y el
papel que desarrolla la enfermera en el proceso educativo del paciente es
fundamental. El paciente debe aprender la pauta de tratamiento correcta, así como el
método concreto de manejo de su inhalador.
PASOS DE LA TÉCNICA DE INHALACIÓN
En el mercado, disponemos de numerosos dispositivos de terapia inhalada diferentes,
pero todos los dispositivos, si se utilizan correctamente, proporcionan un depósito
eficiente de fármaco en el pulmón.
No hay un dispositivo ideal, sino que hay que buscar el mejor para cada uno de
nuestros pacientes. La elección del dispositivo debe hacerse de forma individualizada,
teniendo en cuenta la capacidad y preferencias del paciente. Y, siempre que
farmacológicamente sea posible, se debería utilizar un único tipo de dispositivo.
Sea cual sea el dispositivo prescrito, hay que seguir unos pasos comunes y
fundamentales para su correcta utilización. Realizar todos estos pasos correctamente
garantizará un depósito óptimo de medicación en la vía aérea. Estos pasos son los siguientes:
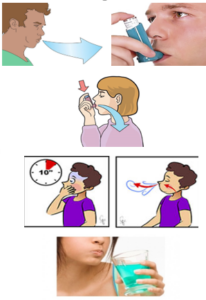
1. Espiración completa: el inhalador alejado de la boca.
2. Colocar el inhalador (previamente cargado con la dosis correspondiente) en la boca:
– Sujetar con los dientes (sin morder).
– Sellar con los labios, sin tapar las ventanas de respiración de los Inhaladores de Polvo Seco (IPS). – No obstruir con la lengua.
3. Inspiración profunda:
– Lenta y mantenida en los Inhaladores de Cartucho Presurizado (ICP) y en los de nube de vapor suave.
– Moderada – rápida en los IPS.
4. Apnea: Mantener la respiración de 8 a 10 segundos y exhalar lentamente (preferentemente por la nariz).
5. Realizar enjuague bucal.
En una próxima entrada al blog de enfermería, se procederá a detallar cada uno de los pasos anteriormente mencionados.
- BIBLIOGRAFIA
– Guía española para el manejo del asma (GEMA). Madrid: Luzán 5.3; 2023. www.gemasma.com
– Consenso SEPAR-ALAT sobre terapia inhalada. Archivos de Bronconeumología. Available from: https://www.archbronconeumol.org/es-consenso-separ-alat-sobre-terapia-inhalada-articulo-S0300289613700681
– Sanchis J, Gich I, Pedersen S; Aerosol Drug Management Improvement Team (ADMIT)Systematic Review of Errors in Inhaler Use: Has Patient Technique Impro? Time? Chest 2016 Aug,150(2):394-406
– Plaza V, Giner J, Rodrigo GJ, Dolovich MB, Sanchis J. Errors in the use of inhalers by healthcare professionals a sustematicreview. J Allergy Clin Inminol Prac.pii: S2213-2198(18)30020-5
– Giner J. et al “Normativa sobre la utilización de fármacos inhalados”. Archivos de Bronconeumología, vol. 36, nº 1, enero 2000, pp. 34-43. DOI. Org (Crossref)
– Asthma and Allergy Foundation of America (AAFA). How to properly use your asthma devices. First Edition and Medical Review August 2018. Update Review and Revised Edition February 2022
– Labris N.R y M.B. Dolovich. ”Pulmonary Drug Delivery”. Part II: The Role of Inhalant Delivery Devices and Drug Formulations in Therapeutic Effectiveness of Aerosolized Medications: Physiological Factors Affecting the Effectiveness of Inhaled Drugs”. British Journal of ClinicalPharmacology, vol 56, nº6, diciembre 2003, pp.600-12. DOI.org (Crossref)
– Berlinski A “Assessing New Technologies in Aerosol Medicine; Strengths and Limitations”. Respiratory Care. Vol 60, nº6, junio 2015, pp. 833-49. Doi. Org (Crossref)
– Newman SP, Pavia D, Garland N, Clarke SW. Effects of varius inhalation modes on the deposition of radioactive pressurized aerosols. Eur J Respir Dis Suppl. 1982; 119:57-65 PMID: 6807705
LAS INMUNODEFICIENCIAS ASOCIADAS A AGENTES BIOLÓGICOS INMUNOMODULADORES COMO FENOCOPIAS DE LAS INMUNODEFICIENCIAS PRIMARIAS
http://www.thehistoryblog.com/archives/14881
En nuestro sistema sanitario, las consultas de Inmunología atienden principalmente pacientes con una respuesta inmunitaria deficiente. Las inmunodeficiencias primarias (IDP) asociadas a errores innatos de la inmunidad son una causa importante de estas consultas, pero no la única. En la práctica clínica, en la mayoría de los casos, habrá que buscar una causa secundaria de la misma.
Las inmunodeficiencias primarias se incluyen bajo el concepto más global de errores innatos de la inmunidad (EII), que representa un grupo de más de 485 enfermedades definidas genéticamente (1). La inmunodeficiencia secundaria (IDS) podría definirse como una alteración transitoria o persistente de la función de las células o tejidos del sistema inmunitario, causada por factores extrínsecos al mismo (2). Estos grupos de factores incluyen agentes ambientales, malnutrición, trastornos metabólicos, uso de medicamentos inmunosupresores e inmunomoduladores, infecciones crónicas, neoplasias malignas, traumatismos graves o simplemente el envejecimiento. El enfoque inicial recomendado para la valoración de una IDS sigue las mismas directrices que en el caso de las IDP. Los hallazgos de la historia clínica, en particular los patrones de infecciones, y los hallazgos en la exploración física son esenciales para guiar la evaluación del sistema inmunitario.
Dentro de las causas de IDS, la generalización del uso de agentes biológicos inmunomoduladores para tratar enfermedades autoinmunes, inflamatorias o neoplasias hematológicas en las últimas dos décadas, se ha acompañado de un mayor riesgo de infecciones e inmunodeficiencias secundarias (3); el abordaje de este importante tema en una entrada a un blog es complicado como revisión sistemática, así que optaré por una exposición narrativa.
Examinar qué enfermedades infecciosas acompañan a una determinada inmunodeficiencia primaria ha permitido obtener información valiosa sobre los componentes del sistema inmunológico que son claves en la respuesta frente a microrganismos particulares. Gracias a ello sabemos que los defectos en moléculas críticas en la ontogenia, activación y proliferación de los linfocitos T, como las mutaciones en el gen IL2RG del cromosoma X humano, que codifica la cadena gamma común (γc) del receptor de interleucina-2 (IL-2R), o una inactivación mutación en la quinasa Jak3, que se asocia físicamente con γc, causan una depleción profunda en la función del sistema inmune, que de forma sindrómica se denomina Inmunodeficiencia combinada severa. Los defectos en el desarrollo de las células B, como la mutación en el gen que codifica una proteína tirosina quinasa llamada BTK (tirosina quinasa de Bruton), que transduce la señal a través del receptor de células pre-B, provocan deficiencias en la producción de anticuerpos que causan una incapacidad para eliminar bacterias extracelulares y algunos virus cuya eliminación eficaz requiere anticuerpos específicos.
Es instructivo considerar los defectos inmunológicos en el contexto de los principales tipos de inmunidad afectada, ya que estos pueden conducir a distintos patrones de infección y enfermedad clínica.
Las terapias biológicas no causan La inmunosupresión global característica de la terapias inmunosupresoras clásicas como los glucocorticoides, azatioprina, metotrexato o ciclosporina (4). Del mismo modo a cómo actúan las mutaciones específicas en cada IDP, las terapias biológicos se dirigen selectivamente a células y vías del sistema inmunitario para lograr efectos terapéuticos específicos, pudiéndose comportar en ciertos casos como fenocopias de la IDP original.
Por ejemplo, el OKT3 (muromonab-CD3) es un anticuerpo monoclonal IgG2 murino que se une a la cadena CD3-epsilon del complejo receptor de células T-CD3 y produce una linfopenia rápida y profunda de las células T (4). Como cabría esperar, la inmunosupresión asociada provoca una mayor susceptibilidad a las infecciones, en particular por virus herpes y bacterias. Igualmente, Alemtuzumab (anti-CD52) es un anticuerpo monoclonal humanizado utilizado para la terapia de inducción del trasplante de órganos sólidos, depletor de células T.
Basiliximab es un monoclonal contra la cadena alfa del receptor de la interleucina (IL)-2 (CD25). La activación de las células T conduce normalmente a una regulación al alza del receptor de IL-2 de alta afinidad que implica la expresión de la cadena alfa del receptor de IL-2 (CD25) que se asocia con las cadenas beta y gamma del receptor de IL-2. Basiliximab inhibe la generación de células T citotóxicas antígeno-específicas.
Las células T necesitan dos señales para activarse. La primera implica la unión directa del receptor de antígeno de la célula T (TcR) con el complejo formado por el péptido antigénico y determinadas moléculas de superficie (moléculas HLA), presentado por las células presentadoras de antígeno (APC). La segunda señal implica vías coestimuladoras específicas. El CD28 de las células T se une a sus ligandos, el CD80 (B7-1) y el CD86 (B7-2), en las APC. La presencia de ambas señales proporciona una señal de activación a las células T. Por el contrario, la molécula CTLA-4 en las células T compite por la unión a las mismas moléculas CD80/CD86, y esta interacción provoca la supresión de la activación. Abatacept y Belatacept son proteínas de fusión del dominio extracelular de CTLA-4 humano unido a una porción Fc modificada de IgG1 humana (CTLA-4-Ig), que interfieren la activación de las células T interrumpiendo la coestimulación CD28. Abatacept no obstante tiene un perfil de seguridad bien establecido en diferentes ensayos y metanálisis. Belatacept por su parte, con mayor capacidad de unión a CD80/CD86, no debe administrarse a pacientes con serología de VEB negativa candidatos a trasplante de un donante con serología VEB positiva, por el mayor riesgo de desarrollar trastornos linfoproliferativos asociados a VEB (4).
Las Janus quinasas (JAK) son una familia de tirosina quinasas no receptoras, cruciales en el desencadenamiento de las señales generadas por el receptor de diversas citoquinas y transducidas aguas abajo a través de las proteínas STAT (transductoras de señales y activadoras de la transcripción). Las STAT fosforiladas se disocian de sus subunidades receptoras y se translocan al núcleo celular para regular la transcripción génica. La familia JAK se compone de cuatro miembros: JAK1, JAK2, JAK3 y tirosina quinasa 2 (Tyk2). Tofacitinib, inhibidor JAK aprobado para la artritis reumatoide que actúa principalmente sobre JAK1 y JAK3, se ha asociado con un mayor riesgo de infección por herpes zoster (4).
Con respecto a las células B, Ibrutinib es una pequeña molécula inhibidora de la tirosina quinasa de Bruton (BTK). El ibrutinib se une a la actividad de la BTK y la inhibe de forma irreversible, impidiendo así tanto la activación de las células B como la señalización mediada por éstas. La BTK es necesaria para la señalización del receptor de células B, desempeña un papel clave en la maduración de las células B. Se han descrito casos de neutropenia e hipogammaglobulinemia. Igualmente, Idelalisib interrumpe la señalización del receptor de células B, de forma similar a ibrutinib, aunque a través de la inhibición de la isoforma delta de la fosfatidilinositol 3-cinasa. Idelalisib se asocia a un aumento de las infecciones oportunistas (4). Belimumab por su parte, es un anticuerpo monoclonal humano que se une al BlyS humano soluble e inhibe su actividad biológica. Está aprobado para el tratamiento de pacientes con LES. La celulitis y la neumonía son las infecciones graves más frecuentes (4).
Pero sin duda, la familia de biológicos con más impacto en la casuística de las consultas de inmunodeficiencias son los anti CD20 y en particular, rituximab. Este anticuerpo monoclonal quimérico (Ig)G1 CD20 específico actúa sobre las células B desde la fase pre-célula B hasta la fase pre-célula plasmática. Rituximab agota las células B de la sangre periférica, y su normalización posterior suele requerir de seis a nueve meses o más, con una variabilidad significativa entre pacientes. Con las células B deplecionadas, la capacidad del paciente para responder a las vacunas, en particular de polisacáridos, se ve afectada. Además, es frecuente cierto grado de hipogammaglobulinemia transitoria, que en algunos pacientes es persistente y significativa clínicamente, dando lugar a infecciones que requieren profilaxis antibiótica y/o terapia sustitutiva (4).
Así, hasta un largo etcétera de terapias biológicas que actúan selectivamente sobre la vía de diferentes citoquinas (interleuquina 6, interleuquina 1, factor de necrosis tumoral alfa, interleuquinas 4 y 13, interleuquina 17), integrinas (alfa-4 integrinas, CD11 alfa), o proteínas del complemento, entre otros, bloqueando con una precisión quirúrgica el normal funcionamiento del sistema inmune.
Disponemos de evidencias y de herramientas para tratar de disminuir el riesgo de IDS asociado al uso de medicamentos biológicos. Este riesgo se debe prevenir con profilaxis antibiótica adecuada, y se debe prever mediante una planificación del programa de vacunación adaptada al tipo de defecto en la respuesta inmune descrito para el fármaco.
Igualmente, las recomendaciones en cuanto a vacunación de pacientes en grupos de riesgo, tanto centrales como de las comunidades autónomas, deberían estar actualizadas acorde a la evidencia disponible e integrar la opinión de expertos con conocimiento en el funcionamiento del sistema inmune y en el mecanismo de acción de estos fármacos.
REFERENCIAS
- Tangye SG, Al-Herz W, Bousfiha A, Cunningham-Rundles C, Franco JL, Holland SM, Klein C, Morio T, Oksenhendler E, Picard C, Puel A, Puck J, Seppänen MRJ, Somech R, Su HC, Sullivan KE, Torgerson TR, Meyts I. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022 Oct;42(7):1473-1507. doi: 10.1007/s10875-022-01289-3. Epub 2022 Jun 24. PMID: 35748970; PMCID: PMC9244088.
- Tuano KS, Seth N, Chinen J. Secondary immunodeficiencies: An overview. Ann Allergy Asthma Immunol. 2021 Dec;127(6):617-626. doi: 10.1016/j.anai.2021.08.413. Epub 2021 Sep 3. PMID: 34481993.
- Cannon L, Pan A, Kovalick L, Sarkissian A, Wu EY. Secondary immunodeficiencies and infectious considerations of biologic immunomodulatory therapies. Ann Allergy Asthma Immunol. 2023 Jun;130(6):718-726. doi: 10.1016/j.anai.2023.02.010. Epub 2023 Feb 18. PMID: 36801438; PMCID: PMC10247415.
- https://www.uptodate.com/contents/secondary-immunodeficiency-induced-by-biologic-therapies (acceso abril/2024).
Curso TRIPLE Asma
Os presentamos el curso TRIPLE ASMA, patrocinado por Chiesi y Avalado por la SEAIC, un programa online avanzado diseñado específicamente para especialistas en alergología,
neumología, medicina familiar y comunitaria. Este curso se centra en la actualización de conocimientos y el desarrollo de habilidades en el manejo del asma incluyendo la utilización de la triple terapia
Link al curso: https://www.tripleasma.com/#/public/inicio
CAJMIR gana el premio a mejor poster de la TPS del EAACI 2024!
Este año se decidió compartir con el resto de EAACI nuestra organización e iniciativas para inspirar a los jóvenes de otras asociaciones nacionales a impulsar la Alergología desde bien el principio.
Nuestro poster titulado «Empowering tomorrow’s Allergy leaders: unveiling the organizational excellence of CAJMIR within SEAIC» ha sido premiado como el mejor de su categoría «systems in medicine» y no podriamos estar más orgullosos de este reconocimiento internacional. ¡Seguimos!
No todas las reacciones por quimioterápicos son debidas a alergia
¿Qué es la quimioterapia?
La quimioterapia es un tipo de tratamiento farmacológico contra el cáncer y funciona destruyendo las células cancerosas o frenando su proliferación. Se trata de un tratamiento sistémico, ya que, una vez administrada, circula a través del torrente sanguíneo pudiendo alcanzar casi cualquier parte del cuerpo. Existen más de 100 quimioterápicos diferentes, como las antraciclinas (doxorubicina, epirubicina), las sales de platino (oxaliplatino, carboplatino, cisplatino) o los taxanos (paclitaxel, docetaxel), entre otras. En función del tipo de cáncer, del grado de extensión y del estado de salud general en el que se encuentre, su oncólogo prescribirá una quimioterapia u otra, sola o en combinación con otros tratamientos.
¿Por qué la quimioterapia causa efectos secundarios?
La quimioterapia no solamente ataca a células cancerosas, sino que también actúa sobre células de tejidos sanos, especialmente aquellos que estén continuamente produciendo células nuevas, por ejemplo, la médula ósea, las mucosas del tracto digestivo o respiratorio, la piel, el cabello, o las uñas. Esto puede conllevar a la aparición de efectos secundarios, como la disminución del nivel de glóbulos rojos y blancos o de las plaquetas en la sangre, vómitos, diarreas, erupciones en la piel, pérdida del cabello, cansancio, mareo, o debilidad. Cada quimioterapia tiene un perfil de efectos secundarios propio, y la mayoría de estos estarán relacionados con su mecanismo de acción y la dosis prescrita. La mayoría de estos efectos secundarios aparecen durante los días posteriores a la administración del ciclo, son temporales y mejoran con el reajuste de la dosis o añadiendo medicación para aliviar los síntomas.
¿Qué es la alergia a la quimioterapia?
La alergia a la quimioterapia es una reacción adversa poco frecuente y está causada por una respuesta inusual del sistema inmunitario frente al fármaco. La mayoría de las reacciones alérgicas a la quimioterapia aparecen inmediatamente o durante la administración al fármaco, y normalmente, aunque no siempre, se acompañan de síntomas en la piel como picor, enrojecimiento o erupciones. En ocasiones, pueden producirse reacciones alérgicas graves, como la anafilaxia, esto es, una reacción de inicio brusco y con síntomas generalizados como la dificultad respiratoria o la hipotensión, pudiendo evolucionar rápidamente a cuadros más graves.
¿Todas las reacciones adversas a la quimioterapia son por alergia?
No, como cualquier medicamento, la quimioterapia puede producir reacciones adversas con síntomas similares a los de una alergia, pero no todas se producen por una respuesta del sistema inmunitario y se deben a otro motivo, por ejemplo, un efecto secundario al propio mecanismo del fármaco.
¿Qué ocurre si tengo alergia a la quimioterapia?
La re-exposición a la quimioterapia en un paciente que se ha vuelto alérgico puede ser potencialmente grave. Por este motivo es importante que los pacientes que han presentado una reacción a su quimioterapia sean estudiados por un especialista en alergología antes de continuar con el tratamiento, para poder confirmar o descartar el origen alérgico de la reacción. En caso de que se confirme la alergia, la desensibilización es un procedimiento que permite que un paciente alérgico a la quimioterapia continúe recibiéndola de forma segura a pesar de su alergia. Este procedimiento no está exento de riesgos y debe realizarse siempre en manos de personal experto, con recursos apropiados y en un entorno preparado.
En resumen, la quimioterapia puede desencadenar distintos efectos secundarios, siendo la alergia a la quimioterapia una reacción poco común pero potencialmente grave. Sin embargo, no todas las reacciones adversas a la quimioterapia son causadas por alergia, ya que pueden deberse a otros factores, como los efectos secundarios propios del fármaco. La identificación precoz de las reacciones alérgicas y el diagnóstico preciso son esenciales para poder elegir la mejor estrategia de tratamiento y garantizar la seguridad de los pacientes.
Paula Vázquez Revuelta
Facultativa Especialista – Servei d’Al·lergologia | Hospital Universitari Bellvitge
En mi familia hay antecedentes de alergia a penicilina, ¿deberían realizarme un estudio alergológico?
La penicilina pertenece al grupo de los antibióticos betalactámicos y es uno de los grupos de antibióticos más utilizados a nivel mundial. En la práctica clínica, la sospecha de alergia a los antibióticos betalactámicos (amoxicilina y penicilina principalmente), es una de las consultas más frecuentes relacionadas con la alergia a medicamentos en las unidades de alergia.
Hasta la fecha, según estudios previos, no existe clara evidencia de que un familiar de un paciente con alergia confirmada a penicilina o a otros antibióticos betalactámicos tenga más riesgo de presentar una reacción que la población general. No existe ninguna prueba alergológica que pueda predecir si dicho paciente va a presentar una reacción alérgica ante la administración de penicilina; por tanto, no está indicado realizarle ningún estudio alergológico a penicilina ni a otros antibióticos betalactámicos.
Un familiar de un paciente con alergia a penicilina y a otros antibióticos betalactámicos, no precisa ninguna precaución adicional con respecto a la administración de antibióticos betalactámicos. No debe ser privado de la administración de dichos antibióticos en caso que los precise ya que pueden ser esenciales para el tratamiento de su proceso infeccioso.
Se debe realizar un estudio alergológico en aquellos pacientes que consulten porque hayan presentado una reacción alérgica a penicilina o a otros antibióticos betalactámicos. Dichos pacientes requerirán de una evaluación alergológica a través de una historia clínica detallada y, posteriormente, se programarán las pruebas alergológicas pertinentes (pruebas cutáneas, pruebas de administración controlada y pruebas de laboratorio) para llegar a su diagnóstico. Entre el 70% y el 90% de los pacientes con sospecha de alergia a antibióticos betalactámicos no son verdaderamente alérgicos.
Pilar Berges Gimeno
Hospital Ramón y Cajal
Bibliografía
1. Ojeda P, Sastre J, Olaguibel JM, Chivato T. Alergologica 2015: A National Survey on Allergic Diseases in the Adult Spanish Population. J Investig Allergol Clin Immunol. 2018;28(3):151- 64
2. Castells M, Khan DA, Phillips EJ. Penicillin Allergy.N Engl J Med. 2019 Dec 12;381(24):2338-2351. doi: 10.1056/NEJMra1807761
3. Faitelson Y, Boaz M, Dalal I. Asthma, family history of drug allergy, and age predict amoxicillin allergy in children. J Allergy Clin Im- munol Pract 2018; 6:1363–7.
4. Paño-Pardo JR, Moreno Rodilla E, Cobo Sacristan S, Cubero Saldaña JL, Periañez Párraga L, Del Pozo León JL, Retamar-Gentil P, Rodríguez Oviedo A, Torres Jaén MJ, Vidal-Cortes P, Colás Sanz C. Management of Patients with Suspected or Confirmed Antibiotic Allergy: Executive Summary of Guidelines from the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC), the Spanish Society of Allergy and Clinical Immunology (SEAIC), the Spanish Society of Hospital Pharmacy (SEFH) and the Spanish Society of Intensive Medicine and Coronary Care Units (SEMICYUC). J Investig AllergolClin Immunol 2023 Apr 18;33(2): 95-101.doi: 10.18176/jiaci.0859.
5. Romano A, Atanaskovic-Markovic M, Barbaud A, Bircher AJ, Brockow K, Caubet JC, et al. Towards a more precise diagnosis of hypersensitivity to betalactams – an EAACI position paper. Allergy. 2019 Nov;10.1111/all.14122.
6. Bourke J., Pavlos R., James I., Phillips E.: Improving the effectiveness of penicillin allergy de-labeling. J Allergy Clin Immunol Pract 2015; 3: 365-334.e1
7. Torres MJ, Adkinson NF, Caubet JC, Khan DA, Kidon MI, Mendelson L, et al. Controversies in Drug Allergy: Beta-Lactam Hypersensitivity Testing. J Allergy Clin Immunol Pract. 2019 Jan;7(1):40-5
8. Stone C.A., Jr., Trubiano J., Coleman D.T., Rukasin C.R.F., Phillips E.J. The challenge of de-labeling penicillin allergy. Allergy. 2020;75:273–288.
Educación terapéutica del adolescente con asma
Según los expertos de la OMS la adolescencia comprende un periodo de edad que va desde los 10-11 hasta los 19 años, aunque algunos autores hablan de adolescencia inicial (10-14 años), adolescencia media (15-17 años) y adolescencia tardía (18-21 años).
El asma es una de las enfermedades crónicas más prevalentes en el adolescente y los sanitarios somos conscientes de que en estas edades cambia el modo de afrontar la enfermedad, especialmente si se trata de una enfermedad crónica. Actitudes de negación o de culpabilidad, complican el abordaje del problema por parte del profesional, cambian sentimientos y actitudes de nuestro paciente y lo que hasta ese momento era responsabilidad de los padres o cuidadores pasa a serlo del propio enfermo, que debe ir asumiendo paulatinamente sus propios compromisos ante la enfermedad.
Para el adolescente con asma la ansiedad y depresión son desencadenantes que favorecen peor control de los síntomas y pueden influir decisivamente en su calidad de vida. La visión del adolescente con asma dificulta en la relación con el grupo de amigos, siente vergüenza.
Conocer al paciente adolescente
¿A qué se dedica, estudia, cuáles son sus aficiones?
¿Qué sabe sobre su enfermedad?
¿Cómo controla el asma?
Intervención enfermera educadora:
Tratamos los objetivos más importantes para el adolescente con asma:
- Comprenda su enfermedad (síntomas del asma, signos de empeoramiento o comienzo de una crisis, tos, cansancio, sibilancia, dificultad para respirar….
- Sepa cómo evitar los desencadenantes (tabaco, alergenos, ejercicios, deporte, infecciones respiratorias, alimentos, fármacos…).
- Reforzamos positivamente en el cumplimiento terapéutico y adherencia al tratamiento para mejor calidad de vida.
Realizamos un plan estructurado con citas que el paciente pueda acudir y de ese modo se pueda repasar sus inquietudes e intentar llegar a acuerdos asumibles y siempre teniendo presente su tratamiento terapéutico.
Conclusiones:
- Adherencia: el paciente acepta voluntariamente las recomendaciones por parte de enfermeros educadores.
- Concordancia: autonomía por parte del paciente adolescente para mantener una relación de igualdad con enfermería para un mejor cumplimiento y manejo de su enfermedad.
- Escuchar: es la prueba de confianza y apoyo asegurando en todo momento la confidencialidad hacia el paciente adolescente.
- Cumplir: los objetivos que nos proponemos con el paciente adolescente para un cumplimiento de su tratamiento y una mejor calidad de vida.
Actualizadas las cartillas de seguimiento de inmunoterapia
¿Alguna vez has necesitado un documento para tus pacientes que recogiera información imprescindible sobre la inmunoterapia sublingual o subcutánea?
El Comité de Inmunoterapia de la SEAIC pone a disposición de los profesionales la “Cartilla de Seguimiento de Inmunoterapia Sublingual” para su descarga.
Es un documento escrito en donde se recogen las condiciones de conservación de la inmunoterapia en domicilio, describe la forma correcta de aplicar la inmunoterapia, detallas las circunstancias por las que se debería suspender la inmunoterapia sublingual, cómo y cuándo retomarla, proporciona información de las reacciones adversas asociadas a su uso y esquemas sobre la actuación en caso de presentar una reacción adversa. Además ofrece un calendario para registro de administración de las dosis y otro apartado para registrar las reacciones adversas en caso de sufrirlas.
La puedes descargar en el siguiente link: https://www.seaic.org/profesionales/material-de-utilidad-clinica/cartilla-seguimiento-inmunoterapia-sublingual.html
¿Necesitas uno así para tus pacientes con inmunoterapia subcutánea?
El Comité de Inmunoterapia de la SEAIC también ofrece a los profesionales la “Cartilla de Seguimiento de Inmunoterapia Subcutánea” para su descarga.
Es un documento escrito en donde se recogen las indicaciones para la administración de la inmunoterapia subcutánea para otros profesionales de la salud, información acerca de las reacciones adversas, la clasificación de las reacciones adversas, cómo actuar ante estas según el grado de reacción y cómo modificar la dosis siguiente.
A los pacientes les ofrece indicaciones de conservación de la inmunoterapia en domicilio, información tras la administración de la dosis de inmunoterapia, un calendario para registro de administración de las dosis y otro apartado para registrar las reacciones adversas en caso de sufrirlas.
La puedes descargar en el siguiente link: https://www.seaic.org/profesionales/material-de-utilidad-clinica/cartilla-seguimiento-inmunoterapia-subcutanea.html
Aprovechamos para agradecer a Inmunotek por su ayuda en la maquetación de las cartillas de seguimiento de inmunoterapia.
Alergia a Alimentos: Cofactores
Desde el Comité de Alergia a Alimentos y el Comité de Anafilaxia hemos creado esta Infografía acerca de la Alergia a Alimentos y los Cofactores que pueden incrementar el riesgo de sufrir una reacción alérgica.
Esperamos que os sea de utilidad:
 Cargando...
Cargando...
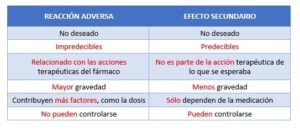
FACTORES DESENCADENANTES DE ASMA: NORMAS DE EVITACIÓN
- Asma alérgica
La realización del estudio de alergia en el paciente con asma tiene como objetivo conocer el alérgeno (sustancia que desencadena la alergia) que pueda estar siendo responsable de los síntomas (tos, ahogo, dolor torácico y “pitos”) que presenta el paciente, o que puedan desencadenar las crisis (1).
- Tratamiento en asma: Tratamiento farmacológico y no farmacológico
En la actualidad las normas de evitación, el tratamiento con fármacos y la educación sanitaria, se consideran los pilares fundamentales para evitar que el paciente con asma presente una crisis (2,3).
– Tratamiento farmacológico del asma
Los fármacos para tratar el asma podemos clasificarlos como fármacos de control o mantenimiento, y fármacos de alivio, también llamados “de rescate”. Los medicamentos de control o mantenimiento deben administrarse de forma continua durante periodos prolongados de tiempo y los medicamentos de rescate se utilizan a demanda para tratar de forma rápida una crisis de asma (2).
– Tratamiento no farmacológico del asma
Por otro lado, conocer los factores que pueden desencadenar los síntomas constituye una parte importante del tratamiento no farmacológico del paciente con asma. El no conocer estos desencadenantes puede convertirse en un factor que facilite la aparición de una crisis.
Además, la educación del paciente asmático debe considerarse como un elemento básico del tratamiento, ya que reduce el riesgo de padecer una crisis y aumenta la calidad de vida del paciente.
- Factores desencadenantes y normas de evitación
Se denominan factores desencadenantes, aquellos factores que presentan capacidad de provocar síntomas o crisis de asma y pueden ser múltiples y diversos.
Es muy importante que el paciente pueda identificarlos y establecer las medidas adecuadas para su evitación.
En el asma alérgica, una vez que se ha identificado el alérgeno o los alérgenos causantes de los síntomas de asma, se deben realizar una serie de recomendaciones para evitarlos.
Los alérgenos que se encuentran en el ambiente o aeroalérgenos son responsables tanto de desencadenar síntomas de asma como la crisis.
- Alérgenos ambientales o aeroalérgenos: Medidas de Evitación
Entre las medidas de evitación de los aeroalérgenos más frecuentes y relevantes encontramos:
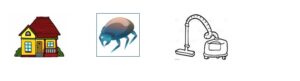
I. Ácaros
Los ácaros son artrópodos de muy pequeño tamaño, no visibles a simple vista. Los ácaros, por estar muy presentes en el espacio doméstico, son una causa importante de alergia y la segunda causa de asma. Ambientes cálidos y húmedos van a ser los hábitats perfectos donde más crezcan. Los podemos encontrar principalmente en colchones, edredones, almohadas, moquetas y alfombras.
Recomendaciones de evitación:
- Evitar realizar tareas de limpieza en presencia del paciente
- Retirar polvo con paño húmedo (secar bien después)
- Evitar cojines o colchones de plumas
- Utilizar fundas anti-ácaros impermeables con garantía certificada para cojines, colchones y edredones
- Evitar moquetas. Lavar regularmente cortinas, tapicerías, peluches, etc.
- Mantener la habitación, limpia y ordenada
- Habitación soleada, luminosa y ventilada
- Utilizar aspiradores con filtro HEPA. No usar escobas o plumeros
- Intentar mantener la temperatura de la vivienda por debajo de los 25°C
- Evitar convivir con animales de pelo o plumas
- Lavar la ropa de cama a temperatura superior a 60 °C.
- Si hay alfombra, deben ser lavables, tratadas con vapor o expuestas periódicamente al sol y despolvadas.
- Aspirar con frecuencia sofás.
- Ventilar la casa, a ser posible cuando haya menos humedad fuera.
- Limpiar con frecuencia los filtros de la calefacción o del aire acondicionado
- Purificadores, desionizadores y deshumificadores: valorar conveniencia de utilizarlos
 |
II. Epitelios de animales
Los animales de pelo son una importante fuente de alergia respiratoria, los que más los gatos, seguido de los perros y caballos, aunque también los conejos, hámster y vaca entre otros.
La retirada de la mascota del ambiente que rodea al paciente constituye el tratamiento de elección en el caso de pacientes alérgicos a epitelio de las mismas, ya que se trata de una medida muy efectiva.
En caso de NO seguir ese consejo será preciso:
- Lavado frecuente de la mascota
- Ideal mantener el animal fuera del hogar, si es posible
- Extremar la limpieza en el ambiente doméstico. No usar moquetas ni alfombras y aspirar frecuentemente con aspiradoras con filtro HEPA
- Aconsejar que la mascota no deambule libremente por las zonas de descanso y menos que duerma en ellas.
- En la medida de lo posible, no interaccionar con la misma.
- Tocar lo menos posible al animal y lavado de manos después de hacerlo.
- Las camas o cojines de los animales deben lavarse regularmente y estar en zonas apartadas.
- Lavar la ropa que ha estado en contacto con los animales.
- En el caso del gato se recomienda su esterilización.
III. Pólenes
En primer lugar, es preciso conocer a qué polen es alérgico el paciente y conocer la época de polinización. En la actualidad podemos encontrar distintas aplicaciones (apps) que nos ayudan a conocer los niveles de polinización ambiental. (https://www.polenes.com/es/home)
Debemos saber que los granos de polen pueden ser diseminados por insectos, viento o ambos y en la época de polinización, pueden desplazarse a kilómetros de distancia.
En días de viento, secos y soleados hay más polen en el ambiente, por el contrario, en días húmedos o de lluvia la presencia de polen disminuye.
Recomendaciones:
- En los meses de predominio de polen en pacientes sensibilizados, evitar las salidas al campo. Tras salidas al exterior ducha y cambio de ropa.
- Evitar salir de casa los días con viento, seco, con recuento alto de pólenes, soleados y en horas vespertinas.
- Al viajar no abrir las ventanillas del coche y revisar el correcto estado de los filtros de polen de los mismos.
- Evitar viajes en moto o bicicleta.
- Utilización de gafas de sol que cubran el máximo posible y mascarillas colocadas correctamente.
- El tiempo para ventilación de los domicilios en épocas con altos niveles de polinización, debe ser breve, evitando sobre todo la primera hora de la mañana y el atardecer. Cerrar ventanas tras ventilación.
- Evitar secar ropa en el exterior.
- Evitar realización de ejercicios físicos enérgicos en días de alta polinización.
IV. Hongos
Los hongos están muy extendidos en la naturaleza y es muy difícil evitarlos por completo.
Cuando hablamos de alergia a los hongos, nos referimos a alergia a la humedad o al moho.
Crecen en el exterior, en lugares con vegetación (tierra, troncos, plantas, restos de hojas), donde se acumula suciedad o desperdicios, pero también en las casas y recintos cerrados (sótanos, trasteros, bodegas). Las piscinas cubiertas son una importante fuente de exposición a esporas de hongos
Abundan especialmente en condiciones de humedad, oscuridad y viento.
Recomendaciones:
- Evitar viviendas poco soleadas y con humedades, deshabitadas, cercanas a ríos, lagos y bosques.
- Evitar pasear por bosques frondosos con abundante materia orgánica vegetal en descomposición.
- En días de viento y humedad evitar salidas, mantener cerradas puertas y ventanas y si se presentan síntomas usar el tratamiento de rescate.
- Evitar plantas de interior.
- Tirar los alimentos que se encuentren en mal estado. Sacar la basura todos los días.
- Evitar las condensaciones de humedad en cuartos de baño, revisar el estado de toallas, y sobre todo evitar humidificadores.
- Mantener en buen estado de higiene y conservación los sistemas de aire acondicionado y de calefacción.
- Limpiar regularmente con lejía bañera, lavabos, azulejos de baño. Tras limpieza de casa ventilar y secar zonas húmedas.
- Reparar y eliminar manchas de humedad, goteras y filtraciones si existen (pinturas antimoho).
- Retirar alfombras o papel de las paredes contaminados con moho.
- Retirar polvo con paño húmedo, usar fregona o aspirador con filtro de agua o HEPA (limpiar filtros con frecuencia).
Por último, y no por ello menos importante, siempre que tenga una duda, diríjase y pregunte a su alergólogo o a su enfermera del Servicio de Alergia.
Bibliografía
- Burbach GJ, Heinzerling LM, Edenharter G, Bachert C, Bindslev-Jensen C, Bonini S, et al. GA(2)LEN skin test study II: clinical relevance of inhalant allergen sensitizations in Europe. Allergy. 2009 Oct;64(10):1507–15.
- Guía Española para el Manejo del Asma (Guía GEMA 5.1). Available from: https://www.gemasma.com
- GINA. Global Strategy for Asthma Management and Prevention. www.ginasthma.org
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
La alfa triptasemia hereditaria es un rasgo genético que ha supuesto un nuevo biomarcador a tener en cuenta, sobre todo entre los pacientes que tienen anafilaxia.
Sin embargo, su diagnóstico está limitado a algunos centros especializados y sus implicaciones clínicas continuan en exploración.
- TRIPTASA.
La actividad tripsina-like se describió por primera vez en mastocitos (MC) en 1960 empleando técnicas histoenzimáticas.(1) Posteriormente, en 1981, se demostró esta misma actividad en los MC humanos de tejido pulmonar,(2) se aisló la enzima con una pureza en torno al 90% y se denominó triptasa (EC 3.4.21.59). La triptasa es producida y almacenada principalmente por los MC, y en una mínima cantidad por los basófilos.(3)
Las protriptasas (α y β) son enzimáticamente inactivas y se liberan de forma constitutiva al plasma, constituyen lo que se determina como triptasa sérica basal (sBT). Tras un proceso de maduración, se producen las triptasas maduras (tetrámeros enzimáticamente activos que forman complejos con la heparina), que se acumulan en los gránulos de los MC. Los tetrámeros activos de β-triptasa y α/β triptasa, se liberan al medio extacelular tras la desgranulación secundaria a la activación mastocitaria, y su determinación resulta de gran utilidad en el diagnóstico de anafilaxia.(4)
Los tetrámeros de β-triptasa madura se comportan como serín proteasas, que actuando sobre el complemento, algunas citoquinas, el fibrinógeno, el cininógeno, prostromelisina y los receptores activados por proteasas (PAR), pueden inducir los siguientes efectos: la proliferación de fibroblastos y músculo liso, la degradación de la matriz extracelular, el reclutamiento de eosinófilos y neutrófilos, la estimulación de células nerviosas y epiteliales, la angiogénesis y la fibrinogenolisis.(5) Sin embargo, los tetrámeros de α-triptasa madura son inactivos.(5,6)
Los heterotetrámeros de α/β triptasa madura, también tienen actividad peptidolítica, siendo su diana los PAR2 presentes en células endoteliales e induciendo extravasación in vitro; y los EMR2 (like module–containing mucin-like hormone receptor-like 2) receptores (proteínas G mecanosensitivas) presentes en la superficie de los MC. La unión de los heterotetrámeros de triptasa madura a este receptor inducen la escisión de la subunidad α del EMR2, y desencadenan la desgranulación mastocitaria(5), mecanismo que se ha relacionado con la urticaria vibratoria.(7) El incremento del número de copias de α-triptasa aumenta la proporción de heterotetrámeros frente a los homotetrámeros llevando a una sobre activación de estos receptores.(8)
La técnica comercial actualmente disponible para la detección de triptasa (ThermoFisher Scientific) es un inmunoensayo que utiliza dos anticuerpos anti-triptasa (el B12 que se emplea para la captura y el G4 para el revelado) siendo el límite inferior de detección de la técnica de 0,5 ng/mL. Esta técnica cuantifica la triptasa total sin distinguir entre formas maduras o precursores, ni isoformas α y β en los fluidos biológicos. El punto de corte establecido para los valores séricos basales de triptasa (sBT) en sujetos sanos es de 11.4 ng/mL.(4)
- ALFA TRIPTASEMIA HEREDITARIA (HαT).
La triptasa en humanos se codifica por 4 genes parálogos TPSG1 (alelos γ), TPSB2 (alelos β2 y β3), TPSAB1 (alelos α y β1), y TPSD1 (alelos δ) localizados en el cromosoma 16p13.3. Presenta diferentes isoformas: α-triptasa, β-triptasa, δ-triptasa y γ-triptasa. El genotipo normal para α y β triptasa contiene 4 copias de los genes, incluyendo estas variaciones 0α:4β, 1α:3β y 2α:2β.(4,9)
También se han descrito variaciones en el número de copias que codifican la β-triptasa, sobre todo en algunos grupos raciales, pero estas variaciones no se asocian con elevaciones de la sBT en las familias. Mientras que, los valores elevados de sBT heredados con patrón dominante en una familia, se asocian con un alelo portador de un gen TPSAB1 que codifica α-triptasa, y se trata de HαT incluso aunque se detecten copias extra de β-triptasa. (4) (Figura 1).
La alfa triptasemia hereditaria (HaT) fue descrita en 2016.(10) Se caracteriza por presentar un número aumentado de copias del gen TPSAB1 que codifica la α-triptasa, tiene un patrón autosómico dominante, se ha descrito en el 4-7% de donantes sanos,(4,6) y asocia un leve predominio entre el género femenino.(11) Los pacientes con HαT suelen tener cifras basales de triptasa (sBT) >11.4 ng/mL; aunque existen casos con valores normales de triptasa (raramente <8 ng/mL). Se recomienda realizar el estudio de HaT en aquellos individuos con sBT >8 ng/mL;(12–14) este punto de corte ha demostrado una sensibilidad del 94% y una especificidad del 100% para detectar copias extra del gen TPSAB1.(12)
Se ha detectado una relación entre el número de copias extra del alelo α del gen TPSAB1 (hasta 4 copias extra) y los niveles de sBT, en familias con HαT+. Parece seguir un patrón por el cual las duplicaciones implican unos niveles de sBT de 15 ± 5 ng/mL, las triplicaciones de 24 ± 6 ng/mL, y las cuadruplicaciones de 37 ± 14 ng/mL.(4)
Además, los valores elevados de sBT se pueden encontrar en otras patologías como las mastocitosis sistémicas (MS), neoplasias mieloides e insuficiencia renal.(7) También se ha publicado en varios estudios, la relación entre los niveles elevados de sBT con la prevalencia y la gravedad de anafilaxia, sin embargo, estos datos deben interpretarse con cautela ya que en muchos de ellos no se ha valorado la presencia concomitante de MC clonales ni de HαT+.(4) En cambio, sí que resulta clara la relación entre HαT+ y las anafilaxias graves desencadenadas por veneno de himenóptero, otras alergias IgE mediadas, así como la asociación con MS.(4)
- GENOTIPADO DE HαT MEDIANTE PCR DIGITAL.
Las PCR (reacción en cadena de la polimerasa) digital, es una tecnología de última generación que se emplea para la cuantificación de ADN de forma reproducible y sensible, y se recomienda para analizar la variación del número de copias. Para llevar a cabo las mediciones, la muestra se divide en particiones, de forma que en cada una de ellas haya cero, una o varias moléculas diana presentes en cada reacción individual. Cada partición es analizada después de un ciclado de PCR en punto final para detectar la presencia (reacción positiva) o ausencia (reacción negativa) de una señal de fluorescencia. Finalmente, se calcula el número absoluto de moléculas presentes en la muestra, sin que los resultados dependan de una curva estándar, de este modo se reduce el error y se incrementa la precisión.(15) Existen en el mercado dos tipos de PCR digital: “Dropled digital PCR (ddPCR)” y “arraybased PCR”. La diferencia principal entre los dos modelos se debe a la estrategia diseñada para la división de la muestra: mediante la formación de gotas tipo emulsión, o mediante el uso de chips compuestos por micropocillos.(16)
Esta técnica detecta las secuencias α y β en los locus de TPSAB1 y TPSB2, a partir de DNA genómico (gDNA) se puede extraer tanto de sangre periférica como de MO.(6) Existe un KIT comercial para conseguir el DNA a partir de un “swab bucal”(17) y posteriormente proceder al estudio de las variaciones en el número de copias de TPSAB1; sin embargo, puede ocurrir que este método se encuentre limitado por problemas de daños y contaminación de las muestras.
- FENOTIPOS DE HαT.(18)
La expresión clínica de HαT puede ser muy variable, desde sujetos asintomáticos (descrito en el 4% de donantes sanos de población española(6), y 1/3 de los portadores) hasta cuadros de anafilaxia grave.(11)
En una reciente revisión, se ha descrito que los síntomas que con mayor frecuencia presentan los pacientes con HαT incluyen: 1) síntomas neuropsiquiátricos (depresión 59%, alteraciones del sueño 69% y alteraciones de memoria 59-68%); 2) síntomas gastrointestinales (colon irritable 30%-60%, nauseas 51%, y reflujo 49%-77%); 3) síntomas secundarios a la liberación de mediadores mastocitarios (flushing 47%, prurito 69%, urticaria 37%, y anafilaxia 14-28%); 4) hiperlaxitud articular 28%; 5) disfunción del sistema autónomo 34% (hipotensión ortostática, palpitaciones, taquicardia, presincope, síncope), y 6) síntomas constitucionales (dolor crónico, astenia 85%).(18,19)
Algunos de los síntomas descritos, aunque se encuentren con una elevada prevalencia, son difíciles de validar como secundarios a HαT+.(18)
Además, los síntomas de HαT+, en muchas ocasiones se pueden superponer con lo que se producen por activación mastocitaria. En este sentido, hay que tener en cuenta que los fenotipos hasta ahora asociados a HαT+ son muy heterogéneos, y que la mayoría de los casos descritos provienen de centros monográficos en patología mastocitaria y/o síndromes genéticos, por lo que es probable la existencia de sesgos en los datos obtenidos a partir de estas poblaciones.(4)
Sí que ha sido validado que los individuos con HαT+ tienen una mayor prevalencia de reacciones de hipersensibilidad inmediata sistémicas. (18)
4.1 HαT Y ANAFILAXIA
La elevación aguda de triptasa es un biomarcador de anafilaxia. El aumento de los valores de sBT triptasa en un 20 % + 2 ng/ml sobre el valor basal de cada individuo en el periodo comprendido entre 1-4 horas desde el inicio del cuadro agudo, es el criterio para confirmar activación mastocitaria y anafilaxia.(20) Esta fórmula tiene una elevada sensibilidad y es útil para identificar anafilaxia en los individuos con exposición parenteral al alérgeno.(21) Sin embargo, se encuentra limitada en algunas circunstancias como en la población pediátrica con alergia a alimentos, y pacientes con reacciones no IgE mediadas. Además, la variabilidad de los niveles de sBT en cada individuo a lo largo del tiempo no está bien estudiada.(22)
Por otra parte, diferentes estudios han identificado los niveles de sBT como un biomarcador asociado con el aumento en la prevalencia y la gravedad de la anafilaxia tras picaduras de insectos (sobre todo himenópteros),(4) y en alergia alimentaria infantil.(23)
HαT+ es el primer modificador genético hereditario descrito para la anafilaxia, que se asocia con un incremento en el riesgo para reacciones alérgicas graves al veneno de himenóptero con un riesgo relativo=2; así como un incremento del riesgo para la anafilaxia idiopática grave(12) y la anafilaxia grave desencadenada por alimentos en niños.(24)
Se ha estimado una prevalencia de HαT+ ≥8.5% en los pacientes con anafilaxia por veneno de himenóptero (HVA) en los que se ha descartado una patología mastocitaria clonal. Además, HαT+ no parece influir en la frecuencia de sensibilización al veneno de himenóptero, sólo influye en la gravedad de la reacción entre los individuos sensibilizados.(25)
También se ha descrito una mayor prevalencia de HαT+ en la anafilaxia idiopática (17%)(25) y en la anafilaxia desencadenada por alimentos en población infantil.(24)
4.2 HαT Y PATOLOGÍA MASTOCITARIA.
HαT+ está asociado a la presencia de patología mastocitaria clonal, encontrándose entre el 12-21% de los pacientes con síndrome de activación mastocitaria clonal (cSAM) y/o MS, sobre todo con formas no avanzadas de la enfermedad -MS indolentes (MSI) y MS quiescentes-.(11)
Un estudio realizado en población adulta española, ha descrito la prevalencia de HαT+ en el 29% de SAM no clonales (ncSAM) y el 18% de las mastocitosis. Entre los casos con mastocitosis, la detección de HαT+ es significativamente más frecuente (21% vs. 10%) entre los casos con la mutación D816V de KIT restringida a mastocitos vs. los casos con la mutación D816V de KIT multilineal. Además, entre los pacientes con mastocitosis, su cuadro clínico debutó con anafilaxia en el 76% vs. 65% (p = 0.18) de los HαT+ vs. HαT–.(6)
El mecanismo subyacente entre ambas entidades no es conocido, pero se ha planteado la hipótesis de que pudiera ser secundario al efecto de mitógeno del exceso de triptasa sobre el microambiente de la médula ósea (MO), promoviendo la selección de los clones aberrantes de MC.(11)
Los pacientes HαT+ con MS tienen una frecuencia de HVA del 30%, y una prevalencia de anafilaxia grave con síntomas cardiovasculares del 35.5%.(11) Así mismo, en población española se ha descrito que los pacientes con mastocitosis tienen una frecuencia de anafilaxia por alimentos del 15% en HαT+ vs. 5% en HαT– (p=0.013).(6)
Si se valora la patología mastocitaria global (clonal y no clonal), se ha descrito que la frecuencia de anafilaxia aumenta progresivamente desde los casos que no tienen alelos para α-triptasa (58%), los que tienen 1 alelo (65%), quienes tienen 2 alelos (72%) y aquellos que tienen ≥3 copias de este alelo (84%). En este estudio, también se describe, que si se analizan sólo los casos HαT+, la frecuencia de anafilaxia es mayor en los que tienen ≥3 copias vs. 2 copias de α-triptasa (82% vs. 61%; p=.017).(6)
- MANEJO DE HAT
Actualmente, para controlar los síntomas que habitualmente presentan los pacientes HAT+, se recomienda emplear el tratamiento antimediador que se suele emplear en la patología mastocitaria.(4) Se ha empleado con éxito el Omalizumab en casos plurisintomáticos complejos, consiguiendo la resolución de la urticaria y de la anafilaxia en el 94% de los pacientes.(13)
MTPS9579A, es un anticuerpo monoclonal humanizado IgG4 anti-triptasa, que inhibe selectivamente la actividad de la triptasa al disociar los tetrámeros activos en monómeros. Este anticuerpo anti-triptasa reduce la gravedad de la anafilaxia IgE mediada en un modelo murino humanizado.(26) Además, se ha desarrollado un modelo farmacocinético/farmacodinámico (PK/PD) para elegir la dosis de anticuerpo anti-triptasa MTPS9579A en pacientes con asma moderado-grave que permite predecir el nivel de exposición y de supresión de la triptasa en los tejidos diana.(27)
Otros estudios, describen anticuerpos monoclonales dirigidos a los receptores inhibidores de los mastocitos, como Siglec-8 (sialic acid-binding immunoglobulin-like lectin 8) [Lirentelimab/AK002], Siglec-6 [AK006], y CD200R [LY3454738].(28)
La eficacia y seguridad de Lirentelimab ha sido evaluado en ensayos clínicos con diferentes patologías en las que participan los mastocitos (incluyendo MSI, urticaria crónica espontanea, dermografismo sintomático, y conjuntivitis alérgica); en todos ellos los pacientes refieren mejoría se los síntomas.(28)
LY3454738 no demostró superioridad frente a placebo en un estudio fase II de urticaria crónica, por lo que esta línea de investigación se ha cerrado. Sin embargo, está pendiente de publicarse sus resultados en un estudio fase I en dermatitis atópica.(28)
AK006 inhibe la anafilaxia IgE mediada en modelos murinos.(28)
Todos estos anticuerpos, podrían abrir líneas de tratamiento de la anafilaxia y de los síntomas de HαT+ en el futuro.
FIGURAS.
Figura. Genotipos de triptasa codificados por TPSAB1 y TPSB2. (18)
BIBLIOGRAFÍA
- Glenner GG, Cohen LA. Histochemical demonstration of a species-specific trypsin-like enzyme in mast cells. Nature. 19 de marzo de 1960;185:846-7.
- Schwartz LB, Lewis RA, Seldin D, Austen KF. Acid hydrolases and tryptase from secretory granules of dispersed human lung mast cells. J Immunol Baltim Md 1950. abril de 1981;126(4):1290-4.
- Castells MC, Irani AM, Schwartz LB. Evaluation of human peripheral blood leukocytes for mast cell tryptase. J Immunol Baltim Md 1950. 1 de abril de 1987;138(7):2184-9.
- Wu R, Lyons JJ. Hereditary Alpha-Tryptasemia: a Commonly Inherited Modifier of Anaphylaxis. Curr Allergy Asthma Rep. 10 de mayo de 2021;21(5):33.
- Lyons JJ. Inherited and acquired determinants of serum tryptase levels in humans. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. octubre de 2021;127(4):420-6.
- González-de-Olano D, Navarro-Navarro P, Muñoz-González JI, Sánchez-Muñoz L, Henriques A, de-Andrés-Martín A, et al. Clinical impact of the TPSAB1 genotype in mast cell diseases: A REMA study in a cohort of 959 individuals. Allergy. 11 de octubre de 2023;
- Khoury P, Lyons JJ. Mast cell activation in the context of elevated basal serum tryptase: genetics and presentations. Curr Allergy Asthma Rep. 27 de noviembre de 2019;19(12):55.
- Zhang H, Zeng X, He S. Evaluation on potential contributions of protease activated receptors related mediators in allergic inflammation. Mediators Inflamm. 2014;2014:829068.
- Caughey GH. Tryptase genetics and anaphylaxis. J Allergy Clin Immunol. junio de 2006;117(6):1411-4.
- Lyons JJ, Yu X, Hughes JD, Le QT, Jamil A, Bai Y, et al. Elevated basal serum tryptase identifies a multisystem disorder associated with increased TPSAB1 copy number. Nat Genet. diciembre de 2016;48(12):1564-9.
- Kačar M, Rijavec M, Šelb J, Korošec P. Clonal mast cell disorders and hereditary α-tryptasemia as risk factors for anaphylaxis. Clin Exp Allergy. 2023;53(4):392-404.
- Robey RC, Wilcock A, Bonin H, Beaman G, Myers B, Grattan C, et al. Hereditary Alpha-Tryptasemia: UK Prevalence and Variability in Disease Expression. J Allergy Clin Immunol Pract. 2020;8(10):3549-56.
- Giannetti MP, Weller E, Bormans C, Novak P, Hamilton MJ, Castells M. Hereditary alpha-tryptasemia in 101 patients with mast cell activation-related symptomatology including anaphylaxis. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. junio de 2021;126(6):655-60.
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 27 de noviembre de 2020;21(23):9030.
- dPCR para principiantes [Internet]. Disponible en: https://www.qiagen.com/es-es/applications/digital-pcr/beginners
- Pérez-Barrios, C. PCR digital en la monitorización de la respuesta al tratamiento del paciente oncológico. En: Aplicaciones clínicas de lsa técnicas actuales de Biología Molecular. Cont. Lab. Clin.; 2018. p. 52-8.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, et al. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol. 2019;144(4):883-96.
- Lyons JJ. Hereditary Alpha Tryptasemia: Genotyping and Associated Clinical Features. Immunol Allergy Clin North Am. 2018;38(3):483-95.
- von Bubnoff D, Koch D, Stocker H, Ludwig RJ, Wortmann F, von Bubnoff N. The Clinical Features of Hereditary Alpha-Tryptasemia—Implications for Interdisciplinary Practice. Dtsch Arzteblatt Int. 22 de marzo de 2024;(Forthcoming):arztebl.m2023.0287.
- Valent P, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, Butterfield JH, et al. Why the 20% + 2 Tryptase Formula Is a Diagnostic Gold Standard for Severe Systemic Mast Cell Activation and Mast Cell Activation Syndrome. Int Arch Allergy Immunol. 2019;180(1):44-51.
- Baretto RL, Beck S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: A perioperative perspective. Allergy. diciembre de 2017;72(12):2031-4.
- Mateja A, Wang Q, Chovanec J, Kim J, Wilson KJ, Schwartz LB, et al. Defining baseline variability of serum tryptase levels improves accuracy in identifying anaphylaxis. J Allergy Clin Immunol. marzo de 2022;149(3):1010-1017.e10.
- Sahiner UM, Yavuz ST, Buyuktiryaki B, Cavkaytar O, Yilmaz EA, Tuncer A, et al. Serum basal tryptase may be a good marker for predicting the risk of anaphylaxis in children with food allergy. Allergy. febrero de 2014;69(2):265-8.
- Lang A, Kubala S, Grieco MC, Mateja A, Pongracic J, Liu Y, et al. Severe food allergy reactions are associated with α-tryptase. J Allergy Clin Immunol. octubre de 2023;152(4):933-9.
- Lyons JJ, Chovanec J, O’Connell MP, Liu Y, Šelb J, Zanotti R, et al. Heritable risk for severe anaphylaxis associated with increased α-tryptase-encoding germline copy number at TPSAB1. J Allergy Clin Immunol. febrero de 2021;147(2):622-32.
- Maun HR, Jackman JK, Choy DF, Loyet KM, Staton TL, Jia G, et al. An Allosteric Anti-tryptase Antibody for the Treatment of Mast Cell-Mediated Severe Asthma. Cell. 3 de octubre de 2019;179(2):417-431.e19.
- Rymut SM, Henderson LM, Poon V, Staton TL, Cai F, Sukumaran S, et al. A mechanistic PK/PD model to enable dose selection of the potent anti-tryptase antibody (MTPS9579A) in patients with moderate-to-severe asthma. Clin Transl Sci. abril de 2023;16(4):694-703.
- Metz M, Kolkhir P, Altrichter S, Siebenhaar F, Levi-Schaffer F, Youngblood BA, et al. Mast cell silencing: A novel therapeutic approach for urticaria and other mast cell-mediated diseases. Allergy. enero de 2024;79(1):37-51.
REACCIÓN ADVERSA VS. EFECTO SECUNDARIO
¿Cuáles son las diferencias entre estos dos términos?
La Organización Mundial de la Salud (OMS) define una Reacción Adversa a un Medicamento (RAM) como “cualquier manifestación clínica de laboratorio no deseada que ocurre después de la administración de uno o más medicamentos”.1 Es un EFECTO INDESEADO de un fármaco a dosis terapéuticas. Ej.: paciente con tratamiento antihipertensivo, siente mareo o aturdimiento si el fármaco disminuye demasiado la tensión arterial. Según el Manual MSD las reacciones adversas a un medicamento pueden ser de tres tipos:2
- Relacionadas con la dosis: suele ser predecible y en ocasiones inevitable, son frecuentes y pueden ser o no graves. Puede ocurrir si la dosis de un fármaco es excesiva (reacción por sobredosis), si la persona es sensible a él o si otro fármaco ralentiza el metabolismo del primero, incrementando la concentración en sangre (interacciones farmacológicas).
- Reacciones alérgicas a los fármacos: Ocurren cuando el sistema inmune provoca una reacción inapropiada ante la administración de un fármaco. Una vez se ha sensibilizado, las exposiciones posteriores producen una reacción alérgica.
- Idiosincrásicas: Imprevisibles, más graves y menos frecuentes.3
Por otro lado, un efecto secundario según la OMS es “efecto que no surge como consecuencia de la acción farmacológica primaria de un medicamento, sino que constituye una consecuencia eventual de esta acción”.4 Es el resultado NO DESEADO, no es una parte esencial de su acción terapéutica. PUNTUAL. Ej.: la diarrea asociada con la alteración de la flora bacteriana, producto de un tratamiento antibiótico.2