recursos paraAlergia Infantil
Dermatitis atópica en niños: lo último en tratamientos y futuro del manejo en 2025
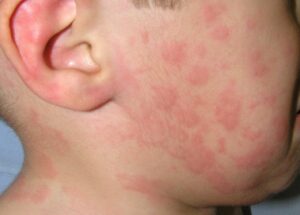
La dermatitis atópica (DA) es la enfermedad inflamatoria cutánea más frecuente en la infancia y representa un verdadero desafío clínico por su curso crónico-recidivante y el importante impacto que genera en la calidad de vida de los niños y sus familias. En los últimos cinco años, las opciones terapéuticas se han ampliado de manera notable gracias al desarrollo de nuevos fármacos biológicos e inhibidores de JAK. La guía EuroGuiDerm 2025 (segunda actualización de la guía europea) incorpora en su última versión las novedades más relevantes para el manejo de la DA en población pediátrica.
La principal novedad del documento europeo radica en las terapias sistémicas avanzadas para la DA grave. En este escenario, cuando la enfermedad no se controla con un tratamiento tópico optimizado, la EuroGuiDerm 2025 recomienda como primera opción los biológicos. Actualmente existen tres aprobados en población pediátrica: dupilumab, autorizado desde los 6 meses de edad; y lebrikizumab y tralokinumab, indicados a partir de los 12 años. Dupilumab sigue siendo el fármaco de referencia por su amplio rango de edad y su perfil de seguridad favorable. Los anti-IL-13 selectivos ofrecen una eficacia comparable y, en el caso de lebrikizumab, la ventaja de una administración mensual en fase de mantenimiento, lo que mejora la adherencia.
Junto a ellos, los inhibidores orales de JAK se consolidan como una alternativa eficaz. La guía incluye baricitinib, aprobado desde los 2 años, así como abrocitinib y upadacitinib, autorizados a partir de los 12 años. Estos fármacos destacan por su inicio de acción rápido y su alta eficacia en la reducción del prurito y las lesiones. Sin embargo, requieren un seguimiento analítico estrecho debido a potenciales efectos adversos (hematológicos, metabólicos, cardiovasculares e infecciosos), por lo que se reservan a pacientes seleccionados, especialmente cuando no hay acceso o respuesta a biológicos.
Cuando los biológicos y los inhibidores de JAK no están disponibles, la ciclosporina A se mantiene como una opción válida en ciclos cortos bajo supervisión especializada, siendo el único inmunosupresor aprobado en pediatría. Otros inmunosupresores, como metotrexato, azatioprina o micofenolato mofetilo, se utilizan de forma off-label, aunque con evidencia limitada.
A pesar de estos avances, los pilares básicos del tratamiento permanecen inalterables. La restauración de la barrera cutánea mediante el uso sistemático de emolientes continúa siendo el fundamento de toda estrategia terapéutica. Se recomienda su aplicación al menos dos veces al día en toda la superficie corporal, incluso en áreas sin lesiones visibles. La llamada “regla del minuto”, que consiste en aplicar el emoliente en el primer minuto tras el baño, mejora la hidratación y previene la pérdida transepidérmica de agua. Los baños, lejos de estar contraindicados, forman parte del tratamiento si se realizan de forma breve, con agua tibia y limpiadores syndet, seguidos de un secado suave sin fricción.
De forma paralela, el control de factores ambientales —evitar fibras irritantes, reducir la exposición a alérgenos en pacientes sensibilizados, mantener una humedad ambiental estable y limitar irritantes como detergentes o humo de tabaco— contribuye a disminuir los brotes y la severidad. Los programas educativos para pacientes y familias son también un componente esencial, ya que mejoran la adherencia, el manejo diario de la enfermedad y el bienestar psicológico de los afectados.
En el abordaje de los brotes agudos, la primera línea continua siendo el tratamiento tópico. Los corticoides tópicos se recomiendan de manera individualizada según la edad, la localización y la intensidad de las lesiones, en pautas de 1–2 aplicaciones diarias durante un máximo de dos semanas. En zonas sensibles o en casos que requieren mantenimiento prolongado, los inhibidores de la calcineurina (tacrolimus 0,03% y pimecrolimus) son una alternativa no esteroidea clave, indicados desde los 2 años y, en algunos países, desde los 3 meses en el caso de pimecrolimus. Su uso intermitente, dos veces por semana en fases de mantenimiento (“estrategia proactiva”), reduce de forma significativa las recaídas. La guía también contempla el empleo de vendajes húmedos con corticoides de baja o media potencia en brotes extensos y refractarios, así como la fototerapia en adolescentes cuando el tratamiento tópico resulta insuficiente, aunque con un grado de recomendación menor. El uso de corticoides orales no se aconseja de manera rutinaria y debe reservarse únicamente como terapia puente en brotes graves, en ciclos cortos y siempre con monitorización estrecha.
Finalmente, las estrategias de modulación del microbioma se han consolidado como un campo clave en la investigación de la dermatitis atópica. Los probióticos —sobre todo combinaciones de Lactobacillus y Bifidobacterium— han mostrado cierto beneficio en formas moderadas-graves, mientras que los prebióticos (como FOS y GOS) favorecen el crecimiento de bacterias protectoras y refuerzan la barrera cutánea. Su combinación en simbióticos parece especialmente útil en niños a partir del primer año de vida. Además, se están desarrollando terapias innovadoras como los probióticos tópicos con cepas como Roseomonas mucosa o Staphylococcus hominis, capaces de reducir la inflamación y limitar la colonización por S. aureus. Aunque aún faltan estudios que definan qué cepas, dosis y duración son más eficaces, todo apunta a que el microbioma jugará un papel decisivo en el futuro de la dermatitis atópica pediátrica.
En conclusión, la EuroGuiDerm 2025 refleja el cambio de paradigma en la dermatitis atópica pediátrica. Los biológicos y los inhibidores de JAK se consolidan como pilares en los casos graves, sin perder de vista que la base del tratamiento sigue siendo la restauración de la barrera cutánea, el control ambiental y la educación familiar. El f uturo apunta hacia una medicina cada vez más personalizada, en la que la elección del tratamiento dependerá del fenotipo y endotipo clínico, la edad y las comorbilidades de cada paciente con el objetivo último de mejorar la calidad de vida de los niños y los adolescentes afectados.
Autora: Dra. Ana Láinez Nuez. Servicio de alergología, Hospital Vithas Turia, Valencia, Comité de Alergia Infantil SEAIC
- Wollenberg A, Kinberger M, Arents B, Aszodi N, Barbarot S, Bieber T, et al. European Guideline (EuroGuiDerm) on atopic eczema: Living update. J Eur Acad Dermatol Venereol. 2025;39(7):1537–66. doi:10.1111/jdv.20639.
“Nuevos horizontes en el tratamiento de las alergias alimentarias”
Durante décadas, el tratamiento de las alergias alimentarias se basaba exclusivamente en la evitación rigurosa del alimento causante y en la intervención de emergencia en caso de exposición accidental. Aunque este enfoque preventivo ha sido útil, conlleva importantes limitaciones, tanto por su impacto en la calidad de vida como por el riesgo constante de reacciones graves. Afortunadamente, en los últimos años, la medicina ha comenzado a ofrecer alternativas más avanzadas, efectivas y personalizadas dando pasos importantes hacia tratamientos más eficaces y seguros. Actualmente, ya no se trata solo de evitar los alérgenos, sino de ayudar al organismo a tolerarlos mejor y reducir el riesgo de reacciones severas.
Una de ellas es la inmunoterapia oral (OIT), que consiste en dar al paciente pequeñas cantidades del alimento al que es alérgico, aumentando la dosis poco a poco, con el objetivo de que el cuerpo se acostumbre y no reaccione con tanta intensidad. Si bien puede ayudar a reducir la gravedad de las reacciones, la OIT no está exenta de efectos adversos, por lo que debe llevarse a cabo bajo estricta supervisión del alergólogo.
Otro avance importante ha sido el uso de medicamentos biológicos, como omalizumab, un anticuerpo monoclonal que bloquea la inmunoglobulina E (IgE), una molécula clave en las reacciones alérgicas. Recientemente aprobado por la FDA para personas con múltiples alergias alimentarias, ha demostrado que puede aumentar la cantidad de alimento tolerada sin provocar síntomas, mejorando así la seguridad y la calidad de vida.
La combinación de este tratamiento biológico con inmunoterapia oral ha mostrado beneficios adicionales: reduce la frecuencia e intensidad de las reacciones durante el tratamiento, lo que facilita su seguimiento y mejora la adherencia. Este enfoque combinado representa un cambio de paradigma, al pasar de la simple evitación a una intervención activa sobre el sistema inmune.
La investigación continúa avanzando. Se están estudiando nuevos biológicos como: Ligelizumab y UB-221, Dupilumab, Etokimab y Tezepelumab.
Estos tratamientos prometen ser más específicos y seguros, abriendo la puerta a una medicina personalizada, adaptada a las características inmunológicas de cada paciente.
Estamos viviendo un momento esperanzador. Las nuevas terapias no solo buscan prevenir las reacciones alérgicas, sino mejorar la vida diaria de quienes conviven con estas condiciones. Tanto pacientes como familias y profesionales sanitarios tienen ahora a su disposición opciones más eficaces, seguras y ajustadas a las necesidades individuales.
Dra. Guacimara Lucia Hernandez Santana. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife. Comité de Alergia Infantil
Bibliografía:
- Wood RA, Togias A, Sicherer SH, Shreffler WG, Kim EH, Jones SM, et al. Omalizumab for the treatment of multiple food allergies. N Engl J Med [Internet]. 2024;390(10):889–99. Disponible en: http://dx.doi.org/10.1056/NEJMoa2312382
- Ghelli C, Costanzo G, Canonica GW, Heffler E, Paoletti G. New evidence in food allergies treatment. Curr Opin Allergy Clin Immunol [Internet]. 2024;24(4):251–6. Disponible en: http://dx.doi.org/10.1097/ACI.0000000000000999
- Schuetz JP, Anderson B, Sindher SB. New biologics for food allergy. Curr Opin Allergy Clin Immunol [Internet]. 2024;24(3):147–52. Disponible en: http://dx.doi.org/10.1097/ACI.0000000000000981
¿Pueden los probióticos durante el embarazo ayudar a prevenir la alergia en nuestros bebés?
¿Pueden los probióticos durante el embarazo ayudar a Prevenir la alergia en nuestros bebés?
Desde el Comité de Alergia Infantil de la SEAIC, sabemos que muchos padres, sobre todo los que ya tienen otros hijos con alergia, se hacen esta pregunta cuando esperan un nuevo bebé. ¿Y si hubiera algo que pudiera hacerse durante el embarazo para reducir el riesgo de alergia en el futuro?
Entre las posibles estrategias preventivas, una que ha generado especial interés en los últimos años es el uso de probióticos. Se ha estudiado su impacto en el desarrollo de diabetes gestacional, en el desarrollo del síndrome metabólico y en otras patologías. Pero ¿y en la prevención de alergia? ¿Qué dice la ciencia al respecto? ¿Sirven realmente? Aquí te lo contamos de forma clara y sencilla.
¿Qué son los probióticos y por qué se habla tanto de ellos?
Los probióticos son microorganismos vivos, como algunas bacterias, que, cuando se consumen en cantidades adecuadas, pueden tener efectos beneficiosos para la salud. Se encuentran de forma natural en algunos alimentos (como yogures o productos fermentados) y también en forma de suplementos alimenticios.
Ya desde el embarazo, el sistema inmunitario de nuestro bebé se está desarrollando. Se sabe que la microbiota intestinal (los microorganismos que habitan en nuestro intestino) juega un papel importante en la maduración del sistema inmune del neonato. Por eso, los científicos se han planteado si los probióticos podrían ayudar a “entrenar” ese sistema inmunitario y reducir el riesgo de desarrollar alergias más adelante.
¿Qué dice la ciencia? Vamos a analizarlo en los diferentes tipos de alergia posible: la cutánea, alimentaria y la alergia respiratoria.
🧴 1. Dermatitis atópica: la evidencia más prometedora
Este es el campo donde los estudios han mostrado resultados más esperanzadores. Algunas investigaciones han encontrado que tomar probióticos en el embarazo, y a veces también durante la lactancia o dárselos al bebé tras el nacimiento, podría reducir el riesgo de que el niño desarrolle dermatitis atópica, sobre todo si tiene antecedentes familiares de alergia.
Determinadas cepas de microorganismos y determinadas combinaciones de varias cepas parecen funcionar mejor que usar una sola cepa de forma aislada.
Cepas como Lactobacillus rhamnosus y algunas bifidobacterias han sido las más estudiadas.
La Organización Mundial de Alergia (WAO) ha hecho una recomendación condicional para usarlos con este fin pero advierte que la calidad de la evidencia aún es baja.
Es decir: hay indicios positivos, pero no es una solución mágica ni garantizada.
🍳 2. Alergias alimentarias: ¿una posible ayuda?
Aquí la evidencia científica es más limitada. Algunos estudios sugieren que el uso de algunos probióticos podría ayudar a reducir el riesgo de desarrollar alergia alimentaria en el futuro (como a la alergia a la leche o al huevo), pero los resultados no son consistentes.
Las principales guías científicas, como las de la Academia Europea de Alergia e Inmunología Clínica (EAACI), aún no recomiendan su uso generalizado con este objetivo.
Se necesitan más estudios para poder considerar el empleo de probióticos como una herramienta preventiva de la alergia alimentaria.
🌬️ 3. Asma bronquial y sibilancias: sin pruebas sólidas de beneficio
En el caso del asma infantil o los episodios de sibilancias (pitos en el pecho), los estudios hasta ahora no han demostrado beneficios claros del uso de probióticos durante el embarazo para prevenir su aparición tras el nacimiento.
Incluso, algunos trabajos han observado un posible (aunque no confirmado) aumento de infecciones respiratorias en bebés que recibieron probióticos. Esto subraya la importancia de seguir investigando.
Cosas importantes que debes saber antes de lanzarte a comprar probióticos:
✅ No todos los probióticos son iguales: cada cepa tiene efectos distintos. Que uno funcione no significa que todos lo hagan.
🕒 El “cuándo” también importa: no está claro si es mejor empezar antes del parto, después, o si continuar durante la lactancia, tampoco cuánto tiempo deben tomarse.
👶 ¿Tu bebé es de “alto riesgo”? Muchos estudios se han hecho con bebés con antecedentes familiares de alergia. Para la población general, los beneficios podrían ser menores.
📊 La evidencia es aún limitada: aunque se han hecho muchos estudios, no todos tienen la misma calidad. Las conclusiones deben tomarse con cautela.
Entonces… ¿debería tomar probióticos en el embarazo para prevenir la aparición de enfermedades alérgicas en mi bebé?
La respuesta corta es: depende.
Para bebés con alto riesgo de eccema, algunas organizaciones internacionales consideran que podría ser útil… pero no es una recomendación firme.
Para prevenir otras alergias (como la alergia alimentaria o el asma bronquial), aún no hay suficiente evidencia.
Lo más importante: consulta siempre con tu médico o especialista antes de empezar cualquier suplemento probiótico durante el embarazo.
- En resumen:
El uso de probióticos durante el embarazo es una línea de investigación interesante, especialmente en relación con la dermatitis atópica. Pero aún no hay una receta única para prevenir las enfermedades alérgicas y son necesarios más estudios para saber qué cepas, dosis y duración son las más eficaces.
Desde el Grupo de Trabajo de Microbiota del Comité de Alergia Infantil de la SEAIC, seguiremos atentos a las novedades científicas para poder informar con la mayor claridad y rigor posible. Mientras tanto, la mejor estrategia sigue siendo el acompañamiento médico personalizado y la información basada en evidencia.
Isabel Fernández de Alba. Hospital HLA Inmaculada. Comité de Alergia Infantil de la SEAIC
Bibliografía:
Recomendaciones generales y dermatitis atópica:
- Yepes-Nuñez, J. J., Fiocchi, A., Pawankar, R., Cuello-Garcia, C. A., Zhang, Y., & Brożek, J. L. (2023). World Allergy Organization (WAO) guideline for the use of probiotics in the management of allergic diseases. World Allergy Organization Journal, 16(1), 100738. (Esta es una actualización que podría reemplazar o complementar la de 2015 si cubre la prevención).
- Fiocchi, A., Pawankar, R., Cuello-Garcia, C., Ahn, K., Al-Hammadi, S., Agarwal, A., … & Yepes-Nuñez, J. J. (2015). World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Organization Journal, 8(1), 4. (Aunque de 2015, fue una guía influyente. Es importante verificar si hay actualizaciones más recientes que la suplanten o la complementen directamente para la prevención, como la mencionada anteriormente o guías específicas de probióticos).
- Cuello-Garcia, C. A., Brożek, J. L., Fiocchi, A., Pawankar, R., Yepes-Nuñez, J. J., Terracciano, L., … & Schünemann, H. J. (2015). Probiotics for the prevention of allergy: A systematic review and meta-analysis of randomized controlled trials. The Journal of Allergy and Clinical Immunology, 136(4), 952-961.
Alergias alimentarias:
- Halken, S., Muraro, A., de Silva, D., Khaleva, E., Angier, E., Arasi, S., … & Roberts, G. (2021). EAACI guideline: Preventing the development of food allergy in infants and young children (2021 update). Pediatric Allergy and Immunology, 32(5), 843-858. (Esta guía de la EAACI aborda la prevención de la alergia alimentaria y discute el papel de los probióticos).
- Garcia-Larsen, V., Ierodiakonou, D., Jarrold, K., Cunha, S., Chivinge, J., Robinson, Z., … & Boyle, R. J. (2018). Diet during pregnancy and infancy and risk of allergic or autoimmune disease: A systematic review and meta-analysis. PLoS medicine, 15(2), e1002507. (Un meta-análisis amplio que incluye probióticos).
Asma bronquial y sibilancias:
- Azad, M. B., Coneys, J. G., Kozyrskyj, A. L., Field, C. J., Ramsey, C. D., Becker, A. B., … & Mandhane, P. J. (2018). Probiotic supplementation and asthma in childhood: a randomized controlled trial. Thorax, 73(6), 527-535. (Ejemplo de un ensayo controlado aleatorizado, aunque las revisiones sistemáticas serían más globales).
- Strachan, D. P. (1989). Hay fever, hygiene, and household size. BMJ, 299(6710), 1259-1260. (Aunque no es sobre probióticos directamente, es el artículo seminal sobre la hipótesis de la higiene, relevante para el contexto de la microbiota y la alergia). Es importante complementarlo con revisiones sistemáticas más recientes sobre probióticos y asma, como:
- Wei, X., Jiang, P., Liu, J., Sun, R., & Lu, W. (2020). Association between probiotic supplementation and asthma incidence in infants: a meta-analysis of randomized controlled trials. Journal of Asthma, 57(6), 647-657.
Revisiones sistemáticas y metaanálisis generales sobre probióticos en embarazo y prevención de alergia
- Pelucchi, C., Chatenoud, L., Turati, F., Galeone, C., Moja, L., Bach, J. F., & La Vecchia, C. (2012). Probiotics supplementation during pregnancy or infancy for the prevention of atopic dermatitis: a meta-analysis. Epidemiology (Cambridge, Mass.), 23(3), 402. (Aunque de 2012, es un meta-análisis citado con frecuencia; buscar también versiones más actualizadas).
- Zuccotti, G., Meneghin, F., Aceti, A., Barone, G., Callegari, M. L., Di Mauro, A., … & Corvaglia, L. (2015). Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis. Allergy, 70(11), 1356-1371.
- Tan-Lim, C. S. C., Esteban-Ipac, N. A. R., Recto, M. S. T., Castor, M. A. R., Casis-Hao, R. J., & Nano, A. L. M. (2021). Comparative effectiveness of probiotic strains for antiallergy outcomes: A systematic review and network meta-analysis. Pediatric Allergy and Immunology, 32(6), 1255-1270.
Actualización en criterios diagnósticos de anafilaxia para niños pequeños (primera infancia).
La anafilaxia es una emergencia médica que requiere establecer su diagnóstico de forma precoz, dada la rapidez de instauración y la gravedad de sus síntomas.
Identificar una anafilaxia puede ser difícil porque los síntomas de la anafilaxia pueden ser muy variables: no siempre hay una erupción cutánea acompañante; en ocasiones se presenta con síntomas digestivos, ginecológicos, neurológicos y cardiovasculares (mareo, hipotensión), sin signos cutáneos visibles. Esta sintomatología puede comenzar de forma leve y progresar en minutos, en ocasiones los síntomas desaparecen y reaparecen varias horas después, dando lugar a una reacción bifásica.
Todo esto nos lleva a confundirla a veces con otras patologías comunes, como un síncope vasovagal o una crisis asmática, complicando su diagnóstico y tratamiento.
En los niños, es aún más d ifícil, ya que no siempre tenemos la posibilidad de comunicación con ellos, sobre todo en pacientes de corta edad que no siempre pueden contar claramente síntomas internos, ya sea porque aún no hablan o porque no saben describirlo.
ifícil, ya que no siempre tenemos la posibilidad de comunicación con ellos, sobre todo en pacientes de corta edad que no siempre pueden contar claramente síntomas internos, ya sea porque aún no hablan o porque no saben describirlo.
El estudio publicado por Handorf et al (1) propone una serie de modificaciones en los criterios diagnósticos actuales para mejorar la identificación de anafilaxia en lactantes y niños en edad preescolar. Estas modificaciones consideran manifestaciones clínicas específicas de la edad, que a menudo se pasan por alto, mejorando así la precisión diagnóstica de este grupo etario.
Los criterios clínicos más utilizados en Estados Unidos actualmente para el diagnóstico de la anafilaxia son los National Institute of Allergy and Infectious Diseases/Food Allergy and Anaphylaxis Network (NIAID/FAAN) , publicados en 2006(2). Estos criterios no han sido validados en niños de menos de dos años y no tienen en cuenta las diferencias específicas que pueden aparecer en esta población.
El grupo de Handorf incluyó una revisión retrospectiva de 337 casos de reacciones alérgicas atendidos en su servicio de urgencias (1). En su artículo, implementan las modificaciones a los criterios NIAID/FAAN que tienen en cuenta diferencias específicas de cada edad, incluyendo el uso de signos equivalentes para remplazar síntomas subjetivos en esta población en ocasiones no verbal. También se añadieron señales del shock anafiláctico compensado (taquicardia, cianosis, cambios en el estado mental) y se incluyeron otros signos de distrés fisiopatológico específico de esta población como taquipnea, tiraje intercostal, llanto ronco, tos etc. La dificultad para tragar o la falta de aire puede manifestarse como llanto o irritabilidad.
Estas diferencias se sintetizan en la tabla:
| Tipo de manifestación | Síntomas incluidos en los criterios NIAID/FAAN | Síntomas propuestos en la modificación de Handorf et al.(1) |
|
Mucocutáneos
|
Habones/urticaria, prurito, flushing, angioedema de labios, de lengua, de úvula o de paladar blando. | Habones/urticaria, prurito, flushing, angioedema de labios, de orejas, párpados, facial, extremidades, picor oral, lingual, faríngeo, protrusión lingual, lamidos* |
|
Respiratorios
|
Disnea, sibilancias, broncoespasmo, estridor, descenso del PEF, hipoxemia. | Disnea, sibilancias, broncoespasmo, estridor, hipoxemia, cianosis, tos, babeo, taquipnea, aumento del trabajo respiratorio, voz o lloro ronco. |
|
Gastrointestinales
|
Dolor abdominal tipo cólico, vómitos. | Dolor abdominal, vómitos, náuseas, esputos, diarrea, arqueo de la espalda o hipertonicidad. |
|
Cardiovasculares/ otros
|
Hipotensión, hipotonía, síncope, incontinencia. | Hipotensión, hipotonía, síncope, incontinencia, taquicardia, cianosis, palidez, moteado cutáneo, letargia, alteración del estado mental#. |
* lamer los labios, las manos u otros objetos.
# Irritable, retraído, inconsolable, menos activo sin otra explicación.
Modificado de Handorf et al (1).
Los casos que cumplieron los criterios de inclusión fueron 175 pacientes, de los que el 33% tenían menos de un año, el 39% entre 12- 36 meses y el 29% eran niños entre 3- 6 años. Según los criterios NIAID/FAAN, se identificaban el 85% de todos los casos, mientras que con los criterios modificados se alcanzó el 98% (p<0.001). Los criterios modificados identificaron un 23% más de casos en lactantes (p<0.001) y un 10% más de en niños de entre 12-36 meses (p=0.04).
Algunos de los síntomas que son frecuentemente pasados por alto fueron: taquicardia, taquipnea, alteración del estado mental y cianosis. Estos no se mencionan en las guías actuales, aunque representan síntomas de shock compensado o de otras formas de compromiso cardiovascular.
Algunos de los síntomas respiratorios que observaron fueron tos (12%), sibilancias (14%), disnea (11%), salivación excesiva o babeo (11%) y aumento del trabajo respiratorio (14%). El síntoma cutáneo más común fue la aparición de habones (74%), pero también se observó con frecuencia inflamación de la cara, ojos o pabellones auriculares (30%), inflamación de labio (30%), flushing facial (30%) y prurito (25%). Los síntomas gastrointestinales incluyeron vómitos (50%), y diarrea (9%).
El uso de estos criterios modificados puede mejorar la identificación de la anafilaxia en niños pequeños comparando con los criterios actuales. Los resultados de este estudio ponen el foco en los diferentes síntomas que puede aparecer en los pacientes pediátricos y ayudan a sensibilizar sobre el manejo de la anafilaxia, especialmente con lactantes o niños pequeños.
Sería conveniente realizar más estudios con mayor número de pacientes y centros participantes para evaluar y validar estos criterios de identificación de anafilaxia.
Olaya Álvarez García. Servicio de Alergia del HUCA, Oviedo. Comité de Alergia Infantil, grupo de trabajo de anafilaxia.
Bibliografía
1.-Handorf A, Roy IR, Cohen A, Camargo CA Jr, Dribin TE, Pistiner M. Development and Evaluation of Modified Criteria for Infant and Toddler Anaphylaxis. J Allergy Clin Immunol Pract. 2024 Aug;12(8):2026-2034.e2
2.-Sampson HA, Munoz-Furlong A, Campbell RL, et al. Second symposium on the definition and management of anaphylaxis: Summary report—Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol. 2006;117(2):391–397.doi: 10.1016/j.jaci.2005.12.1303
Dermatitis Alérgica de Contacto en niños: Una realidad cada vez más frecuente
Situación actual y epidemiología
Durante mucho tiempo se pensó que la dermatitis alérgica de contacto (DAC) era una enfermedad exclusiva del adulto. Sin embargo, estudios recientes revelan una prevalencia similar a la de adultos, con casos descritos incluso en lactantes (1). Se estima que hasta un 16–20% de la población pediátrica está sensibilizada a algún alérgeno, aunque muchos casos no se diagnostican porque los síntomas se confunden con otras afecciones más comunes, como la dermatitis atópica (DA) (1,2). De hecho, menos del 10% de las pruebas epicutáneas se realizan en niños, lo que contribuye a este infradiagnóstico (1).
Dermatitis atópica y dermatitis alérgica: ¿cómo se relacionan?
La DAC y la DA pueden coexistir y a menudo se solapan, ya que ambas provocan inflamación y picor. Más de un tercio de los niños con DAC tienen también DA (1), y en muchos casos, los productos utilizados para tratar la piel atópica contienen ingredientes sensibilizantes que agravan los síntomas (1). Esta superposición puede dificultar el diagnóstico y retrasar el tratamiento adecuado.
En niños con DA, debe sospecharse una DAC cuando la dermatitis es recalcitrante al tratamiento convencional, presenta una distribución atípica (como afectación localizada de párpados, labios, manos, pies o zona del pañal), o empeora con el uso de productos destinados al cuidado de la piel atópica, los cuales pueden contener alérgenos como fragancias, lanolina o conservantes. También debe considerarse la DAC si las lesiones se localizan en áreas en contacto con cosméticos, cremas, ropa, joyas, materiales escolares o deportivos. En estos casos, la realización de pruebas epicutáneas permite identificar alérgenos relevantes y guiar el tratamiento (1,3).
¿Cómo se diagnostica?
El diagnóstico de la DAC en niños se basa en la historia clínica detallada y en la realización de pruebas epicutáneas, que son el método de referencia para identificar alérgenos causantes. Estas pruebas consisten en aplicar parches con alérgenos sobre la espalda del niño, retirarlos a las 48 horas, y realizar segunda lectura a las 72-96 horas. También se puede complementar con pruebas como el ROAT (Repeat Open Application Test), una prueba sencilla, no invasiva, que se utiliza para evaluar si un producto concreto (como una crema, cosmético o medicamento tópico) está causando una DAC. Es especialmente útil en niños o cuando no es posible realizar pruebas epicutáneas estándar (3,4).
En 2015, la EAACI (European Academy of Allergy and Clinical Immunology) propuso una batería reducida de alérgenos como herramienta práctica y segura para facilitar el diagnóstico en población pediátrica (5). Con el tiempo, la experiencia clínica y nuevas evidencias han puesto de manifiesto la necesidad de considerar también alérgenos emergentes, cada vez más presentes en productos infantiles como la metilisotiazolinona aislada, hidroperóxidos de limoneno y linalol, benzofenonas, 3-dimetilaminopropilamina (DMAPA), isobornil acrilato y clorhexidina. Además, se recomienda adaptar las pruebas a la exposición individual de cada paciente y complementarlas con productos propios y alérgenos actuales, con el objetivo de optimizar la precisión diagnóstica en niños (6-8).
¿Cuáles son los alérgenos más frecuentes?
En los niños, los alérgenos más comunes que pueden causar DAC incluyen (8-13):
- Metales: como el níquel, cloruro de cobalto y dicromato potásico, presentes en objetos de uso cotidiano como bisutería, gafas, relojes, calzado, ropa, juguetes, videoconsolas, teléfonos móviles, tablets, aparatos de ortodoncia, botas, sandalias o material deportivo.
- Conservantes: destacan la metilisotiazolinona (MI) y la metilcloroisotiazolinona (MCI), que se encuentran en productos como el slime, pinturas, productos de limpieza y equipamiento deportivo. Otro conservante importante es el formaldehído, que puede estar presente en algunas toallitas infantiles.
- Fragancias: como las mezclas de fragancias I y II, el bálsamo del Perú, y los hidroperóxidos de linalol y limoneno, que se utilizan en cosméticos, medicamentos tópicos y productos de limpieza.
- Emolientes: como la lanolina y el propilenglicol, habituales en cosméticos, bálsamos labiales y medicamentos de aplicación tópica.
- Tensoactivos: derivados del aceite de coco como la cocamidopropil betaína (CAPB) y su principal fracción alergénica, la 3-dimetilaminopropilamina (DMAPA), presentes en champús, acondicionadores y detergentes.
- Parafenilendiamina (PPDA): sustancia empleada en tatuajes de henna y tintes capilares.
- Colofonia: una resina procedente de la savia del pino, utilizada en adhesivos, apósitos, tintas, cosméticos, productos farmacéuticos y material escolar.
- Antibióticos tópicos: como la neomicina y la bacitracina, ampliamente utilizados en cremas y pomadas.
Además de los alérgenos clásicos, en los últimos años se han identificado alérgenos emergentes en la población pediátrica. Entre ellos destacan la benzisotiazolinona, presente en ropa, calzado y detergentes (5); la acetofenona azina, un derivado de la goma EVA presente en espinilleras y calzado infantil (6); el isobornil acrilato (IBOA), utilizado en dispositivos médicos como las bombas de insulina (4); la benzofenona-4, presente en algunos protectores solares; y la clorhexidina, cuyo uso cada vez más frecuente en antisépticos se ha relacionado con un aumento de casos de sensibilización (8–13).
Estrategias de prevención
Una de las estrategias más prometedoras es el enfoque PEAS (Pre-Emptive Avoidance Strategy), que propone evitar desde el inicio los alérgenos más comunes en productos infantiles. Esta medida preventiva puede aplicarse incluso sin diagnóstico previo, especialmente en niños con piel sensible o antecedentes de dermatitis, para prevenir sensibilizaciones en la población pediátrica (14).
Manejo y tratamiento
El tratamiento principal es la evitación del alérgeno, una vez identificado mediante pruebas epicutáneas. Para controlar los brotes, se utilizan corticoides tópicos suaves, inmunomoduladores y emolientes para restaurar la barrera cutánea. En casos más graves, puede ser necesaria la fototerapia o tratamiento sistémico (3,4). El seguimiento debe incluir educación continua a las familias, revisión de productos y apoyo emocional, ya que un manejo adecuado mejora significativamente la calidad de vida del niño y su entorno (1,14).
Autora: Dra. Ana Láinez Nuez. Servicio de alergología, Hospital IMED Valencia. Comité de Alergia Infantil SEAIC
Bibliografía
- Neale H, Garza-Mayers AC, Tam I, Yu J. Pediatric allergic contact dermatitis. Part I. Clinical features and common contact allergens in children. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.002
- Ortiz Salvador JM, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017. doi:10.1016/j.ad.2016.12.018
- Neale H, et al. Pediatric allergic contact dermatitis. Part II. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.001
- Young K, et al. Pediatric allergic contact dermatitis registry patch testing results from 2016–2022. J Am Acad Dermatol. 2023. doi:10.1016/j.jaad.2023.01.016
- de Waard-van der Spek FB, Darsow U, Mortz CG, et al. EAACI position paper for practical patch testing in allergic contact dermatitis in children. Pediatr Allergy Immunol. 2015;26(7):598–606. doi:10.1111/pai.12463
- Ortiz Salvador JM, Esteve Martínez A, Subiabre Ferrer D, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017;108(6):571–578. doi:10.1016/j.ad.2016.12.018
- Felmingham C, Davenport R, Bala H. Allergic contact dermatitis in children and proposal for an Australian Paediatric Baseline Series. Australas J Dermatol. 2019;60(4):308–313. doi:10.1111/ajd.13169
- Yu J, Atwater AR, Brod B, et al. Pediatric Baseline Patch Test Series: Initial Findings of the Pediatric Contact Dermatitis Workgroup. Dermatitis. 2018;29(4):206–212. doi:10.1097/DER.0000000000000353
- Lidén C, White I. Increasing non-cosmetic exposure and sensitization to isothiazolinones. Contact Dermatitis. 2024. doi:10.1111/cod.14433
- Manière I, et al. Sensitization properties of acetophenone azine: a new skin sensitizer identified in textiles. Contact Dermatitis. 2023. doi:10.1111/cod.14284
- Magdaleno-Tapial J, et al. Allergic contact dermatitis to chlorhexidine in pediatric patients. Pediatr Dermatol. 2019. doi:10.1111/pde.13808
- Heurung AR, Raju SI, Warshaw EM. Dermatitis. 2014;25(1):3–10. doi:10.1097/DER.0000000000000025
- Moral L, et al. Allergic contact dermatitis to chlorhexidine in children. Allergol Immunopathol (Madr). 2024;52(6):33–39. doi:10.15586/aei.v52i6.1171
- Hill H, et al. Pre-emptive avoidance strategy (PEAS). Expert Rev Clin Immunol. 2016. doi:10.1586/1744666X.2016.1142373
¿Puede ser preventiva la inmunoterapia con alergenos inhalantes en niños?
Las enfermedades alérgicas suponen una carga de salud que afecta a todos los grupos de edad y que pueden manifestarse temprano en la vida como dermatitis atópica, alergia alimentaria, rinitis/conjuntivitis alérgica y asma alérgica.
En una revisión bibliográfica recientemente publicada por Dwived y col.1 revisan las estrategias de prevención que se pueden implementar en cada etapa de la vida:
- Primaria: se dirige a niños, preferiblemente recién nacidos, que están en alto riesgo de desarrollar enfermedades alérgicas pero que aún no están sensibilizados. El objetivo en esta etapa es prevenir el desarrollo de sensibilizaciones y el consiguiente inicio de una enfermedad alérgica.
- Secundaria: involucra a niños sensibilizados antes de la aparición de síntomas. Este enfoque se centra en la prevención de nuevas sensibilizaciones y el inicio de nuevas enfermedades alérgicas.
- Terciaria: se dirige a niños con enfermedades alérgicas existentes. Los objetivos en esta etapa son prevenir la progresión de la enfermedad alérgica existente a otra y prevenir nuevas sensibilizaciones.
Dado que el sistema inmunológico es más plástico en la primera infancia, esta etapa se considera ideal para llevar a cabo medidas para prevenir enfermedades alérgicas. En este sentido, se han investigado los efectos preventivos de la inmunoterapia con alérgenos (AIT). La evidencia para aplicar la inmunoterapia preventiva con alérgenos (pAIT) está creciendo rápidamente, aunque aún enfrenta desafíos debido a factores relacionados con la edad y que los datos son limitados.
Esta revisión presenta un resumen actualizado de la evidencia disponible sobre aspectos preventivos de AIT con alérgenos respiratorios en nuevas sensibilizaciones, inicio y progresión de enfermedades alérgicas, así como otros efectos inmunomoduladores, centrándose particularmente en niños.
Los autores realizaron una búsqueda en PubMed, Embase y el Registro Central de Ensayos Controlados de Cochrane (CCRCT) para estudios pediátricos sobre AIT con alérgenos inhalantes. Se evaluaron 33 publicaciones de 27 cohortes. En estos informes, participaron 2952 niños y 1491 fueron tratados activamente.
Según los datos obtenidos, la prevención primaria con pAIT parece segura, aunque con resultados inciertos. En uno de los ensayos se observó una efecto preventivo para nuevas sensibilizaciones transitorio y no alérgeno-específico al final del tratamiento (pero no durante ni tras el tratamiento). La reducción en la proporción de asma solo se evidenció después de una prolongación en uno de los estudios. Por tanto, este enfoque plantea algunos retos que aclarar, incluyendo la identificación de sujetos y la optimización de la dosis y duración efectivas.
La prevención secundaria sí demostró ser viable y segura según esta revisión. En un ensayo clínico doble ciego controlado con placebo se evaluó la prevención secundaria en niños asintomáticos y sensibilizados a ácaros o polen de gramíneas. Tras dos años de tratamiento con inmunoterapia sublingual, en este estudio no se observó una prevención en nuevas sensibilizaciones y tampoco mostró datos en relación al inicio de la enfermedad alérgica. Sin embargo, se describieron efectos pro-tolerogénicos como el desarrollo de IgG específica en el grupo activo y la inducción de citoquinas reguladores: Il10 y TGF-b. Por tanto, los niños en edad preescolar sensibilizados pero asintomáticos podrían ser objeto de intervención a este nivel de prevención.
La prevención terciaria fue estudiada en 28 publicaciones. Cambios en la tasa de sensibilización fueron reportados en 13 grupos al final del tratamiento. 6 de ellos observaron protección frente a nuevas sensibilizaciones en los grupos activos. En 9 publicaciones se evidenció un efecto tras el tratamiento en desarrollo de nuevas sensibilizaciones. 4 de ellos reportaron efectos favorables, mientras que en uno se observó un incremento en nuevas sensibilizaciones en el grupo activo. En 3 de 5 cohortes hubo un efecto de la pAIT sobre la progresión de la rinoconjuntivitis alérgica. La persistencia a largo plazo de este efecto se observó en 2 cohortes. 5 estudios que analizaban parámetros inmunomoduladores reportaron efectos favorables al final y tras el tratamiento (incremento en los niveles de IgG e IgG4 específicas, citoquinas reguladoras o niveles bajos de eosinófilos). Por tanto, a nivel de prevención terciaria, los resultados sobre la eficacia de la pAIT en nuevas sensibilizaciones o la progresión de la enfermedad alérgica se describen de manera inconsistente. Los autores concluyen que evaluar la eficacia de este enfoque es complejo y requiere más ensayos, particularmente enfocados en aspectos preventivos.
Los posibles mecanismos subyacentes a la inducción de tolerancia en AIT se han observado en niveles de prevención terciaria y secundaria, pero no en el nivel primario. Para la prevención primaria, algunos autores sugirieron que la inducción de tolerancia específica de alérgeno podría requerir un paso obligatorio que implicara la activación transitoria de la inmunidad primaria. En los otros niveles de prevención (secundaria y terciaria), los posibles mecanismos tolerogénicos incluyen la regulación positiva de IgG1 e IgG 4, principalmente, pero también IgA1 e IgA2. Estos anticuerpos pueden poseer capacidad neutralizante y podrían competir con IgE por el alérgeno. También pueden prevenir la activación de mastocitos y basófilos e inducir células B, que secretan estos anticuerpos bloqueadores y son responsables de la inmunotolerancia a largo plazo. Otras respuestas celulares implican la reducción del reclutamiento de eosinófilos, la supresión de células Th2 y la inducción de poblaciones de células reguladoras (de células linfoides innatas, células dendríticas, células T y B) y respuestas de citoquinas reguladoras (IL10 y TGF β), restableciendo el equilibrio Th1-Th2.
Según los autores, los efectos diferenciales de pAIT en cada etapa del desarrollo de niños y adolescentes deben ser evaluados para identificar la ventana de oportunidad para la prevención. Enfatizan en un inicio temprano de pAIT, ya que tener como objetivo el sistema inmunológico infantil puede ofrecer beneficios preventivos más efectivos y duraderos. Tener una sensibilización, especialmente polisensibilizaciones, a la edad escolar ya eleva el riesgo de asma en la edad adulta. Por lo tanto, los niños entre 5 meses y la edad preescolar, con un riesgo alto de desarrollar alergias debido a antecedentes familiares positivos, teniendo un menor grado de sensibilización y sin síntomas alérgicos o con síntomas leves, parecerían óptimos para pAIT.
El pAIT de ácaros es el más comúnmente estudiado. A diferencia de las mezclas heterogéneas de alérgenos, la aplicación de monoterapia de ácaros para la prevención primaria mostró un efecto protector sobre el desarrollo de nuevas sensibilizaciones.
Se ha establecido que la administración de AIT debe durar 2–3 años para lograr una inmunotolerancia duradera. Se están explorando regímenes de tratamiento más cortos, aunque el valor definitivo de los mismos aún no se ha aclarado, particularmente para enfoques de prevención primaria y secundaria.
Los autores de la revisión concluyen explicando que la eficacia global de pAIT sigue sin aclararse en niños debido a la naturaleza multifactorial de los resultados. La prevención secundaria parece factible y puede inducir inmunotolerancia. La prevención terciaria usando pAIT de pólenes de gramíneas y/o árboles parece ser capaz de prevenir la progresión de rinoconjuntivitis a asma, aunque los beneficios de pAIT basada en otras fuentes de alérgenos no son concluyentes. Es necesario definir la dosis óptima de alérgenos, adyuvantes y vías de administración.
La infancia representa una ventana de oportunidad para iniciar medidas profilácticas, pero se necesitan ensayos pediátricos adicionales bien diseñados para comprender los efectos preventivos de la AIT sobre las nuevas sensibilizaciones, el inicio y la progresión de enfermedades alérgicas junto con los beneficios inmunomoduladores.
Mercedes Ramírez Hernández. Complejo Hospitalario Universitario de Cartagena.Comité de Alergia Infantil SEAIC.
Bibliografía:
1,. Varsha Dwived, Sonja Kopanja, Klara Schmidthaler, Justyna Sieber, Christina Bannert, Zsolt Szépfalusi. Preventive allergen immunotherapy with inhalant allergens in Children. Allergy. 2024;79:2065–2087. DOI: 10.1111/all.16115
Importancia de la correcta identificación del niño con anafilaxia en Urgencias pediátricas
La mayoría de las guías nacionales e internacionales de anafilaxia recomiendan a nuestros pacientes acudir a urgencias después de un episodio de anafilaxia, independientemente de que se hayan tratado o no.
La puerta de entrada de todos ellos en Urgencias es el triaje. Allí, el personal, habitualmente de enfermería, decidirá en pocos minutos, cuándo, quién y donde serán atendidos. En esto consiste la priorización o triaje.
Todos sabemos que la anafilaxia es una reacción de hipersensibilidad potencialmente mortal y que por ello requiere el máximo nivel de prioridad. Sin embargo, los pocos datos disponibles muestran que estos pacientes no se identifican correctamente, reciben una prioridad menor que la merecen y reciben tratamiento tarde, con riesgo de empeorar su pronóstico.
Hasta la fecha, los datos disponibles acerca de la priorización del paciente con anafilaxia se han limitado a hospitales seleccionados y a sistemas de triaje específicos.
Desde el Comité de Alergia Infantil de Seaic, nuestro objetivo ha sido conocer y describir la priorización que reciben los niños con anafilaxia en España. Este es el primer estudio que revisa la priorización de la anafilaxia pediátrica más allá de un solo centro, superando las barreras de los múltiples sistemas de triaje existentes en España. Los participantes en el estudio trabajan en 36 hospitales de 12 comunidades autónomas distintas. Su conocimiento acerca de que anafilaxia es una emergencia que merece atención médica inmediata es correcto. Sin embargo, su aplicación práctica no lo es al analizar la prioridad que recibirían casos reales. Asi, los niños con anafilaxia probablemente son identificados de forma incorrecta en los servicios de urgencias pediátricas en España, lo que puede empeorar su pronóstico.
La anafilaxia debería identificarse en triaje para garantizar un tratamiento precoz y adecuado.
Los alergólogos podemos ayudar a mejorar el triaje del niño con anafilaxia por nuestro conocimiento acerca de sus peculiaridades, variedades en la presentación clínica, ausencia de datos patognomónicos, y porque aportamos un punto de vista que complementa la visión del especialista en Urgencias.
“Anaphylaxis must be suspected in triage. Triage advice regarding anaphylaxis identification should be included in anaphylaxis guidelines”
J Investig Allergol Clin Immunol 2025; Vol. 35(4)(enlace a la versión del artículo) doi10.18176_jiaci.1064.pdf
Esozia Arroabarren Aleman. Servicio de Alergología del Hospital Universitario de Navarra. Comité de Alergia Infantil de la Sociedad Española de Alergia e Inmunología Clínica
La dermatitis atópica no sólo afecta a la piel
La dermatitis atópica (DA) es un proceso inflamatorio de la piel caracterizado por un intenso prurito (picor) y piel seca, que presenta una evolución crónica y que cursa en forma de brotes. Es la enfermedad crónica de la piel más común en la infancia, aunque puede iniciarse a cualquier edad. Su desarrollo se debe a interacciones complejas entre la disfunción de la barrera cutánea, alteraciones de la microbiota de la piel e intestinal, desregulación del sistema inmunológico y susceptibilidad genética.
La DA se ha asociado a diferentes enfermedades (comorbilidades) tanto alérgicas como no alérgicas, aunque los mecanismos exactos de estas asociaciones no se conocen por completo. En algunos casos, estas asociaciones podrían ser coincidentes y no una consecuencia directa de la DA.
Recientemente, ha sido publicado un estudio coreano que ha analizado las enfermedades que se asocian a la DA, en más de 67.000 niños con esta enfermedad y que han sido evaluados desde el nacimiento hasta los 15 años de edad. A continuación, detallaremos las comorbilidades encontradas en este estudio 1.
Enfermedades alérgicas:
La DA se asocia con diferentes enfermedades alérgicas como la alergia alimentaria y el asma y rinitis alérgicas, dentro de lo que se conoce como “la marcha atópica”. Este término se refiere a este conjunto de enfermedades alérgicas que, por este orden, se suceden a medida que avanza la edad del paciente. Sin embargo, en algunos casos, esta secuencia no se cumple y las enfermedades alérgicas aparecen de manera independiente y en cualquier etapa de la vida. Posiblemente esto se deba al solapamiento que se produce entre la susceptibilidad genética y los factores ambientales que están involucrados en el desarrollo de las comorbilidades alérgicas.
Enfermedades no alérgicas extracutáneas:
Enfermedades psiquiátricas y neurológicas:
En cuanto a las comorbilidades no alérgicas, las más destacadas son las enfermedades psiquiátricas y neurológicas. Estos autores identifican una asociación entre la DA y la hiperactividad con déficit de atención (TDAH), desórdenes del sueño, alteraciones de la conducta o emocionales, así como con la convulsión febril y las cefaleas. Estas comorbilidades psiquiátricas pueden interrelacionarse, lo que podría jugar un papel importante en la asociación de estas enfermedades con la DA. Por lo tanto, es importante considerar los efectos de las comorbilidades de la DA en las enfermedades psicológicas, pero también el efecto de estas comorbilidades psicológicas en la DA.
Procesos infecciosos cutáneos y extracutáneos:
Los niños con DA presentan infecciones cutáneas más frecuentemente, como cabe esperar al tratarse de una piel alterada. Este estudio también reveló un incremento en las infecciones del tracto respiratorio y gastrointestinal, así como una mayor prevalencia de amigdalectomía. La desregulación inmunológica y la disfunción de la barrera, no sólo a nivel cutáneo sino también en otros órganos, podría contribuir al aumento en el riesgo a infecciones en órganos sistémicos, particularmente en una edad en la que las infecciones son muy comunes. Por otro lado, las infecciones fuera de la piel pueden exacerbar la DA y factores asociados al tratamiento de la DA podrían estar también relacionados con un incremento en el riesgo de infección.
Alteraciones gastrointestinales:
Se identificó una relación entre la DA y alteraciones gastrointestinales como el reflujo esofágico sin esofagitis, el estreñimiento o enfermedades hepáticas. Estas asociaciones podrían deberse a que comparten regulación inmunológica, en el eje intestino-piel a través de la microbiota intestinal, junto con la interrelación con otras comorbilidades de la DA.
Anemia por déficit de hierro:
También se encontró un incremento de la anemia de origen nutricional, posiblemente relacionado con dietas restrictivas injustificadas o a la malabsorción de nutrientes como resultado de la activación inmunológica. El estreñimiento es una comorbilidad de aparición más precoz que la anemia, lo que incrementaría la posibilidad de desarrollarla, dado que el enlentecimiento del tránsito intestinal puede ocasionar pérdida de apetito, dificultar la absorción de nutrientes y aumentar la excreción de hierro. Además, el estreñimiento interrumpe el equilibrio de la microbiota intestinal, afectando al metabolismo nutricional, pudiendo ocasionar también esta pérdida de hierro.
Enfermedades no alérgicas cutáneas:
Además de las comorbilidades fuera de la piel, la DA aumenta el riesgo de enfermedades cutáneas. Las enfermedades autoinmunes, incluyendo el vitíligo, la dermatitis herpetiforme y la psoriasis, comparten fisiopatología en aspectos como la disfunción de la barrera cutánea, la desregulación inmunológica, factores propios del paciente y factores ambientales.
Otros estudios han encontrado asociación entre la DA y la urticaria crónica, que podría explicarse por la desregulación inmunológica, factores genéticos compartidos y el estrés oxidativo.
Riesgo y cronología
El estudio concluye que tanto la edad de aparición como la gravedad de la DA influyen en el número de comorbilidades asociadas. La presencia de comorbilidades fue más frecuente en los niños con un inicio más precoz de la DA, en los varones y en aquellos con dermatitis más grave (medida por un mayor número de ingresos hospitalarios y mayores tasas de prescripción de corticoides tópicos).
La presencia de rinitis y asma alérgicas, principalmente las de inicio en preescolar, se asociaba, en este estudio, a la presencia de varias comorbilidades en el niño mayor y, el asma en concreto, tenía un efecto significativo en las alteraciones psiquiátricas y neurológicas. Sin embargo, la aparición de enfermedades autoinmunes no estaba influida por estas comorbilidades.
En resumen, los niños con DA pueden presentar varias comorbilidades. Reconocerlas a tiempo puede ayudar a mejorar los síntomas y reducir las complicaciones y el impacto tanto de las comorbilidades como de la propia DA.
Dra. Eva María Lasa Luaces. Unidad de Alergología Infantil del Hospital Universitario Donostia. Comité de Alergia Infantil SEAIC.
- Kim JH, Lee E, Ha EK, Shin J, Lee GC, Rha YH, Han MY. Cascade of atopic dermatitis comorbidities in children after birth for 15 years. 2024 Jan;79(1):153-163. doi: 10.1111/all.15917. Epub 2023 Oct 16. PMID: 37843069.
Alergia a las carnes
El valor nutricional de la carne se debe a que está formada por proteínas de alto valor biológico como fuente de aminoácidos esenciales, vitamina B y hierro, muy aprovechables por nuestro organismo.
La alergia a las carnes es una alergia alimentaria poco frecuente en los países desarrollados, a pesar de su elevado consumo. En la infancia, suele asociarse con dermatitis atópica y tiende a desaparecer en los primeros años de vida. No obstante, la alergia a la carne también puede aparecer “de novo” en la edad adulta.
En la actualidad, se desconoce la incidencia general y la prevalencia de la alergia a las carnes en la población general. Entre los pacientes con alergia alimentaria, se ha informado de alergia a la carne en el 3-15% de casos pediátricos y en el 3% de casos adultos.
Su baja prevalencia puede atribuirse, en parte, al hecho de que la mayoría de las carnes se consumen cocidas, y cocinarlas, normalmente aunque no siempre, reduce su alergenicidad.
Las reacciones pueden ser muy variables, desde un cuadro leve de picor en la boca y garganta o algunos habones aislados, pasando por angioedema (inflamación) de labios, párpados… hasta urticaria más extensa, rinoconjuntivitis, asma, síntomas digestivos, y/o cuadros muy graves de anafilaxia.
El tipo de carne que causa la alergia, presenta variabilidad geográfica, en relación con los diferentes hábitos de consumo. En nuestro medio, la alergia a las carnes de mamíferos es más frecuente que la alergia a las aves de corral. De acuerdo con esto, se ha descrito alergia a carne de canguro en Australia y a carne foca y ballena en Alaska.
La alergia a carne de vaca es la más comúnmente reportada, con una prevalencia que oscila entre el 1,5 y el 6,5% entre los niños con dermatitis atópica o con alergia alimentaria. Sin embargo, la alergia a carne de ternera, puede llegar al 20% en niños con alergia a leche de vaca. También se han informado casos de alergia a carne de cerdo, cordero, conejo, pollo y pavo, pudiendo ser alérgico a la carne de una especie o de varias.
- Alergia a carne de vacuno: frecuentemente debida a una proteína (albúmina sérica bovina), que se inactiva con el calor, pudiendo producir reacciones si la carne está cruda o poco cocinada, tolerándose perfectamente cuando la carne está bien cocinada. Se ha demostrado que la homogeneización y liofilización (empleadas en la producción de alimentos para bebés) disminuyen el contenido de albúminas e inmunoglobulinas en la carne, al igual que la digestión con pepsina. Algunos niños con alergia a proteínas de leche de vaca pueden presentar también reacciones con ternera e incluso con otras carnes, pero esto solo ocurre en un pequeño número de casos, generalmente cuando el alérgeno responsable de su alergia es la albúmina sérica bovina.
- Alergia a carne de cerdo: se pueden producir sensibilizaciones primarias a la albúmina sérica y a las inmunoglobulinas por vía inhalada o cutánea, que en primer lugar ocasionan alergia respiratoria y, de forma secundaria, y por reactividad cruzada, reacciones alérgicas tras la ingestión de carne de cerdo poco cocinada. El denominado “síndrome gato-cerdo” es la asociación de alergia respiratoria a gato y alergia alimentaria a la carne de cerdo. Característicamente, estos pacientes pueden no tener síntomas de rinitis al contacto con gatos, ya que la mayoría de los pacientes con síntomas alérgicos a la caspa de gato están sensibilizados a un alérgeno diferente. Se ha descrito también una asociación entre la alergia respiratoria a gato y la carne de cordero o de caballo, y una alergia respiratoria a hámster y alergia a carne de caballo.
- Alergia a carne de cordero: es la más infrecuente aunque, en ocasiones, se asocia a alergia a carne de ternera y cerdo.
- Alergia a carne de pollo: aunque la alergia a huevo es muy frecuente en la infancia, casi todos los niños alérgicos a huevo toleran la carne de pollo. Por otro lado, se han descrito adultos alérgicos a la carne de ave, con tolerancia de huevo y sin alergia a plumas o caspa de ave, cuyos alérgenos responsables, no han sido identificados. Por otra parte existe un síndrome poco frecuente, el “síndrome pescado-pollo”, donde las personas presentan síntomas alérgicos tanto con carne de pollo como pescado y en el que los alérgenos principalmente responsables son las parvalbúminas.
- Síndrome ave-huevo: debido al contacto frecuente con pájaros en el domicilio o en criaderos, hay un grupo minoritario de alérgicos que se sensibilizan por vía inhalada a proteínas de las plumas y/o excrementos de las aves y posteriormente desarrollan alergia al huevo y a la carne de pollo u otras aves (loros, periquitos, canarios, palomas, aves de corral, etc.). Afecta a personas adultas que presentan síntomas con la yema de huevo cruda o poco cocinada, a diferencia de lo que ocurre con la forma de alergia más habitual al huevo que se produce en la infancia y es por sensibilización a proteínas de la clara.
- Síndrome Alfa-gal: en general, las reacciones alérgicas a las carnes suelen ser reacciones de hipersensibilidad inmediata, que ocurren en la primera hora tras la ingesta. En este síndrome, las reacciones tras ingerir carnes de mamíferos (ternera, cerdo, cordero) tienen lugar más tarde de lo habitual, entre 3, 6 y hasta 8 horas después de haberlas ingerido, debido a la unión del alérgeno alfa-gal a los lípidos, que se absorben más lentamente y mediante mecanismos diferentes en comparación con las proteínas. Pueden producirse desde urticarias más o menos extensas hasta cuadros graves de anafilaxia. Estas personas reaccionan a un carbohidrato presente en las carnes de mamíferos no primates llamado galactosa alfa 1-3 galactosa (alfa-gal), al que se han sensibilizado. La sensibilización se ha producido en algún momento, tras la picadura de garrapatas que llevan alfa-gal en su saliva y la inoculan con la picadura. Además de reaccionar a los alimentos, los pacientes sensibilizados a alfa-gal también pueden tener reacciones al anticuerpo monoclonal cetuximab, gelatinas, coloides intravenosos, heparina, válvulas cardiacas de origen bovino o porcino y otros agentes hemostáticos derivados de productos animales.
En la alergia a las carnes, a diferencia de lo que sucede con otros alimentos, se han identificado alérgenos tanto de proteínas como de carbohidratos. Las albúminas séricas y las inmunoglobulinas parecen ser las principales proteínas alergénicas en la carne de ternera y otras carnes de mamíferos (cerdo, cordero, conejo), con una gran homología entre sí, lo que explicaría la alta reactividad cruzada entre carnes de mamíferos. Estas proteínas también podemos encontrarlas en aves como el pollo, aunque con una menor homología con las de los mamíferos, lo que explicaría que los individuos tiendan a reaccionar a carnes de mamíferos o aves pero rara vez a ambas.
El diagnóstico general de alergia a las carnes se realizará en base a la historia clínica y mediante la realización de pruebas cutáneas (prick-test) con extractos de las distintas carnes y la medición en sangre de los niveles de anticuerpos IgE específicos para cada uno de ellos. En ocasiones es necesaria la realización de una prueba cutánea con el alimento en freso (prick-prick) y si hay dudas, también puede ser necesario realizar un test de exposición oral controlada, siempre bajo supervisión del especialista.
En las reacciones con preparados cárnicos, como embutidos o salchichas, habrá que descartar una alergia a algún alimento o compuesto añadido o en el proceso de elaboración, como las proteínas de la leche, el huevo o los hongos.
Ante un diagnóstico confirmado, hoy por hoy, el tratamiento es evitar la ingesta de la carne responsable y los productos elaborados con ella (embutidos, salchichas, gelatinas,…). No obstante, conocer los alérgenos responsables, puede permitir una dieta más flexible, de manera que hay pacientes, cuya alergia depende de las albúminas séricas, que toleran la carne bien cocinada, y otros, presentan síntomas o no dependiendo del grado de cocinado y otro grupo no la tolera de ninguna forma. En algunos casos, se deberán eliminar de la dieta varios tipos de carnes, en cuyo caso, podría ser necesario aportar a la dieta suplementos de hierro y vitamina B.
Dra. Angélica Feliú Vila. Hospital Universitario del Tajo, Madrid. Comité de Alergia Infantil. SEAIC
Bibliografía
- Scott P Commins, MD, PhD. Allergy to meats. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed),Up To Date, Anna M Feldweg, MD. (Accessed on april of 2024).
- Scott H Sicherer, MD, FAAAAI. Food allergens: Clinical aspects of cross-reactivity. In: UpToDate, Robert A Wood, MD (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april of 2024).
- Julie Wang, MD. Component testing for animal-derived food allergies. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april 2024).
- García Figueroa, B.E, Mateo Borrega, M.B, 2021. Alergia a las carnes. Zubeldia, J.M, Baeza, M.L, Chivato, T, Jáuregui, I, Senent, C.J. Libro de las enfermedades alérgicas (287-292).
Anafilaxia en niños y adolescentes
La anafilaxia, como extremo más grave del espectro de las reacciones alérgicas, de afectación sistémica, aguda y potencialmente mortal, representa una patología de especial interés en pediatría.
En Europa, la anafilaxia es un problema común que afecta aproximadamente a 1 de cada 300 habitantes en algún momento de su vida. Según datos de la red europea de reacciones alérgicas graves, el 27% de los casos de anafilaxia se produce en menores de 18 años. Además, se ha descrito un incremento de su incidencia, especialmente en niños y preescolares.
Causas/desencadenantes
La causa más común de anafilaxia en niños son los alimentos (75%), seguida a distancia por los medicamentos (11%). Estudios epidemiológicos de la SEAIC* señalan a la alergia alimentaria como tercer motivo de consulta a los servicios de Alergología en edad pediátrica, con una tendencia al alza. La anafilaxia representa el 7,5% de los casos diagnosticados, siendo la leche de vaca, el huevo, los frutos secos y las frutas, los alimentos implicados más frecuentemente.
Los desencadenantes alimentarios varían según la edad y el área geográfica. En los dos primeros años de vida, la leche de vaca y el huevo son los desencadenantes más habituales; posteriormente, los frutos secos en edad preescolar, siendo el cacahuete el más común en todas las edades. En ciertos países europeos, particularmente en el área mediterránea, el melocotón tiene especial relevancia.
La anafilaxia inducida por ejercicio y dependiente de alimentos también debe ser considerada en los niños. Es un tipo especial de alergia mediada por IgE en la que el ejercicio o el consumo de un alimento causante no inducen síntomas por sí solos, pero el ejercicio tras la ingestión del alimento desencadena anafilaxia.
Por último, los padres con frecuencia expresan su preocupación sobre el riesgo de anafilaxia por vacunas; sin embargo, son una causa excepcional en niños.
Factores de riesgo y casos fatales
Las muertes por anafilaxia son raras. En aquellas relacionadas con alimentos, el 73% son debidas a frutos secos o cacahuete, siendo la leche de vaca responsable del 21% de las muertes en <16 años. El riesgo de muerte por anafilaxia aumenta dos veces entre adolescentes en comparación con los niños de 0-2 años. En general, los factores de riesgo identificados para la anafilaxia fatal por alimentos en niños incluyen asma coexistente, edad >10 años, alergia al cacahuete o frutos secos y la falta o la administración tardía de adrenalina.
Un tercio de los casos de anafilaxia ocurren en casa, el 25% en restaurantes y un 15% en la escuela.
Diagnóstico de anafilaxia
La anafilaxia es un diagnóstico predominantemente clínico, con afectación de varios sistemas y de inicio rápido tras la exposición al desencadenante. En los niños muy pequeños, el diagnóstico puede presentar algunos desafíos por la dificultad para describir ciertos síntomas como el prurito o la opresión faríngea; y ciertos signos, como la irritabilidad y los cambios de comportamiento, pueden ser difíciles de interpretar. La anafilaxia en los lactantes suele afectar a la piel (98%), al sistema respiratorio (59%), al aparato digestivo (56%) y, con menos frecuencia, al sistema cardiovascular. Cuando se produce hipotensión, en niños <10 años se define como una tensión arterial sistólica inferior a <70mmHg + (2 x edad en años) o un descenso >30% respecto a un registro basal.
Los síntomas respiratorios aparecen con frecuencia en los niños, especialmente en aquellos que padecen asma. Por otro lado, la anafilaxia puede suceder sin afectación de la piel, de tal forma que los signos cutáneos están ausentes en 10-20% de las anafilaxias. Este hecho afecta de manera crítica a su diagnóstico y tratamiento precoces.
Manejo
Para el autocuidado temprano de los pacientes con anafilaxia es fundamental educar a los padres, cuidadores y a los niños sobre el riesgo de anafilaxia, el control de las enfermedades concomitantes y sus desencadenantes y el autotratamiento de cualquier recurrencia. Durante la infancia, el cuidado/responsabilidad en la aplicación de medidas de evitación, reconocimiento de reacciones y tratamiento de las mismas recae inicialmente en padres y cuidadores. A medida que el niño crece se le enseña a evitar los desencadenantes, reconocer los síntomas y tratar futuras reacciones. Se ha estimado por encuestas que los niños de 9-11 años podrían reconocer síntomas y utilizar correctamente un AIA*.
A los pacientes se les deben recetar uno o más AIA*. Se recomienda que lleven siempre consigo un plan de acción de emergencia escrito y personalizado que ilustre cómo reconocer los síntomas e instruya sobre cómo inyectar rápidamente la adrenalina. Esta debe ser administrada por vía intramuscular en la parte anterolateral media del muslo manteniendo el AIA durante aproximadamente 3-10 segundos. La administración de adrenalina es el tratamiento de primera línea y no existen contraindicaciones absolutas para su administración. La dosis debe repetirse cada 5-15 minutos si los síntomas persisten y tras su administración se debe solicitar asistencia médica. Estas medidas preparan a los padres y a los niños para afrontar una reacción y evitar que se agrave.
Durante una anafilaxia es crucial evaluar periódicamente las vías respiratorias, la respiración, la circulación, el estado mental y la piel, posicionar al paciente según sus características y simultáneamente llamar a los servicios de emergencia. La mayoría de los niños deben colocarse tumbados boca arriba, a menos que haya dificultad respiratoria, en cuyo caso una posición sentada optimiza el esfuerzo respiratorio; si está inconsciente, el niño puede colocarse en posición de recuperación. Al mismo tiempo, y si es posible, se debe eliminar la exposición al desencadenante (p. ej., suspender la administración de medicamentos/agentes terapéuticos).
El tratamiento de la anafilaxia continúa con el traslado a un entorno de atención sanitaria, idealmente en ambulancia. En niños con anafilaxia y síntomas de broncoespasmo, se pueden administrar agonistas beta-2 de acción corta inhalados (p. ej., salbutamol); sin embargo, en presencia de síntomas persistentes no son alternativa a la administración repetida de adrenalina intramuscular. En caso de obstrucción de las vías respiratorias superiores debe considerarse nebulizar adrenalina. Los medicamentos de segunda línea incluyen agonistas beta2-adrenérgicos, glucocorticoides y antihistamínicos. Es necesario observar a los niños durante varias horas, siendo especialmente importante en reacciones graves y en aquellas que requieren varias dosis de adrenalina.
Conclusiones
La anafilaxia es una patología de especial relevancia en edad pediátrica, siendo los alimentos su causa más común. En los niños, los síntomas respiratorios y la ausencia de afectación cutánea son características que deben ser consideradas en su presentación. El asma, la adolescencia, la alergia al cacahuete o los frutos secos y la falta o la administración tardía de adrenalina son factores asociados a mayor gravedad. La educación periódica de niños y familias, sobre cómo identificar los episodios, responder adecuadamente y emplear el AIA son vitales y deben ser revisados regularmente.
Dr. Carmelo Escudero Díez. Servicio de Alergología Hospital Infantil Universitario Niño Jesús (Madrid). Comité de Alergia Infantil.
*SEAIC: Sociedad Española de Alergología e Inmunología Clínica.
*AIA: Auto-inyector de adrenalina.
Referencias recomendadas
- Turner PJ, Campbell DE, Motosue MS, Campbell RL. Global Trends in Anaphylaxis Epidemiology and Clinical Implications. J Allergy Clin Immunol Pract. 2020;8:1169-76.
- Wang Y, Allen KJ, Suaini NHA, McWilliam V, Peters RL, Koplin JJ. The global incidence and prevalence of anaphylaxis in children in the general population: A systematic review. Allergy. 2019;74:1063-80.
- Ojeda P, Ibáñez MD, Olaguibel JM, Sastre J, Chivato T. Alergológica 2015: A National Survey on Allergic Diseases in the Spanish Pediatric Population. J Investig Allergol Clin Immunol 2018;28(5):321-329. doi: 10.18176/jiaci.0308.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
- MS Shaker, DV Wallace, DBK Golden, J Oppenheimer, JA Bernstein, RL Campbell, et al. Anaphylaxis—a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020;145:1082–1123.
- Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020 Jun;8(6):1854-1864. doi: 10.1016/j.jaip.2020.02.010.
MI HIJO ES ALÉRGICO AL MARISCCO ¿PUEDE COMER PESCADO?
INTRODUCCIÓN
La alergia a marisco es una de las alergias alimentarias más frecuentes. Es más frecuente en adultos que en niños y en éstos últimos suele debutar en la infancia tardía o adolescencia. Su prevalencia varía entre países, siendo del 1.3% en Europa en niños entre 2 y 17 años1.
CLASIFICACION TAXONÓMICA
Marisco se define como animal marino invertebrado, por ello es importante conocer su clasificación taxonómica. El marisco se divide en dos reinos: moluscos y artrópodos2-4.
- Los moluscos se dividen a su vez en los subfilos:
- Gastrópoda (abalón, caracol, lapa)
- Bivalvos (almeja, mejillón, vieira, ostra)
- Cefalópodos (pulpo, sepia, calamar)
- Los artrópodos se clasifican en los subfilos:
- Crustáceos (gamba, langosta, bogavante, nécora, cigala, langostino, buey de mar, centollo, santiaguiño)
- Queliceratos (ácaros, arañas)
- Hexópodos (cucaracha)
Los crustáceos producen reacciones alérgicas más frecuentemente que los moluscos y dentro de ellos, la gamba es el crustáceo que con más frecuencia produce reacciones alérgicas2.
REACCIONES ADVERSAS
En cuanto a las reacciones adversas al marisco, hemos de diferenciar las reacciones adversas inmunológicas de las no inmunológicas:
- REACCIONES ADVERSAS INMUNOLÓGICAS:
IgE mediadas: ocurren en las 2 horas siguientes a la ingesta del alimento. Pueden producir desde picor oral (60-95%), ronchas, inflamación facial; síntomas gastrointestinales como náuseas, vómitos, dolor abdominal (20%); síntomas respiratorios como congestión nasal, tos, dificultad para respirar o dificultad para tragar o anafilaxia (21-33%)1,2. La reacción alérgica no sólo ocurre tras la ingesta, sino que también puede desencadenarse con la inhalación de los vapores de cocción. También es importante saber que el ejercicio físico es un cofactor muy frecuente en la anafilaxia por marisco en niños1,2.
La sensibilización puede producirse bien a través de la ingesta o bien a través de la piel (sobre todo en pacientes con dermatitis atópica)2,3.
No IgE-mediadas: El Síndrome de enterocolitis por proteínas de la dieta (FPIES en inglés) por marisco en niños es poco frecuente (0,8% de los casos de FPIES) 5. Los síntomas consisten en vómitos proyectivos, repetidos, entre 1 y 4 horas de la ingesta del alimento, que pueden ir asociados a letargia, hipotensión, palidez y/o diarrea. Los síntomas se repiten cada vez que el niño toma el alimento y se resuelve una vez se retira el alimento implicado de la dieta5-6.
- REACCIONES ADVERSAS NO INMUNOLÓGICAS:
Estos animales invertebrados pueden ingerir toxinas (algas tóxicas), contaminantes o parásitos. Dependiendo de la cantidad de toxina ingerida, los síntomas y duración de la clínica varía. Los síndromes más frecuentes son los síntomas gastrointestinales (náuseas, vómitos, dolor abdominal, diarrea), intoxicación paralítica (hormigueo o adormecimiento de lengua, cuello y dedos, debilidad, dificultad respiratoria), neurotoxicidad (síntomas gastrointestinales y neurológicos, como parálisis y coma), ciguatera (síntomas neurológicos y cardiovasculares) e intoxicación amnésica (síntomas gastrointestinas seguidos de síntomas neurológicos)1.
ALERGENOS DEL MARISCO
Un alérgeno es una sustancia antigénica que induce una reacción alérgica en un organismo. Los alérgenos más importantes del marisco son1,2:
- Tropomiosina: es el principal alergeno de la alergia a gamba, ostra, caracol y calamar. También está en insectos, ácaros, insectos comestibles y anisakis simplex. Es resistente a la temperatura y a la digestión, por lo que no se degrada al cocinarlo ni con el jugo gástrico. El 90-100% de los pacientes alérgicos a un tipo de crustáceo también lo será a otros crustáceos y el 65% también tendrá alergia a moluscos. Hay estudios que demuestran que pacientes con alergia a marisco pueden tener alergia a los ácaros del polvo.
- Arginina-kinasa: también resiste altas temperaturas y es muy volátil, por lo que el vapor producido durante la cocción del marisco puede producir síntomas respiratorios. La arginina-kinasa se encuentra fundamentalmente en el camarón, cangrejo, pulpo y ácaros.
- Otros alérgenos menos relevantes son: cadena ligera de la miosina, proteína de unión al calcio sarcoplásmico, troponina C, etc.
Reactividad cruzada
- Crustáceos-moluscos: El 45% de los alérgicos a crustáceos también tienen alergia a moluscos, sin embargo, la mayoría (70-80%) de las personas alérgicas a moluscos también lo son a crustáceos1,2.
- Ácaros- crustáceos: pacientes alérgicos a ácaros pueden desarrollar alergia a marisco por reactividad cruzada. En ocasiones los síntomas tras ingesta de marisco se limitan al área orofaríngea (picor de boca, de garganta…) debido a la reactividad cruzada entre a tropomiosina de ácaros y marisco; a esto se le llama Síndrome de Alergia Oral ácaros-marisco 1-2
TRATAMIENTO
Los pacientes alérgicos a algún tipo de marisco deben evitar el consumo de todo tipo de marisco hasta que sea estudiado en Alergología1.
ENTONCES, ¿MI HIJO PUEDE COMER PESCADO?
El principal responsable de la alergia al pescado es la parvalbúmina. Es un alérgeno distinto al alérgeno principal del marisco (tropomiosina). Como diría una sabia compañera: «en lo único en que se parece el marisco y el pescado es que ambos viven en el mar». Por tanto, los pacientes alérgicos a marisco sí pueden comer pescado1.
Dra. Paloma Jaqueti Moreno. Hospital La Mancha Centro, Alcázar de San Juan, Ciudad Real. Comité de Alergia Infantil SEAIC.
BIBLIOGRAFÍA
- IgE-Mediated Shellfish Allergy in Children. Mattia Giovanini, Burcin Beken, Betul Buyuktiryaki, Simona Barni, Giulia Liccioli, Lucrezia Sarti, Lorenzo Lodi, Matteo Pontone, Irene Bartha, Francesca Mori, Cansin Sackesen, George du Toit, Andreas L Lopata, Antonella Muraro. 2023 Jun 11;15(12):2714. doi:10.3390/nu15122714.
- IgE Mediated Shellfish Allergy in Children-A Review. Ariana Giannetti, Andrea Pession, Irene Bettini, Giampaolo Ricci, Giuliana Gianni, Carlo Caffarelli. 2023 Jul 12;15(14):3112. doi: 10.3390/nu1514311
- Food allergy and hypersensitivity reactions in children and adults-A review. Sandra G Tedner, Anna Asarnoj, Helena Thulin, Marit Westman, Jon R Konradsen, Caroline Nilsson. J Intern Med. 2022 Mar;291(3):283-302. doi: 10.1111/joim.13422. Epub 2021 Dec 22
- C. Diéguez Pastor, F. Martín Muñoz, M. Reche Frutos, P.C. Vlaicu. Peculiaridades clínicas de la alergia a los alimentos de origen animal. En: Dávila, I. Jáuregui, I. Olaguibel, J. Zubeldía, J. SEAIC (Sociedad Española de Alergología e Inmunología Clínica). Tratado de Alergología tomo III. 2ª edición. Madrid: Ergon. 2016. Página 1023-1048.
- Infante S, Argiz L, Cabrera-Freitag P, Fernández-de-Alba I, Moya B, Escudero C (2022) Spanish Survey of Food Protein-Induced Enterocolitis Syndrome. J Investig Allergol Clin Immunol 2023; Vol 33(2): 134-136. doi: 10.18176/jiaci.0828
- Infante, S., Marco-Martín, G., Sánchez-Domínguez, M., Rodríguez-Fernández, A., Fuentes-Aparicio, V., Alvarez-Perea, A., … Zapatero, L. (2017). Food protein-induced enterocolitis syndrome by fish: Not necessarily a restricted diet. Allergy, 73(3), 728–732. doi:10.1111/all.13336
Mi niño tiene urticaria. ¿La urticaria es igual a alergia?
La urticaria es una enfermedad de la piel muy común. Consiste en la aparición de ronchas/habones y/o hinchazón/angioedema, que habitualmente se acompañan de picor. Si dura menos de 6 semanas se clasifica como urticaria aguda y si dura más de 6 semanas como urticaria crónica. Las ronchas aparecen y desaparecen con rapidez, cambian de localización y duran menos de 24 horas y puedes reaparecer en los días siguientes. La hinchazón puede afectar a la cara, las manos, los pies, los genitales y suele ser pruriginoso.
La mayoría de las urticarias en la edad infantil son agudas y no tienen relación con la alergia. La infección parece ser la causa predisponente más frecuente (más del 40%) de urticaria en lactantes y niños en comparación con los adultos. Suelen ser infecciones víricas leves y el niño mantiene buen estado general a pesar de que la urticaria afecte a gran parte de la superficie corporal. Los síntomas de la infección viral pueden estar presentes o no.
¿La urticaria es igual a alergia? En pocas ocasiones la urticaria que dura varios días o semanas es producida por una alergia alimentaria; medicamentosa o por una picadura de insecto. En estos casos, es habitual que la urticaria aparezca antes de que pasen dos horas tras la ingesta del alimento/medicamento o haya antecedente de picadura de insecto en los minutos previos (muy inusual en niños). En ocasiones, pueden asociarse síntomas respiratorios, digestivos, mareos, el niño podría estar mucho más nervioso y afectado. En estos casos, podría tratarse de una reacción alérgica generalizada (anafilaxia) y se debe instaurar tratamiento con adrenalina y solicitar asistencia sanitaria de inmediato.
La urticaria crónica es mucho menos frecuente en niños y en la práctica, la mayoría de los pacientes no tienen una causa identificable. Se clasifica como urticaria crónica espontánea. En un pequeño porcentaje la urticaria crónica en niños se asocia a presencia de anticuerpos autoinmunes. Los medicamentos antiinflamatorios no esteroideos (ibuprofeno, metamizol, paracetamol, etc.) se han identificado como principales factores agravantes de la urticaria crónica espontánea en niños.
En conclusión, la urticaria aguda (<6 semanas de duración) es más frecuente en niños que la urticaria crónica (>6 semanas de duración) y suele ser un proceso benigno, transitorio, y que no se asocia a patología grave subyacente en la la gran mayoría de los casos.
Autora:
Krasimira Baynova, MD. Comité de Alergia Infantil SEAIC. CSUR Angioedema. UGC Alergología. Hospital Universitario Virgen del Rocío. Sevilla.
Bibliografía
1) Meeyong Shin et al. Prevalence and Causes of Childhood Urticaria Allergy Asthma Immunol Res. 2017 May; 9(3): 189–190.
2) Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et all. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018 Jul;73(7):1393-1414. doi: 10.1111/all.13397. PMID: 29336054.
3) Brüske I, Standl M, Weidinger S, et al. Epidemiology of urticaria in infants and young children in Germany–results from German LISAplus and GINIplus Birth Cohort Studies. Pediatr Allergy Immunol 2014;25:36 –42.
4) Cornillier, H., Giraudeau, B., Munck, S., Hacard, F., Jonville-Bera, A.-P., d’ Acremont, G., … Maruani, A. (2018). Chronic spontaneous urticaria in children – a systematic review on interventions and comorbidities. Pediatric Allergy and Immunology, 29(3), 303–310.
Enlace de interés práctico:
https://enfamilia.aeped.es/temas-salud/decalogo-urticaria-infantil
¿Es usted alérgico a la proteína de leche de vaca o intolerante a la lactosa?: La pregunta que salva vidas
Y es que la diferencia es ciertamente importante. Tan importante como que una de ellas puede ser potencialmente mortal. ¿Sabrías decir a cuál de las dos nos referimos?
Comencemos por los términos importantes:
- Leche: según la definición de la RAE:
- Líquido blanco que segregan las mamas de las hembras de los mamíferos para alimento de sus crías.
- Leche de algunos animales que se emplea como alimento de las personas.
- Jugo blanco obtenido de algunas plantas, frutos o semillas.
- Es decir, CUIDADO, la leche puede ser de origen ANIMAL (vaca, oveja, cabra, búfala…) o VEGETAL (soja, arroz, avena, almendra, coco…).
- Lactosa: según la definición de la RAE:
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Presente en leches de mamíferos.
- La lactosa se “destruye” (es decir, se separa en glucosa y galactosa) mediante la acción de una enzima digestiva llamada lactasa.
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Leche de vaca (composición): agua, proteínas (beta-lactoglobulina, alfa-lactoalbúmina, caseína…), grasas, vitaminas, hidratos de carbono (entre ellos, la lactosa) y minerales.
- Yogures y quesos de origen animal: producto lácteo obtenido al fermentar la leche de animales mediante bacterias que transforman la lactosa en ácido láctico, por tanto, el contenido de lactosa en estos productos es menor. Pero siguen conteniendo lactosa (salvo aquellos específicos sin lactosa) y proteínas de leche de animales.
- Leche/yogures/quesos sin lactosa: leche de animales a los que se ha añadido lactasa de forma artificial (pero siguen conteniendo proteínas de leche).
- Leches/yogures vegetales (composición): NO contienen Contienen proteínas diferentes a las de la leche de animales.
DIFERENCIAS FUNDAMENTALES ENTRE AMBAS (ver cuadro)
 Cargando...
Cargando...
La alergia a las proteínas de la leche de vaca:
- Los pacientes pueden tener reacción con leches de otros mamíferos (vaca, cabra, oveja…).
- Reaccionan con pequeñas cantidades (el 50% con menos de 4.1 ml de leche).
- Pueden detectar trazas (menos de 0.1 ml de leche). Los pacientes altamente sensibilizados pueden reaccionar con mínimas cantidades e incluso con contaminaciones indirectas.
- Toleran leches vegetales (excepto si tienen además de su APLV, alergia a alguna de éstas).
- Las reacciones aparecen generalmente en las 2 primeras horas tras la ingesta.
- Los síntomas pueden ser cutáneos (habones, hinchazón de labios…), respiratorios (congestión nasal, dificultad para respirar…), digestivos (dolor abdominal, vómitos, diarrea…) y/o cardiovasculares (mareo, pérdida de conocimiento…).
- Las reacciones pueden ser potencialmente mortales en el caso de afectar a 2 o más órganos o sistemas (ANAFILAXIA).
- Requieren tratamiento urgente específico (por ejemplo, si la afectación es exclusivamente cutánea puede ser tratada con antihistamínicos y corticoides en caso de edema asociado, si los síntomas son respiratorios habrá que utilizar broncodilatadores de rescate y si estamos ante una anafilaxia, el tratamiento de elección será la adrenalina intramuscular).
La intolerancia a lactosa:
- Los pacientes toleran leche sin lactosa.
- Pueden consumir yogures sin lactosa y quesos con bajo contenido en lactosa (queso curado, parmesano, gruyere, mozzarella…). Pero es recomendable preguntar si pueden consumirlo.
- Pueden toleran leche y derivados lácteos con lactosa si toman previamente comprimidos de lactasa.
- Toleran leches vegetales.
- Suelen tener reacciones de tipo digestivo (dolor abdominal, diarrea, flatulencias…).
La cantidad SÍ importa:
3.2 mg de proteína de leche (unos 0.1 ml de leche de vaca) pueden desencadenar una reacción alérgica en al menos el 5% de los pacientes alérgicos a proteínas de leche de vaca. Al menos el 50% reaccionan con 133 mg de proteína de leche (unos 4.1 ml de leche).
EN RESUMEN: el conocimiento es poder. Y en este caso, el uso correcto del lenguaje es de vital importancia.
Grabémonos la pregunta clave:
¿Es usted alérgico a la proteína de la leche de vaca o intolerante a la lactosa?
- Si la respuesta es SOY ALÉRGICO: CUIDADO, pueden tener reacciones alérgicas potencialmente mortales, incluso con trazas, que requieran tratamiento urgente. Tendremos que evitar cualquier contacto con leche de mamíferos y aquellos productos que puedan contenerla.
- Si la respuesta es SOY INTOLERANTE: podemos dar leche y productos lácteos SIN lactosa. Podemos también preguntar por el grado de tolerancia, es decir, si tolera yogures o quesos.
- Si tenemos DUDAS: es mejor SER PRECAVIDOS y EVITAR cualquier contacto con leche de mamíferos o aquellos productos que puedan contenerlos.
Porque hay preguntas que salvan vidas. Usémoslas.
Dra. Laura Argiz Álvarez. Clínica Universidad de Navarra (Madrid).
Bibliografía:
- Turner PJ, d’Art YM, Duca B, et al. Single-dose oral challenges to validate eliciting doses in children with cow’s milk allergy. Pediatr Allergy Immunol. 2021;32(5):1056-1065. doi:10.1111/pai.13482
- Blom WM, Westerhout J, Baumert JL, et al. Updated full range of Eliciting Dose values for Cow’s milk for use in food allergen risk assessment. Food Chem Toxicol. 2022;168:113381. doi:10.1016/j.fct.2022.113381
Microbiota y alergia alimentaria – una nueva herramienta para su tratamiento
Lo primero, ¿Qué es eso de la microbiota intestinal?
La microbiota intestinal se define como la comunidad de microorganismos que habita en nuestro tracto digestivo. Esta comunidad está formada por una gran variedad de bacterias, hongos, virus y otros microorganismos que desempeñan un papel fundamental en la salud humana.
La composición de la microbiota intestinal depende de factores como la genética, la dieta, el modo de nacimiento, el tipo de lactancia y la toma de antibióticos entre otros, sobre todo en los tres primeros años de vida, que es cuando se establece la composición de nuestra microbiota intestinal que tiende a persistir en la vida adulta.
Nuestro estilo de vida urbano e industrializado nos expone a una menor diversidad microbiana y hace que esa exposición microbiana sea frente a una serie ¿concreta? O ¿microorganismos específicos? de microorganismos, lo que se traduce en una menor diversidad de nuestra microbiota intestinal y el desarrollo de una microbiota intestinal ¿específica? concreta que a su vez se ha relacionado con un mayor riesgo de desarrollar una patología alérgica en general y alergia alimentaria en concreto.
En los últimos años, se ha demostrado que la microbiota intestinal juega un papel importante en la alergia alimentaria, lo que hace plantearnos si este papel podría aprovecharse a nuestro favor para prevenir e incluso llegar a tratar la alergia alimentaria.
Pero… ¿y qué es exactamente la alergia alimentaria?
La alergia alimentaria es una reacción exagerada e inapropiada del sistema inmunológico ante la proteína de un alimento específico. Puede producir diferentes síntomas desde los más leves (ej. picor en la boca) hasta las reacciones más graves potencialmente mortales llamadas anafilaxias.
¿Qué relación existe entre la microbiota intestinal y la alergia alimentaria?
Entre las funciones de la microbiota intestinal se encuentra el desarrollo y mantenimiento de un sistema inmunológico saludable.
Cuando se produce la introducción de la alimentación complementaria en los lactantes, la microbiota intestinal juega un papel fundamental en el desarrollo de tolerancia oral a los alimentos. Se trata de un momento crucial en el que una microbiota intestinal alterada puede contribuir a la aparición y desarrollo de la alergia alimentaria. A continuación, resumimos los hallazgos más relevantes obtenidos en estudios observacionales y preclínicos que apuntan al papel de la microbiota intestinal en el desarrollo de alergia alimentaria:
- Determinadas exposiciones microbianas en la primera infancia se asocian a menor o mayor riesgo de desarrollar alergia alimentaria. Así, tener hermanos mayores o perro en domicilio durante el primer año de vida se asocia a un menor riesgo de desarrollar alergia a huevo al año de edad, mientras que nacer mediante cesárea se asocia a un mayor riesgo de tener alergia alimentaria.
- La composición de la microbiota intestinal en los primeros meses de vida, se asocia a riesgo de desarrollar sensibilización alimentaria (el paso previo a una posible alergia alimentaria) en los primeros años de vida.
- La composición de la microbiota intestinal de niños con alergia alimentaria es distinta a la de niños sin alergia alimentaria.
- En niños con alergia alimentaria, la composición de su microbiota intestinal en los primeros meses de vida podría estar asociada a la adquisición de tolerancia espontánea en los siguientes años.
- Modelos murinos han demostrado que: (i) la microbiota intestinal tiene un papel supresor y evita la sensibilización y el desarrollo de alergia alimentaria y que (ii) la susceptibilidad de tener alergia alimentaria se transmite a través de la microbiota fecal.
Los conocimientos adquiridos en estos estudios han sentado las bases para llevar a cabo ensayos clínicos en humanos en los que se emplean probióticos, prebióticos y simbióticos con el fin de manipular la microbiota intestinal existente como herramienta preventiva o terapéutica en la alergia alimentaria. Sin embargo, a día de hoy no existe evidencia científica suficiente que avale el empleo de estas terapias microbianas para prevenir o tratar la alergia alimentaria aunque sin duda es un campo prometedor en el que seguir trabajando.
Para ampliar: video en youtube de la Dra. Venter sobre el papel de la microbiota en la alergia alimentaria: (2023) Youtube.com: https://www.youtube.com/watch?v=IpZXU-iKF9A (Accessed: 14 February 2023).
Dra. Isabel Fernández de Alba Porcel, Hospital HLA Inmaculada, Granada. Comité de Alergia Infantil
Bibliografía
- Azad MB, Konya T, Guttman DS, Field CJ, Sears MR, HayGlass KT, Mandhane PJ, Turvey SE, Subbarao P, Becker AB, Scott JA, Kozyrskyj AL; CHILD Study Investigators. Infant gut microbiota and food sensitization: associations in the first year of life. Clin Exp Allergy. 2015 Mar;45(3):632-43. doi: 10.1111/cea.12487. PMID: 25599982.
- Bager P, Wohlfahrt J, Westergaard T. Caesarean delivery and risk of atopy and allergic disease: meta-analyses. Clin Exp Allergy. 2008 Apr;38(4):634-42. doi: 10.1111/j.1365-2222.2008.02939.x. Epub 2008 Feb 11. PMID: 18266879.
- Bunyavanich S, Berin MC. Food allergy and the microbiome: Current understandings and future directions. J Allergy Clin Immunol. 2019 Dec;144(6):1468-1477
- Bunyavanich S, Shen N, Grishin A, Wood R, Burks W, Dawson P, Jones SM, Leung DYM, Sampson H, Sicherer S, Clemente JC. Early-life gut microbiome composition and milk allergy resolution. J Allergy Clin Immunol. 2016 Oct;138(4):1122-1130. doi: 10.1016/j.jaci.2016.03.041. Epub 2016 May 10. PMID: 27292825; PMCID: PMC5056801.
- Fazlollahi M, Chun Y, Grishin A, Wood RA, Burks AW, Dawson P, Jones SM, Leung DYM, Sampson HA, Sicherer SH, Bunyavanich S. Early-life gut microbiome and egg allergy. Allergy. 2018 Jul;73(7):1515-1524. doi: 10.1111/all.13389. Epub 2018 Mar 15. PMID: 29318631; PMCID: PMC6436531.
- Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, Arshad H, Bahnson HT, Beyer K, Boyle R, du Toit G, Ebisawa M, Eigenmann P, Grimshaw K, Hoest A, Jones C, Lack G, Nadeau K, O’Mahony L, Szajewska H, Venter C, Verhasselt V, Wong GWK, Roberts G; European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021 Jul;32(5):843-858. doi: 10.1111/pai.13496. Epub 2021 Mar 29. PMID: 33710678.
- Jungles KN, Jungles KM, Greenfield L, Mahdavinia M. The Infant Microbiome and Its Impact on Development of Food Allergy. Immunol Allergy Clin North Am. 2021 May;41(2):285-299.
- Koplin JJ, Dharmage SC, Ponsonby AL, Tang ML, Lowe AJ, Gurrin LC, Osborne NJ, Martin PE, Robinson MN, Wake M, Hill DJ, Allen KJ; HealthNuts Investigators. Environmental and demographic risk factors for egg allergy in a population-based study of infants. Allergy. 2012 Nov;67(11):1415-22. doi: 10.1111/all.12015. Epub 2012 Sep 7. PMID: 22957661.
- Noval Rivas M, Burton OT, Wise P, Zhang YQ, Hobson SA, Garcia Lloret M, Chehoud C, Kuczynski J, DeSantis T, Warrington J, Hyde ER, Petrosino JF, Gerber GK, Bry L, Oettgen HC, Mazmanian SK, Chatila TA. A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis. J Allergy Clin Immunol.2013 Jan;131(1):201-12. doi: 10.1016/j.jaci.2012.10.026. Epub 2012 Nov 30. PMID: 23201093; PMCID: PMC3860814.
- Otero, Olalla (2022) El revolucionario mundo de los probióticos: Qué son, cómo funcionan y para qué sirven. Barcelona, Alienta editorial.
- Rachid R, Stephen-Victor E, Chatila TA. The microbial origins of food allergy. J Allergy Clin Immunol. 2021Mar;147(3):808-813. doi: 10.1016/j.jaci.2020.12.624. Epub 2020 Dec 22. PMID: 33347905; PMCID: PMC8096615.
- Savage JH, Lee-Sarwar KA, Sordillo J, Bunyavanich S, Zhou Y, O’Connor G, Sandel M, Bacharier LB, Zeiger R, Sodergren E, Weinstock GM, Gold DR, Weiss ST, Litonjua AA. A prospective microbiome-wide association study of food sensitization and food allergy in early childhood. Allergy. 2018 Jan;73(1):145-152. doi: 10.1111/all.13232. Epub 2017 Aug 2. PMID: 28632934; PMCID: PMC5921051.
Nuevos alimentos, viejos alérgenos
Los insectos forman parte de la cocina de muchos países del mundo y su consumo dentro de Europa va avanzando en últimos años. Aproximadamente dos mil millones de personas en todo el mundo consumen insectos especialmente en países como Asia, América Latina y África1.
El consumo de insectos es en la actualidad una tendencia alimentaria en auge. Desde el 1 de enero de 2018 la legislación europea cataloga a los insectos como “nuevo alimento” y según la Organización para la Agricultura y la Alimentación de las Naciones Unidas (FAO), les considera “el alimento del futuro”.
Hoy en día, son cuatro los insectos autorizados en el mercado europeo: las larvas del gusano de la harina (en forma congelada, desecada y en polvo), la langosta migratoria (en forma congelada, desecada y en polvo), el grillo doméstico (en forma congelada, desecada, en polvo y polvo parcialmente desgrasado) y las larvas del escarabajo del estiércol (en forma congelada, en pasta, desecada y en polvo) 2. Aunque a nivel general este habito de consumo no está muy extendido, en nuestra dieta, consumimos de forma inadvertida el componente “E12” o carmín, una sustancia que se obtiene del insecto cochinilla, que se utiliza para teñir diversos alimentos de confiterías, pasteles y mermeladas, jarabes, yogures, bebidas y carnes.
Además, hay ocho solicitudes pendientes para insectos destinados a ser comercializados en diferentes formas que actualmente están siendo objeto de una evaluación de seguridad2.
Los insectos representan una alternativa a la carne y el pescado para satisfacer la creciente demanda de fuentes sostenibles de nutrición 1.
Desde el punto de vista nutricional, los estudios científicos avalan que los insectos son una fuente de nutrientes muy saludables con alto contenido en proteínas, vitaminas B1, B2 y B3, contienen omega 3 y 6, todos los aminoácidos esenciales y son una fuente importante de minerales como el hierro.
Hay otro factor que debe tenerse en cuenta y que juega a favor del consumo de insectos: el impacto medioambiental. La producción de proteína de insectos supone una importante reducción de gases de efecto invernadero y supone una menor contaminación respecto a otras proteínas de origen animal.
Respecto a la seguridad de su consumo, la Comisión Europea con el reglamento sobre nuevos alimentos, asegura que se disponga de la información alimentaria obligatoria para que sean seguros para los consumidores y estén debidamente etiquetados, incluyendo la identificación correcta de alérgenos.
Al igual que las proteínas de otros alimentos, las contenidas en los insectos, son susceptibles de desencadenar reacciones alérgicas graves. Cada vez son más los pacientes que llegan a nuestras consultas por reacciones alérgicas, incluyendo reacciones anafilácticas, tras la ingestión de insectos.
Se han identificado varios alérgenos implicados en la alergia a insectos, entre ellos la tropomiosina y la arginina quinasa, ambos panalérgenos conocidos por su reactividad cruzada con proteínas homólogas en crustáceos y ácaros del polvo doméstico. Se ha demostrado reactividad cruzada y/o cosensibilización de la tropomiosina de insectos y la arginina quinasa en pacientes alérgicos a los ácaros del polvo doméstico y a los mariscos (p. ej., langostinos, gambas). También se ha demostrado que el procesamiento térmico y la digestión no eliminaron la alergenicidad de las proteínas de insectos1.
Algunos estudios señalan que la proteína de la cutícula de la larva del gusano, podría ser un alérgeno importante en la sensibilización primaria al gusano de la harina. Otros alérgenos, como la actina,insectoo la cadena ligera similar a la miosina, también se identifican como factor de riesgo de reactividad cruzada entre crustáceos y gusanos de la harina 3.
La disponibilidad de este tipo de alimentos en supermercados y su venta on-line, esta haciendo que cada vez su consumo sea más frecuente.
Es importante el papel que juega el alergólogo en este momento en el que el consumo de insectos empieza a instaurarse poco a poco en nuestra dieta para poder asesorar adecuadamente a los pacientes.
Rocío Candón Morillo. Hospital Universitario de Jerez. Comité de Alergia Infantil SEAIC.
Bibliografía
1.-Insect (food) allergy and allergens. Steffie de Gier , Kitty Verhoeckx .Molecular Immunology. Volume 100, August 2018, Pages 82-106
2.- Los insectos como nuevos alimentos: claves para asesorar adecuadamente a la población sobre su consumo. Diario medico.
3.-Mankouri F1, Sereme Y2,3, Michel M2,3, Piarroux R4, Pahus , Chanez P1,6, Vitte J2,3, Gouitaa MJ Investig . Immediate Hypersensitivity to Mealworm and Cricket: Beyond Shrimp and House Dust Mite
Cross-Reactivity. Allergol Clin Immunol 2022; Vol. 32(1): 56-78
Telealergia: ¿vino para quedarse?
Artículo: Teleallergy: Where Have We Been and Where Are We Going? Ramsey A, Chen Wu A, Bender B, Portnoy J. J Allergy Clin Immunol Pract 2023;11:126-31.
La telemedicina se puede definir, como el uso de las tecnologías de la información, por medio de los sistemas telemáticos, para proporcionar asistencia médica, independientemente de la distancia que separa al paciente del profesional médico.
Los primeros datos de telemedicina aplicados al campo de la Alergología son muy escasos a partir de los años 90. Sin embargo, el uso de la telemedicina se incrementa de forma exponencial a partir del año 2020. Este año, queda marcado en la historia por la extensión de la enfermedad provocada por el virus SARS-CoV-2019 (COVID-19), lo que condicionó un cierre de la actividad socioeconómica mundial casi global. Tras declararse la pandemia por la Organización Mundial de la Salud en marzo de 2020, el gobierno español decretó el estado de alarma con el consiguiente confinamiento domiciliario, que se prolongó hasta junio de 2020. Posteriormente se han sucedido diversas olas pandémicas que han ido afectando de forma diversa la asistencia médica.
El modelo de acceso y prestación de la asistencia sanitaria cambió bruscamente, primero en la Atención Primaria, y posteriormente en las diferentes especialidades médicas. El patrón clásico de asistencia presencial, ha sido sustituido por un patrón mixto, en el que las herramientas de telemedicina han desempeñado un papel determinante. Centrándonos en el campo de la Alergología, investigadores norteamericanos dirigidos por Ramsey y cols., han llevado a cabo una revisión sobre el impacto de la telemedicina en la satisfacción de los pacientes alérgicos, en el coste de la asistencia, así como en el entorno normativo que debe regular en el futuro la telemedicina.
1.- Satisfacción del paciente
- Satisfacción del paciente antes de la epidemia COVID:
Hay diversos estudios en los primeros años del siglo XXI. Así, en 2015, Portnoy y cols., compararon las visitas presenciales frente a la teleasistencia, en 169 pacientes pediátricos con asma bronquial. El 90% de los pacientes consideraban satisfactoria la asistencia sanitaria, y un 88% la recomendaría para las revisiones médicas.
- Satisfacción durante la epidemia COVID:
Diversos estudios muestran una opinión favorable. En el estudio de Mustafa y cols., con 251 pacientes alérgicos, la satisfacción fue general para todos los tipos de enfermedades alérgicas, salvo en la alergia a alimentos, donde los pacientes consideraron óptima la visita presencial. En otro estudio dirigido por Emory con 269 pacientes, la satisfacción fue plena con la consulta telemática para el 79% de los pacientes, siendo el dato mas relevante la facilidad para poder asistir a la cita. No obstante, incluso con datos satisfactorios, los investigadores refieren que determinados procedimientos en el campo de la Alergología, como la realización de las pruebas cutáneas o los estudios de pruebas de tolerancia con alimentos o medicamentos requieren de la visita presencial. Otros estudios, sin embargo, muestran una mayor satisfacción con las visitas presenciales, especialmente en pacientes con dermatitis atópica, múltiples alergias a alimentos o pacientes pediátricos con asma bronquial.
2.- Satisfacción del médico
Tradicionalmente los alergólogos no han utilizado la telemedicina, por lo que se les deben facilitar herramientas que permitan su uso. Sin embargo, salvo en algunos países, no se han desarrollado programas de formación para los especialistas ni tampoco la asistencia mediante aplicaciones informáticas.
La principal ventaja de utilizar la telemedicina en la práctica clínica habitual es el ahorro de tiempo que supone para el médico disminuir las horas de consulta dedicadas a labores burocráticas. Este tiempo podría reinvertirse en reducir las listas de espera dedicadas a dar resultados analíticos, resolver dudas a pacientes a cerca de tratamientos de una forma más rápida, así como conseguir una comunicación más fluida con pacientes y médicos de Atención Primaria. De esta manera, se agilizarían procedimientos ordinarios y mejoraría la calidad asistencial del paciente.
3.- Coste socioeconómico de la telemedicina
Por un lado, la telemedicina puede reducir los costes de las enfermedades alérgicas ya que disminuye los gastos en el transporte hasta la consulta médica, así como el absentismo escolar y laboral. Sin embargo, tiene otras desventajas que pueden incrementar el coste como es la falta de acceso directo al profesional sanitario y su supervisión, lo que puede implicar una peor evolución clínica de la enfermedad. Existen pocos estudios durante la pandemia Covid de telemedicina y coste sanitario. En un estudio sobre pacientes pediátricos diagnosticados de asma bronquial, se observó que tras realizar un programa de telemedicina en el primer año de la pandemia Covid, hubo una reducción en las reagudizaciones asmáticas. Este hecho puede ser atribuible no a la telemedicina en si misma, sino a la escolarización en casa durante los primeros meses Covid, así como el uso de la mascarilla, ya que ambas situaciones redujeron la exposición a diferentes virus durante ese periodo de tiempo, lo que puede explicar la reducción en las exacerbaciones asmáticas. Por otro lado, es conocido que la telealergia tiene su mayor potencial de mejora del gasto sanitario en las zonas rurales o áreas que no disponen de alergólogo cercano, por lo que requieren un desplazamiento importante para la asistencia médica. Así, en un estudio alemán hecho con 112 pacientes con rinitis alérgica, la telemedicina generó un ahorro de 60.000 euros por año y redujo en 2.3 los días perdidos de trabajo o escuela, por paciente y año.
4.- Cambios en el marco regulatorio
La introducción y el uso progresivo de la telemedicina aplicado al campo de la Alergología, debe acompañarse de una actualización en el marco legislativo, así como de la cobertura y coste de los seguros de asistencia médica, tanto en la Sanidad Privada como Pública, que deben ir acometiéndose durante los próximos años.
CONCLUSIONES
Tras la pandemia Covid, la telemedicina aplicada al campo de la Alergología es una realidad. Esta herramienta ofrece ventajas, las principales, la reducción de absentismo laboral/escolar y transporte, la mejor adherencia en el seguimiento y la mayor agilidad en las revisiones médicas. Ofrece también una posible mejoría en la educación continuada del paciente alérgico con las diferentes herramientas informáticas, así como en el seguimiento del cumplimiento terapéutico. Sin embargo, pese a estas ventajas, la asistencia presencial seguirá siendo vital en nuestra especialidad, para la realización de muchos de nuestros procedimientos diagnósticos y terapéuticos, así como para aquellos pacientes que requieran un diagnóstico inicial, una valoración directa por parte del alergólogo o cuando la gravedad o el control de la enfermedad así lo requiera.
Marta Reche. Servicio de Alergología. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid. Comité de Alergia Infantil
Alergia al veneno de himenópteros en niños
La picadura de insectos en la población pediátrica es una causa frecuente de búsqueda de asistencia médica en época estival. La alergia al veneno de los himenópteros es una reacción del sistema inmunitario frente al veneno tras la picadura de éstos.
Las picaduras de himenópteros, principalmente de abejas y avispas, son los principales responsables de las reacciones alérgicas tras picadura de insectos en nuestro medio. Según la Guía Alergia al Veneno de los Himenópteros de la EAACI (Academia Europea de Alergia e Inmunología Clínica) las reacciones alérgicas sistémicas a picaduras de estos insectos afectan al 3,4% de los niños. La alergia a su veneno suele aparecer a partir de una segunda picadura, que es cuando el menor habrá quedado sensibilizado a su veneno, por lo que es más frecuente en niños mayores.
Las reacciones que suelen producirse son de dos tipos:
– Locales cuando aparece enrojecimiento, hinchazón y dolor en la zona y puede afectar hasta a dos articulaciones. El tratamiento es la limpieza de la zona con agua y jabón, se puede aplicar amoniaco y frío local, además de antihistamínicos y corticoides orales.
– Sistémicas o generalizadas cuando los síntomas afectan a otras partes del cuerpo, suelen aparecer lesiones habonosas y mucho picor, inflamación en los ojos y la boca, síntomas respiratorios, dificultad para tragar, mareo, bajada de tensión e incluso pérdida de conocimiento. Estaríamos ante una anafilaxia que puede ser peligrosa para la vida si no se trata a tiempo. Por ello hay que administrar de forma rápida adrenalina intramuscular, además de corticoides y antihistamínicos orales y se debe acudir de inmediato a urgencias para una valoración por el equipo médico y completar el tratamiento si fuera necesario.
La alergia al veneno de avispa o de abeja puede diagnosticarse mediante una prueba de punción cutánea y/o con una analítica en sangre de anticuerpos en suero (IgE).
Una vez diagnosticada la alergia a veneno de himenópteros y con antecedentes de reacción anafiláctica, la vacuna con veneno es el único tratamiento existente para prevenir futuros episodios y evitar las reacciones. Además, goza de muy buena reputación entre los pacientes pues claramente mejora su calidad de vida.
Los riesgos de reacción alérgica a picaduras de himenópteros en niños diagnosticados de alergia a su veneno, se incrementan durante los meses de verano debido al mayor tiempo que pasan al aire libre. El campo, la piscina y todos aquellos lugares con mucha vegetación o aguas estancadas son el ambiente ideal para este tipo de insectos.
Para evitar que estas picaduras se produzcan, sobre todo durante el verano, lo aconsejable es evitar en la medida de lo posible la proximidad a los nidos de avispas o abejas. Además, es recomendable que el niño no ande descalzo por el césped, sacudir la ropa antes de ponérsela, comprobar que los asientos, vasos u otros utensilios están limpios de insectos, evitar que lleven ropas llamativas o colonias y cremas muy perfumadas en el campo o tener los cubos de basura bien cerrados en lugares con vegetación.
Dra. Paula Méndez Brea. Médico adjunto del Servicio de Alergología. Complexo hospitalario universitario De Santiago de Compostela. Comité de Alergia Infantil SEAIC
Bibliografía:
Tankersley M, Ledford D. Stinging Insect Allergy: State of the Art 2015. J Allergy Clin Immunol Pract 2015;3(3):315-22.
Krishna M, Ewan P, Diwakar L, et al. Diagnosis and management of hymenoptera venom allergy: British Society for Allergy and Clinical Immunology (BSACI) guidelines. Clin Exp Allergy 2011;41(9):1201-20.
Karabus S. Hypersensitivity to stinging insects. Curr Allergy Clin Im 2012;25(3):132-8.
Nevot Falcó S, Ferré Ybarz L. Hipersensibilidad a veneno de himenópteros. Protoc Diagn Ter Pediatr 2013;1:135-44.
Lange J, Cichocka-Jarosz E, Marczak H, et al. Natural history of Hymenoptera venom allergy in children not treated with immunotherapy. Ann Allergy Asthma Immunol 2016;116(3):225-9.
Bilo MB, Bonifazi F. The natural history and epidemiology of insect venom allergy: Clinical implications. Clin Exp Allergy. 2009;39(10):1467-76.
Sturm GJ, Varga E-M, Roberts G, et al. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy. 2017;00:1–20.
Sturm GJ el al. EAACI guidelines on allergen immunotherapy: Hymenopteravenom allergy. Allergy . 2018;73(4):744-764.
Actualización en Anafilaxia (guía GALAXIA)
Recientemente, se ha presentado en el Congreso de la Sociedad Española de Alergología e Inmunología Clínica, la tercera actualización de la Guía Galaxia, un documento de posicionamiento sobre el diagnóstico y el tratamiento de la anafilaxia, en esta edición se presentan novedades relevantes como la perspectiva del paciente y la implicación de la sociedad para la creación de ambientes seguros.
La anafilaxia es la presentación clínica aguda más grave de una reacción alérgica y puede comprometer la vida del paciente, es una emergencia médica que requiere de una actuación inmediata, con el reconocimiento de la clínica y un tratamiento precoz, y de un manejo a medio y, largo plazo que incluya medidas de educación y prevención, en algunos casos se puede conseguir la curación, como la anafilaxia por veneno de himenópteros, o en algunas alergias alimentarias
Todo paciente que ha sufrido una anafilaxia debe ser derivado a un especialista de Alergología para realizar un estudio completo, confirmar el desencadenante sospechoso, prevenir nuevos episodios, evaluando la posibilidad del paciente de volver a desarrollarlos y recibir información, y un tratamiento adecuado.
El paciente diagnosticado de anafilaxia debe ser valorado por el especialista
por lo menos una vez al año, y en esa consulta se le debe explicar y dar por escrito:
- Normas estrictas de evitación de los alérgenos (sustancias que provoca la reacción alérgica) implicados o sospechosos que incluyan los alergenos específicos y su reactividad cruzada con otros productos, esta información debe ser revisada en cada visita
- Educación para el reconocimiento precoz de los síntomas típicos de la anafilaxia incluyendo un plan de actuación que indique al paciente que tratamiento administrar dependiendo de la clínica que presente en el momento de la reacción, y que le permita una actuación lo más rápida posible, para evitar un desenlace fatal
- Educación y entrenamiento sobre el uso de autoinyectores de adrenalina. En los siguientes casos es necesario llevar dos dispositivos: si hay coexistencia de asma inestable o moderada-grave persistente y alergia a alimentos, si hay coexistencia de enfermedad mastocitaria y/o triptasa basal elevada, falta de acceso rápido a asistencia sanitaria por barreas geográficas o idiomáticas, requerimiento previo de más de una dosis antes de llegar a un hospital, reacción previa casi mortal, dosis del autoinyector inferior a la calculada por peso del paciente. Se deben administrar de forma precoz.
Existe un uso deficiente de los autoinyectores, por escasa información, miedo o aversión al tratamiento intramuscular, dificultades económicas o afectación en la calidad de vida por la dificultad de llevarlo consigo. Los padres, tutores y docentes deben estar entrenados en su uso en el caso de los niños. El alergólogo debe informar de que la adrenalina tiene una vida útil corta, por lo que se debe revisar la fecha de caducidad y la reposición de los dispositivos caducados
- Recibir información sobre las enfermedades o tratamientos (comorbilidades) que pueden provocar una sintomatología más grave, o disminuir la atención del paciente ante los síntomas. El asma mal controlada, las enfermedades cardiovasculares, algunos fármacos como los betabloqueantes, los IECA (inhibidores del enzima convertidor de la angiotensina), ansiolíticos, pueden aumentar el riesgo de desarrollar una anafilaxia fatal
- Medidas de prevención: Tratamientos que pueden curar o mitigar la sensibilización a alérgenos específicos, como la inmunoterapia oral con alimentos en casos seleccionados, desensibilización a fármacos, o inmunoterapia con venenos de himenópteros. Llevar una pulsera o tarjeta de identificación médica en la cartera, recomendar llevar teléfono móvil si el paciente está solo
También es labor de los especialistas, pacientes, y asociaciones de pacientes impulsar medidas de salud pública, como exigir la mejora del etiquetado de los alimentos, exigir planes de acción en colegios, restaurantes ( información disponible y accesible para los ingredientes del alimento no envasado) y centros de ocio ( recomendar espacios alergoprotegidos que dispongan de lo necesario para asistir a una persona que sufra un episodio de anafilaxia ) e intentar conseguir que en edificios públicos, centros de ocio , y comerciales se disponga de autoinyectores de adrenalina, como ahora se dispone de desfibriladores.
Se aconseja al lector visualizar los siguientes videos sobre
Auto inyectores de adrenalina:
Anapen: https://youtu.be/8I-r_ftcUMc
Jext:: https://youtu.be/QDXRhZBNjFw
Altellus: https://www.epinefrina.es/es-es/epinefrinaguide?userstate=public#
Emerade: https://youtu.be/NzyNoUeiu9o
Dra. M.ª Isabel Alvarado Izquierdo. Alergóloga del Complejo Hospitalario Universitario de Cáceres. Miembro del Comité de Alergia Infantil de la SEAIC
CÓMO ENFRENTARSE A UNA EPIDEMIA DE BRONQUIOLITIS Y EL ASMA INFANTIL.
Hemos superado una pandemia en los últimos años de un virus respiratorio que nos ha traído de cabeza y cuando estábamos “descuidados” nos encontramos con que nuestros niños ahora están “en peligro”. ¿Es así?, ¿nos debemos preocupar los padres/madres? ¿Y si nuestros hijos tienen asma?, ¿hay algo que podamos hacer?
Tenemos las UCI pediátricas y los servicios de urgencia saturados con casos de esta enfermedad respiratoria. Se ha estimado que hasta un 40% más que en años anteriores a la pandemia. Entonces: ¿Qué debemos saber?, ¿podemos prevenir esta infección? ¿Si nuestro hijo/a tiene asma, debemos tener especial precaución?
Esto era algo que podíamos prever, pues hemos pasado 2 años en los que los niños han estado con medidas de aislamiento estrictas que han ido desapareciendo, tales como mascarillas y la distancia social, han estado menos expuestos a virus y ahora, se enfrentan de nuevo a los virus típicos de estas fechas: la bronquiolitis, que aunque es una enfermedad epidémica y por tanto, todos los años hay muchos casos, este año parece que se están detectando con mayor frecuencia; la gripe, que se trata de otra enfermedad epidémica y se puede solapar con la anterior y además la Covid-19. Y los 3, pueden solaparse y darse en la misma época.
La bronquiolitis es una enfermedad de la vía respiratoria inferior que suele darse en menores de 2 años y que es causada fundamentalmente por el virus respiratorio sincitial (VRS) aunque también pueden influir otros virus respiratorios. Las pequeñas vías respiratorias bajas llamadas bronquios y bronquiolos se inflaman debido a esta infección, se llenan de moco y esto causa dificultad respiratoria. Suele ocurrir en los meses de invierno pero también puede tener un pico en los meses de primavera. Llamamos “bronquiolitis” al primer episodio y el resto ya serían episodios de “bronquitis”.
Lo primero que debemos saber es que no debemos alarmarnos a priori. Nos preocuparían sobre todo los niño/as más pequeñitos, fundamentalmente entre 2 y 6 meses o aquellos con algún factor de riesgo (inmunodeprimidos, prematuros, enfermedades cardiológicas, asma no controlada…) pero debemos ser conscientes, que aunque no existe un tratamiento específico, podemos tomar ciertas medidas para “prevenir” o tratar de la forma más adecuada. Generalmente en niños mayores y adultos, el cuadro suele pasarse como un simple cuadro catarral leve con mucosidad.
Ya que no existe un tratamiento específico, pues sobre todo en lactantes muy pequeños, los broncodilatadores no son eficaces, y no se trata con antibióticos, puede ser que estos niños precisen de oxigenoterapia y tengan que acudir a urgencias y que ingresar en el hospital. De ahí el “colapso” de urgencias y la atención hospitalaria. La buena noticia es que recientemente la Comisión Europea acaba de aprobar un anticuerpo monoclonal, llamado nirsevimab, que ha demostrado eficacia y seguridad en la prevención de enfermedad e ingreso por VRS para toda la población de recién nacidos y lactantes sanos o con enfermedades previas, aunque todavía no es de uso generalizado y habrá que esperar, por el momento, en la mayoría de casos.
Debemos estar atentos a las señales de alarma: decaimiento, falta de apetito, adormecimiento, fiebre de varios días que no cede (aunque no siempre tiene que haber fiebre) que puede significar una sobreinfección bacteriana, respiración superficial con taquipnea y tiraje subcostal (respiración rápida, podemos ver como las costillas suben y el abdomen sube y baja) y ante éstas, acudir a nuestro pediatra o médico especialista, y establecer las medidas de confort más adecuadas (tenerlos nutridos e hidratados, antitérmicos en caso de fiebre, etc).
Para prevenir estas infecciones podemos realizar lavado frecuente de manos, evitar el contacto con personas que presenten síntomas de catarro (no visitar o coger a niños de riesgo o bebés muy pequeños si tenemos un leve catarro aunque sea con síntomas leves) o evitar espacios con humo de tabaco, entre otras.
El 50% de los niños que tienen un episodio de bronquiolitis tiene más probabilidades de sufrir nuevos episodios de bronquitis y tener bronquitis de repetición, aunque normalmente conforme van creciendo y sobre todo a partir de los 3 años estos cuadros se reducen y dejan de ocurrir. Esto no quiere decir que todos vayan a ser asmáticos con el tiempo, pero evidentemente, habrá que vigilar y seguir su curso para ver evolución, pues un pequeño porcentaje de estos niños podrán desarrollar un asma infantil en el futuro.
En el caso de niños con episodios de broncoespasmos de repetición y/o asma debemos tener la precaución de mantener su tratamiento de base en el caso de que lo tengan, bien con inhaladores u otros fármacos, seguir las instrucciones en cuanto al tratamiento del pediatra o especialista (alergólogo, neumólogo) que les trate y establecer las medidas anteriormente descritas.
En definitiva, mucho ánimo a esos padres y madres que se enfrentan a esta época de virus; recomendando información veraz y actualizada y trabajo en equipo, padres/madres y personal sanitario.
Margarita Tomás Pérez. Médico adjunto de Alergología. Hospital Universitario La Paz. Comité de Alergia Infantil. SEAIC
1-. Susana Rodríguez M. Bronchiolitis in the year of COVID-19. Arch Argent Pediatr.2020;118(3):222-223.
2-. Gómez C, Alarcón G, Cifuentes L. Beta-2 agonists for the treatment of bronchiolitis. Beta-2 agonistas para el tratamiento de bronquiolitis. Medwave. 2020;20(8):e7945. Published 2020 Sep 3. doi:10.5867/medwave.2020.08.7947.
3-. Hammitt LL, Dagan R, Yuan Y, Baca Cots M, Bosheva M, Madhi SA, et al;MELODY Study Group. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022;386(9):837-846.
4-. Garcia-Garcia ML, Calvo Rey C, Rabes T. Pediatric Asthma and viral infection. Arch Bronconeumol. 2016; 52(5): 269–273.
Más allá de la piel
La dermatitis atópica es una condición dermatológica cuya cronicidad afecta la calidad de vida de pacientes pediátricos y de sus cuidadores.
A menudo nuestros esfuerzos terapéuticos se centran en tratar lo más visible, olvidándonos o subestimando las heridas y cicatrices más profundas e invisibles.
El artículo “Skin Disease in Children: Effects on Quality of Life, Stigmatization, Bullying, and Suicide Risk in Pediatric Acne, Atopic Dermatitis, and Psoriasis Patients” se centra en investigar las consecuencias emocionales que pueden desencadenaralgunas patologías dermatológicas crónicas, entre ellas la dermatitis atópica.
El peso emocional de la dermatitis atópica es más extenso que el prurito que puede manifestar. La carga emocional producida por la percepción negativa de la propia imagen corporal dificulta las relaciones sociales con otros coetáneos o incluso con los familiares más cercanos.
Los padres u otros familiares manifiestan a menudo sensación de frustración, agotamiento, culpabilidad e impotencia que inconscientemente puede repercutir en la relación con el menor y alterar las dinámicas familiares.
Se ha observado que pacientes los pediátricos con dermatitis atópica sufren alteraciones del comportamiento (mayor dependencia, aflicción, trastornos del sueño) similares a las que pueden padecer los pacientes pediátricos con otras enfermedades crónicas de mayor afectación sistémica.
El prurito les limita no sólo en sus casas, sino también fuera, en las actividades de ocio y extraescolares. Les exponen a actos de bulling que a veces conllevan a estados de ansiedad e incluso depresión que, en ocasiones, por suerte raras, pueden conducir a ideas autolíticas e intento de suicidio.
Para frenar esa deriva es necesario implantar herramientas para aquellas figuras que a todos los niveles son referencia en la vida del menor:
- A los padres, cuidadores principales, hay que educarles sobre los diferentes aspectos de la enfermedad y ofrecerles herramientas saludables para saber resolver conflictos y asegurar una armonía familiar.
- A los educadores hay que instruirles para que sean capaces de desarrollar un ambiente escolar que ofrezca apoyo al menor. Programas escolares dirigidos a entrenar al profesorado a reconocer precozmente actos de bulling y favorecer la inclusión y relación entre compañeros.
- A los médicos para que seamos capaces de tratar el paciente de manera global y no sólo las lesiones físicas de la enfermedad. Para que no nos limitemos en la apariencia del cuadro cutáneo, sino investigando también componentes emocionales, derivar a otros especialistas si fuera necesario, o poniendo en contacto al paciente y la familia con otros pacientes que sufran o haya sufrido de la misma condición. Además de intentar una decisión compartida médico-paciente de la mejor línea terapéutica que tenga en cuenta las prioridades del paciente, y así fortalecer la relación médico-paciente.
Concluyendo, la dermatitis atópica es una patología con gran impacto en todos los niveles de la vida del paciente, tanto físico como psicológicos. Se necesita de una visión multidisciplinar que incluya a todas las figuras capaces de mejorar la calidad de vida del paciente y limitar las afecciones de la dermatitis atópica, que va “mas allá de la piel”.
Nicola Giangrande, Hospital público da Mariña, Burela, Lugo. Comité de Alergia Infantil. SEAIC.