resultados de la búsqueda: Asma
SLAAI 2015
Estimados Socios:
Se adjunta información sobre el próximo XVIII congreso Latinoamericano de Alergia, Asma e Inmunología de la SLAAI, que se celebrará de 14 al 16 de Marzo en la ciudad de Buenos Aires.
Para más información, se puede consultar su página web: http://www.slaai2015.com/
Un cordial saludo,
Dr. Darío Antolín
Secretario de la Junta Directiva de la SEAIC
Monografías de la Fundación
La Fundación de la SEAIC colabora científicamente con la edición y difusión de publicaciones. Desde 1990 ha publicado diversas obras que ofrecen actualizaciones sobre destacados temas de estudio de Alergia Clínica.
Títulos publicados:
 Libro de las enfermedades alérgicas de la Fundación BBVA (2012) (website)
Libro de las enfermedades alérgicas de la Fundación BBVA (2012) (website) Libro de las enfermedades alérgicas de la Fundación BBVA (2012) (documento)
Libro de las enfermedades alérgicas de la Fundación BBVA (2012) (documento)- Normativa sobre inmunoterapia en enfermedades alérgicas (1990).
- Enzimas y alergia (1991).
- Pruebas de provocación bronquial inespecíficas y específicas (1993).
- Aditivos. Patología alergológica (1994).
- Asma ocupacional (1995).
- Inducción de muestras de esputo para el estudio citológico y de químicos presentes en la fase fluida (1998).
- Alergia cutánea (2002).*
- Alergia a medicamentos (2005).
- Alergia a alimentos (2007).*
(*) Números disponibles para los socios en la biblioteca virtual.
Becas congreso SEAIC 2016
Se han publicado los formularios de solicitud para las becas de asistencia al Congreso SEAIC 2016 y a la Escuela de Asma-CAJMIR. Aquellos interesados, deberán enviar sus datos antes del 12 de julio de 2016.
Alergia a himenópteros
La vuelta al colegio puede suponer un riesgo para los niños alérgicos. Un tercio de las reacciones alérgicas se inician en la escuela. Las manifestaciones más frecuentes de alergia en la infancia son el asma y la alergia a alimentos.
XV Reunión CYNA
Presentación
Los días 25 y 26 de enero de 2019 tendrá lugar en Madrid la XV edición de la reunión Controversias Y Novedades en Alergia (CYNA), convocado por la Fundación de la Sociedad Española de Alergología e Inmunología Clínica, con el patrocinio de GSK.
En esta edición, se ha puesto el foco en aspectos capitales de las enfermedades alérgicas: alergia a alimentos, contaminación, asma e inmunoterapia. Para ello, contará con ponentes de reconocido prestigio a nivel nacional e internacional.
La sede de la reunión volverá a ser el Hotel Meliá Castilla, en el distrito financiero de la capital. Asimismo, el evento podrá seguirse en directo de forma online a través de esta web. Habrá sedes alternativas presenciales en Badajoz, en Santiago de Compostela y en Valladolid.
Programa
![]() Programa final XV Reunión CYNA (5460 descargas )
Programa final XV Reunión CYNA (5460 descargas )
Evaluación XV Reunión CYNA
![]() Acceso restringido para socios. Iniciar sesión.
Acceso restringido para socios. Iniciar sesión.
BABY LED WEANING. VISION DEL ALERGÓLOGO
En los últimos 15 años una nueva forma de alimentación del bebé, Baby led weaning (BLW), ha ido creciendo en popularidad. Se inició en Reino Unido y Nueva Zelanda y después se ha ido extendiendo por el resto de los países de Europa, así que en la actualidad no es raro que atendamos a pacientes cuyos padres están siguiendo este método de alimentación.
BLW se define como el proceso de iniciar la alimentación complementaria del niño con alimentos del tamaño y textura adecuados para comer por sí mismo, comenzando aproximadamente a los 6 meses de edad. Se define también como “auto-weaning” lo cual significa ofrecer los alimentos individuales troceados o triturados que toma habitualmente la familia. El bebé decide qué, cuánto, y en qué tiempo come, siendo así un compañero activo en el proceso de su alimentación en lugar de un recipiente pasivo al que hay que llenar de alimentos.
En general, es más fácil para los cuidadores, ahorra dinero y tiempo, ya que los bebés pueden comer la comida familiar con algunos ajustes menores (como reservar una porción para el bebé antes de agregarle sal), reduciendo la necesidad de comprar o preparar comida específica para ellos.
Sin embargo, este procedimiento causa preocupación a los pediatras por el riesgo de una ingesta deficitaria en vitaminas y minerales, como el hierro, u otros nutrientes, así como por el riesgo de atragantamiento.
La Sociedad Europea de Gastroenterología pediátrica, Hepatología y Nutrición (ESPGHAN) en 2021 ha declarado que no hay suficiente evidencia para concluir acerca de la conveniencia de este procedimiento. Una revisión no sistemática de 2016 había llegado a conclusiones similares. En el año 2018, una revisión sistemática analizó la evidencia publicada hasta entonces, para valorar si este método es seguro y recomendable, así como la necesidad de futuras investigaciones. Esta revisión concluyó que, para evitar riesgos en el bebé, los padres que deseen seguir este método necesitan una cuidadosa y profunda educación nutricional, particularmente sobre cómo preparar los alimentos para que resulten seguros, saludables y nutritivos. Esta revisión sistemática concluye que existe insuficiente evidencia para determinar si es adecuada la ingesta de nutrientes y energía. De hecho, persiste la preocupación de estudios previos observacionales en los que se determina que los padres que siguen BLW estiman que sus hijos toman más lácteos y menos alimentos sólidos comparados con los que siguen el método tradicional. Sin embargo, estudios más recientes sugieren que un método de BLW modificado, que incluya recomendaciones sobre la introducción de alimentos ricos en hierro y evitando aquellos con riesgo de atragantamiento, pueden tener efectos preventivos de estos riesgos y posibles deficiencias. En cualquier caso, se necesitan investigaciones con estudios más grandes y randomizados.
Sin embargo, en estas revisiones no se contempla la influencia que puede tener el seguimiento de este método en la incidencia de alergia a alimentos; particularmente en los niños con riesgo alto de atopia, es decir, aquellos con antecedentes personales o familiares de primer grado (padres o hermanos) con dermatitis atópica, alergia alimentaria o alergia respiratoria en forma de rinoconjuntivitis y/o asma.
En estos niños habría que considerar de forma especial por una parte, el momento y la forma de introducción de los alimentos y por otra, la exposición epicutánea temprana a dichos alimentos.
Se han publicado múltiples estudios controlados, randomizados, prospectivos, que muestran evidencia de que la introducción temprana de cacahuete y huevo cocinado disminuye la incidencia de alergia a estos alimentos en niños de alto riesgo de presentarla, aunque la cantidad y la forma precisa de introducción requiere más investigación. Varios estudios de prevención de alergia a otros alimentos han mostrado evidencia de seguridad, pero no de eficacia. El estudio EAT (Enquiring About Tolerance) randomizó a lactantes de la población general para una intervención en la cual se introducía leche, huevo, cacahuete, sésamo, pescado y trigo desde los 3 meses de edad, pero tuvo una moderada adherencia y el análisis estadístico no mostró significación estadística para la prevención de alergia alimentaria. No obstante, no hubo un riesgo aumentado de alergia a ninguno de estos alimentos comparado con el grupo de introducción estándar. Otro estudio (“HealthNuts study”) demostró que la introducción del anacardo antes del año de edad se asocia a la ausencia de alergia a este alimento a los 6 años. Hasta la actualidad no hay estudios de seguridad y eficacia de la introducción temprana de otros frutos secos, soja o mariscos. Varios estudios han indicado que los niños con dieta más diversa de forma temprana tienen una incidencia inferior de alergia a alimentos.
Recientemente la Sociedad europea de Alergia e Inmunología Clínica (EAACI) ha publicado una guía de prevención de desarrollo de alergia a alimentos en lactantes y preescolares basada en una revisión sistemática de la evidencia actual y en la opinión de expertos. En ella se recomienda lactancia materna exclusiva los 6 primeros meses de vida, aunque la introducción de alimentos sólidos entre los 4 a 6 meses es también recomendada. Como novedad respecto a la guía anterior de 2014, sugieren evitar suplementos de fórmula de leche de vaca en la primera semana de vida, la introducción temprana de huevo bien cocinado (evitando huevo crudo o pasteurizado sin cocinar) y la introducción de cacahuete en una forma apropiada para el lactante, aunque no está claro el beneficio de la introducción de cacahuete en países sin alta prevalencia de alergia a este alimento. Tampoco está claro el beneficio en la introducción temprana de otros frutos secos y otros alérgenos alimentarios.
La mayoría de otras guías sugieren también no retrasar la introducción en la dieta de los alimentos alergénicos. Aunque el orden de introducción depende de las guías de cada país, es común en todas ellas, al igual que en la guía de la EAACI, la recomendación de introducir precozmente el huevo y cacahuete basados en la evidencia actual. Otros alimentos evaluados, como la leche, trigo, sésamo y pescados en los que se ha descartado riesgo de alergia con su introducción precoz, podrían ser la siguiente prioridad. Habría que analizar la influencia en la introducción precoz en niños de alto riesgo de aquellos otros aún sin evidencia actual, como los frutos secos, soja y mariscos.
Esta introducción temprana podría verse favorecida por el método BLW siempre que se hiciese en la forma, cantidad y frecuencia adecuada. Una vez que la introducción de un alimento se ha iniciado, es muy importante que se mantenga de forma regular en la dieta. No hay que olvidar, por otra parte, que el objetivo de la alimentación complementaria temprana con alimentos alergénicos es ofrecerlos sin exceder las necesidades calóricas en este periodo de alimentación y sin desplazar a otros alimentos ricos en nutrientes como frutas, verduras, carnes y cereales.
En conclusión, aunque existe interés creciente en la introducción temprana de los alimentos alergénicos, las decisiones con respecto a la eficacia preventiva, seguridad, momento de introducción, dosis y formas de estos alimentos alergénicos son difíciles dado que aún no disponemos de la evidencia científica suficiente para todos ellos y suponen un reto para pediatras, alergólogos y familias.
Por otra parte, este método en el que el lactante se autoalimenta, podría aumentar la exposición epicutánea temprana a los alimentos a través del traspaso de las manos al cuerpo del bebé. Actualmente hay una creciente evidencia de la exposición epicutánea temprana, particularmente en aquellos pacientes con barrera cutánea alterada, favorece la sensibilización y la exposición oral favorece la tolerancia.
En modelos animales se ha demostrado que la exposición epicutánea sensibiliza a los animales de manera más efectiva que la oral e intraperitoneal y que la alteración de la barrera cutánea juega un papel importante en el desarrollo de alergia alimentaria y puede contribuir a la gravedad de las reacciones.
La sensibilización a través de la piel puede ser explicada por la exposición de los alimentos a través del ambiente (polvo, superficies…) o a la transferencia de los alérgenos a través del contacto mano-cuerpo. En este sentido, un estudio demostró que la aplicación de cremas que contenían cacahuete era un factor de riesgo independiente para el desarrollo de alergia a este alimento y varios estudios han encontrado relación entre la exposición a cacahuete en el ambiente del bebé (ropa de cama, zona de juegos) y la alergia al mismo, llegándose a cuantificar el aumento del riesgo de sensibilización a cacahuete por cada unidad de su concentración en el ambiente.
Otros estudios en humanos muestran que la alteración de la barrera cutánea en la dermatitis atópica, debida a la mutación del gen de la filagrina, puede favorecer la penetración de los antígenos y la inflamación tipo2. Actualmente hay una evidencia creciente de la importancia de la inflamación de la barrera cutánea en el desarrollo de sensibilización y alergia a alimentos, de ahí el interés reciente de la restauración de esta barrera cutánea en la prevención de la alergia alimentaria.
De todas estas consideraciones deducimos que el seguimiento del método BLW debería ser, en los pacientes de alto riesgo de alergia alimentaria, consensuado y supervisado por pediatras y/o alergólogos.
Atendiendo a los datos de los que hasta ahora tenemos evidencia deberían seguirse las siguientes recomendaciones:
- Introducir de manera prioritaria el huevo cocinado que es el alimento sólido con mayor incidencia de alergia en niños en nuestro medio.
- Posteriormente se introducirían otros alimentos alergénicos: pescado, legumbres, etc.
- Respecto a los frutos secos distintos de cacahuete o mariscos, no existen suficientes datos para recomendar su introducción temprana, aunque hipotéticamente podría ser también preventiva si se introducen en forma y cantidad segura.
- Los alimentos se deben introducir de manera progresiva y no deberían introducirse más de uno cada día. Una vez introducidos es importante que se mantengan de forma regular en la dieta.
- Por otra parte, habría que evitar que el método BLW conlleve una mayor exposición epicutánea por el contacto de los alimentos con la piel, lo que favorecería la sensibilización. No debemos olvidar el control de la dermatitis atópica en estos niños para evitar la alteración en la barrera cutánea de la piel inflamada.
Dra. Soledad Terrados, Hospital Ramón y Cajal. Comité de Alergia Infantil SEAIC
BIBLIOGRAFIA
-Enza D’Auria1* , Marcello Bergamini et all Baby-led weaning: what a systematic review of the literature adds on. Italian Journal of Pediatrics (2018) 44:49
-Susanne Halken, Antonella Muraro, Debra de Silva et all. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update) Pediatr Allergy Immunol. 2021;32:843–858
-Brian Schroer, MDa, Marion Groetch, MS et all Practical Challenges and Considerations for Early Introduction of Potential Food Allergens for Prevention of Food Allergy .J Allergy Clin Immunol Pract 2021;9:44-56
-H.A. Brough, K.C. Nadeau et all Epicutaneous sensitization in the development of food allergy: what is the evidence and how can this be prevented? Allergy. 2020 September ; 75(9): 2185–2205.
App MACVIA-ARIA
La aplicación móvil «Diario de Alergia de MACVIA-ARIA» le permite mantener un registro diario de los síntomas de su rinitis alérgica y asma, así como de la medicación que usa. La app es de fácil uso, y combina la funcionalidad con la buena práctica científica, habiendo sido desarrollada por un equipo global de líderes mundiales en alergia clínica. Se encuentra disponible en App Store y Google Play.
Guía de actuación en Anafilaxia
Nueva edición GALAXIA 2022, ya disponible aquí.

Para realizar esta guía se ha contando con profesionales con una amplia experiencia en el diagnóstico y tratamiento de la anafilaxia, representando a varias sociedades:
– Sociedad Española de Alergología e Inmunología Clínica
– Asociación Española de Pediatría
– Asociación Española de Pediatría de Atención Primaria
– Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica
– Sociedad Española de Médicos de Atención Primaria
– Sociedad Española de Medicina de Emergencias
– Sociedad Española de Medicina de Familia y Comunitaria
– Sociedad Española de Médicos Generales y de Familia
– Sociedad Española de Urgencias Pediátricas
En esta guía se ha realizado un consenso actualizado en el diagnóstico y tratamiento de las reacciones anafilácticas. En su contenido destacan las recomendaciones prácticas sencillas de aprender y fáciles de aplicar en la mayoría de los casos de anafilaxia, contemplando además las peculiaridades en la edad pediátrica de las reacciones anafilácticas.
Descargar documento: ![]() GALAXIA 2016 (61331 descargas )
GALAXIA 2016 (61331 descargas )
Fe de errata (28 de Noviembre de 2016):
En la página 33, en la Tabla 5, la dosis de glucagón para niños constaba «20-30 g/kg (máx 1 mg); puede repetirse en 5 min» y debería ser «20-30 µg/kg (máx 1 mg); puede repetirse en 5 min».
Documento actualizado el día 2/11/2022
¿Puede hacer deporte un asmático?
En general, el ejercicio físico moderado es recomendable en personas asmáticas, aunque siempre bajo un control médico adecuado. En el caso particular del asma inducida por ejercicio debe tenerse en cuenta la necesidad de unas medidas preventivas adecuadas, siguiendo las recomendaciones del médico especialista.
Vuelta al colegio
La vuelta al colegio puede suponer un problema para los niños alérgicos. Un tercio de las reacciones alérgicas se inicia en la escuela. Las manifestaciones más frecuentes de alergia en la infancia son el asma y la alergia a alimentos.
Alergia a frutos secos. Información divulgativa
LA SEAIC OFRECE INFORMACIÓN DIVULGATIVA SOBRE ALERGIA A FRUTOS SECOS
Cualquier fruto seco puede dar alergia.
Los cacahuetes ocupan el primer puesto en el contexto mundial dado su gran consumo en el continente americano y países anglosajones. En España, observamos con más frecuencia, reacciones por nueces y avellanas, esta diferencia está condicionada por los hábitos de alimentación de diferentes zonas geográficas.
La edad de presentación de alergia a frutos secos puede ser cualquiera. Lo más frecuente es que comience en la infancia, en torno a los 3-4 años, aunque sabemos que depende de la zona geográfica, costumbres, dieta, edad de introducción temprana o tardía, carga genética etc.
La causa concreta por la que aparece la alergia a alimentos es multifactorial y desconocida. Existen diferentes teorías sobre por qué la alergia alimentaria es cada vez más frecuente. Los estudios apuntan hacia una mayor prevalencia con el estilo de vida en países industrializados que conlleva un aumento de pacientes con dermatitis atópica, rinitis alérgica y asma.
La “forma de ser alérgico” a los frutos secos y su pronóstico lo marca el análisis molecular que tenemos accesible desde hace pocos años. Se puede hacer aproximaciones mediante las pruebas cutáneas, pero es en los análisis de sangre como podemos determinar “a qué proteína de los frutos secos soy alérgico”.
Los niños que son alérgicos a las proteínas de almacenamiento de los frutos secos, suelen debutar con reacciones más severas, aunque la cantidad del alimento sea pequeña. Es decir, tienen un menor umbral de tolerancia. Estas proteínas son muy estables a la temperatura (cocción), pH ácido (digestión) y mantienen su estructura a pesar de cocinar los alimentos. Incluso se ha visto que la forma de procesar los cacahuetes (tostados) puede provocar mayor alergenicidad. Estos pacientes alérgicos a proteínas de almacenamiento llegan a la edad adulta y mantienen síntomas graves con la ingesta de frutos secos, incluso con trazas.
Los pacientes alérgicos a LTP (por sus siglas en inglés proteína transportadora de lípidos), pueden debutar con alergia a frutos secos en la edad adulta y sus síntomas pueden ser más leves como picor de boca con muchos alimentos, o más graves como urticaria, broncoespasmo o anafilaxia. Estos pacientes suelen asociar alergia con cofactores (ejercicio físico intenso, alcohol, toma de antiinflamatorios, fiebre, mal estar general, menstruación, falta de sueño). Son pacientes que se sensibilizan a la familia de las rosáceas como son las frutas de hueso central como melocotón, nectarina, ciruela, cereza, manzana y, por similitud, a los frutos secos.
La LTP es muy ubicua en el reino vegetal. Los pacientes pueden presentar, por reactividad cruzada, síntomas con distintos alimentos vegetales (frutas, frutos secos, legumbres, cereales, hortalizas). Son pacientes complejos y heterogéneos. A veces, estos pacientes pueden tolerar de nuevo los alimentos que les dieron reacción, si retiramos los cofactores. Los síntomas pueden ser graves, persisten en el tiempo y presentan gran restricción dietética lo que afecta a su calidad de vida.
El paciente alérgico a frutos secos debe conocer el “perfil de su alergia” y conocer qué tipo de alimentos no puede comer. Acudir a su alergólogo para conocer en detalle su alergia y mantenerse informado es fundamental. Es importante portar siempre su medicación de rescate y estar alerta a los alimentos que consumen, especialmente fuera del domicilio, e informar siempre de su alergia a los anfitriones.
Pólenes
El polen es una partícula reproductora que emiten los órganos florales masculinos para fecundar a las flores femeninas y así comenzar la formación del fruto. Durante el periodo de polinización, una sola planta produce miles de granos de pólenes, que no se ven a simple vista. En ocasiones, la emisión de pólenes puede ser tan intensa que forme un polvo amarillento en suspensión, similar a una nube. Con el viento, el polen circula en el aire alcanzando grandes distancias, dependiendo de la naturaleza de la planta y del tamaño del polen que produce. Con la lluvia, el nivel de pólenes en suspensión desciende, aunque posteriormente puede alcanzar niveles más altos.
Las enfermedades causadas por alergia a pólenes son: conjuntivitis, rinitis y asma. Todo paciente alérgico a pólenes debe conocer a cuales es alérgico, así como las fechas en las que su concentración atmosférica alcanza niveles significativos. Durante este periodo se recomienda mantener una serie de medidas preventivas:
Como medida general, deberá evitar la estancia prolongada y la actividad física innecesaria en parques, jardines y zonas de arbolado, intentando permanecer el mayor tiempo posible en interiores limpios, sobre todo cuando haya mucho viento.
Mantenga habitualmente cerradas las ventanas de su dormitorio, excepto en el momento de ventilarlo. Es recomendable ventilar la habitación al atardecer y realizar pulverizaciones de agua antes de acostarse.
Si viaja en automóvil mantenga las ventanillas cerradas para evitar el impacto del aire sobre la cara. Los filtros que incorpora el sistema de aire acondicionado pueden ayudar a impedir que el polen penetre en el habitáculo.
Más información en la página del Comité de Aerobiología: www.polenes.com
———————————————–
Alergia a ácaros
La alergia a los ácaros afecta a entre el 70% y el 80% de los niños que viven en zonas costeras, y puede dar origen a síntomas de asma,
rinitis, conjuntivitis y dermatitis atópica. Del 26 al 28 de octubre se celebra en Murcia el Simposio Internacional de Aerobiología, Contaminación y Cambio Climático de la SEAIC con la participación de casi mil alergólogos nacionales e internacionales.
Nota de Prensa: Vuelta a la Rutina
Una vez llegado Septiembre es un buen momento para ponerse al día con las alergias. En Verano se relajan los hábitos de salud en muchas ocasiones porque patologías como la Dermatitis Atópica, la Rinitis o el Asma mejoran; por este motivo desde la Sociedad Española de Alergología e Inmunología Clínica os dejamos las siguientes recomendaciones para afrontar la Vuelta a la Rutina.
¿Qué es la alergia?
Conceptos básicos:
Alergia, atopia e hipersensibilidad
———————————————————————————————————————————–

El término alergia fue acuñado en 1906 por el Dr. Clemens Von Pirquet para definir un tipo especial de respuesta inmunológica o defensiva frente a sustancias que normalmente no inducen reacciones en la mayoría de las personas. El origen de una reacción alérgica no está por tanto en el agente que la produce, sino en el propio individuo.
Por ello se considera que la condición de ser alérgico tiene un importante componente constitucional, es decir, depende de una predisposición individual que frecuentemente es hereditaria. Para definir esta predisposición se emplea el término atopia (que literalmente significa “fuera de lugar”), propuesto por el Dr. Arthur Fernández-Coca en 1922. La atopia se define como un estado de hipersensibilidad en personas con enfermedades tales como asma, rinitis, conjuntivitis y algunas dermatitis, motivo por el cual los términos alergia y atopia se utilizan indistintamente para designar globalmente estas enfermedades.

Los conceptos de alergia y atopia están muy ligados al de hipersensibilidad, hasta el punto de que en ocasiones se consideran sinónimos. De hecho, al hablar de hipersensibilidad nos referimos a al mecanismo de respuesta inmunológica que conduce a la reacción alérgica, por lo que ambos conceptos están muy relacionados, aunque no son lo mismo.
Este mecanismo de hipersensibilidad no es único, ya que dentro de la complejidad de nuestro sistema inmunológico existen diversas formas de respuesta con distintas manifestaciones. En todos los casos debemos saber que cualquier respuesta alérgica implica un proceso inflamatorio en el que participan distintos tipos de células y una enorme diversidad de sustancias producidas por estas células.
.
Hipersensibilidad inmediata:
Alergia mediada por IgE
———————————————————————————————————————————–
Para comprender los mecanismos por los que se desarrolla una respuesta alérgica, describimos brevemente una de las formas más frecuentes de hipersensibilidad: la respuesta mediada por IgE o hipersensibilidad inmediata.
La inmunoglobulina E (IgE) es un tipo de anticuerpo presente en todas las personas. Al igual que otras inmunoglobulinas, interviene en la respuesta inmune específica al reconocer un agente extraño potencialmente peligroso sobre el que actúan nuestras defensas. Este agente se denomina antígeno.
En las personas atópicas, la IgE reacciona contra un agente generalmente inofensivo que al unirse a la IgE induce una serie de mecanismos que desencadenan la liberación de mediadores inflamatorios que producen la reacción alérgica. Este agente, que funciona como un antígeno, se denomina alérgeno.
Pero esta reacción no sucede repentinamente sin una fase previa denominada sensibilización. Como en toda respuesta inmune específica, los anticuerpos tienen que producirse tras una o varias exposiciones previas al alérgeno, durante las cuales se tolera su contacto. En esta fase se generan anticuerpos IgE que reconocen al alérgeno, de forma que en posteriores contactos se desencadena la reacción.
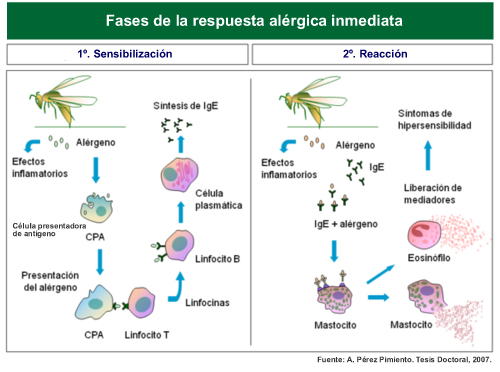
La reacción alérgica se produce por la liberación de sustancias procedentes de células inflamatorias. En el caso de las reacciones mediadas por IgE, la célula implicada se denomina mastocito. Esta célula se descarga bruscamente al ser activada por la IgE, con la consecuente liberación de los mediadores responsables de todas las manifestaciones de la reacción.
Última edición: 01/07/2019
———————————————–
Látex
El látex es la materia prima de la que se obtiene el caucho o la goma natural. Numerosos productos de uso habitual y del entorno sanitario están fabricados con látex, por lo que los alérgicos al látex deben conocer las posibles fuentes de exposición y mantener unas estrictas medidas de evitación, advirtiendo al personal sanitario antes de cualquier intervención
Originariamente, el látex es un fluido lechoso que se recoge a partir del sangrado de la corteza del árbol del caucho (Hevea brasiliensis). Para lograr su coagulación y facilitar su almacenamiento, el látex se mezcla con ácido acético. Para proporcionar resistencia y elasticidad se realiza un proceso de vulcanización, que consiste en el calentamiento en presencia de azufre. En el proceso de elaboración del producto final se añaden diversos aditivos: aceleradores de la vulcanización, antioxidantes, pigmentos, materiales de relleno y plastificantes.
Las reacciones alérgicas al látex ocurren por sensibilización previa a las proteínas que contiene. Se manifiestan con síntomas inmediatos, habitualmente por contacto directo con productos de uso común como los guantes, en forma de urticaria y angioedema. Las partículas que se respiran pueden causar conjuntivitis, rinitis y asma. En casos de exposición intensa al látex pueden ocurrir reacciones graves como la anafilaxia.
Es importante diferenciar estas reacciones inmediatas de otros cuadros que ocurren por sensibilización a los aditivos del caucho, generalmente aceleradores de la vulcanización (grupos “tiuram”, “mercapto”, “carbamatos”). Se manifiestan por eccema o dermatitis (picor y erupción exclusivamente en la zona de contacto). Estas reacciones, relativamente frecuentes y de mecanismo retardado, no conllevan riesgo de reacción inmediata. Por ello no contraindican un contacto esporádico con productos de látex.
———————————————–
Repercusión de la rinitis alérgica
El coste socioeconómico global de la rinitis alérgica supera al de otras enfermedades más graves como el asma o la EPOC, según se desprende de los resultados del Estudio FERIN. Se estima que más del 20% de la población española padece rinitis alérgica.
Conozca sus causas
Los alérgenos
Los agentes que producen enfermedades alérgicas se denominan alérgenos. Los alérgenos se pueden definir como sustancias inocuas que inducen reacciones de hipersensibilidad en personas susceptibles.
El sistema inmunitario del enfermo alérgico reconoce a estas sustancias como extrañas y potencialmente peligrosas, por lo que desencadena una serie de mecanismos de defensa que se manifiestan con los síntomas característicos de la reacción alérgica. Esta reacción es variable según el grado de respuesta y depende, entre otras cosas, de la susceptibilidad de cada persona, la intensidad de la exposición y la vía de exposición al alérgeno (respiratoria, cutánea, digestiva, etc.).
Los alérgenos respiratorios (aeroalérgenos) producen enfermedades por inhalación y posterior contacto con las vías respiratorias (asma, rinitis) y/o la conjuntiva ocular (conjuntivitis). Los aeroalérgenos más comunes son los pólenes, las esporas de hongos, los ácaros y los animales domésticos.
Los alérgenos alimentarios (trofoalérgenos) producen reacciones inmediatas por su consumo, con la aparición de síntomas digestivos, respiratorios y/o cutáneos. Los más frecuentes en los niños son las proteínas de la leche y del huevo, mientras que en los adultos predominan las frutas y los mariscos.
Los alérgenos de contacto (contactantes) producen reacciones cutáneas al contactar sobre la piel durante un tiempo más o menos prolongado, manifestándose en forma de eccema o dermatitis. Los alérgenos de contacto más comunes son los metales (sobre todo el níquel) y algunos medicamentos de uso tópico.
Otros alérgenos de interés son los medicamentos, el látex, el veneno de los himenópteros (abejas y avispas) y parásitos como el Anisakis.
En el menú de la izquierda puede encontrar algunas causas frecuentes de enfermedades alérgicas. Tenga en cuenta que esta información no pretende ser exhaustiva y tan sólo muestra unos conceptos básicos sobre cada grupo de alérgenos.
Última edición: 01/07/2019
———————————————–
II Congreso Internacional de las Sociedades Ibéricas de Alergología SPAIC- SEAIC 2025
Cruzando Fronteras en la Alergia.
Las Juntas Directivas de SPAIC y SEAIC anuncian el II Congreso Internacional de las Sociedades Ibéricas de Alergología SPAIC- SEAIC 2025, que se celebrará los días 4 y 5 de abril de 2025 en el Hotel Sheraton de Oporto.
Accediendo mediante el enlace II Congreso Ibérico SEAIC-SPAIC 2025 podrá consultar el programa científico, inscribirse y enviar su comunicación (envío de resúmenes hasta el 16 de marzo).
Este evento representa una oportunidad para actualizar conocimientos, intercambiar experiencias y fortalecer la relación y colaboración entre los profesionales de la Alergología e Inmunología Clínica a nivel internacional.
El programa científico abordará temas de gran relevancia, como el asma grave, la alergia alimentaria, la rinosinusitis crónica, el angioedema, la dermatitis atópica, la urticaria y los avances en inmunoterapia.
Aparte de las tradicionales mesas redondas, podrás participar de foros dirigidos a jóvenes investigadores y espacios especialmente diseñados para la presentación de pósteres, debates interactivos que serán una oportunidad para intercambiar ideas y experiencias en un ambiente colaborativo y enriquecedor.
El congreso incluirá sesiones en español, y las sesiones en portugués contarán con traducción simultánea al español.
No pierdas la oportunidad de formar parte de este encuentro científico.
¡Te esperamos en Oporto!
Curso de actualización en enfermedades inflamatorias T2: enfoque basado en Evidencia
Programa DPC SEAIC
- Curso exclusivo para socios de SEAIC
- Desde 1 de diciembre de 2025 al 30 de junio de 2026
- https://dpc.seaic.org
- ONLINE
- Estructura del curso
Módulo 1. Dermatitis Atópica
Módulo 2. Asma
Módulo 3. Esofagitis eosinofílica (EoE)
Módulo 4. Rinosinusitis Crónica con Pólipos Nasales (RSCcPN)  Programa DPC SEAIC Actualizacióm en enfermedades inflamatorias T2 (848 descargas )
Programa DPC SEAIC Actualizacióm en enfermedades inflamatorias T2 (848 descargas )
