resultados de la búsqueda: asma/profesionales/aviso-importante/inicio/cme-jiaci
LAS INMUNODEFICIENCIAS ASOCIADAS A AGENTES BIOLÓGICOS INMUNOMODULADORES COMO FENOCOPIAS DE LAS INMUNODEFICIENCIAS PRIMARIAS
http://www.thehistoryblog.com/archives/14881
En nuestro sistema sanitario, las consultas de Inmunología atienden principalmente pacientes con una respuesta inmunitaria deficiente. Las inmunodeficiencias primarias (IDP) asociadas a errores innatos de la inmunidad son una causa importante de estas consultas, pero no la única. En la práctica clínica, en la mayoría de los casos, habrá que buscar una causa secundaria de la misma.
Las inmunodeficiencias primarias se incluyen bajo el concepto más global de errores innatos de la inmunidad (EII), que representa un grupo de más de 485 enfermedades definidas genéticamente (1). La inmunodeficiencia secundaria (IDS) podría definirse como una alteración transitoria o persistente de la función de las células o tejidos del sistema inmunitario, causada por factores extrínsecos al mismo (2). Estos grupos de factores incluyen agentes ambientales, malnutrición, trastornos metabólicos, uso de medicamentos inmunosupresores e inmunomoduladores, infecciones crónicas, neoplasias malignas, traumatismos graves o simplemente el envejecimiento. El enfoque inicial recomendado para la valoración de una IDS sigue las mismas directrices que en el caso de las IDP. Los hallazgos de la historia clínica, en particular los patrones de infecciones, y los hallazgos en la exploración física son esenciales para guiar la evaluación del sistema inmunitario.
Dentro de las causas de IDS, la generalización del uso de agentes biológicos inmunomoduladores para tratar enfermedades autoinmunes, inflamatorias o neoplasias hematológicas en las últimas dos décadas, se ha acompañado de un mayor riesgo de infecciones e inmunodeficiencias secundarias (3); el abordaje de este importante tema en una entrada a un blog es complicado como revisión sistemática, así que optaré por una exposición narrativa.
Examinar qué enfermedades infecciosas acompañan a una determinada inmunodeficiencia primaria ha permitido obtener información valiosa sobre los componentes del sistema inmunológico que son claves en la respuesta frente a microrganismos particulares. Gracias a ello sabemos que los defectos en moléculas críticas en la ontogenia, activación y proliferación de los linfocitos T, como las mutaciones en el gen IL2RG del cromosoma X humano, que codifica la cadena gamma común (γc) del receptor de interleucina-2 (IL-2R), o una inactivación mutación en la quinasa Jak3, que se asocia físicamente con γc, causan una depleción profunda en la función del sistema inmune, que de forma sindrómica se denomina Inmunodeficiencia combinada severa. Los defectos en el desarrollo de las células B, como la mutación en el gen que codifica una proteína tirosina quinasa llamada BTK (tirosina quinasa de Bruton), que transduce la señal a través del receptor de células pre-B, provocan deficiencias en la producción de anticuerpos que causan una incapacidad para eliminar bacterias extracelulares y algunos virus cuya eliminación eficaz requiere anticuerpos específicos.
Es instructivo considerar los defectos inmunológicos en el contexto de los principales tipos de inmunidad afectada, ya que estos pueden conducir a distintos patrones de infección y enfermedad clínica.
Las terapias biológicas no causan La inmunosupresión global característica de la terapias inmunosupresoras clásicas como los glucocorticoides, azatioprina, metotrexato o ciclosporina (4). Del mismo modo a cómo actúan las mutaciones específicas en cada IDP, las terapias biológicos se dirigen selectivamente a células y vías del sistema inmunitario para lograr efectos terapéuticos específicos, pudiéndose comportar en ciertos casos como fenocopias de la IDP original.
Por ejemplo, el OKT3 (muromonab-CD3) es un anticuerpo monoclonal IgG2 murino que se une a la cadena CD3-epsilon del complejo receptor de células T-CD3 y produce una linfopenia rápida y profunda de las células T (4). Como cabría esperar, la inmunosupresión asociada provoca una mayor susceptibilidad a las infecciones, en particular por virus herpes y bacterias. Igualmente, Alemtuzumab (anti-CD52) es un anticuerpo monoclonal humanizado utilizado para la terapia de inducción del trasplante de órganos sólidos, depletor de células T.
Basiliximab es un monoclonal contra la cadena alfa del receptor de la interleucina (IL)-2 (CD25). La activación de las células T conduce normalmente a una regulación al alza del receptor de IL-2 de alta afinidad que implica la expresión de la cadena alfa del receptor de IL-2 (CD25) que se asocia con las cadenas beta y gamma del receptor de IL-2. Basiliximab inhibe la generación de células T citotóxicas antígeno-específicas.
Las células T necesitan dos señales para activarse. La primera implica la unión directa del receptor de antígeno de la célula T (TcR) con el complejo formado por el péptido antigénico y determinadas moléculas de superficie (moléculas HLA), presentado por las células presentadoras de antígeno (APC). La segunda señal implica vías coestimuladoras específicas. El CD28 de las células T se une a sus ligandos, el CD80 (B7-1) y el CD86 (B7-2), en las APC. La presencia de ambas señales proporciona una señal de activación a las células T. Por el contrario, la molécula CTLA-4 en las células T compite por la unión a las mismas moléculas CD80/CD86, y esta interacción provoca la supresión de la activación. Abatacept y Belatacept son proteínas de fusión del dominio extracelular de CTLA-4 humano unido a una porción Fc modificada de IgG1 humana (CTLA-4-Ig), que interfieren la activación de las células T interrumpiendo la coestimulación CD28. Abatacept no obstante tiene un perfil de seguridad bien establecido en diferentes ensayos y metanálisis. Belatacept por su parte, con mayor capacidad de unión a CD80/CD86, no debe administrarse a pacientes con serología de VEB negativa candidatos a trasplante de un donante con serología VEB positiva, por el mayor riesgo de desarrollar trastornos linfoproliferativos asociados a VEB (4).
Las Janus quinasas (JAK) son una familia de tirosina quinasas no receptoras, cruciales en el desencadenamiento de las señales generadas por el receptor de diversas citoquinas y transducidas aguas abajo a través de las proteínas STAT (transductoras de señales y activadoras de la transcripción). Las STAT fosforiladas se disocian de sus subunidades receptoras y se translocan al núcleo celular para regular la transcripción génica. La familia JAK se compone de cuatro miembros: JAK1, JAK2, JAK3 y tirosina quinasa 2 (Tyk2). Tofacitinib, inhibidor JAK aprobado para la artritis reumatoide que actúa principalmente sobre JAK1 y JAK3, se ha asociado con un mayor riesgo de infección por herpes zoster (4).
Con respecto a las células B, Ibrutinib es una pequeña molécula inhibidora de la tirosina quinasa de Bruton (BTK). El ibrutinib se une a la actividad de la BTK y la inhibe de forma irreversible, impidiendo así tanto la activación de las células B como la señalización mediada por éstas. La BTK es necesaria para la señalización del receptor de células B, desempeña un papel clave en la maduración de las células B. Se han descrito casos de neutropenia e hipogammaglobulinemia. Igualmente, Idelalisib interrumpe la señalización del receptor de células B, de forma similar a ibrutinib, aunque a través de la inhibición de la isoforma delta de la fosfatidilinositol 3-cinasa. Idelalisib se asocia a un aumento de las infecciones oportunistas (4). Belimumab por su parte, es un anticuerpo monoclonal humano que se une al BlyS humano soluble e inhibe su actividad biológica. Está aprobado para el tratamiento de pacientes con LES. La celulitis y la neumonía son las infecciones graves más frecuentes (4).
Pero sin duda, la familia de biológicos con más impacto en la casuística de las consultas de inmunodeficiencias son los anti CD20 y en particular, rituximab. Este anticuerpo monoclonal quimérico (Ig)G1 CD20 específico actúa sobre las células B desde la fase pre-célula B hasta la fase pre-célula plasmática. Rituximab agota las células B de la sangre periférica, y su normalización posterior suele requerir de seis a nueve meses o más, con una variabilidad significativa entre pacientes. Con las células B deplecionadas, la capacidad del paciente para responder a las vacunas, en particular de polisacáridos, se ve afectada. Además, es frecuente cierto grado de hipogammaglobulinemia transitoria, que en algunos pacientes es persistente y significativa clínicamente, dando lugar a infecciones que requieren profilaxis antibiótica y/o terapia sustitutiva (4).
Así, hasta un largo etcétera de terapias biológicas que actúan selectivamente sobre la vía de diferentes citoquinas (interleuquina 6, interleuquina 1, factor de necrosis tumoral alfa, interleuquinas 4 y 13, interleuquina 17), integrinas (alfa-4 integrinas, CD11 alfa), o proteínas del complemento, entre otros, bloqueando con una precisión quirúrgica el normal funcionamiento del sistema inmune.
Disponemos de evidencias y de herramientas para tratar de disminuir el riesgo de IDS asociado al uso de medicamentos biológicos. Este riesgo se debe prevenir con profilaxis antibiótica adecuada, y se debe prever mediante una planificación del programa de vacunación adaptada al tipo de defecto en la respuesta inmune descrito para el fármaco.
Igualmente, las recomendaciones en cuanto a vacunación de pacientes en grupos de riesgo, tanto centrales como de las comunidades autónomas, deberían estar actualizadas acorde a la evidencia disponible e integrar la opinión de expertos con conocimiento en el funcionamiento del sistema inmune y en el mecanismo de acción de estos fármacos.
REFERENCIAS
- Tangye SG, Al-Herz W, Bousfiha A, Cunningham-Rundles C, Franco JL, Holland SM, Klein C, Morio T, Oksenhendler E, Picard C, Puel A, Puck J, Seppänen MRJ, Somech R, Su HC, Sullivan KE, Torgerson TR, Meyts I. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022 Oct;42(7):1473-1507. doi: 10.1007/s10875-022-01289-3. Epub 2022 Jun 24. PMID: 35748970; PMCID: PMC9244088.
- Tuano KS, Seth N, Chinen J. Secondary immunodeficiencies: An overview. Ann Allergy Asthma Immunol. 2021 Dec;127(6):617-626. doi: 10.1016/j.anai.2021.08.413. Epub 2021 Sep 3. PMID: 34481993.
- Cannon L, Pan A, Kovalick L, Sarkissian A, Wu EY. Secondary immunodeficiencies and infectious considerations of biologic immunomodulatory therapies. Ann Allergy Asthma Immunol. 2023 Jun;130(6):718-726. doi: 10.1016/j.anai.2023.02.010. Epub 2023 Feb 18. PMID: 36801438; PMCID: PMC10247415.
- https://www.uptodate.com/contents/secondary-immunodeficiency-induced-by-biologic-therapies (acceso abril/2024).
¡Tengo alergia al sol!
¡Cuántas veces escuchamos esta frase en esta época del año en la que nuestra exposición solar ha sido máxima! Son muchos los pacientes que ante reacciones cutáneas coincidiendo con la exposición solar se refieren a ellas como “alergia al sol”. Aunque es un término científicamente incorrecto, se refiere a aquellas fotodermatosis (reacciones anormales o adversas de la piel a la luz ultravioleta o la radiación visible) en las que subyace un mecanismo inmunológico.
Entre ellas, la erupción polimorfa lumínica es la entidad más frecuente, afectando al 10-20% de la población occidental. Aparece sobre todo en mujeres jóvenes y es más típico en las primeras exposiciones solares del año (primavera), mejorando a medida que la estación soleada avanza (tras exposiciones repetidas al sol y la progresiva melanización de la piel).
Se caracteriza por brotes repetidos de lesiones cutáneas pruriginosas con localización predominante en aquellas zonas de mayor exposición solar: cara, cuello, zona alta del tórax, caras laterales de antebrazos y cara anterior de las piernas.
Las lesiones pueden ser de distinto tipo (de ahí el término polimorfismo): pápulas, pápulo-vesículas, eccema, placas, erosiones o costras; aunque, en un paciente individual, las lesiones son normalmente monomórficas y simétricas, apareciendo habitualmente a las pocas horas de exposición al sol.
Las reacciones agudas requerirán el tratamiento sintomático acorde con la gravedad del cuadro. Los antihistamínicos ayudarán a controlar el prurito; aunque, en ocasiones, puede ser necesario el uso de corticoides sistémicos. Sin embargo, lo más importante es prevenir la aparición de la erupción mediante fotoprotección adecuada (ropa, protección solar UVA y UVB). Si con ello no se consigue evitar la aparición de los brotes, se puede llevar a cabo una terapia de “desensibilización mediante fototerapia” con radiación UVB de banda estrecha (UVB-BE) para conseguir el endurecimiento (hardening) de la piel. Se basa en ir acostumbrando poco a poco a nuestra piel a la exposición al sol (fototolerancia), mediante la aplicación de cursos cortos de UVB-BE desde principios de la primavera y durante varias semanas, hasta alcanzar niveles que permitan al paciente tolerar exposiciones solares diarias de 15-20min de duración. Además, en adultos jóvenes, que viajan de vacaciones a zonas soleadas, se ha comprobado que la realización de ciclos cortos (6-7 días) de corticoides sistémicos (prednisona 0,6-0,8 mg/kg/día) es útil en la prevención de aparición de brotes.
Entre las fotodermatosis que afectan con más frecuencia a población infantil, se encuentra la erupción primaveral juvenil, considerada una variedad localizada de la erupción polimorfa lumínica, de origen desconocido y que afecta más frecuentemente a varones entre 5 y 12 años. Cursa con pápulas eritematosas pruriginosas que aparecen típicamente durante la primavera en el hélix de las orejas que no está cubierto por pelo. Pueden evolucionar a vesículas y costras sin dejar lesiones residuales o solo mínimas cicatrices.
También el hidroa vacciniforme, aunque es una afección rara, se suele dar en niños menores de 10 años, mejorando hacia la edad adulta. Algunos autores consideran que se trata de una variante cicatricial de la erupción polimorfa lúminica. Consiste en brotes recurrentes de lesiones vesiculosas, de contenido viscoso, seroso o hemorrágico, que evolucionan a costras y escaras negruzcas que se desprenden, dejando lesiones cicatriciales varioliformes, deprimidas e hipopigmentadas. Suelen darse cada verano en las partes descubiertas del cuerpo tras la exposición a la luz solar. Su localización más frecuente es en orejas, nariz, dedos, mejillas, dorso de manos o antebrazos y, a veces, puede afectar también a ojos y cuero cabelludo, con efectos adversos importantes sobre la calidad de vida de los niños. Se desconoce la patogenia, aunque se ha asociado a infecciones por virus de Epstein-Barr, y puede evolucionar a linfoma.
Otras fotodermatosis menos frecuentes en niños son el prurigo actínico, la dermatitis actínica crónica o la urticaria solar.
Todas ellas se engloban dentro de este grupo de fotodermatosis inmunológicamente mediadas conocido coloquial- y erróneamente bajo el único nombre de “alergia solar”. Sin embargo la patogenia y clínica de cada una de ellas es diferente y por tanto su tratamiento. Por ello es importante acudir al especialista quien establecerá un diagnóstico preciso y con ello el tratamiento más adecuado.
Dra. Paula Cabrera Freitag, Hospital Universitario Gregorio Marañón de Madrid. Comité de Alergia Infantil SEIAC
Bibiliografía:
- Barceló JM, Rosillo MR, Muñoz C. Fotodermatosis. En IJ Dávila, I Jáuregui, JM Olaguibel y JM Zubeldia, eds. Tratado de Alergología. 2ª ed. Madrid: Ergon, 2016, 889-912.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses. Part 1: pathophysiology and technical aspects of photobiologic studies. Actas Dermosifiliogr. 2014 Mar;105(2):112-21.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses, part II: photobiologic testing. Actas Dermosifiliogr. 2014 Apr;105(3):233-42.
- Gruber-Wackernagel A, Byrne SN, Wolf P. Polymorphous light eruption: clinic aspects and pathogenesis. Dermatol Clin. 2014 Jul;32(3):315-34
¿Cómo reconocer una anafilaxia?
Es muy importante reconocer rápidamente que una persona puede estar presentando una anafilaxia para administrar adrenalina precozmente.
Los síntomas de la anafilaxia suelen aparecer de manera brusca y súbita y afectan simultáneamente o de forma rápidamente sucesiva (en minutos) a diferentes órganos del cuerpo. Algunos de los signos más comunes incluyen:
• Un síntoma precoz y frecuente de la anafilaxia es un picor intenso en palmas, plantas y axilas.
• Suele acompañarse de enrojecimiento de la piel, junto con habones (ronchas) que pueden extenderse rápidamente a todo el cuerpo.
• Otro signo típico es la hinchazón, que puede afectar a los párpados y/o los labios, pero también a la lengua y la garganta, provocando en este último caso dificultad respiratoria y alteraciones en el tono de voz o imposibilidad de hablar.
• Pueden darse síntomas en el aparato digestivo, tales como dolor abdominal, náuseas, vómitos o diarrea.
• Si la anafilaxia afecta a los bronquios habrá también dificultad para respirar, pitidos en el pecho, opresión torácica.
• En los casos más graves, si hay bajada de la presión arterial, el paciente puede sufrir mareos intensos e incluso pérdida de conciencia.
A menudo estos síntomas se dan a los minutos del contacto (ingesta, picadura, administración intravenosa) con un alérgeno conocido o potencial, lo cual facilita el diagnóstico. En otras ocasiones, asumir que una persona está sufriendo una anafilaxia no es tan evidente.
La combinación de síntomas que puede presentar cada persona es variable; por tanto es importante saber que la anafilaxia puede manifestarse de diferentes formas.
Utilidad del Diagnóstico Molecular en Alergia a Alimentos
La alta prevalencia de la alergia a los alimentos y el importante impacto socioeconómico de esta patología sobre los pacientes, el sistema sanitario y la sociedad hace imprescindible poder contar con herramientas de diagnóstico validadas. La primera línea de diagnóstico en la alergia a los alimentos es la historia clínica adecuada y la demostración de anticuerpos de clase IgE frente a los alimentos implicados, mediante prueba cutánea o determinación de IgE específica. Sin embargo, está única aproximación no es siempre concluyente, ni para el propio diagnóstico ni para establecer el riesgo futuro del paciente. La confirmación ideal, es la prueba de exposición frente al alérgeno implicado, realizada en condiciones de doble ciego y controlada con placebo, tipo de metodología que consume tiempo, recursos y no está exenta de reacciones que pueden ser graves, por lo que se convierten en estudios difíciles de realizar en la práctica clínica. Las técnicas de diagnóstico fundamentadas en la identificación de los alérgenos moleculares de los alimentos, comúnmente denominada como diagnóstico por componentes, ha permitido la identificación de fenotipos clínicos en cuanto a la gravedad de la respuesta clínica y la detección de las moléculas alergénicas responsables de la reactividad cruzada entre los alimentos. En la última década se ha avanzado en la identificación de los alérgenos mayores, sin embargo, el valor diagnóstico y la utilidad clínica del diagnóstico por componentes aún no está establecido.
Determinar la validez del diagnóstico por componentes en la alergia a los siguientes grupos de alimentos: leche, trigo, cacahuete, soja, frutos secos, pescados y maricos, así como estimar el coste-efectividad del diagnóstico por componentes en comparación con las técnicas convencionales, y por último, resumir la evidencia de la capacidad del diagnóstico por componentes de predecir la gravedad de las reacciones alérgicas han sido los objetivos de una revisión sistemática recientemente publicada (Diagnostic accuracy, risk assessment, and cost-effectiveness of component-resolved diagnostics for food allergy: A systematic review. Flores Kim J, McCleary N, Nwaru BI, Stoddart A, Sheikh. Allergy. 2018 Jan 10. doi: 10.1111/all.13399).
Los autores pudieron incluir un total de 11 artículos elegibles entre más de 7000 artículos revisados. Los componentes moleculares evaluados fueron: para la leche de vaca (Bos d4, Bos d 4, Bos d 5, Bos d 8, y las caseínas); para el huevo (Gal d 1, Gal d 2, Gal d 3, Gal d 4); para el cacahuete (Ara h 1, Ara h 2, Ara 3, Ara h 6, Ara h 8, Ara h 9); para la avellana ( Cor a 1, Cor a 8, Cor a 9, Cor a 14, Bet v 1, Bet v 2); para la gamba (Pen a 1, Lit v 1, Lit v 4), no se encontraron estudios válidos para trigo, soja y pescados. Los componentes con mejor validez diagnóstica teniendo en cuenta el binomio sensibilidad- especificidad han sido: Bos d 4 para Leche de vaca (62.0%- 87.5%), para huevo Gal d 1 (84.2%- 89.8%) para huevo cocido y 60.6%-97,1% para huevo crudo, para cacahuete Ara 6 (94.9%-95.1%), para avellana Cor a 14 (100%-93,8%), y para gamba Lit v1 (82.8%-56.3%).
Los autores ponen de manifiesto la necesidad de estudios de calidad incluyendo la utilización del patrón de oro, la provocación oral doble ciego controlada con placebo, o bien de alternativas, que podrían estandarizarse como la combinación de pruebas de exposición abiertas y otros marcadores de sensibilización. Igualmente, es necesario definir unos puntos de corte que faciliten la agrupación de datos provenientes de diferentes estudios, se requiere la estandarización de los ensayos técnicos, para asegurar resultados comparables, es necesario tener estudios que evalúen en términos económicos el coste- efectividad de esta prueba y por último, los autores concluyen en que no es posible evaluar la capacidad del diagnóstico por componentes para evaluar el riesgo de la enfermedad en el contexto de los modelos clínicos actuales, si bien en algunos casos la sensibilización frente a algunos alérgenos moleculares, si pueden identificar los fenotipos más graves de la enfermedad como Ara h 2 y Ara h 6 para la alergia al cacahuete y Cor a 9 y Cor a 14 para la avellana. En resumen, esta revisión sistemática pone de manifiesto, que el diagnóstico por componentes es una herramienta muy importante para el conocimiento de la alergia a los alimentos, pero son necesarios estudios bien diseñados y con muestras de pacientes suficientes que abarquen todo el espectro de fenotipos desde los pacientes con clínica leve hasta los que tienen manifestaciones muy graves, para conocer realmente su utilidad en la práctica clínica.
Autor: Belén de la Hoz Caballer. Servicio de Alergología. Hospital Universitario Ramón y Cajal. Comité de Alergia Infantil.
Las abejas y las avispas
1. LOS HIMENÓPTEROS ABEJAS Y AVISPAS
Los himenópteros son un grupo de insectos artrópodos, caracterizados por poseer alas membranosas (del griego hymen y ptera, membrana y ala, respectivamente) y una organización social compleja. Dentro de los himenópteros existentes son de interés desde el punto de vista alergológico las familias Apidae (abejas) y Vespidae (avispas), ya que son los que ocasionan la mayoría de reacciones alérgicas en nuestro medio.
En el continente americano las hormigas también son causa frecuente de reacciones alérgicas, especialmente la hormiga roja.
La alergia a veneno de himenópteros es conocida desde antiguo: en las paredes de la tumba del rey egipcio Menes (año 2621 a.C.) puede verse representada su muerte por la picadura de una avispa (Figura 1).

Características morfológicas de los himenópteros
El reconocimiento de las características morfológicas, comportamiento y del hábitat del insecto que ha producido la picadura es importante, ya que puede ayudar en su identificación y por tanto mejorar el diagnóstico. La mayoría de los himenópteros son especies solitarias. Una minoría de especies forman sociedades en las cuales se agrupa un número mayor o menor de individuos los cuales trabajan en común para acumular reservas alimenticias y cuidar de sus larvas. Las construcciones donde lo hacen se llaman nidos.
Son estas especies las que interesan desde el punto de vista alergológico, ya que la formación de estas sociedades hace que el riesgo de picadura aumente al aumentar el número de individuos, y lo que es más importante, al aumentar su agresividad como mecanismo de defensa del nido, ya que los himenópteros pican para defender su comida o sus crías.
¿Es usted alérgico a la proteína de leche de vaca o intolerante a la lactosa?: La pregunta que salva vidas
Y es que la diferencia es ciertamente importante. Tan importante como que una de ellas puede ser potencialmente mortal. ¿Sabrías decir a cuál de las dos nos referimos?
Comencemos por los términos importantes:
- Leche: según la definición de la RAE:
- Líquido blanco que segregan las mamas de las hembras de los mamíferos para alimento de sus crías.
- Leche de algunos animales que se emplea como alimento de las personas.
- Jugo blanco obtenido de algunas plantas, frutos o semillas.
- Es decir, CUIDADO, la leche puede ser de origen ANIMAL (vaca, oveja, cabra, búfala…) o VEGETAL (soja, arroz, avena, almendra, coco…).
- Lactosa: según la definición de la RAE:
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Presente en leches de mamíferos.
- La lactosa se “destruye” (es decir, se separa en glucosa y galactosa) mediante la acción de una enzima digestiva llamada lactasa.
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Leche de vaca (composición): agua, proteínas (beta-lactoglobulina, alfa-lactoalbúmina, caseína…), grasas, vitaminas, hidratos de carbono (entre ellos, la lactosa) y minerales.
- Yogures y quesos de origen animal: producto lácteo obtenido al fermentar la leche de animales mediante bacterias que transforman la lactosa en ácido láctico, por tanto, el contenido de lactosa en estos productos es menor. Pero siguen conteniendo lactosa (salvo aquellos específicos sin lactosa) y proteínas de leche de animales.
- Leche/yogures/quesos sin lactosa: leche de animales a los que se ha añadido lactasa de forma artificial (pero siguen conteniendo proteínas de leche).
- Leches/yogures vegetales (composición): NO contienen Contienen proteínas diferentes a las de la leche de animales.
DIFERENCIAS FUNDAMENTALES ENTRE AMBAS (ver cuadro)
 Cargando...
Cargando...
La alergia a las proteínas de la leche de vaca:
- Los pacientes pueden tener reacción con leches de otros mamíferos (vaca, cabra, oveja…).
- Reaccionan con pequeñas cantidades (el 50% con menos de 4.1 ml de leche).
- Pueden detectar trazas (menos de 0.1 ml de leche). Los pacientes altamente sensibilizados pueden reaccionar con mínimas cantidades e incluso con contaminaciones indirectas.
- Toleran leches vegetales (excepto si tienen además de su APLV, alergia a alguna de éstas).
- Las reacciones aparecen generalmente en las 2 primeras horas tras la ingesta.
- Los síntomas pueden ser cutáneos (habones, hinchazón de labios…), respiratorios (congestión nasal, dificultad para respirar…), digestivos (dolor abdominal, vómitos, diarrea…) y/o cardiovasculares (mareo, pérdida de conocimiento…).
- Las reacciones pueden ser potencialmente mortales en el caso de afectar a 2 o más órganos o sistemas (ANAFILAXIA).
- Requieren tratamiento urgente específico (por ejemplo, si la afectación es exclusivamente cutánea puede ser tratada con antihistamínicos y corticoides en caso de edema asociado, si los síntomas son respiratorios habrá que utilizar broncodilatadores de rescate y si estamos ante una anafilaxia, el tratamiento de elección será la adrenalina intramuscular).
La intolerancia a lactosa:
- Los pacientes toleran leche sin lactosa.
- Pueden consumir yogures sin lactosa y quesos con bajo contenido en lactosa (queso curado, parmesano, gruyere, mozzarella…). Pero es recomendable preguntar si pueden consumirlo.
- Pueden toleran leche y derivados lácteos con lactosa si toman previamente comprimidos de lactasa.
- Toleran leches vegetales.
- Suelen tener reacciones de tipo digestivo (dolor abdominal, diarrea, flatulencias…).
La cantidad SÍ importa:
3.2 mg de proteína de leche (unos 0.1 ml de leche de vaca) pueden desencadenar una reacción alérgica en al menos el 5% de los pacientes alérgicos a proteínas de leche de vaca. Al menos el 50% reaccionan con 133 mg de proteína de leche (unos 4.1 ml de leche).
EN RESUMEN: el conocimiento es poder. Y en este caso, el uso correcto del lenguaje es de vital importancia.
Grabémonos la pregunta clave:
¿Es usted alérgico a la proteína de la leche de vaca o intolerante a la lactosa?
- Si la respuesta es SOY ALÉRGICO: CUIDADO, pueden tener reacciones alérgicas potencialmente mortales, incluso con trazas, que requieran tratamiento urgente. Tendremos que evitar cualquier contacto con leche de mamíferos y aquellos productos que puedan contenerla.
- Si la respuesta es SOY INTOLERANTE: podemos dar leche y productos lácteos SIN lactosa. Podemos también preguntar por el grado de tolerancia, es decir, si tolera yogures o quesos.
- Si tenemos DUDAS: es mejor SER PRECAVIDOS y EVITAR cualquier contacto con leche de mamíferos o aquellos productos que puedan contenerlos.
Porque hay preguntas que salvan vidas. Usémoslas.
Dra. Laura Argiz Álvarez. Clínica Universidad de Navarra (Madrid).
Bibliografía:
- Turner PJ, d’Art YM, Duca B, et al. Single-dose oral challenges to validate eliciting doses in children with cow’s milk allergy. Pediatr Allergy Immunol. 2021;32(5):1056-1065. doi:10.1111/pai.13482
- Blom WM, Westerhout J, Baumert JL, et al. Updated full range of Eliciting Dose values for Cow’s milk for use in food allergen risk assessment. Food Chem Toxicol. 2022;168:113381. doi:10.1016/j.fct.2022.113381
¿Debe suspenderse el tratamiento antiasmático durante el embarazo y la lactancia?
En general, se recomienda evitar el empleo de fármacos durante el embarazo, dado el riesgo de malformaciones. Sin embargo, en una mujer asmática embarazada es muy importante obtener un adecuado control de la enfermedad, ya que una crisis puede ser causa de un importante sufrimiento del feto por falta de oxígeno. Si para alcanzar este control es necesario el uso de medicación, no debe suspenderse ni demorarse su administración.
Revisión con enfoque al paciente de Esofagitis Eosinofílica
La esofagitis eosinofílica (EoE) es una enfermedad de tipo alérgico caracterizada por una inflamación crónica del esófago (el tubo muscular que transporta la comida desde la boca hasta el estómago) por eosinófilos. En condiciones
normales no hay eosinófilos en el esófago. Esta acumulación es consecuencia de una reacción frente a determinados alimentos, alérgenos ambientales (polen, polvo, hongos…) o en ocasiones también al reflujo gastroesofágico y puede
dañar el tejido esofágico, lo que origina dificultad para tragar la comida (disfagia) o hacer que los alimentos queden atascados (impactación).
Los eosinófilos son las células que participan habitualmente en enfermedades alérgicas como la rinitis, la conjuntivitis, la dermatitis atópica o el asma bronquial. Sin embargo, a diferencia de éstas, el mecanismo alérgico no es inmediato, si no retardado.
La EoE se conoce desde hace menos de tres décadas y desde entonces, el número de casos nuevos ha crecido exponencialmente, especialmente en Norteamérica y Europa. En la actualidad, se estima que la prevalencia (número
de personas afec- tas) media de la EoE es de 22 personas por cada 100.000 habitantes, con cifras de 46 y 55 casos por 100.000 habitantes recientemente descritas en España y EE.UU. En la actualidad, ya representa la segunda
causa de inflamación del esófago (tras la enfermedad por reflujo gastroesofágico) y es la primera causa de disfagia e impactación alimentaria en niños y adultos jóvenes.
Esta patología se puede presentar a cualquier edad y sexo, si bien suele ser más común en jóvenes caucásicos de sexo masculino. Los síntomas varían dependiendo de la edad a la que se manifieste. La gran mayoría de los pacientes
suelen padecer otras enfermedades alérgicas, como rinitis, asma bronquial o alergia a alimentos.
CAUSAS
Los alimentos que producen esta alergia son muy variados y en muchos pacientes no conocidos con certeza. Los más frecuentes son la leche de vaca, el trigo, el huevo, las legumbres, además de alérgenos aéreos, como pólenes, ácaros del polvo,etc. No está claro por qué los alimentos que se han consumido durante siglos ahora puedan causar estos síntomas, si bien todo apunta a que el aumento en la contaminación ambiental, las modificaciones genéticas
aplicadas a las plantas, la maduración artificial de los alimentos vegetales y otros factores, posiblemente sean los causantes del aumento en la frecuencia de ésta y del resto de enfermedades alérgicas en los países desarrollados.
SÍNTOMAS
En niños menores de 2 años, las manifestaciones clínicas más comunes son el rechazo del alimento y vómitos. Entre los 2 y los 8 años predominan los vómitos, regurgitación, ardores y dolor abdominal o torácico, además puede existir
de pérdida de peso o retraso en el crecimiento. A partir de los 10 años, todos los pacientes refieren como síntomas dominantes y de forma intermitente la disfagia para sólidos (dificultad para el paso de la comida) y la impactación
alimentaria (atascamiento de comida), debido a la presencia de inflamación y en algunos casos, de disminución en el calibre del esófago.
PREVENCIÓN
Puesto que esta enfermedad aún permanece en estudio, no se conocen medidas concretas que puedan prevenirla. Todos los pacientes que tienen alguna patología alérgica diagnosticada deberían estar atentos ante los síntomas de alerta y
consultar con un alergólogo y/o gastroenterólogo si comienzan a tener alguno de ellos.
DIAGNÓSTICO
Hoy en día sólo existe una manera de diagnosticar la enfermedad y es realizando una endoscopia digestiva alta con toma de biopsias por el gastroenterólogo. En las biopsias se confirmará la existencia de eosinófilos.
Después, el alergólogo le realizará un estudio y junto con el gastroenterólogo, se diseñará el tratamiento más adecuado.
TRATAMIENTO
Los objetivos principales del tratamiento son la curación de los síntomas, de la inflamación esofágica, así como la eliminación o reducción de las estrecheces (si las hubiera) en el esófago.
La curación de la inflamación esofágica se puede conseguir mediante tres tipos de tratamientos: protectores de estómago (por ejemplo, omeprazol), corticoides tópicos (fórmulas viscosas o líquidas que actúan al adherirse a la pared del esófago) o la eliminación de determinados alimentos de la dieta. La dieta que se incluya como parte del tratamiento se establecerá a partir de las características individuales de cada uno de los pacientes.
Además del tratamiento para la inflamación, en algunos casos se debe añadir dilatación (ensanchamiento) mediante endoscopia en el caso de la existencia de estrecheces en el esófago.
La EoE es una enfermedad crónica progresiva, por lo que la presencia de inflamación mantenida en el esófago sin tratamiento da lugar a una elevada probabilidad de estrecheces con el paso del tiempo. Por lo tanto, es tan
importante el diagnóstico y tratamiento precoz, como el seguimiento y tratamiento a largo plazo, que se deben de consensuar con el paciente, dado que es una enfermedad que incide negativamente en la calidad de vida del
paciente.
PRONÓSTICO
La EoE es una enfermedad de buen pronóstico, si bien al ser una enfermedad nueva, no existe un seguimiento de pacientes superior a los 15 años. Hasta la fecha no se ha descrito que predisponga a enfermedades malignas, tales como cáncer de esófago ni que evolucione hacia otros tipos enfermedades alérgicas más graves.
SUBCOMITÉ ESOFAGITIS EOSINOFILICA
Rosario González Mendiola. Facultativo Especialista en Alergología. Hospital
Central de la Cruz Roja, Madrid
Joan Doménech Witek. Facultativo Especialista en Alergología. Hospital de
Elda, Alicante
Recomendaciones para pasar un Verano seguro con niños con Alergia Alimentaria
En los últimos años debido a que la pandemia nos ha obligado a mantener unos horarios y actividades más rutinarias, ha sido mucho más sencillo para los niños alérgicos a alimentos, sus padres y los responsables escolares, establecer y seguir unas medidas de control tanto en casa como en los comedores de colegios o institutos.
Con la llegada de este verano, un verano sin restricciones, el buen tiempo y los largos días de ocio y descanso, todos nos volvemos a plantear las vacaciones con un sinfín de posibilidades que incluyen viajes nacionales e internacionales, comidas fuera de nuestro domicilio en restaurantes, asistencia con cierta frecuencia a reuniones familiares, fiestas, etc.; situaciones potencialmente de riesgo en las que se relajan las medidas de vigilancia recomendadas y dificultan la completa evitación de los alimentos a los que nuestro hijos son alérgicos.
Para poder disfrutar sin sobresaltos ni sustos de estos meses de verano, desde el Comité de Alergia a Alimentos de la SEAIC queremos hacer llegar a nuestros niños alérgicos y sus familiares, tal y como hicimos el año pasado, una serie de directrices, recomendaciones o consejos:
1 – Continuar con el tratamiento de mantenimiento de otras patologías alérgicas, en especial del asma bronquial. La alergia a alimentos puede coexistir con diversas patologías alérgicas como dermatitis atópica, esofagitis eosinofílica, rinocojuntivitis o asma. El padecer asma bronquial, sobre todo si está mal controlada, aumenta el riesgo de sufrir una reacción alérgica a alimentos más grave. En vacaciones son más habituales los olvidos en la toma de la medicación, en particular los inhaladores que mantienen el asma estable.
2 – Siempre que se viaje o cuando se acuda a campamentos de verano es aconsejable llevar un informe en el que se especifique el tipo de alergia alimentaria que se padece y el tratamiento que se debe administrar en caso de una reacción alérgica. En su defecto existe un “protocolo de actuación ante una reacción alérgica en la escuela de la Asociación Española de Personas con Alergia a Alimentos y Látex (AEPNAA)”, avalado por la sociedad española de alergología e inmunología clínica (SEAIC), una guía para el tratamiento en las escuelas de niños con alergia a alimentos de fácil cumplimentación por parte del médico alergólogo. Tampoco hay que olvidar la tarjeta sanitaria y se deberá solicitar la tarjeta sanitaria europea (TSE) cuando se viaje a países del territorio del Espacio Económico Europeo, Reino Unido o Suiza.
3 – Preparar un botiquín con toda la medicación necesaria para su administración en caso de una reacción alérgica, el informe médico con el plan de tratamiento individualizado y los teléfonos de emergencias del lugar donde se viaja. El paciente alérgico a alimentos debe ser capaz de reconocer las distintas manifestaciones de una reacción alérgica a alimentos y las fuentes de exposición alergénica, debe estar entrenado en las medidas que son necesarias tomar en caso de que se presente una reacción, incluyendo la administración de mediación de urgencia. En el caso de los niños, lo recomendable es que sean dos las personas responsables.
La medicación que se incluirá en el botiquín será aquella aconsejada por su alergólogo y especificada en el informe, pudiendo tratarse de antihistamínicos, corticoides, inhaladores de acción rápida y/o adrenalina autoinyectable. La adrenalina es el tratamiento específico y de primera línea en la anafilaxia, por lo que se debe conocer las situaciones en las que debe ser administrada y cómo hacerlo.
Si se viaja en avión, tren o barco, puede solicitar a su alergólogo el “DOCUMENTO QUE ACREDITA LA NECESIDAD DE PORTAR ADRENALINA AUTOINYECTABLE EN MEDIOS DE TRANSPORTE” confeccionado por el Comité de Alergia a Himenópteros de la SEAIC en sus versiones en inglés, francés y español.
4 – Extremar las precauciones en las comidas que se realicen fuera de casa. Las reacciones más graves ocurren fuera del hogar, en lugares públicos, la mayoría en restaurantes, fiestas o reuniones.
En las comidas en restaurantes hay que leer detenidamente la carta y ante la duda, preguntar directamente a los empleados sobre los ingredientes de los platos que se van a consumir antes de elegir la comida. La mayoría de las reacciones alérgicas a alimentos están causadas por nueve grupos de alimentos, cuatro de origen animal (leche de vaca, huevo, pescado y marisco) y cinco de origen vegetal (legumbres, frutos secos, cereales, frutas y verduras). Las legislaciones de países desarrollados tienen en común la declaración obligatoria de ocho “alérgenos principales”: leche, huevo, pescado, mariscos crustáceos, nueces de árbol, trigo, cacahuete y soja. La normativa europea es más exigente aumentando el número a 14 alérgenos de declaración obligatoria: cereales que contengan gluten (trigo, centeno, cebada, avena, espelta, kamut o sus variedades híbridas), crustáceos, moluscos, huevo, pescado, cacahuete, soja, leche, frutos de cáscara (almendras, avellanas, nueces, anacardos, pacanas, castañas de Pará, pistachos/alfóncigos y macadamias o nueces de Australia), altramuces, apio, mostaza, sésamo y dióxido de azufre.
Por último, los pacientes deben estar familiarizados con situaciones en las que los alimentos puedan contaminarse con otros como en la utilización de planchas, batidoras… Y tener en cuenta que hay pacientes muy sensibles, que presentan síntomas tras el contacto cutáneo con los alimentos a los que son alérgicos, o trazas de éstos y tras la inhalación de vapores de su cocinado como es el caso de los algunos alérgicos a pescados. Y nunca deben compartir comida ni utensilios.
Finalmente, sólo queda desearos desde el Comité de Alergia Alimentos de SEAIC un feliz y seguro verano libre de reacciones alérgicas.
Dra Rosario Escudero
Hospital Reina Sofía de Tudela (Navarra)
¿Qué es la SEAIC?
 La Sociedad Española de Alergología e Inmunología Clínica (SEAIC) es una sociedad profesional y científica, sin ánimo de lucro, que desarrolla sus actividades en todo el territorio español. La Sociedad está constituida por más de un millar de profesionales que trabajan en el estudio de las enfermedades de mecanismo inmunológico, particularmente por hipersensibilidad.
La Sociedad Española de Alergología e Inmunología Clínica (SEAIC) es una sociedad profesional y científica, sin ánimo de lucro, que desarrolla sus actividades en todo el territorio español. La Sociedad está constituida por más de un millar de profesionales que trabajan en el estudio de las enfermedades de mecanismo inmunológico, particularmente por hipersensibilidad.
Los principales objetivos de la SEAIC se centran en:
- Fomentar y difundir la investigación sobre la especialidad de alergología y la inmunología clínica.
- Promover actividades de formación y perfeccionamiento profesional.
- Fomentar el contacto, el intercambio de experiencias y la puesta en común entre sus socios.
- Intervenir en los problemas que puedan afectar a sus miembros.
- Promover la información y la educación sanitaria para el público en general, en el área de estudio que le corresponde.
Asimismo, la Sociedad también lleva a cabo diferentes actividades destinadas a contribuir y mejorar el conocimiento de la especialidad, como:
- Organización de congresos y simposios con periodicidad anual.
- Publicación de guías, monografías y tratados.
- Establecimiento de pautas y protocolos a través de sus grupos de trabajo, también de programas de formación continuada.
- Representación en la Comisión Nacional de la Especialidad de Alergología.
- Representación en otras sociedades científicas.
- Colaboración con la industria farmacéutica.
- Colaboración con los medios de comunicación.
- Colaboración con asociaciones de pacientes alérgicos.
- Divulgación sobre enfermedades alérgicas.
- Financiación de trabajos de investigación a través de la «Fundación SEAIC».
Cada año se incorporan a SEAIC varias decenas de jóvenes especialistas que creen que la relevancia de las enfermedades alérgicas se merecen una atención especial y por ello trabajan en el avance de los conocimientos científicos, en el incremento de la calidad asistencial y en la capacidad divulgativa de todos aquellos factores clave para el diagnóstico, tratamiento y la prevención de enfermedades alérgicas.
Las enfermedades alérgicas son de las más frecuentes en el mundo occidental. Hasta un 20% de la población mundial padece algún tipo de enfermedad alérgica, aproximadamente 1.300 millones de personas. Las enfermedades alérgicas llevan aparejado un alto coste económico. Por un lado, suponen un gran consumo de recursos sanitarios y provocan una pérdida de productividad laboral y escolar. Además, derivan en un deterioro significativo de la calidad de vida y una cifra nada desdeñable de muertes asociadas principalmente a la anafilaxia y el asma mal controlada.
Como una muestra más del compromiso de la SEAIC con las enfermedades alérgicas, la Sociedad creó, en 1986, la Fundación SEAIC, una entidad sin ánimo de lucro cuyo objetivo prioritario se basa en estimular la investigación en el campo de la Alergología y la Inmunología Clínica. La Fundación ha llevado a cabo diversas actividades dirigidas al colectivo de alergólogos, fundamentalmente convocatoria de ayudas para trabajos de investigación, becas para jóvenes alergólogos y edición de monografías de elevado nivel científico.
Más detalles en Dosier informativo Fundación de la SEAIC (7265 descargas )
El portal web de la SEAIC está destinado a ofrecer información actualizada sobre estas actividades, poniendo a disposición de profesionales y pacientes los canales de comunicación propios de Internet para transmitir esta información.
En relación con las actividades divulgativas, informamos que los contenidos ofrecidos en este sitio están desarrollados por profesionales especialistas de la SEAIC. La información ofrecida en este sitio no puede sustituir en ningún caso la necesaria relación médico-paciente en que se sustenta la asistencia sanitaria especializada.
De acuerdo con la estrategia institucional de la SEAIC, como sociedad profesional y científica sin ánimo de lucro, esta página no aloja ni recibe financión procedente de la publicidad.
Última edición: 13/02/2016
—————————————–
PAAM 2025: ciencia e innovación en alergia pediátrica
Anunciamos el Meeting de EAACI sobre Alergia y Asma Pediátrica – PAAM 2025, que se celebrará del 23 al 25 de octubre de 2025 en Palma de Mallorca, España.
Inscríbete antes del 18 de septiembre a las 23:59 CET para aprovechar la tarifa estándar. Después de esta fecha, los precios aumentarán.
Este año contarán con expertos internacionales de reconocido prestigio, comprometidos a compartir sus investigaciones y hallazgos más recientes, así como a proponer soluciones innovadoras para los desafíos más urgentes en el ámbito pediátrico.
EAACI ha diseñado un programa científico innovador, que incluirá ponencias magistrales, simposios innovadores y talleres interactivos sobre temas como:
- El papel de la epigenética y el medio ambiente en el desarrollo de las alergias.
- Avances en terapias de inmunomodulación.
- Enfoques prácticos para el manejo de comorbilidades como eccema, rinitis y alergia alimentaria.
También abordaremos cuestiones clave como la atención a la anafilaxia grave, el impacto del cambio climático en la alergia pediátrica y las estrategias para fortalecer la colaboración entre profesionales sanitarios, pacientes y familias.
II Congreso Internacional de las Sociedades Ibéricas de Alergología SPAIC- SEAIC 2025
Cruzando Fronteras en la Alergia.
Las Juntas Directivas de SPAIC y SEAIC anuncian el II Congreso Internacional de las Sociedades Ibéricas de Alergología SPAIC- SEAIC 2025, que se celebrará los días 4 y 5 de abril de 2025 en el Hotel Sheraton de Oporto.
Accediendo mediante el enlace II Congreso Ibérico SEAIC-SPAIC 2025 podrá consultar el programa científico, inscribirse y enviar su comunicación (envío de resúmenes hasta el 16 de marzo).
Este evento representa una oportunidad para actualizar conocimientos, intercambiar experiencias y fortalecer la relación y colaboración entre los profesionales de la Alergología e Inmunología Clínica a nivel internacional.
El programa científico abordará temas de gran relevancia, como el asma grave, la alergia alimentaria, la rinosinusitis crónica, el angioedema, la dermatitis atópica, la urticaria y los avances en inmunoterapia.
Aparte de las tradicionales mesas redondas, podrás participar de foros dirigidos a jóvenes investigadores y espacios especialmente diseñados para la presentación de pósteres, debates interactivos que serán una oportunidad para intercambiar ideas y experiencias en un ambiente colaborativo y enriquecedor.
El congreso incluirá sesiones en español, y las sesiones en portugués contarán con traducción simultánea al español.
No pierdas la oportunidad de formar parte de este encuentro científico.
¡Te esperamos en Oporto!
European Biologics Course
EUFOREA presenta su primera edición del Curso Europeo de Formación Híbrida sobre Biológicos que tendrá lugar en la Real Academia de Medicina de Bruselas, Bélgica, el viernes 1 de marzo de 2024. Este curso de formación híbrido está diseñado para aumentar el compromiso y la comprensión de los productos biológicos entre los profesionales sanitarios (otorrinolaringólogos, neumólogos y alergólogos) que tratan a pacientes con enfermedades de tipo 2 no controladas, como el asma, la rinosinusitis crónica con pólipos nasales y la dermatitis atópica.
Toda la información diponible en la web (https://www.euforea.eu/events/european-biologics-training-course-2024) y en el siguiente documento: European-Biologic-Course-Agenda_SEAIC.pdf (1227 descargas )
Congreso SEAIC 2010 en Facebook
El XXVII Congreso Nacional de la SEAIC dispone de un área de participación en Facebook. Acceda a la página desde aquí o desde el enlace de la página de inicio.
No todas las reacciones por quimioterápicos son debidas a alergia
¿Qué es la quimioterapia?
La quimioterapia es un tipo de tratamiento farmacológico contra el cáncer y funciona destruyendo las células cancerosas o frenando su proliferación. Se trata de un tratamiento sistémico, ya que, una vez administrada, circula a través del torrente sanguíneo pudiendo alcanzar casi cualquier parte del cuerpo. Existen más de 100 quimioterápicos diferentes, como las antraciclinas (doxorubicina, epirubicina), las sales de platino (oxaliplatino, carboplatino, cisplatino) o los taxanos (paclitaxel, docetaxel), entre otras. En función del tipo de cáncer, del grado de extensión y del estado de salud general en el que se encuentre, su oncólogo prescribirá una quimioterapia u otra, sola o en combinación con otros tratamientos.
¿Por qué la quimioterapia causa efectos secundarios?
La quimioterapia no solamente ataca a células cancerosas, sino que también actúa sobre células de tejidos sanos, especialmente aquellos que estén continuamente produciendo células nuevas, por ejemplo, la médula ósea, las mucosas del tracto digestivo o respiratorio, la piel, el cabello, o las uñas. Esto puede conllevar a la aparición de efectos secundarios, como la disminución del nivel de glóbulos rojos y blancos o de las plaquetas en la sangre, vómitos, diarreas, erupciones en la piel, pérdida del cabello, cansancio, mareo, o debilidad. Cada quimioterapia tiene un perfil de efectos secundarios propio, y la mayoría de estos estarán relacionados con su mecanismo de acción y la dosis prescrita. La mayoría de estos efectos secundarios aparecen durante los días posteriores a la administración del ciclo, son temporales y mejoran con el reajuste de la dosis o añadiendo medicación para aliviar los síntomas.
¿Qué es la alergia a la quimioterapia?
La alergia a la quimioterapia es una reacción adversa poco frecuente y está causada por una respuesta inusual del sistema inmunitario frente al fármaco. La mayoría de las reacciones alérgicas a la quimioterapia aparecen inmediatamente o durante la administración al fármaco, y normalmente, aunque no siempre, se acompañan de síntomas en la piel como picor, enrojecimiento o erupciones. En ocasiones, pueden producirse reacciones alérgicas graves, como la anafilaxia, esto es, una reacción de inicio brusco y con síntomas generalizados como la dificultad respiratoria o la hipotensión, pudiendo evolucionar rápidamente a cuadros más graves.
¿Todas las reacciones adversas a la quimioterapia son por alergia?
No, como cualquier medicamento, la quimioterapia puede producir reacciones adversas con síntomas similares a los de una alergia, pero no todas se producen por una respuesta del sistema inmunitario y se deben a otro motivo, por ejemplo, un efecto secundario al propio mecanismo del fármaco.
¿Qué ocurre si tengo alergia a la quimioterapia?
La re-exposición a la quimioterapia en un paciente que se ha vuelto alérgico puede ser potencialmente grave. Por este motivo es importante que los pacientes que han presentado una reacción a su quimioterapia sean estudiados por un especialista en alergología antes de continuar con el tratamiento, para poder confirmar o descartar el origen alérgico de la reacción. En caso de que se confirme la alergia, la desensibilización es un procedimiento que permite que un paciente alérgico a la quimioterapia continúe recibiéndola de forma segura a pesar de su alergia. Este procedimiento no está exento de riesgos y debe realizarse siempre en manos de personal experto, con recursos apropiados y en un entorno preparado.
En resumen, la quimioterapia puede desencadenar distintos efectos secundarios, siendo la alergia a la quimioterapia una reacción poco común pero potencialmente grave. Sin embargo, no todas las reacciones adversas a la quimioterapia son causadas por alergia, ya que pueden deberse a otros factores, como los efectos secundarios propios del fármaco. La identificación precoz de las reacciones alérgicas y el diagnóstico preciso son esenciales para poder elegir la mejor estrategia de tratamiento y garantizar la seguridad de los pacientes.
Paula Vázquez Revuelta
Facultativa Especialista – Servei d’Al·lergologia | Hospital Universitari Bellvitge
Hongos
Los hongos son seres vivos ampliamente distribuidos en la naturaleza. Las esporas que desprenden numerosas especies para su reproducción se encuentran en la atmósfera alcanzando niveles que varían según las condiciones ambientales. Estas esporas suelen ser los agentes responsables de las reacciones que sufren los enfermos alérgicos a hongos.
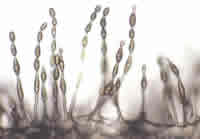
En general, los hongos requieren una humedad ambiental elevada para su crecimiento y proliferación, por lo que los niveles de esporas se multiplican en lugares húmedos como pueden ser las zonas pantanosas o ribereñas.
En los recintos cerrados suelen concentrarse en áreas donde más se acumula la humedad (sótanos, trasteros, bodegas, etc.). Las piscinas cubiertas son una importante fuente de exposición a esporas de hongos.
Cómo evitarlos
En el domicilio del paciente es recomendable mantener una humedad relativa por debajo del 60%, evitando el uso de humidificadores ambientales. Si tiene aire acondicionado, límpielo con frecuencia y cambie regularmente los filtros de agua.
Es aconsejable evitar la estancia prolongada en ambientes húmedos y lugares que hayan estado cerrados durante largo tiempo, así como el exceso de plantas de interior o vegetación densa en terrazas y ventanas, montoneras de leña y hojas secas.
———————————————–
Dermatitis atópica en niños: lo último en tratamientos y futuro del manejo en 2025
La dermatitis atópica (DA) es la enfermedad inflamatoria cutánea más frecuente en la infancia y representa un verdadero desafío clínico por su curso crónico-recidivante y el importante impacto que genera en la calidad de vida de los niños y sus familias. En los últimos cinco años, las opciones terapéuticas se han ampliado de manera notable gracias al desarrollo de nuevos fármacos biológicos e inhibidores de JAK. La guía EuroGuiDerm 2025 (segunda actualización de la guía europea) incorpora en su última versión las novedades más relevantes para el manejo de la DA en población pediátrica.
La principal novedad del documento europeo radica en las terapias sistémicas avanzadas para la DA grave. En este escenario, cuando la enfermedad no se controla con un tratamiento tópico optimizado, la EuroGuiDerm 2025 recomienda como primera opción los biológicos. Actualmente existen tres aprobados en población pediátrica: dupilumab, autorizado desde los 6 meses de edad; y lebrikizumab y tralokinumab, indicados a partir de los 12 años. Dupilumab sigue siendo el fármaco de referencia por su amplio rango de edad y su perfil de seguridad favorable. Los anti-IL-13 selectivos ofrecen una eficacia comparable y, en el caso de lebrikizumab, la ventaja de una administración mensual en fase de mantenimiento, lo que mejora la adherencia.
Junto a ellos, los inhibidores orales de JAK se consolidan como una alternativa eficaz. La guía incluye baricitinib, aprobado desde los 2 años, así como abrocitinib y upadacitinib, autorizados a partir de los 12 años. Estos fármacos destacan por su inicio de acción rápido y su alta eficacia en la reducción del prurito y las lesiones. Sin embargo, requieren un seguimiento analítico estrecho debido a potenciales efectos adversos (hematológicos, metabólicos, cardiovasculares e infecciosos), por lo que se reservan a pacientes seleccionados, especialmente cuando no hay acceso o respuesta a biológicos.
Cuando los biológicos y los inhibidores de JAK no están disponibles, la ciclosporina A se mantiene como una opción válida en ciclos cortos bajo supervisión especializada, siendo el único inmunosupresor aprobado en pediatría. Otros inmunosupresores, como metotrexato, azatioprina o micofenolato mofetilo, se utilizan de forma off-label, aunque con evidencia limitada.
A pesar de estos avances, los pilares básicos del tratamiento permanecen inalterables. La restauración de la barrera cutánea mediante el uso sistemático de emolientes continúa siendo el fundamento de toda estrategia terapéutica. Se recomienda su aplicación al menos dos veces al día en toda la superficie corporal, incluso en áreas sin lesiones visibles. La llamada “regla del minuto”, que consiste en aplicar el emoliente en el primer minuto tras el baño, mejora la hidratación y previene la pérdida transepidérmica de agua. Los baños, lejos de estar contraindicados, forman parte del tratamiento si se realizan de forma breve, con agua tibia y limpiadores syndet, seguidos de un secado suave sin fricción.
De forma paralela, el control de factores ambientales —evitar fibras irritantes, reducir la exposición a alérgenos en pacientes sensibilizados, mantener una humedad ambiental estable y limitar irritantes como detergentes o humo de tabaco— contribuye a disminuir los brotes y la severidad. Los programas educativos para pacientes y familias son también un componente esencial, ya que mejoran la adherencia, el manejo diario de la enfermedad y el bienestar psicológico de los afectados.
En el abordaje de los brotes agudos, la primera línea continua siendo el tratamiento tópico. Los corticoides tópicos se recomiendan de manera individualizada según la edad, la localización y la intensidad de las lesiones, en pautas de 1–2 aplicaciones diarias durante un máximo de dos semanas. En zonas sensibles o en casos que requieren mantenimiento prolongado, los inhibidores de la calcineurina (tacrolimus 0,03% y pimecrolimus) son una alternativa no esteroidea clave, indicados desde los 2 años y, en algunos países, desde los 3 meses en el caso de pimecrolimus. Su uso intermitente, dos veces por semana en fases de mantenimiento (“estrategia proactiva”), reduce de forma significativa las recaídas. La guía también contempla el empleo de vendajes húmedos con corticoides de baja o media potencia en brotes extensos y refractarios, así como la fototerapia en adolescentes cuando el tratamiento tópico resulta insuficiente, aunque con un grado de recomendación menor. El uso de corticoides orales no se aconseja de manera rutinaria y debe reservarse únicamente como terapia puente en brotes graves, en ciclos cortos y siempre con monitorización estrecha.
Finalmente, las estrategias de modulación del microbioma se han consolidado como un campo clave en la investigación de la dermatitis atópica. Los probióticos —sobre todo combinaciones de Lactobacillus y Bifidobacterium— han mostrado cierto beneficio en formas moderadas-graves, mientras que los prebióticos (como FOS y GOS) favorecen el crecimiento de bacterias protectoras y refuerzan la barrera cutánea. Su combinación en simbióticos parece especialmente útil en niños a partir del primer año de vida. Además, se están desarrollando terapias innovadoras como los probióticos tópicos con cepas como Roseomonas mucosa o Staphylococcus hominis, capaces de reducir la inflamación y limitar la colonización por S. aureus. Aunque aún faltan estudios que definan qué cepas, dosis y duración son más eficaces, todo apunta a que el microbioma jugará un papel decisivo en el futuro de la dermatitis atópica pediátrica.
En conclusión, la EuroGuiDerm 2025 refleja el cambio de paradigma en la dermatitis atópica pediátrica. Los biológicos y los inhibidores de JAK se consolidan como pilares en los casos graves, sin perder de vista que la base del tratamiento sigue siendo la restauración de la barrera cutánea, el control ambiental y la educación familiar. El f uturo apunta hacia una medicina cada vez más personalizada, en la que la elección del tratamiento dependerá del fenotipo y endotipo clínico, la edad y las comorbilidades de cada paciente con el objetivo último de mejorar la calidad de vida de los niños y los adolescentes afectados.
Autora: Dra. Ana Láinez Nuez. Servicio de alergología, Hospital Vithas Turia, Valencia, Comité de Alergia Infantil SEAIC
- Wollenberg A, Kinberger M, Arents B, Aszodi N, Barbarot S, Bieber T, et al. European Guideline (EuroGuiDerm) on atopic eczema: Living update. J Eur Acad Dermatol Venereol. 2025;39(7):1537–66. doi:10.1111/jdv.20639.
Acta final TC Webex GEAB – 10 febrero 2020
Dermatitis Alérgica de Contacto en niños: Una realidad cada vez más frecuente
Situación actual y epidemiología
Durante mucho tiempo se pensó que la dermatitis alérgica de contacto (DAC) era una enfermedad exclusiva del adulto. Sin embargo, estudios recientes revelan una prevalencia similar a la de adultos, con casos descritos incluso en lactantes (1). Se estima que hasta un 16–20% de la población pediátrica está sensibilizada a algún alérgeno, aunque muchos casos no se diagnostican porque los síntomas se confunden con otras afecciones más comunes, como la dermatitis atópica (DA) (1,2). De hecho, menos del 10% de las pruebas epicutáneas se realizan en niños, lo que contribuye a este infradiagnóstico (1).
Dermatitis atópica y dermatitis alérgica: ¿cómo se relacionan?
La DAC y la DA pueden coexistir y a menudo se solapan, ya que ambas provocan inflamación y picor. Más de un tercio de los niños con DAC tienen también DA (1), y en muchos casos, los productos utilizados para tratar la piel atópica contienen ingredientes sensibilizantes que agravan los síntomas (1). Esta superposición puede dificultar el diagnóstico y retrasar el tratamiento adecuado.
En niños con DA, debe sospecharse una DAC cuando la dermatitis es recalcitrante al tratamiento convencional, presenta una distribución atípica (como afectación localizada de párpados, labios, manos, pies o zona del pañal), o empeora con el uso de productos destinados al cuidado de la piel atópica, los cuales pueden contener alérgenos como fragancias, lanolina o conservantes. También debe considerarse la DAC si las lesiones se localizan en áreas en contacto con cosméticos, cremas, ropa, joyas, materiales escolares o deportivos. En estos casos, la realización de pruebas epicutáneas permite identificar alérgenos relevantes y guiar el tratamiento (1,3).
¿Cómo se diagnostica?
El diagnóstico de la DAC en niños se basa en la historia clínica detallada y en la realización de pruebas epicutáneas, que son el método de referencia para identificar alérgenos causantes. Estas pruebas consisten en aplicar parches con alérgenos sobre la espalda del niño, retirarlos a las 48 horas, y realizar segunda lectura a las 72-96 horas. También se puede complementar con pruebas como el ROAT (Repeat Open Application Test), una prueba sencilla, no invasiva, que se utiliza para evaluar si un producto concreto (como una crema, cosmético o medicamento tópico) está causando una DAC. Es especialmente útil en niños o cuando no es posible realizar pruebas epicutáneas estándar (3,4).
En 2015, la EAACI (European Academy of Allergy and Clinical Immunology) propuso una batería reducida de alérgenos como herramienta práctica y segura para facilitar el diagnóstico en población pediátrica (5). Con el tiempo, la experiencia clínica y nuevas evidencias han puesto de manifiesto la necesidad de considerar también alérgenos emergentes, cada vez más presentes en productos infantiles como la metilisotiazolinona aislada, hidroperóxidos de limoneno y linalol, benzofenonas, 3-dimetilaminopropilamina (DMAPA), isobornil acrilato y clorhexidina. Además, se recomienda adaptar las pruebas a la exposición individual de cada paciente y complementarlas con productos propios y alérgenos actuales, con el objetivo de optimizar la precisión diagnóstica en niños (6-8).
¿Cuáles son los alérgenos más frecuentes?
En los niños, los alérgenos más comunes que pueden causar DAC incluyen (8-13):
- Metales: como el níquel, cloruro de cobalto y dicromato potásico, presentes en objetos de uso cotidiano como bisutería, gafas, relojes, calzado, ropa, juguetes, videoconsolas, teléfonos móviles, tablets, aparatos de ortodoncia, botas, sandalias o material deportivo.
- Conservantes: destacan la metilisotiazolinona (MI) y la metilcloroisotiazolinona (MCI), que se encuentran en productos como el slime, pinturas, productos de limpieza y equipamiento deportivo. Otro conservante importante es el formaldehído, que puede estar presente en algunas toallitas infantiles.
- Fragancias: como las mezclas de fragancias I y II, el bálsamo del Perú, y los hidroperóxidos de linalol y limoneno, que se utilizan en cosméticos, medicamentos tópicos y productos de limpieza.
- Emolientes: como la lanolina y el propilenglicol, habituales en cosméticos, bálsamos labiales y medicamentos de aplicación tópica.
- Tensoactivos: derivados del aceite de coco como la cocamidopropil betaína (CAPB) y su principal fracción alergénica, la 3-dimetilaminopropilamina (DMAPA), presentes en champús, acondicionadores y detergentes.
- Parafenilendiamina (PPDA): sustancia empleada en tatuajes de henna y tintes capilares.
- Colofonia: una resina procedente de la savia del pino, utilizada en adhesivos, apósitos, tintas, cosméticos, productos farmacéuticos y material escolar.
- Antibióticos tópicos: como la neomicina y la bacitracina, ampliamente utilizados en cremas y pomadas.
Además de los alérgenos clásicos, en los últimos años se han identificado alérgenos emergentes en la población pediátrica. Entre ellos destacan la benzisotiazolinona, presente en ropa, calzado y detergentes (5); la acetofenona azina, un derivado de la goma EVA presente en espinilleras y calzado infantil (6); el isobornil acrilato (IBOA), utilizado en dispositivos médicos como las bombas de insulina (4); la benzofenona-4, presente en algunos protectores solares; y la clorhexidina, cuyo uso cada vez más frecuente en antisépticos se ha relacionado con un aumento de casos de sensibilización (8–13).
Estrategias de prevención
Una de las estrategias más prometedoras es el enfoque PEAS (Pre-Emptive Avoidance Strategy), que propone evitar desde el inicio los alérgenos más comunes en productos infantiles. Esta medida preventiva puede aplicarse incluso sin diagnóstico previo, especialmente en niños con piel sensible o antecedentes de dermatitis, para prevenir sensibilizaciones en la población pediátrica (14).
Manejo y tratamiento
El tratamiento principal es la evitación del alérgeno, una vez identificado mediante pruebas epicutáneas. Para controlar los brotes, se utilizan corticoides tópicos suaves, inmunomoduladores y emolientes para restaurar la barrera cutánea. En casos más graves, puede ser necesaria la fototerapia o tratamiento sistémico (3,4). El seguimiento debe incluir educación continua a las familias, revisión de productos y apoyo emocional, ya que un manejo adecuado mejora significativamente la calidad de vida del niño y su entorno (1,14).
Autora: Dra. Ana Láinez Nuez. Servicio de alergología, Hospital IMED Valencia. Comité de Alergia Infantil SEAIC
Bibliografía
- Neale H, Garza-Mayers AC, Tam I, Yu J. Pediatric allergic contact dermatitis. Part I. Clinical features and common contact allergens in children. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.002
- Ortiz Salvador JM, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017. doi:10.1016/j.ad.2016.12.018
- Neale H, et al. Pediatric allergic contact dermatitis. Part II. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.001
- Young K, et al. Pediatric allergic contact dermatitis registry patch testing results from 2016–2022. J Am Acad Dermatol. 2023. doi:10.1016/j.jaad.2023.01.016
- de Waard-van der Spek FB, Darsow U, Mortz CG, et al. EAACI position paper for practical patch testing in allergic contact dermatitis in children. Pediatr Allergy Immunol. 2015;26(7):598–606. doi:10.1111/pai.12463
- Ortiz Salvador JM, Esteve Martínez A, Subiabre Ferrer D, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017;108(6):571–578. doi:10.1016/j.ad.2016.12.018
- Felmingham C, Davenport R, Bala H. Allergic contact dermatitis in children and proposal for an Australian Paediatric Baseline Series. Australas J Dermatol. 2019;60(4):308–313. doi:10.1111/ajd.13169
- Yu J, Atwater AR, Brod B, et al. Pediatric Baseline Patch Test Series: Initial Findings of the Pediatric Contact Dermatitis Workgroup. Dermatitis. 2018;29(4):206–212. doi:10.1097/DER.0000000000000353
- Lidén C, White I. Increasing non-cosmetic exposure and sensitization to isothiazolinones. Contact Dermatitis. 2024. doi:10.1111/cod.14433
- Manière I, et al. Sensitization properties of acetophenone azine: a new skin sensitizer identified in textiles. Contact Dermatitis. 2023. doi:10.1111/cod.14284
- Magdaleno-Tapial J, et al. Allergic contact dermatitis to chlorhexidine in pediatric patients. Pediatr Dermatol. 2019. doi:10.1111/pde.13808
- Heurung AR, Raju SI, Warshaw EM. Dermatitis. 2014;25(1):3–10. doi:10.1097/DER.0000000000000025
- Moral L, et al. Allergic contact dermatitis to chlorhexidine in children. Allergol Immunopathol (Madr). 2024;52(6):33–39. doi:10.15586/aei.v52i6.1171
- Hill H, et al. Pre-emptive avoidance strategy (PEAS). Expert Rev Clin Immunol. 2016. doi:10.1586/1744666X.2016.1142373
Inmunología
La Alergología y las enfermedades alérgicas se generan por mecanismos de hipersensibilidad del sistema inmunitario. De la misma manera, la inmunoterapia, modalidad de tratamiento que define al alergólogo, así como los nuevos fármacos biológicos actúan modulando la respuesta del sistema inmunitario. Además, muchas de las técnicas diagnósticas del laboratorio están basadas en ensayos inmunológicos complejos. Por otro lado, algunos trastornos por inmunodeficiencia pueden asociarse con enfermedades alérgicas. De ahí la importancia de que los alergólogos dispongan de una base sólida de conocimientos en inmunología que está garantizada gracias a la importante labor de formación que realiza el Comité de Inmunología de la SEAIC. Tiene importantes vínculos científicos con el resto de los comités de la SEAIC.
| Presidenta: | María Elena Seoane Reula (Madrid) |
| Vicepresidenta: | Gabriela Andrea Zambrano Ibarra (Madrid) |
| Secretaria: | Víctor Matheu Delgado (Santa Cruz De Tenerife) |
| Miembros estables: | José Alessandro Bastidas Parlanti (Ávila) María Vanessa Chica Guzmán (Cuenca) María Marta Escribese (Madrid) Valentina Gutierrez Val De Cabrés (Valencia) Elena Izquierdo Álvarez (Madrid) Rodrigo Jiménez Saiz (Madrid) Aurora Jurado Roger (Córdoba) Moisés Labrador Horrillo (Barcelona) Luis Manso Alonso (Madrid) Almudena Matito Bernechea (Toledo) Cristobalina Mayorga (Málaga) Mariona Pascal Capdevila (Barcelona) Marina Pérez Gordo (Madrid) Marina Sabaté Brescó (Navarra) Miguel Zamorano Serrano (Madrid) Araceli Díaz Perales (Madrid) María Núñez Beltrán (Castellón) Laura Palomino Lozano (Madrid) Inmaculada Piorno González (Madrid) |
| Grupo de especial interés en hipereosinofilia: |
Dra. María Elena Seoane Reula
Dra. Gabriela Zambrano Ibarra Dra. Almudena Matito Bernechea Dr. Víctor Matheu Delgado Dr. Jose Alessandro Bastidas Parlanti Dr. Moisés Labrador Horrillo |
Actualizado el día 21/02/2024
