resultados de la búsqueda: profesionales/aviso-importante/wp-content/uploads/cme-jiaci
Dificultades diagnóstica en alergia a picadura de himenópteros
El diagnóstico de alergia a veneno de himenópteros consiste en identificar el veneno (o los venenos) responsable de causar reacción alérgica tras una picadura. Para este fin se cuentan con diversas técnicas diagnósticas como lo son las pruebas cutáneas, la determinación de IgE especifica, además de la información que proporciona el paciente sobre el insecto sospechoso.
Pero en ocasiones llegar a descubrir cual es el veneno responsable no es tan sencillo. Esto puede deberse a que: (1) el paciente no puede identificar el insecto que le ha picado, (2) las técnicas diagnósticas (pruebas cutáneas o la determinación de IgE especifica) son negativas, (3) presencia de resultados positivos a varios venenos y (4) discordancia entre el resultado de las pruebas cutáneas y los valores de IgE específica.
Para abordar estas dificultades es recomendable:
(1) Ampliar la historia clínica. Se debe de preguntar por la presencia de aguijón tras la picadura. Cuestionar si había alimentos cerca. Interrogar sobre el lugar donde sufrió la picadura (cerca de ríos, pantanos, lagos o piscinas). Recabar información sobre la presencia de colmenas próximas. Indagar sobre la visualización de nidos (terrestres o aéreos). Investigar sobre la profesión o “hobbies”. Es también muy importante conocer la región geográfica donde presentó la picadura.
(2) Optimizar las técnicas diagnósticas. Reducir el punto de cohorte de la IgE específica a 0,10 kU/L. Repetir las pruebas cutáneas o la determinación de IgE especifica pasados 1 a 2 meses. Ampliar el estudio a todos los venenos disponibles. Emplear otras técnicas diagnósticas más complejas.
(3) Diferenciar reactividad cruzada de doble sensibilización. Cuantificar alergenos especie específicos y alérgenos de reactividad cruzada. Establecer la ratio de antígeno 5 (en caso de resultados positivos para polistes y vespula). Identificar la presencia de CCD’s (en caso de resultados positivos para apis y vespula).
(4) Repetir estudio alergológico. Volver a realizar las pruebas cutáneas y determinación de IgE especifica. Valorar utilizar otro extracto diagnóstico al repetir las pruebas cutáneas. Aplicar plataformas multiplex.
Si tras haber completado todas las recomendaciones anteriores la identificación del veneno no es posible se puede intentar enviar suero del paciente a centros especializados que cuenten con la infraestructura y la experiencia para realizar técnicas diagnósticas más complejas (Test de activación de basófilos, Immunoblot o CAP-inhibición).
Lamentablemente enviar suero o derivar pacientes a otros centros no siempre es posible. A pesar de no poder establecer con una precisión del 100% el veneno (o los venenos) responsable de la reacción, el paciente subsidiario de beneficiarse de inmunoterapia específica para venenos debe recibirla. Si la reacción que presenta pone en riesgo su vida (anafilaxia) o implica un deterioro importante en su calidad de vida se le debe de administrar inmunoterapia específica contra todos los venenos identificados como probables responsables de la reacción.
Actualmente existen protocolos y guías clínicas que explican la forma en la que se debe de iniciar una doble inmunoterapia para veneno de himenópteros en aquellos pacientes que lo requieran. La administración de doble inmunoterapia es segura y confiere una buena protección en caso nuevas picaduras.
Federico de la Roca Pinzón
Médico Especialista en Alergología.
Miembro del comité de alergia a himenópteros.
¿QUÉ ES UNA REACCIÓN ALÉRGICA PERIOPERATORIA? ¿CUÁLES SON LAS CAUSAS MÁS FRECUENTES DE ESTAS REACCIONES?
Las reacciones alérgicas perioperatorias (RAP) son las reacciones alérgicas que surgen en quirófano o en el área de reanimación. La incidencia es baja, varía entre 1:353 hasta 1:18600 anestesias, sin embargo, pueden ser graves e implicar un retraso en la cirugía. Tienen un diagnóstico diferencial amplio y precisan un estudio extenso ya que hay múltiples causas que pueden simular una RAP además de recibir un gran número de fármacos en este periodo.
Las reacciones pueden surgir en cualquier momento de la anestesia, pero la mayoría, aproximadamente el 90% de ellas, aparecen en la fase de inducción. Además de los fármacos anestésicos recibidos, cualquier medicamento administrado en ese periodo (antibióticos, antiinflamatorios no esteroideos, contrastes yodados, antisépticos, látex, etc.) puede ser responsable de la RAP.
Clásicamente los relajantes musculares están descritos como la causa más frecuente de RAP y en algunos países como Francia, Noruega, Bélgica lo siguen siendo. Sin embargo, los antibióticos se han convertido en la primera causa de RAP en países como, Estados Unidos, España y el Reino Unido, siendo los betalactámicos, especialmente la amoxicilina y la cefazolina los agentes más implicados.
Anteriormente el látex era una de las principales causas, pero en la última década, debido a la mejora de la calidad del látex y a la reducción de la exposición al mismo, el número de casos ha disminuido de forma muy importante siendo anecdótica en los últimos estudios.
La clorhexidina, el desinfectante más utilizado, representa una causa relativamente frecuente de RAP en algunos países como Reino Unido o Dinamarca. Por este motivo, actualmente en muchos centros se recomienda incluir la clorhexidina en el estudio alergológico de rutina de una RAP.
Las reacciones por propofol son raras a pesar de ser el anestésico intravenoso más utilizado. También, los anestésicos locales, a pesar de su uso muy frecuente, raramente causan RAP.
Entre los fármacos utilizados para el control del dolor, los antiinflamatorios no esteroideos son otras de las causas, aunque no muy frecuentes, estando el metamizol entre los más implicados de este grupo en España.
En los últimos años se han presentado casos de RAP por excipientes y cada vez más casos por gelatinas y sugammadex.
Otras causas raras de RAP pueden ser las heparinas, el ácido tranexámico, la atropina o la oxitocina.
En conclusión, las RAP representan un problema importante para el paciente y suponen en muchas ocasiones un reto diagnóstico. Es recomendable por tanto que los hospitales tengan protocolos de actuación en esta situación que contemplen la colaboración estrecha entre alergólogos y anestesistas.
Cosmin Boteanu
Hospital Central de la Cruz Roja, Madrid.
MI HIJO ES ALÉRGICO AL MARISCCO ¿PUEDE COMER PESCADO?
INTRODUCCIÓN
La alergia a marisco es una de las alergias alimentarias más frecuentes. Es más frecuente en adultos que en niños y en éstos últimos suele debutar en la infancia tardía o adolescencia. Su prevalencia varía entre países, siendo del 1.3% en Europa en niños entre 2 y 17 años1.
CLASIFICACION TAXONÓMICA
Marisco se define como animal marino invertebrado, por ello es importante conocer su clasificación taxonómica. El marisco se divide en dos reinos: moluscos y artrópodos2-4.
- Los moluscos se dividen a su vez en los subfilos:
- Gastrópoda (abalón, caracol, lapa)
- Bivalvos (almeja, mejillón, vieira, ostra)
- Cefalópodos (pulpo, sepia, calamar)
- Los artrópodos se clasifican en los subfilos:
- Crustáceos (gamba, langosta, bogavante, nécora, cigala, langostino, buey de mar, centollo, santiaguiño)
- Queliceratos (ácaros, arañas)
- Hexópodos (cucaracha)
Los crustáceos producen reacciones alérgicas más frecuentemente que los moluscos y dentro de ellos, la gamba es el crustáceo que con más frecuencia produce reacciones alérgicas2.
REACCIONES ADVERSAS
En cuanto a las reacciones adversas al marisco, hemos de diferenciar las reacciones adversas inmunológicas de las no inmunológicas:
- REACCIONES ADVERSAS INMUNOLÓGICAS:
IgE mediadas: ocurren en las 2 horas siguientes a la ingesta del alimento. Pueden producir desde picor oral (60-95%), ronchas, inflamación facial; síntomas gastrointestinales como náuseas, vómitos, dolor abdominal (20%); síntomas respiratorios como congestión nasal, tos, dificultad para respirar o dificultad para tragar o anafilaxia (21-33%)1,2. La reacción alérgica no sólo ocurre tras la ingesta, sino que también puede desencadenarse con la inhalación de los vapores de cocción. También es importante saber que el ejercicio físico es un cofactor muy frecuente en la anafilaxia por marisco en niños1,2.
La sensibilización puede producirse bien a través de la ingesta o bien a través de la piel (sobre todo en pacientes con dermatitis atópica)2,3.
No IgE-mediadas: El Síndrome de enterocolitis por proteínas de la dieta (FPIES en inglés) por marisco en niños es poco frecuente (0,8% de los casos de FPIES) 5. Los síntomas consisten en vómitos proyectivos, repetidos, entre 1 y 4 horas de la ingesta del alimento, que pueden ir asociados a letargia, hipotensión, palidez y/o diarrea. Los síntomas se repiten cada vez que el niño toma el alimento y se resuelve una vez se retira el alimento implicado de la dieta5-6.
- REACCIONES ADVERSAS NO INMUNOLÓGICAS:
Estos animales invertebrados pueden ingerir toxinas (algas tóxicas), contaminantes o parásitos. Dependiendo de la cantidad de toxina ingerida, los síntomas y duración de la clínica varía. Los síndromes más frecuentes son los síntomas gastrointestinales (náuseas, vómitos, dolor abdominal, diarrea), intoxicación paralítica (hormigueo o adormecimiento de lengua, cuello y dedos, debilidad, dificultad respiratoria), neurotoxicidad (síntomas gastrointestinales y neurológicos, como parálisis y coma), ciguatera (síntomas neurológicos y cardiovasculares) e intoxicación amnésica (síntomas gastrointestinas seguidos de síntomas neurológicos)1.
ALERGENOS DEL MARISCO
Un alérgeno es una sustancia antigénica que induce una reacción alérgica en un organismo. Los alérgenos más importantes del marisco son1,2:
- Tropomiosina: es el principal alergeno de la alergia a gamba, ostra, caracol y calamar. También está en insectos, ácaros, insectos comestibles y anisakis simplex. Es resistente a la temperatura y a la digestión, por lo que no se degrada al cocinarlo ni con el jugo gástrico. El 90-100% de los pacientes alérgicos a un tipo de crustáceo también lo será a otros crustáceos y el 65% también tendrá alergia a moluscos. Hay estudios que demuestran que pacientes con alergia a marisco pueden tener alergia a los ácaros del polvo.
- Arginina-kinasa: también resiste altas temperaturas y es muy volátil, por lo que el vapor producido durante la cocción del marisco puede producir síntomas respiratorios. La arginina-kinasa se encuentra fundamentalmente en el camarón, cangrejo, pulpo y ácaros.
- Otros alérgenos menos relevantes son: cadena ligera de la miosina, proteína de unión al calcio sarcoplásmico, troponina C, etc.
Reactividad cruzada
- Crustáceos-moluscos: El 45% de los alérgicos a crustáceos también tienen alergia a moluscos, sin embargo, la mayoría (70-80%) de las personas alérgicas a moluscos también lo son a crustáceos1,2.
- Ácaros- crustáceos: pacientes alérgicos a ácaros pueden desarrollar alergia a marisco por reactividad cruzada. En ocasiones los síntomas tras ingesta de marisco se limitan al área orofaríngea (picor de boca, de garganta…) debido a la reactividad cruzada entre a tropomiosina de ácaros y marisco; a esto se le llama Síndrome de Alergia Oral ácaros-marisco 1-2
TRATAMIENTO
Los pacientes alérgicos a algún tipo de marisco deben evitar el consumo de todo tipo de marisco hasta que sea estudiado en Alergología1.
ENTONCES, ¿MI HIJO PUEDE COMER PESCADO?
El principal responsable de la alergia al pescado es la parvalbúmina. Es un alérgeno distinto al alérgeno principal del marisco (tropomiosina). Como diría una sabia compañera: «en lo único en que se parece el marisco y el pescado es que ambos viven en el mar». Por tanto, los pacientes alérgicos a marisco sí pueden comer pescado1.
Dra. Paloma Jaqueti Moreno. Hospital La Mancha Centro, Alcázar de San Juan, Ciudad Real. Comité de Alergia Infantil SEAIC.
BIBLIOGRAFÍA
- IgE-Mediated Shellfish Allergy in Children. Mattia Giovanini, Burcin Beken, Betul Buyuktiryaki, Simona Barni, Giulia Liccioli, Lucrezia Sarti, Lorenzo Lodi, Matteo Pontone, Irene Bartha, Francesca Mori, Cansin Sackesen, George du Toit, Andreas L Lopata, Antonella Muraro. 2023 Jun 11;15(12):2714. doi:10.3390/nu15122714.
- IgE Mediated Shellfish Allergy in Children-A Review. Ariana Giannetti, Andrea Pession, Irene Bettini, Giampaolo Ricci, Giuliana Gianni, Carlo Caffarelli. 2023 Jul 12;15(14):3112. doi: 10.3390/nu1514311
- Food allergy and hypersensitivity reactions in children and adults-A review. Sandra G Tedner, Anna Asarnoj, Helena Thulin, Marit Westman, Jon R Konradsen, Caroline Nilsson. J Intern Med. 2022 Mar;291(3):283-302. doi: 10.1111/joim.13422. Epub 2021 Dec 22
- C. Diéguez Pastor, F. Martín Muñoz, M. Reche Frutos, P.C. Vlaicu. Peculiaridades clínicas de la alergia a los alimentos de origen animal. En: Dávila, I. Jáuregui, I. Olaguibel, J. Zubeldía, J. SEAIC (Sociedad Española de Alergología e Inmunología Clínica). Tratado de Alergología tomo III. 2ª edición. Madrid: Ergon. 2016. Página 1023-1048.
- Infante S, Argiz L, Cabrera-Freitag P, Fernández-de-Alba I, Moya B, Escudero C (2022) Spanish Survey of Food Protein-Induced Enterocolitis Syndrome. J Investig Allergol Clin Immunol 2023; Vol 33(2): 134-136. doi: 10.18176/jiaci.0828
- Infante, S., Marco-Martín, G., Sánchez-Domínguez, M., Rodríguez-Fernández, A., Fuentes-Aparicio, V., Alvarez-Perea, A., … Zapatero, L. (2017). Food protein-induced enterocolitis syndrome by fish: Not necessarily a restricted diet. Allergy, 73(3), 728–732. doi:10.1111/all.13336
¿Cómo saber si soy alérgico a las picaduras de abejas y avispas?
La alergia al veneno de himenópteros (abejas, avispas, etc.) no es una enfermedad genética o de nacimiento, sino que se puede desarrollar a lo largo de la vida tras haber sufrido picaduras de estos insectos y haberse sensibilizado a ellos. El estudio alergológico está indicado en pacientes que, o bien han sufrido una reacción generalizada con alguna de estas picadura, o que presentan reacciones locales extensas y tienen una alta exposición o mala calidad de vida, con el objetivo de demostrar la presencia de sensibilización específica mediada por IgE frente al veneno del insecto responsable y valorar si son candidatos a recibir una inmunoterapia con alérgenos (vacuna). Por lo tanto, no está indicado el estudio predictivo ni preventivo en pacientes con miedo a las reacciones o con antecedentes familiares de esta alergia.
Para realizar un diagnóstico correcto, se disponen de una serie de procedimientos que explicamos a continuación:
Historia clínica
Es la herramienta fundamental. Los síntomas presentados con la picadura permiten conocer el tipo de reacción sufrida. Es decir, si se trató de una reacción local normal, local extensa, sistémica o incluso si pueden existir otras enfermedades asociadas como los síndromes de activación mastocitaria. Debe recogerse el número y la zona de las picaduras recibidas, el intervalo de tiempo entre la picadura y el inicio de los síntomas y el tratamiento que se administró en ese momento. Otro aspecto muy importante es la identificación del insecto picador. En algunas ocasiones puede parecer más evidente, aunque en otras es posible que sea ambiguo o realmente difícil. El entorno en el que se produce la picadura puede ayudar a ello, sobre todo con respecto al lugar donde sucedió, época del año, comportamiento del insecto, alimentos cercanos, persistencia del aguijón tras la picadura o presencia cercana de nidos o de colmenas. Es posible que esta información pueda sugerir el género del himenóptero, si se trataba de una avispa (Vespula, Dolichovespula, Vespa, Polistes), una abeja (Apis) o un abejorro (Bombus), entre los más habituales. Incluso, en el caso de que se pudiera haber recogido el insecto que picó, se podría aportar el ejemplar en la consulta.
El cuestionario de calidad de vida (HiCaVi), validado por nuestro comité de la SEAIC, permite evaluar este aspecto en este grupo de pacientes y apoyar la indicación de tratamiento con inmunoterapia en algunos casos.
Pruebas cutáneas
Se realizan de dos tipos: Intraepidérmicas o skin prick test, que son similares a las que se hacen en el estudio de pólenes y de otros alérgenos respiratorios ; e intradérmicas, a concentraciones crecientes seriadas. Su positividad es suficiente para demostrar sensibilización.
Pruebas de laboratorio
Mediante una analítica de sangre se pueden medir las IgE específicas frente a venenos completos, que son los anticuerpos que una persona puede generar después de recibir picaduras. Se consideran positivas a partir de 0,1 kUA/L.
El conocido como diagnóstico molecular permite detectar anticuerpos frente a alérgenos concretos para conocer la clase de proteínas que han podido causar la alergia. Es útil en el caso de que varios venenos sean positivos, con el fin de poder diferenciar entre si estamos sensibilizados de forma primaria a uno solo, a varios a la vez (cosensibilización) o si es por el fenómeno de reactividad cruzada (que es la positividad de varios pero por la composición parecida entre ellos).
El uso de otras técnicas de laboratorio más complejas como el CAP-Inhibición o el test de activación de basófilos (TAB) permiten aumentar la precisión y poder llegar a un diagnóstico definitivo.
Además, en todo paciente que haya sufrido una anafilaxia debe solicitarse una triptasa basal, que es una proteasa que puede estar elevada en algunas patologías del sistema inmunitario.
La prueba de exposición mediante repicadura controlada con el propio insecto no está indicada como método diagnóstico por motivos éticos, pero sí es un procedimiento utilizado en pacientes que ya están recibiendo una vacuna y que tiene como objetivo comprobar la eficacia de este tratamiento.
En el caso de pacientes con una historia de una reacción sistémica y un estudio temprano negativo, hay que repetir las pruebas aproximadamente 1-2 meses después, ya que existe un periodo de tiempo en el que pueden darse falsos negativos. Sin embargo, en un 15% de los pacientes con una historia sugerente de alergia no se llega a detectar IgE específica frente a venenos. Igualmente, es importante señalar que los resultados de estas pruebas no se correlacionan con la gravedad de la picadura ni con el riesgo de tener una nueva reacción generalizada posterior.
Finalmente y teniendo en cuenta lo anterior, queda de manifiesto la relevancia de ser valorado por un médico alergólogo, quien brindará a sus pacientes el diagnóstico más preciso y los mejores cuidados.
Jesús Macías Iglesias
Médico Especialista en Alergología
Miembro del Comité de Alergia a Himenópteros y Mastocitosis de la SEAIC
Bibliografía: Comité de Alergia a Himenópteros de la SEAIC. Algoritmo básico: Alergia al veneno de los himenópteros. En: Alergia a Himenópteros: Recomendaciones y algoritmos de práctica clínica de la Sociedad Española de Alergología e Inmunología Clínica. Actualización. Majadahonda (Madrid): ERGON; 2021. 11-21. ISBN: 978-84-18576-24-9
¿Debo suspender algún tratamiento para poder realizarme el estudio de alergia a medicamentos?
Ésta es una pregunta muy frecuente en las consultas de Alergología previa a la realización del estudio de alergia a medicamentos. Es importante conocer qué medicación podemos mantener el día de la prueba y cuál tendríamos que evitar. Esto es lo que se denomina período de lavado y es fundamental para eliminar el tratamiento en cuestión y que no produzca efectos que pudieran alterar o invalidar el resultado del estudio de medicamentos.
Lo primero es informar al alergólogo sobre el tratamiento que tomamos de forma habitual, la posología, motivo de prescripción y frecuencia de administración.
De forma general, podemos diferenciar entre dos tipos de tratamientos:
1. Medicamentos utilizados para patologías crónicas no alérgicas: entre ellos se incluirían medicamentos para controlar la tensión arterial, el colesterol o los triglicéridos, diabetes, coagulación, antiinflamatorios, protectores gástricos, entre otros. Todos estos medicamentos se deben mantener el día de la prueba con su pauta habitual, excepto los betabloqueantes (atenolol, bisoprolol, carvedilol, etc), que deben suspenderse el mismo día previo a la prueba, ya que pueden interferir en la respuesta de tratamientos específicos, como la adrenalina, necesarios en caso de reacción durante el estudio de alergia a medicamentos.
2. Medicamentos utilizados para patologías alérgicas: entre ellos se incluirían medicamentos como los inhaladores, antihistamínicos, corticoides orales, colirios antihistamínicos, sprays nasales, etc. En líneas generales, tanto los antihistamínicos como los corticoides sí necesitarán un período de lavado (no tomarlos) para no interferir en los resultados. Generalmente, se recomienda suspender los antihistamínicos orales o los corticoides orales o intramusculares de 5 a 7 días antes del estudio de alergia para evitar que falseen los resultados, aunque para algunos antihistamínicos de primera generación el plazo puede ser de hasta 10 días. Sin embargo, en la mayoría de los casos se recomienda un mínimo de 5 días, y siempre se debe seguir la pauta específica indicada por el alergólogo, ya que el tiempo puede variar según el tipo de antihistamínico o corticoide. En relación con sprays nasales o inhaladores, generalmente, no es necesario suspenderlos antes de realizar una prueba de alergia a medicamentos.
En resumen, es muy importante informar al alergólogo de toda la medicación que tomamos habitualmente, incluyendo pautas y dosis, de cara a obtener un resultado correcto en las pruebas de alergia a medicamentos, reduciendo, además, los riesgos para el paciente.
Ignacio García Núñez
Especialista en Alergología
Hospitales Quironsalud Córdoba y Quironsalud Campo de Gibraltar
La alergia a veneno de himenópteros, ¿se cura?
Se estima que entre el 56-94 % de la población general padecerá una picadura de himenóptero (abejas y avispas). Según algunos estudios epidemiológicos, en Europa entre el 0,3 y el 7,5 % de la población adulta, y el 3,4 % de los niños, puede padecer una reacción alérgica generalizada tras la picadura de un avispa o abeja, y entre el 2,4-26,4% podrían presentar reacciones alérgicas locales. La población rural presenta un riesgo superior por el hecho de estar más expuesta a las picaduras de estos insectos.
El tratamiento principal para las personas alérgicas es la inmunoterapia (IT) con veneno de himenóptero, también conocida como “vacuna para la alergia”. La IT consiste en administrar de forma subcutánea pequeñas cantidades del alérgeno de forma gradual (fase de inicio y de mantenimiento) para que el sistema inmunológico se “acostumbre” y reduzca su reacción.
La eficacia de la inmunoterapia específica, o vacunación con extractos de veneno de himenópteros, está ampliamente demostrada. La IT a veneno de himenópteros es muy efectiva para reducir los síntomas alérgicos y mejorar la calidad de vida de las personas sensibilizadas alérgicas a estos insectos. Actualmente es el único tratamiento capaz de prevenir futuras reacciones sistémicas, y está indicada en niños y adultos que hayan padecido alguna reacción generalizada moderada o grave, con síntomas cutáneos y respiratorios o cardiovasculares, y siempre que se demuestre un mecanismo dependiente de la Inmunoglobulina E (IgE). La IT también se puede considerar en adultos con solo síntomas cutáneos, pero con alto riesgo de exposición y/o empeoramiento de su calidad de vida. La duración convencional del tratamiento es de 3 a 5 años. La eficacia de la inmunoterapia varía de persona a persona, pero en general se ha demostrado que es altamente efectiva hasta en un 97% de los casos, consiguiendo la reducción de los síntomas y prevención de reacciones graves. El efecto terapéutico es duradero, de modo que incluso 10 años después de la finalización de la IT alrededor del 90 % de los pacientes sigue estando protegido.
Es importante tener en cuenta que la IT es un tratamiento a largo plazo que requiere un compromiso y seguimiento adecuados. Debe ser administrada bajo la supervisión de alergólogos en una unidad de inmunoterapia y se realiza en etapas, comenzando con dosis bajas e incrementándolas gradualmente hasta llegar al mantenimiento (dosis fija mensual o cada dos meses). Además, es fundamental seguir tomando precauciones para evitar picaduras, como usar ropa protectora y evitar áreas donde suelen encontrarse estos insectos. Sin embargo lo más importante es portar un kit de emergencia con adrenalina auto inyectable hasta que se alcance el mantenimiento con la vacuna.
Javier Pereira
Médico Especialista en Alergología
Miembro del Comité de Alergia a Himenópteros y Mastocitosis de la SEAIC
Administración de inmunoterapia subcutánea: mucho mas que una inyección subcutánea: La Enfermera de Alergología te lo explica.
Cuantas veces nos han preguntado “¿Eres la enfermera/o de alergia? ¿La que pone las vacunas no?”.
 Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
El paciente acude a nuestra consulta con la incertidumbre ante lo desconocido, a pesar de haber recibido información el día de la prescripción del tratamiento por el alergólogo/a, sobre el procedimiento y sus riesgos.
Es importante que nos presentemos, que conozca nuestro nombre, y le indiquemos que somos las enfermeras/os responsables de la administración del tratamiento. Es muy importante que el paciente se encuentre tranquilo.
Así mismo, procederemos a resolver aquellas dudas que pueda tener acerca de la inmunoterapia (IT) específica de alergia, además de informarle que este tratamiento consta de dos fases:
- Fase de Inicio: Donde se irá incrementando de forma periódica la dosis/concentración de la vacuna, comprobando la tolerancia a la misma. En esta fase deberemos preguntar siempre si han tolerado bien la dosis anterior y si han sufrido algún tipo de reacción en su domicilio (reacción tardía).
- Fase de Mantenimiento: Donde se habrá alcanzado la dosis terapéutica que se continuará administrando de forma periódica.
Respecto a la administración del tratamiento, como responsables de su administración, deberemos comprobar siempre:
- Que la vacuna que nos entrega el paciente es la que ha prescrito su alergólogo.
- Que corresponde con el nombre del paciente, ya que están identificadas nominalmente.
- La fecha de caducidad.
- Que se ha conservado en nevera (entre 2 y 8 ºC teniendo especial cuidado que no se congele, pues se inactiva y pierde sus propiedades terapéuticas), y trasportada en bolsa térmica .
Procederemos a realizar la valoración de enfermería, recogiendo información sobre su estado de salud:
- Si se encuentra sin síntomas de infección activa (fiebre).
- Si no está presente un episodio agudo (crisis) de su enfermedad alérgica: asma mal controlada o rinoconjuntivitis alérgica.
- Si se encuentra en tratamiento con antibióticos. En cuyo caso se postpondrá la administración hasta su recuperación .
- Si ha recibido en los últimos 7-10 dias vacunas de virus atenuados (gripe, covid…). Como norma general es el intervalo de tiempo mínimo que se recomienda para la administración de la IT específica de alergia.
A continuación procederemos a la toma de constantes vitales (tensión arterial, frecuencia cardiaca, saturación de oxígeno y temperatura) y a la administración del tratamiento de IT específica de alergia siguiendo el protocolo establecido.
Los pacientes deben saber:
- Que tras la administración de su vacuna deben estar un tiempo mínimo de 30 minutos en nuestro servicio de alergia (o Centro de Salud), con el fin de comprobar que ha tolerado bien su IT, y que no han aparecido reacciones adversas inmediatas (por su seguridad).
- Que las reacciones adversas más frecuentes que pueden aparecer son: Enrojecimiento y picor (prurito) en la zona de administración.
- La presencia de síntomas como tos, falta de aire (disnea), aparición de eritemas (zonas enrojecidas en la piel), picor en palma de manos o síntomas exacerbados de su alergia deben ser comunicados inmediatamente para actuar de manera precoz.
- Que la IT especifica de alergia NO sustituye al tratamiento pautado por su alergólogo/a en referencia a antihistamínicos, colirios, inhaladores o nebulizadores nasales. Es un tratamiento conjunto.
- Que no deben practicar ejercicio físico intenso, coger peso, ir a saunas/piscinas cubiertas (ambientes húmedos y cargados) al menos en las 4 primeras horas de la administración de ITSC.
- Que deben informar de la aparición de reacciones tardías (en su domicilio): Aumento de eritema en zona de administración (recomendaremos que se realicen fotos), o cualquier otro síntoma que hayan podido experimentar.
- Que los beneficios de la IT específica de alergia se consiguen a medio/largo plazo y por ello, es necesario que los pacientes acudan a las revisiones programadas por sus alergólogos/as, para valorar la evolución con del tratamiento y si es oportuno continuar con el tratamiento o suspenderlo.
DESAFÍO DIAGNÓSTICO DE LA ALERGIA A AINE EN NIÑOS
Según Alergológica 2015, un estudio epidemiológico de referencia sobre las enfermedades alérgicas en España la alergia a medicamentos fue el motivo de consulta en el 18,7% de los casos, y en particular en niños en el 9%. En los niños, las enfermedades exantemáticas son frecuentes y muchas veces no se puede discernir que la causa de las lesiones cutáneas sean los fármacos o la propia enfermedad. Siendo los antiinflamatorios no esteroideos (AINE) los segundos medicamentos que más frecuentemente causan reacciones alérgicas en niños. Un alto porcentaje de niños que han presentado alguna reacción donde hubiese implicado un AINE, los evitan sin ningún estudio.
Las reacciones asociadas a los AINE se dividen principalmente en dos tipos: agudas (reacción inmediata o reacción hasta varias horas después de la exposición) y retardadas (más de 24 horas después de la exposición). Las reacciones agudas a los AINE pueden ser selectivas (mecanismo inmunológico) o inducidas por múltiples AINE (reactividad cruzada, no inmunológicas), siendo estas últimas las más comunes en niños.
Hasta la fecha los estudios relacionados con reacciones alérgicas a los AINE en niños son limitados. Como variables predictoras encontramos una reacción sugestiva en los primeros 60 minutos y 2 o más reacciones con distintos AINE implicados. No queda claro si se podría involucrar a la genética como variable: algunos estudios apuntan el antecedente de padres alérgicos a AINE como un factor de riesgo.
En niños, entre los fármacos más frecuentemente implicados se encuentran el Ibuprofeno y derivados del ácido propiónico, junto al Paracetamol por ser los más utilizados. Las reacciones adversas a AINE en lactantes y preescolares son menos frecuentes, lo que se atribuye a su menor consumo.
Para no catalogar a los niños de alérgicos a fármacos que le serán imprescindibles en el futuro es importante realizar un estudio alergológico, en el que la prueba definitiva es la prueba de exposición controlada para determinar el tipo de alergia selectiva o reactividad múltiple, y en caso de confirmarse ésta última probar otros AINE alternativos. Las pruebas cutáneas solo son de utilidad en determinados casos de alergia selectiva.
Recientemente se ha publicado un trabajo interesante que insiste en la importancia de la valoración alergológica, sobre todo de cara a la evolución de la alergia ya que una proporción importante de niños con reacciones por reactividad múltiple tolera los AINE tras ser reevaluados a los 6 años (Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs). Dicha reevaluación es crucial considerando el gran número de niños que podrían estar evitando los AINE. Esto unido a que condiciones comórbidas como infecciones, fiebre o el uso concomitante de otros fármacos podrían causar los síntomas en estos pacientes nos hacen concluir que la historia detallada y las pruebas de provocación farmacológica son fundamentales para un diagnóstico definitivo de alergia a los AINE en niños.
Paula Méndez. Complexo Hospitalario Universitario de Santiago de Compostela. Comité de Alergia Infantil SEAIC
Biliografía:
- Erdem Topal 1, Mehmet Halil Celiksoy, Ferhat Catal, Yekbun Gamze Sayan, Recep Sancak The value of the clinical history for the diagnosis of immediate nonsteroidal anti-inflammatory drug hypersensitivity and safe alternative drugs in children.. Allergy Asthma Proc. Jan-Feb 2016;37(1):57-63. doi: 10.2500/aap.2016.37.3917.
- Yilmaz I. H. Ertoy Karagol A. Bakirtas E. Topal G. E. Celik M. S. Demirsoy I. Turktas Challenge‐proven nonsteroidal anti‐inflammatory drug hypersensitivity in children. Allergy. 2013 Dec;68(12):1555-61. doi: 10.1111/all.12266. Epub 2013 Oct 11.
- Hakan Guvenir 1, Emine Dibek Misirlioglu, Emine Vezir, Muge Toyran, Tayfur Ginis, Ersoy Civelek, Can N Kocabas Nonsteroidal anti-inflammatory drug hypersensitivity among children. Allergy Asthma Proc. Sep-Oct 2015;36(5):386-93. doi: 10.2500/aap.2015.36.3858.
- Sánchez-Borges M, Kidon M.Reactions to nonsteroidal anti-inflammatory drugs in children. J Allergy Clin Immunol Pract. 2018; 6(4):1236-7.
- Kidon M, Blanca-López N, Gomes E, Terreehorst I, et al.EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal antiinflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018; 29(5):469-80
- J Quiralte 1, R Avila-Castellano, S Cimbollek. A phenotype‐based classification of NSAIDs hypersensitivity: new patients, new challenges. Allergy 2014 Jun;69(6):814-5. doi: 10.1111/all.12377
- Inmaculada Doña, Natalia Pérez-Sánchez, Ibon Eguiluz-Gracia, Rosa Muñoz-Cano, Joan Bartra, María José Torres, José Antonio Cornejo-García. Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Allergy. 2020 Mar;75(3):561-575.
Acta Reunión Comité Alergia Cutánea SEAIC 18/Octubre/2012, Pamplona
![]() Contenido disponible sólo para socios.
Contenido disponible sólo para socios.
¿Debe suspenderse el tratamiento antiasmático durante el embarazo y la lactancia?
En general, se recomienda evitar el empleo de fármacos durante el embarazo, dado el riesgo de malformaciones. Sin embargo, en una mujer asmática embarazada es muy importante obtener un adecuado control de la enfermedad, ya que una crisis puede ser causa de un importante sufrimiento del feto por falta de oxígeno. Si para alcanzar este control es necesario el uso de medicación, no debe suspenderse ni demorarse su administración.
Enterocolitis por proteínas de la dieta en adultos, ¿es realmente una entidad poco frecuente?
En los últimos años asistimos a un incremento muy importante en el diagnóstico y conocimiento de la enterocolitis inducida por proteínas de la dieta (FPIES, del acrónimo en inglés). Aunque se trata de una entidad inicialmente descrita en la edad pediátrica, cada vez observamos más casos en la población adolescente y adulta. En una encuesta realizada en EEUU en el año 2019, se observó que esta entidad puede afectar al 0.22% de la población adulta de este país, si bien desconocemos los datos en nuestro entorno.
En la población pediátrica, el cuadro clínico se caracteriza por la aparición entre 1-4 horas después de la ingesta de vómitos repetitivos, diarrea, decaimiento, flacidez, letargo y en casos severos puede acompañarse de deshidratación y shock. Los alimentos implicados habitualmente en la edad infantil son la leche soja, huevo y cereales. Sin embargo, esto varía en función de la localización geográfica ya que depende mucho de los hábitos dietéticos, por ejemplo, en nuestro país uno de los alimentos más frecuentes, después de la leche y el
huevo, es el pescado.
Por lo que respecta a la población adulta, vemos cada vez con mayor frecuencia en las consultas de Alergología, pacientes que tras la ingesta de marisco, pescado o huevo refieren la presencia de dolor abdominal de tipo cólico, acompañado de diarrea, vómitos y en ocasiones, decaimiento. En muchos casos los enfermos son diagnosticados erróneamente de gastroenteritis aguda o intoxicación alimentaria.
El hecho de que el estudio alergológico (pruebas cutáneas y determinaciones analíticas) sea negativo, así como un periodo de latencia entre la ingesta y la aparición de síntomas más largo que en la alergia mediada por IgE (alergia
típica) junto con la ausencia de síntomas cutáneos y respiratorios, hace que sea difícil su diagnóstico. A esto se suma, que en muchas ocasiones el paciente se limita a evitar la ingesta del alimento implicado y no solicita
valoración médica. Estamos por tanto, ante una entidad infradiagnosticada, en la que la prevalencia es mucho mayor de la que se presupone.
A toda esta complejidad se suma el hecho de que muchos pacientes presentan síntomas con distintos grupos de alimentos (por ejemplo: marisco y pescado, leche y huevo, etc.).
La evolución también varía en función de la edad de presentación. Si el inicio es en la infancia, la evolución es favorable alcanzando la tolerancia con el paso del tiempo, sin embargo, cuando este cuadro aparece en la edad adulta tiende a la cronificación.
En la actualidad no existen biomarcadores que apoyen el diagnóstico, por lo que este se realiza en base a unos determinados síntomas (que varían en función de la edad de presentación) con un amplio diagnóstico diferencial.
Debido a esto, es muy importante que el médico sea conocedor de esta patología para poder llegar a un diagnóstico correcto. En los casos en los que el diagnóstico no esté claro, se puede recurrir al test de exposición controlado,
que debe realizarse siempre en un medio hospitalario con el material necesario y personal entrenado, prácticas habituales en las Consultas de Alergología.
El tratamiento se basa en la evitación del alimento o alimentos implicados y para el episodio agudo se recomienda la reposición de líquidos (en muchos casos por vía intravenosa) y el ondasetrón, que al ser un antagonista selectivo del receptor de la serotonina (5-HT3) en el intestino resulta muy eficaz para paliar los vómitos y la diarrea. La adrenalina no está indicada porque el mecanismo inmunológico subyacente no está mediado por la IgE.
Además, se recomienda seguimiento alergológico para valorar la posible aparición de nuevos alimentos implicados o confirmar si se ha alcanzado la tolerancia, a través de los test de exposición controlada.
Aunque en los últimos años ha aumentado considerablemente el número de publicaciones científicas sobre esta patología, son necesarios más estudios que ayuden a confirmar la verdadera prevalencia de esta entidad, así como para conocer los mecanismos inmunológicos subyacentes y el desarrollo de biomarcadores diagnósticos.
Ana Entrala Bueso. Hospital Paz Research Institute (IdiPaz). Madrid
Purificación Gonzalez-Delgado. Hospital General Universitario. Alicante
“BLOG” DEL COMITÉ DE INMUNOLOGIA CLINICA COMO FORO DE INFORMACION Y DISCUSION DE TEMAS DE ACTUALIDAD. MARZO 2012
ACTUALIZACIONES BASICAS EN PATOLOGIA ALERGICA
En este blog sobre “Actualizaciones básicas en la patología alérgica” queremos comentar un articulo publicado hace aproximadamente un año en el J Allergy Clin Immunol que nos parece relevante no solo por su contenido básico sino también por su diseño y elaboracion. La hipótesis de trabajo consiste en la posibilidad de que los niños alérgicos pueden tener alterada su capacidad de respuesta inmunológica “natural” frente a determinados componentes bacterianos, lo que daría lugar a una desviación en la maduración del sistema inmunológico, que impide el viraje de la respuestas neonatales con predominio Th2 hacia el predominio de las respuestas Th1 de la edad adulta.
El trabajo en cuestión ha sido realizado en Perth por la Prof. Meri Tulic ![]() , University of Western Australia, en la School of Paediatrics and Child Health (SPACH) y dirigido por la Prof. Susan L. Prescott
, University of Western Australia, en la School of Paediatrics and Child Health (SPACH) y dirigido por la Prof. Susan L. Prescott ![]() , destacada alergóloga con excelentes publicaciones en el campo de la alergia básica y clínica, formada en la escuela del Prof. Patrik Holt, en la misma Universidad de Perth.
, destacada alergóloga con excelentes publicaciones en el campo de la alergia básica y clínica, formada en la escuela del Prof. Patrik Holt, en la misma Universidad de Perth.
La investigación se realizó en colaboración con diferentes Centros y Universidades de Suecia y Reino Unido: Tulic MK, Hodder M, Forsberg A, McCarthy S, Richman T, D’Vaz N, van den Biggelaar AH, Thornton CA, Prescott SL. Differences in innate immune function between allergic and nonallergic children: new insights into immune ontogeny. J Allergy Clin Immunol. 2011 Feb;127(2):470-478.
El reconocimiento bacteriano por el sistema inmune “natural” o innato depende del buen funcionamiento de los receptores Toll que existen en determinadas células del sistema linfo monocitario (Fagocitos mononucleares, linfocitos B, células dendríticas, mastocitos y otras). Estos receptores, alertan al sistema inmune sobre la presencia de los microbios, que detectan reconociendo los antígenos microbianos. El reconocimiento por los receptores Toll y la correspondiente activación celular pone en marcha la defensa primaria o “natural” y en definitiva, representa la primera barrera de los organismos frente a la invasión bacteriana.
El trabajo de Meri Tulic es un estudio caso-control en el que se analiza la respuesta de la inmunidad “natural” o “innata” frente a diferentes productos microbianos que son ligandos de los receptores Toll, como el lipopolisacarido bacteriano o LPS de E. coli o componentes de las membranas bacterianas como el acido lipoteicoico o las partículas de zimosan o bien oligonucleótidos CpG´s no metilados y otros mas, de forma, que cada uno de esos ligandos es especifico para un tipo concreto del repertorio de los receptores Toll, y una vez reconocido el ligando por su correspondiente receptor, se transmite la señal para la activación de la célula correspondiente y la liberación de las citocinas proinflamatorias.
El análisis de activación celular se realizo en 35 niños alérgicos seguidos desde el nacimiento hasta la edad de 5 años, frente a otros 35 controles sanos, en similares circunstancias. Se han estudiado las dos vertientes de la respuesta inmune la “natural” o innata y la “adquirida” o “adaptativa” Para la primera, se estimularon las células mononucleadas de los pacientes con los ligandos citados anteriormente, específicos de los receptores Toll (TLR 2, 3, 4, 2-6, 7/8, y 9) y para la segunda se utilizó la estimulación celular in vitro con antígenos o alérgenos específicos como ácaros y albumina de huevo (OA). Lógicamente, la respuesta que se mide en cada caso es diferente.
En el primero o inmunidad “natural” se mide la síntesis in vitro de citocinas dependientes de TLR´s como la IL-1 beta, IL-6 y el TNF alfa. Por el contrario, para analizar el funcionamiento de la inmunidad “adquirida” o adaptativa, se mide la síntesis de IFN gamma y de IL-13, por las células mononucleares después de la estimulación antígeno específica y mitógenos. En la valoración de las respuestas no solo se analizaron las citocinas solubles sino además se realizó citometria de flujo para cotejar la correspondiente activación celular como consecuencia de la estimulación de los receptores TOLL en las células mononucleares.
Los resultados indican que los niños sanos tienen al nacer una débil respuesta “innata” o “natural”, con escasa producción de IL-1 beta y otras citocinas de la inmunidad “natural”. Con el paso del tiempo, esa respuesta “natural” madura, asemejándose a la de los adultos sanos, además, paralelamente y como consecuencia de esa buena maduración de la respuesta “natural”, la otra respuesta llamada “adquirida” o adaptativa vira hacia un predomino Th1 que es la que prevalece en los sujetos normales adultos. La respuesta normal “adquirida” inducida por alérgenos a los cinco años, será pues de tipo Th1 con predominio de la producción in vitro de interferón gamma. Por el contrario, los niños alérgicos tienen una respuesta “innata” o natural exagerada, ya desde el nacimiento, que es similar o mayor que la de los adultos, pero a lo largo de los primeros años, hay un empobrecimiento de esa respuesta a los ligandos de los TLR ´s, siendo considerablemente menor que la obtenida en los controles sanos a los cinco años. Hay por tanto, en los alérgicos, una respuesta “natural” inicial exageradamente alterada, para deprimirse y deteriorarse a lo largo del desarrollo hacia los cinco años. Se produce una parada en la maduración de la respuesta “adquirida” anti alérgenos , y por tanto, no hay viraje del entorno Th2 de la época prenatal a Th1 como ocurre en los sanos.
Hay unas bases celulares para explicar el que una maduración alterada de la inmunidad “natural” antimicrobiana puede producir una mala respuesta “adquirida” frente a los alérgenos, especialmente, en niños genéticamente predispuestos a las enfermedades alérgicas. Además no solo las células T reguladoras están afectadas sino que en los niños alérgicos hay una mayor expresión de receptores Toll en las células dendríticas plasmocitoides con un incremento en la síntesis de IL-6 y con el consiguiente deterioro en la maduración de las T reguladoras: Dominitzki S, Fantini MC, Neufert C, Nikolaev A, Galle PR, Scheller J, Monteleone G, Rose-John S, Neurath MF, Becker C Cutting edge: trans-signaling via the soluble IL-6R abrogates the induction of FoxP3 in naive CD4+CD25 T cells. J Immunol. 2007 Aug 15;179(4):2041-5.
La modulación de la respuesta alérgica relacionada con la interacción con los agentes microbianos no se limita a la maduración del sistema inmune que condiciona la tendencia a la génesis de la enfermedad alérgica, sino también, es importante por su papel en la rama efectora de la respuesta inflamatoria, previniendo la inflamación eosinofilica que ocurre en el asma bronquial y disminuyendo la hiperreactividad bronquial. Hay un trabajo reciente que utilizando un modelo murino de asma bronquial, demuestra como la infección por H pylori previene la inflamación asmática por inducción de linfocitos T reguladores: Arnold IC, Dehzad N, Reuter S, Martin H, Becher B, Taube C, Müller A. Helicobacter pylori infection prevents allergic asthma in mouse models through the induction of regulatory T cells. J Clin Invest. 2011 Aug;121(8):3088-93. Los efectos beneficiosos (tolerancia inmunológica) sobre la prevención del asma bronquial se manifiestan con mayor intensidad cuando los ratones son infectados con H pylori en el periodo neonatal. El trabajo es un análisis exhaustivo y muy demostrativo desde el punto de vista de la inflamación asmática y su prevención por la infección no solo a nivel histológico sino también molecular.
Obviamente por estos dos trabajos que comentamos en este blog da la impresión que estamos revisitando la “teoría de la higiene” que como es sabido, sostiene que la exposición temprana a los antígenos microbianos es esencial para la prevención de las enfermedades alérgicas. Esto es así, pero querríamos dejar conciencia de que al ser una enfermedad multifactorial no es este aspecto el único ni el mas importante, que modula la aparición de la enfermedad. (Platts-Mills TA, Erwin E, Heymann P, Woodfolk J. Is the hygiene hypothesis still a viable explanation for the increased prevalence of asthma? Allergy. 2005;60 Suppl 79:25-31.)
En algún momento, tendremos que centrar nuestros esfuerzos en una investigación a fondo sobre el papel de las vacunas bacterianas, que en los años 40-50 tuvieron su preponderancia en la alergia, pero que por influencia de la escuela anglosajona, se dejaron de utilizar, incluso fueron denostadas, posiblemente con razón, por falta de los conocimientos científicos adecuados en aquellos tiempos. Es ahora, con todos estos efectos que se han demostrado de la modulación con los productos bacterianos (LPS?) de la respuesta inmunológica, cuando merecería la pena realizar un esfuerzo para aconsejar o no la utilización de estos productos, revisitando los conocimientos, siempre con bases científicas actualizadas por el conocimiento moderno del sistema inmunológico y su modulación por los microbios y sus productos.
LAS INMUNODEFICIENCIAS ASOCIADAS A AGENTES BIOLÓGICOS INMUNOMODULADORES COMO FENOCOPIAS DE LAS INMUNODEFICIENCIAS PRIMARIAS
http://www.thehistoryblog.com/archives/14881
En nuestro sistema sanitario, las consultas de Inmunología atienden principalmente pacientes con una respuesta inmunitaria deficiente. Las inmunodeficiencias primarias (IDP) asociadas a errores innatos de la inmunidad son una causa importante de estas consultas, pero no la única. En la práctica clínica, en la mayoría de los casos, habrá que buscar una causa secundaria de la misma.
Las inmunodeficiencias primarias se incluyen bajo el concepto más global de errores innatos de la inmunidad (EII), que representa un grupo de más de 485 enfermedades definidas genéticamente (1). La inmunodeficiencia secundaria (IDS) podría definirse como una alteración transitoria o persistente de la función de las células o tejidos del sistema inmunitario, causada por factores extrínsecos al mismo (2). Estos grupos de factores incluyen agentes ambientales, malnutrición, trastornos metabólicos, uso de medicamentos inmunosupresores e inmunomoduladores, infecciones crónicas, neoplasias malignas, traumatismos graves o simplemente el envejecimiento. El enfoque inicial recomendado para la valoración de una IDS sigue las mismas directrices que en el caso de las IDP. Los hallazgos de la historia clínica, en particular los patrones de infecciones, y los hallazgos en la exploración física son esenciales para guiar la evaluación del sistema inmunitario.
Dentro de las causas de IDS, la generalización del uso de agentes biológicos inmunomoduladores para tratar enfermedades autoinmunes, inflamatorias o neoplasias hematológicas en las últimas dos décadas, se ha acompañado de un mayor riesgo de infecciones e inmunodeficiencias secundarias (3); el abordaje de este importante tema en una entrada a un blog es complicado como revisión sistemática, así que optaré por una exposición narrativa.
Examinar qué enfermedades infecciosas acompañan a una determinada inmunodeficiencia primaria ha permitido obtener información valiosa sobre los componentes del sistema inmunológico que son claves en la respuesta frente a microrganismos particulares. Gracias a ello sabemos que los defectos en moléculas críticas en la ontogenia, activación y proliferación de los linfocitos T, como las mutaciones en el gen IL2RG del cromosoma X humano, que codifica la cadena gamma común (γc) del receptor de interleucina-2 (IL-2R), o una inactivación mutación en la quinasa Jak3, que se asocia físicamente con γc, causan una depleción profunda en la función del sistema inmune, que de forma sindrómica se denomina Inmunodeficiencia combinada severa. Los defectos en el desarrollo de las células B, como la mutación en el gen que codifica una proteína tirosina quinasa llamada BTK (tirosina quinasa de Bruton), que transduce la señal a través del receptor de células pre-B, provocan deficiencias en la producción de anticuerpos que causan una incapacidad para eliminar bacterias extracelulares y algunos virus cuya eliminación eficaz requiere anticuerpos específicos.
Es instructivo considerar los defectos inmunológicos en el contexto de los principales tipos de inmunidad afectada, ya que estos pueden conducir a distintos patrones de infección y enfermedad clínica.
Las terapias biológicas no causan La inmunosupresión global característica de la terapias inmunosupresoras clásicas como los glucocorticoides, azatioprina, metotrexato o ciclosporina (4). Del mismo modo a cómo actúan las mutaciones específicas en cada IDP, las terapias biológicos se dirigen selectivamente a células y vías del sistema inmunitario para lograr efectos terapéuticos específicos, pudiéndose comportar en ciertos casos como fenocopias de la IDP original.
Por ejemplo, el OKT3 (muromonab-CD3) es un anticuerpo monoclonal IgG2 murino que se une a la cadena CD3-epsilon del complejo receptor de células T-CD3 y produce una linfopenia rápida y profunda de las células T (4). Como cabría esperar, la inmunosupresión asociada provoca una mayor susceptibilidad a las infecciones, en particular por virus herpes y bacterias. Igualmente, Alemtuzumab (anti-CD52) es un anticuerpo monoclonal humanizado utilizado para la terapia de inducción del trasplante de órganos sólidos, depletor de células T.
Basiliximab es un monoclonal contra la cadena alfa del receptor de la interleucina (IL)-2 (CD25). La activación de las células T conduce normalmente a una regulación al alza del receptor de IL-2 de alta afinidad que implica la expresión de la cadena alfa del receptor de IL-2 (CD25) que se asocia con las cadenas beta y gamma del receptor de IL-2. Basiliximab inhibe la generación de células T citotóxicas antígeno-específicas.
Las células T necesitan dos señales para activarse. La primera implica la unión directa del receptor de antígeno de la célula T (TcR) con el complejo formado por el péptido antigénico y determinadas moléculas de superficie (moléculas HLA), presentado por las células presentadoras de antígeno (APC). La segunda señal implica vías coestimuladoras específicas. El CD28 de las células T se une a sus ligandos, el CD80 (B7-1) y el CD86 (B7-2), en las APC. La presencia de ambas señales proporciona una señal de activación a las células T. Por el contrario, la molécula CTLA-4 en las células T compite por la unión a las mismas moléculas CD80/CD86, y esta interacción provoca la supresión de la activación. Abatacept y Belatacept son proteínas de fusión del dominio extracelular de CTLA-4 humano unido a una porción Fc modificada de IgG1 humana (CTLA-4-Ig), que interfieren la activación de las células T interrumpiendo la coestimulación CD28. Abatacept no obstante tiene un perfil de seguridad bien establecido en diferentes ensayos y metanálisis. Belatacept por su parte, con mayor capacidad de unión a CD80/CD86, no debe administrarse a pacientes con serología de VEB negativa candidatos a trasplante de un donante con serología VEB positiva, por el mayor riesgo de desarrollar trastornos linfoproliferativos asociados a VEB (4).
Las Janus quinasas (JAK) son una familia de tirosina quinasas no receptoras, cruciales en el desencadenamiento de las señales generadas por el receptor de diversas citoquinas y transducidas aguas abajo a través de las proteínas STAT (transductoras de señales y activadoras de la transcripción). Las STAT fosforiladas se disocian de sus subunidades receptoras y se translocan al núcleo celular para regular la transcripción génica. La familia JAK se compone de cuatro miembros: JAK1, JAK2, JAK3 y tirosina quinasa 2 (Tyk2). Tofacitinib, inhibidor JAK aprobado para la artritis reumatoide que actúa principalmente sobre JAK1 y JAK3, se ha asociado con un mayor riesgo de infección por herpes zoster (4).
Con respecto a las células B, Ibrutinib es una pequeña molécula inhibidora de la tirosina quinasa de Bruton (BTK). El ibrutinib se une a la actividad de la BTK y la inhibe de forma irreversible, impidiendo así tanto la activación de las células B como la señalización mediada por éstas. La BTK es necesaria para la señalización del receptor de células B, desempeña un papel clave en la maduración de las células B. Se han descrito casos de neutropenia e hipogammaglobulinemia. Igualmente, Idelalisib interrumpe la señalización del receptor de células B, de forma similar a ibrutinib, aunque a través de la inhibición de la isoforma delta de la fosfatidilinositol 3-cinasa. Idelalisib se asocia a un aumento de las infecciones oportunistas (4). Belimumab por su parte, es un anticuerpo monoclonal humano que se une al BlyS humano soluble e inhibe su actividad biológica. Está aprobado para el tratamiento de pacientes con LES. La celulitis y la neumonía son las infecciones graves más frecuentes (4).
Pero sin duda, la familia de biológicos con más impacto en la casuística de las consultas de inmunodeficiencias son los anti CD20 y en particular, rituximab. Este anticuerpo monoclonal quimérico (Ig)G1 CD20 específico actúa sobre las células B desde la fase pre-célula B hasta la fase pre-célula plasmática. Rituximab agota las células B de la sangre periférica, y su normalización posterior suele requerir de seis a nueve meses o más, con una variabilidad significativa entre pacientes. Con las células B deplecionadas, la capacidad del paciente para responder a las vacunas, en particular de polisacáridos, se ve afectada. Además, es frecuente cierto grado de hipogammaglobulinemia transitoria, que en algunos pacientes es persistente y significativa clínicamente, dando lugar a infecciones que requieren profilaxis antibiótica y/o terapia sustitutiva (4).
Así, hasta un largo etcétera de terapias biológicas que actúan selectivamente sobre la vía de diferentes citoquinas (interleuquina 6, interleuquina 1, factor de necrosis tumoral alfa, interleuquinas 4 y 13, interleuquina 17), integrinas (alfa-4 integrinas, CD11 alfa), o proteínas del complemento, entre otros, bloqueando con una precisión quirúrgica el normal funcionamiento del sistema inmune.
Disponemos de evidencias y de herramientas para tratar de disminuir el riesgo de IDS asociado al uso de medicamentos biológicos. Este riesgo se debe prevenir con profilaxis antibiótica adecuada, y se debe prever mediante una planificación del programa de vacunación adaptada al tipo de defecto en la respuesta inmune descrito para el fármaco.
Igualmente, las recomendaciones en cuanto a vacunación de pacientes en grupos de riesgo, tanto centrales como de las comunidades autónomas, deberían estar actualizadas acorde a la evidencia disponible e integrar la opinión de expertos con conocimiento en el funcionamiento del sistema inmune y en el mecanismo de acción de estos fármacos.
REFERENCIAS
- Tangye SG, Al-Herz W, Bousfiha A, Cunningham-Rundles C, Franco JL, Holland SM, Klein C, Morio T, Oksenhendler E, Picard C, Puel A, Puck J, Seppänen MRJ, Somech R, Su HC, Sullivan KE, Torgerson TR, Meyts I. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022 Oct;42(7):1473-1507. doi: 10.1007/s10875-022-01289-3. Epub 2022 Jun 24. PMID: 35748970; PMCID: PMC9244088.
- Tuano KS, Seth N, Chinen J. Secondary immunodeficiencies: An overview. Ann Allergy Asthma Immunol. 2021 Dec;127(6):617-626. doi: 10.1016/j.anai.2021.08.413. Epub 2021 Sep 3. PMID: 34481993.
- Cannon L, Pan A, Kovalick L, Sarkissian A, Wu EY. Secondary immunodeficiencies and infectious considerations of biologic immunomodulatory therapies. Ann Allergy Asthma Immunol. 2023 Jun;130(6):718-726. doi: 10.1016/j.anai.2023.02.010. Epub 2023 Feb 18. PMID: 36801438; PMCID: PMC10247415.
- https://www.uptodate.com/contents/secondary-immunodeficiency-induced-by-biologic-therapies (acceso abril/2024).
Vacunarte si tienes asma o asma grave puede cambiar tu salud
La vacunación como herramienta esencial
La vacunación es una de las medidas de salud pública con más impacto, más eficaces y coste-efectivas para prevenir enfermedades que representan una causa importante de hospitalización y muerte a nivel mundial.
Las campañas de vacunación masiva suponen una estrategia de prevención que incluye no sólo a los individuos vacunados, contribuyendo a la inmunidad colectiva, reduciendo la propagación de patógenos y protegiendo a los grupos más vulnerables (niños, ancianos y personas con comorbilidades)
En las personas con asma —y en especial en quienes tienen asma grave— las infecciones respiratorias (gripe, neumonía, COVID-19, Virus respiratorio sincitial (VRS), etc.) pueden provocar exacerbaciones, o crisis de asma, que empeoran la función pulmonar, reducen la calidad de vida y pueden requerir ingreso hospitalario o incluso representar riesgo vital. Protegerse mediante las vacunas recomendadas es una estrategia simple, segura y poderosa para reducir ese riesgo.
¿Por qué las personas con asma y asma grave son más vulnerables?
El asma grave suele cursar con inflamación bronquial sostenida, niveles de medicación más altos y, en algunos casos, tratamiento con corticoides sistémicos o terapias biológicas. Estos factores pueden alterar las defensas respiratorias frente a virus y bacterias, facilitando infecciones más severas y aumentando la probabilidad de exacerbaciones. Las guías actuales (Guía Española para el Manejo del Asma (GEMA), y la Iniciativa Global para el Asma (GINA) subrayan la importancia de prevenir infecciones en asmáticos como parte del manejo integral.
Impacto de las infecciones respiratoria en el control del asma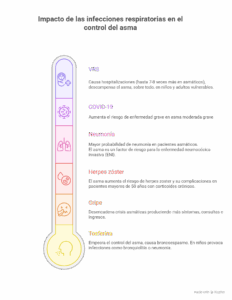
Qué vacunas se recomiendan para personas con asma o asma grave (tabla resumen)
A continuación, se expone una tabla resumen clara y práctica para pacientes, según indicaciones habituales en España:
| Vacuna | Recomendación | Motivo / Beneficio | Fuente |
| Gripe estacional | Anual — recomendada en asmáticos (especialmente moderado/grave) | Evita gripe que puede desencadenar exacerbaciones y hospitalizaciones. Es una estrategia coste-efectiva | Ministerio de Sanidad / Calendario 2025. (Ministerio de Sanidad) |
| Neumocócica (PCV20 / PCV13 + PPSV23 según caso) | Recomendada en asma grave; valorar en asma con tratamiento corticoideo. En España se suele emplear la vacuna conjugada de 20 serotipos (PCV20) en adultos con asma grave, siguiendo las indicaciones de Pediatría y Salud Pública. | Protege frente a neumonía y ENI; reduce riesgo de complicaciones respiratorias | Documentos técnicos y GEMA 5.5. (separ.es) |
| COVID-19 | Completar pauta y refuerzos según indicación (grupos de riesgo) | Reduce hospitalización, UCI y mortalidad por SARS-CoV-2 | Recomendaciones SNS / campañas 2024–25. (Ministerio de Sanidad) |
| VRS (vacuna para adultos / profilaxis en lactantes) | Indicada en mayores de 60 años, con comorbilidades; profilaxis (nirsevimab) en lactantes de riesgo | Previene hospitalizaciones por VRS, protege a bebés y a adultos vulnerables | AEP / calendario infantil / novedades VRS. (vacunasaep.org) |
| Herpes zóster (HZ/su, 2 dosis) | Recomendado en adultos ≥50 con condiciones de riesgo (incluido asma corticodependiente) | Evita zóster y neuralgia postherpética que empeoran la calidad de vida | Recomendaciones clínicas y documentación técnica. (Ministerio de Sanidad) |
| Tosferina (dTpa) | Una dosis de recuerdo en adultos no vacunados en la adolescencia o según historia vacunal | Evita tosferina que puede desencadenar broncoespasmos y empeorar el asma
Reduce el riesgo de enfermedad grave relacionada con esta enfermedad |
Calendario / recomendaciones de vacunación. (Ministerio de Sanidad) |
| Otras vacunas del calendario vacunal | Mantener al día según edad y situación clínica | Protección general que evita enfermedades que podrían complicar el asma | Calendario de vacunaciones SNS 2025. (Ministerio de Sanidad) |
*Elaboración propia
Nota: la elección del tipo de vacuna y el momento de la vacunación deben decidirse con el profesional sanitario (medicina de familia, neumología o alergología, medicina preventiva) según edad, tratamiento (corticoides, biológicos), historial vacunal y comorbilidades.
Consideraciones especiales en asma grave
- Asma grave no controlada: las personas con asma grave no controlada (tratamientos escalón 5–6, uso prolongado de corticoides orales o frecuentes exacerbaciones) tienen una vulnerabilidad mayor y son prioridad para las vacunas indicadas. GEMA 5.5 y GINA instan a integrar la vacunación en el plan de cuidados del asmático grave. (separ.es)
- Tratamientos biológicos (mAbs): en general no están contraindicadas las vacunas actualmente, con excepción de los virus vivos atenuados (varicela, triple vírica, fiebre amarilla…) a los cuales se debe vacunar el paciente previo al inicio del tratamiento biológico. Consulta las recomendaciones clínicas con tu enfermera de referencia ya que algunas precisan gestionar tiempos (p. ej. espaciar 5–7 días entre vacunación y administración de los biológicos)
- Corticoides orales crónicos: aumentan el riesgo de algunas infecciones (p. ej. herpes zóster), por lo que la vacunación frente a HZ y otras infecciones es especialmente importante.
- Niños con asma grave: en lactantes/menores de 2 años existen estrategias de protección frente al VRS (profilaxis con nirsevimab en grupos de riesgo) y la vacunación infantil del calendario debe mantenerse estrictamente. (vacunasaep.org)
En el caso de la vacunación frente al neumococo en niños la Asociación Española de Pediatría (AEP) recomienda en asma ampliar la cobertura a la vacuna polisacárida 23 valente (en vacunados previamente con 13 o 15 valente)
En niños con asma grave no controlado la infección por SARS-CoV-2 podría ser más grave, por lo que se debe valorar su inmunización en este casos.
Qué dicen las guías y autoridades
- GEMA 5.5 (Guía Española para el Manejo del Asma, 2025): destaca la prevención de exacerbaciones como objetivo clave y apoya integrar la vacunación en el manejo del asmático. (separ.es)
- GINA (Global Initiative for Asthma): la guía internacional recalca la importancia de prevenir factores precipitantes de exacerbaciones, incluyendo infecciones prevenibles por vacuna; su estrategia 2024–2025 actualiza el enfoque del manejo integral. (Global Initiative for Asthma – GINA)
- Consejo Interterritorial / Ministerio de Sanidad (Calendario 2025): define los grupos de riesgo y el calendario común de vacunación (gripe, neumococo, COVID, etc.) aplicable a personas con enfermedades respiratorias crónicas. (Ministerio de Sanidad)
Vacúnate y cuida tu asma
Vacunarte es una decisión activa para proteger tu respiración y tu vida diaria. Las vacunas recomendadas reducen exacerbaciones, evitan ingresos y te ayudan a mantener un mejor control del asma. Su uso generalizado puede reducir la carga de enfermedad y mejorar tu calidad de vida. Consulta con tu médico o enfermera cuáles son las vacunas que te corresponden, revisa tu historial vacunal y aprovecha cada temporada (por ejemplo, la campaña de gripe) para actualizar tu protección. Vacunarte no solo te protege a ti, sino también a los que te rodean.
¡Vacúnate hoy y respira con más tranquilidad mañana!
Bibliografía
- De Miguel-Díez J, Torres-Castro R, Sanz Herrero F, Menéndez Villanueva R, Solís Gómez B, Quirós Fernández S, Pérez Rojo R, Mora Cuesta VM, Entrenas Castillo M, Serrano Fernández L, Cabrera Martínez MM, Mediano O, García-Ortega A, García Rivero JL, de la Rosa-Carrillo D. SEPAR. Recomendaciones de la SEPAR sobre la vacunación de pacientes respiratorios crónicos. Arch Bronconeumol. 2025 Jun 17: S0300-2896(25)00218-2. Doi: 10.1016/j.arbres.2025.06.005.
- Álvarez-Gutiérrez FJ, Blanco Aparicio M, Casas Maldonado F, Plaza V, Soto Campos G, González-Barcala FJ, et al. Documento de consenso de asma grave. Actualización 2025. Open Respiratory Archives. 2025; 7:100486. Doi: 10.1016/j.opresp.2025.100486.
- GEMA 5.5. Guía Española para el Manejo del Asma. 2025. Sociedad Española de Alergología/SEPAR (actualización GEMA 5.5). Disponible en: https://www.separ.es/gema-5.5-asma.
- Global Initiative for Asthma (GINA). GINA Strategy Report 2024/2025. 2024–2025. Disponible en: www.ginasthma.org. (Global Initiative for Asthma – GINA)
- Ministerio de Sanidad. Calendario de vacunación e inmunizaciones a lo largo de toda la vida. Calendario recomendado 2025. Madrid: Ministerio de Sanidad; 2025. Disponible en: Ministerio de Sanidad
- AEP / Vacunas AEP. Recomendaciones y calendario 2025 (incluye recomendaciones sobre nirsevimab y VRS en lactantes). 2025.Disponible en: vacunasaep.org
- Cates CJ, Rowe BH. Vaccines for preventing influenza in people with asthma. Cochrane Database Syst Rev. 2013;(2):CD000364. DOI: 10.1002/14651858.CD000364.pub4-
- Walters JAE, Tang JN, Poole P, Wood-Baker R. Pneumococcal vaccines for preventing pneumonia in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017;(1):CD001390. DOI: 10.1002/14651858.CD001390.pub4
- Villar-Álvarez F, Rosa-Carrillo D, Fariñas-Guerrero F. Vacunación en el paciente respiratorio adulto, ¿bailamos? Vacunas. 2023;24(2):150–157. Disponible en: https://doi.org/10.1016/j.vacun.2023.04.005
- Desvaux-García M, Martínez-Calvo FF, López-Campos M, Viñas V. Observational study of the first month of the influenza vaccination campaign in patients followed up for asthma in 2019 and 2020. Rev Pediatr Aten Primaria. 2022;24:e81–e85. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1139-76322022000100012&lng=es&tlng=es.
Autoras:
Mónica Martín Gómez (enfermera Servicio de Alergología, Hospital Universitario Puerta de Hierro Majadahonda, Madrid)
- Carmen Sánchez Fernández (enfermera, Servicio de Alergología, Hospital Clínic Barcelona)
En colaboración con el Grupo de Respiratorio del Comité de Enfermería de la Sociedad Española de Alergología e Inmunología Clínica)
Recomendaciones para niños alérgicos y con inmunodeficiencias durante la pandemia COVID-19
En el número especial del Pediatric Allergy and Immunolgy del mes de abril de 2020, a causa de la pandemia COVID-19, aparece esta revisión firmada por destacados especialistas en alergia pediátrica con una serie de recomendaciones a tener en cuenta de cara al manejo del paciente alérgico y/o asmático pediátrico en esta pandemia mundial: Brough, H.A., Kalayci, O., Sediva, A., Untersmayr, E., Munblit, D., Rodriquez del Rio, P., Vazquez‐Ortiz, M., Arasi, S., Alvaro‐ Lozano, M., Tsabouri, S., Galli, E., Beken, B. and Eigenmann, P.A. (2020), Managing childhood allergies and immunodeficiencies during respiratory virus epidemics – the 2020 COVID‐19 pandemic. Mas información aquí
Aunque cualquier persona es susceptible de contagiarse de COVID-19, la edad es el principal factor de riesgo para desarrollar una infección grave1. Afortunadamente, los niños son el rango de población menos afectada2, pero debe garantizarse la atención de otras patologías que puedan presentar.
Las enfermedades alérgicas y el asma son las enfermedades crónicas más comunes en la población infantil3. Con los datos publicados hasta el momento, no hay evidencias de que la alergia aumente el riesgo de enfermedad grave, y solo las inmunodeficiencias y el asma grave mal controlada son factores de riesgo4, por lo que el control del asma tiene que ser óptimo.
Estos son los 6 puntos a tener en cuenta en el manejo del paciente pediátrico con alergia o inmunodeficiencia que expone la revisión citada:
- El alergólogo/a debe buscar el mejor control de los síntomas, instruir al paciente en las recomendaciones de higiene y aislamiento social, y guiar y apoyar al paciente y su familia ante esta situación de incertidumbre.
- Cuando sea posible, deben evitarse los desencadenantes de los síntomas. La alergia estacional que se presentan en primavera puede cursar con asma. A partir del 26 de abril se permita la salida al exterior de niños hasta 14 años de edad, y es aconsejable que en estas salidas los alérgicos al polen de gramíneas eviten zonas ajardinadas.
- Es importante diferenciar los síntomas de alergia de los signos de inicio de infección. Cuando los síntomas se deben a la alergia predominan el picor nasal, ocular, estornudos… Estos empeoran al contactar con el desencadenante y suelen remitir con antihistamínicos. No hay fiebre salvo complicaciones como sinusitis aguda. El asma tampoco cursa con fiebre, y suele mejorar con broncodilatadores.
Sin embargo, en la infección por COVID-19 hay síntomas generales como fiebre, malestar, abatimiento, problemas digestivos y suelen aparecer de manera más progresiva.
- Tratamiento de acuerdo con las guías habituales. No hay evidencia de que el tratamiento habitual de la alergia y el asma (antihistamínicos, broncodilatadores o antileucotrienos) aumenten el riesgo de enfermedad grave. Por lo tanto, se recomienda mantener el tratamiento que tengan indicado para lograr un adecuado control de síntomas.
En el caso del tratamiento con corticoides inhalados, no existen datos de que este tratamiento modifique la susceptibilidad ni la gravedad del COVID-19. Los niños padecen frecuentemente infecciones respiratorias por otros virus como VRS o rinovirus, que predisponen a la hiperreactividad bronquial, y se tratan con corticoides inhalados de forma habitual, sin haberse observado aumento de neumonías o empeoramiento del pronóstico.
Cabe destacar que los fármacos biológicos se han convertido en terapias habituales en muchos pacientes. Aunque no existe una actuación común, el grupo de expertos de la EAACI recomienda mantener el tratamiento biológico en pacientes sanos, y suspenderlo en paciente infectados por COVID-19 hasta la resolución del cuadro.
Se debe evitar la utilización de nebulizadores, ya que generan aerosoles que pueden provocar la difusión del virus. La administración de broncodilatadores debe realizarse usando dispositivos MDI presurizados con espaciador.
5.- Los niños con inmunodeficiencias tienen un riesgo potencial de padecer una enfermedad más grave. En ellos es aún más importante mantener su tratamiento crónico, incluso el inmunosupresor, y extremar las medidas de higiene y distanciamiento social.
6.- Las guías están sujetas a cambios. El conocimiento de esta infección por COVID-19 aumenta día a día, y aunque no se espera que el riesgo en niños crezca, hay que ser flexibles y estar abiertos nuevas evidencias científicas.
Olaya Alvarez García
Sección de Alergoloxía. Complexo Hospitalario Universitario de Ferrol
Comité de Alergia Infantil de la SEAIC
BIBLIOGRAFÍA
- Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA Published Online First: 24 February 2020. doi:10.1001/jama.2020.2648.
- CDCMMWR. Coronavirus Disease 2019 in Children — United States, February 12–April 2, 2020. MMWR Morb Mortal Wkly Rep 2020: 69. doi:10.15585/mmwr.mm6914e4.
- ENSE Encuesta Nacional de Salud España 2017 Madrid, Ministerio de Sanidad, Consumo y Bienestar Social.
- Garg S, Kim L, Whitaker M et al. Hospitalization Rates and Characteristics of Patients Hospitalized with Laboratory-Confirmed Coronavirus Disease 2019 — COVID-NET, 14 States, March 1–30, 2020. MMWR Morb Mortal Wkly Rep 2020: 69:458–464
¡Tengo alergia al sol!
¡Cuántas veces escuchamos esta frase en esta época del año en la que nuestra exposición solar ha sido máxima! Son muchos los pacientes que ante reacciones cutáneas coincidiendo con la exposición solar se refieren a ellas como “alergia al sol”. Aunque es un término científicamente incorrecto, se refiere a aquellas fotodermatosis (reacciones anormales o adversas de la piel a la luz ultravioleta o la radiación visible) en las que subyace un mecanismo inmunológico.
Entre ellas, la erupción polimorfa lumínica es la entidad más frecuente, afectando al 10-20% de la población occidental. Aparece sobre todo en mujeres jóvenes y es más típico en las primeras exposiciones solares del año (primavera), mejorando a medida que la estación soleada avanza (tras exposiciones repetidas al sol y la progresiva melanización de la piel).
Se caracteriza por brotes repetidos de lesiones cutáneas pruriginosas con localización predominante en aquellas zonas de mayor exposición solar: cara, cuello, zona alta del tórax, caras laterales de antebrazos y cara anterior de las piernas.
Las lesiones pueden ser de distinto tipo (de ahí el término polimorfismo): pápulas, pápulo-vesículas, eccema, placas, erosiones o costras; aunque, en un paciente individual, las lesiones son normalmente monomórficas y simétricas, apareciendo habitualmente a las pocas horas de exposición al sol.
Las reacciones agudas requerirán el tratamiento sintomático acorde con la gravedad del cuadro. Los antihistamínicos ayudarán a controlar el prurito; aunque, en ocasiones, puede ser necesario el uso de corticoides sistémicos. Sin embargo, lo más importante es prevenir la aparición de la erupción mediante fotoprotección adecuada (ropa, protección solar UVA y UVB). Si con ello no se consigue evitar la aparición de los brotes, se puede llevar a cabo una terapia de “desensibilización mediante fototerapia” con radiación UVB de banda estrecha (UVB-BE) para conseguir el endurecimiento (hardening) de la piel. Se basa en ir acostumbrando poco a poco a nuestra piel a la exposición al sol (fototolerancia), mediante la aplicación de cursos cortos de UVB-BE desde principios de la primavera y durante varias semanas, hasta alcanzar niveles que permitan al paciente tolerar exposiciones solares diarias de 15-20min de duración. Además, en adultos jóvenes, que viajan de vacaciones a zonas soleadas, se ha comprobado que la realización de ciclos cortos (6-7 días) de corticoides sistémicos (prednisona 0,6-0,8 mg/kg/día) es útil en la prevención de aparición de brotes.
Entre las fotodermatosis que afectan con más frecuencia a población infantil, se encuentra la erupción primaveral juvenil, considerada una variedad localizada de la erupción polimorfa lumínica, de origen desconocido y que afecta más frecuentemente a varones entre 5 y 12 años. Cursa con pápulas eritematosas pruriginosas que aparecen típicamente durante la primavera en el hélix de las orejas que no está cubierto por pelo. Pueden evolucionar a vesículas y costras sin dejar lesiones residuales o solo mínimas cicatrices.
También el hidroa vacciniforme, aunque es una afección rara, se suele dar en niños menores de 10 años, mejorando hacia la edad adulta. Algunos autores consideran que se trata de una variante cicatricial de la erupción polimorfa lúminica. Consiste en brotes recurrentes de lesiones vesiculosas, de contenido viscoso, seroso o hemorrágico, que evolucionan a costras y escaras negruzcas que se desprenden, dejando lesiones cicatriciales varioliformes, deprimidas e hipopigmentadas. Suelen darse cada verano en las partes descubiertas del cuerpo tras la exposición a la luz solar. Su localización más frecuente es en orejas, nariz, dedos, mejillas, dorso de manos o antebrazos y, a veces, puede afectar también a ojos y cuero cabelludo, con efectos adversos importantes sobre la calidad de vida de los niños. Se desconoce la patogenia, aunque se ha asociado a infecciones por virus de Epstein-Barr, y puede evolucionar a linfoma.
Otras fotodermatosis menos frecuentes en niños son el prurigo actínico, la dermatitis actínica crónica o la urticaria solar.
Todas ellas se engloban dentro de este grupo de fotodermatosis inmunológicamente mediadas conocido coloquial- y erróneamente bajo el único nombre de “alergia solar”. Sin embargo la patogenia y clínica de cada una de ellas es diferente y por tanto su tratamiento. Por ello es importante acudir al especialista quien establecerá un diagnóstico preciso y con ello el tratamiento más adecuado.
Dra. Paula Cabrera Freitag, Hospital Universitario Gregorio Marañón de Madrid. Comité de Alergia Infantil SEIAC
Bibiliografía:
- Barceló JM, Rosillo MR, Muñoz C. Fotodermatosis. En IJ Dávila, I Jáuregui, JM Olaguibel y JM Zubeldia, eds. Tratado de Alergología. 2ª ed. Madrid: Ergon, 2016, 889-912.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses. Part 1: pathophysiology and technical aspects of photobiologic studies. Actas Dermosifiliogr. 2014 Mar;105(2):112-21.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses, part II: photobiologic testing. Actas Dermosifiliogr. 2014 Apr;105(3):233-42.
- Gruber-Wackernagel A, Byrne SN, Wolf P. Polymorphous light eruption: clinic aspects and pathogenesis. Dermatol Clin. 2014 Jul;32(3):315-34
¿Cómo reconocer una anafilaxia?
Es muy importante reconocer rápidamente que una persona puede estar presentando una anafilaxia para administrar adrenalina precozmente.
Los síntomas de la anafilaxia suelen aparecer de manera brusca y súbita y afectan simultáneamente o de forma rápidamente sucesiva (en minutos) a diferentes órganos del cuerpo. Algunos de los signos más comunes incluyen:
• Un síntoma precoz y frecuente de la anafilaxia es un picor intenso en palmas, plantas y axilas.
• Suele acompañarse de enrojecimiento de la piel, junto con habones (ronchas) que pueden extenderse rápidamente a todo el cuerpo.
• Otro signo típico es la hinchazón, que puede afectar a los párpados y/o los labios, pero también a la lengua y la garganta, provocando en este último caso dificultad respiratoria y alteraciones en el tono de voz o imposibilidad de hablar.
• Pueden darse síntomas en el aparato digestivo, tales como dolor abdominal, náuseas, vómitos o diarrea.
• Si la anafilaxia afecta a los bronquios habrá también dificultad para respirar, pitidos en el pecho, opresión torácica.
• En los casos más graves, si hay bajada de la presión arterial, el paciente puede sufrir mareos intensos e incluso pérdida de conciencia.
A menudo estos síntomas se dan a los minutos del contacto (ingesta, picadura, administración intravenosa) con un alérgeno conocido o potencial, lo cual facilita el diagnóstico. En otras ocasiones, asumir que una persona está sufriendo una anafilaxia no es tan evidente.
La combinación de síntomas que puede presentar cada persona es variable; por tanto es importante saber que la anafilaxia puede manifestarse de diferentes formas.
Utilidad del Diagnóstico Molecular en Alergia a Alimentos
La alta prevalencia de la alergia a los alimentos y el importante impacto socioeconómico de esta patología sobre los pacientes, el sistema sanitario y la sociedad hace imprescindible poder contar con herramientas de diagnóstico validadas. La primera línea de diagnóstico en la alergia a los alimentos es la historia clínica adecuada y la demostración de anticuerpos de clase IgE frente a los alimentos implicados, mediante prueba cutánea o determinación de IgE específica. Sin embargo, está única aproximación no es siempre concluyente, ni para el propio diagnóstico ni para establecer el riesgo futuro del paciente. La confirmación ideal, es la prueba de exposición frente al alérgeno implicado, realizada en condiciones de doble ciego y controlada con placebo, tipo de metodología que consume tiempo, recursos y no está exenta de reacciones que pueden ser graves, por lo que se convierten en estudios difíciles de realizar en la práctica clínica. Las técnicas de diagnóstico fundamentadas en la identificación de los alérgenos moleculares de los alimentos, comúnmente denominada como diagnóstico por componentes, ha permitido la identificación de fenotipos clínicos en cuanto a la gravedad de la respuesta clínica y la detección de las moléculas alergénicas responsables de la reactividad cruzada entre los alimentos. En la última década se ha avanzado en la identificación de los alérgenos mayores, sin embargo, el valor diagnóstico y la utilidad clínica del diagnóstico por componentes aún no está establecido.
Determinar la validez del diagnóstico por componentes en la alergia a los siguientes grupos de alimentos: leche, trigo, cacahuete, soja, frutos secos, pescados y maricos, así como estimar el coste-efectividad del diagnóstico por componentes en comparación con las técnicas convencionales, y por último, resumir la evidencia de la capacidad del diagnóstico por componentes de predecir la gravedad de las reacciones alérgicas han sido los objetivos de una revisión sistemática recientemente publicada (Diagnostic accuracy, risk assessment, and cost-effectiveness of component-resolved diagnostics for food allergy: A systematic review. Flores Kim J, McCleary N, Nwaru BI, Stoddart A, Sheikh. Allergy. 2018 Jan 10. doi: 10.1111/all.13399).
Los autores pudieron incluir un total de 11 artículos elegibles entre más de 7000 artículos revisados. Los componentes moleculares evaluados fueron: para la leche de vaca (Bos d4, Bos d 4, Bos d 5, Bos d 8, y las caseínas); para el huevo (Gal d 1, Gal d 2, Gal d 3, Gal d 4); para el cacahuete (Ara h 1, Ara h 2, Ara 3, Ara h 6, Ara h 8, Ara h 9); para la avellana ( Cor a 1, Cor a 8, Cor a 9, Cor a 14, Bet v 1, Bet v 2); para la gamba (Pen a 1, Lit v 1, Lit v 4), no se encontraron estudios válidos para trigo, soja y pescados. Los componentes con mejor validez diagnóstica teniendo en cuenta el binomio sensibilidad- especificidad han sido: Bos d 4 para Leche de vaca (62.0%- 87.5%), para huevo Gal d 1 (84.2%- 89.8%) para huevo cocido y 60.6%-97,1% para huevo crudo, para cacahuete Ara 6 (94.9%-95.1%), para avellana Cor a 14 (100%-93,8%), y para gamba Lit v1 (82.8%-56.3%).
Los autores ponen de manifiesto la necesidad de estudios de calidad incluyendo la utilización del patrón de oro, la provocación oral doble ciego controlada con placebo, o bien de alternativas, que podrían estandarizarse como la combinación de pruebas de exposición abiertas y otros marcadores de sensibilización. Igualmente, es necesario definir unos puntos de corte que faciliten la agrupación de datos provenientes de diferentes estudios, se requiere la estandarización de los ensayos técnicos, para asegurar resultados comparables, es necesario tener estudios que evalúen en términos económicos el coste- efectividad de esta prueba y por último, los autores concluyen en que no es posible evaluar la capacidad del diagnóstico por componentes para evaluar el riesgo de la enfermedad en el contexto de los modelos clínicos actuales, si bien en algunos casos la sensibilización frente a algunos alérgenos moleculares, si pueden identificar los fenotipos más graves de la enfermedad como Ara h 2 y Ara h 6 para la alergia al cacahuete y Cor a 9 y Cor a 14 para la avellana. En resumen, esta revisión sistemática pone de manifiesto, que el diagnóstico por componentes es una herramienta muy importante para el conocimiento de la alergia a los alimentos, pero son necesarios estudios bien diseñados y con muestras de pacientes suficientes que abarquen todo el espectro de fenotipos desde los pacientes con clínica leve hasta los que tienen manifestaciones muy graves, para conocer realmente su utilidad en la práctica clínica.
Autor: Belén de la Hoz Caballer. Servicio de Alergología. Hospital Universitario Ramón y Cajal. Comité de Alergia Infantil.
Las abejas y las avispas
1. LOS HIMENÓPTEROS ABEJAS Y AVISPAS
Los himenópteros son un grupo de insectos artrópodos, caracterizados por poseer alas membranosas (del griego hymen y ptera, membrana y ala, respectivamente) y una organización social compleja. Dentro de los himenópteros existentes son de interés desde el punto de vista alergológico las familias Apidae (abejas) y Vespidae (avispas), ya que son los que ocasionan la mayoría de reacciones alérgicas en nuestro medio.
En el continente americano las hormigas también son causa frecuente de reacciones alérgicas, especialmente la hormiga roja.
La alergia a veneno de himenópteros es conocida desde antiguo: en las paredes de la tumba del rey egipcio Menes (año 2621 a.C.) puede verse representada su muerte por la picadura de una avispa (Figura 1).

Características morfológicas de los himenópteros
El reconocimiento de las características morfológicas, comportamiento y del hábitat del insecto que ha producido la picadura es importante, ya que puede ayudar en su identificación y por tanto mejorar el diagnóstico. La mayoría de los himenópteros son especies solitarias. Una minoría de especies forman sociedades en las cuales se agrupa un número mayor o menor de individuos los cuales trabajan en común para acumular reservas alimenticias y cuidar de sus larvas. Las construcciones donde lo hacen se llaman nidos.
Son estas especies las que interesan desde el punto de vista alergológico, ya que la formación de estas sociedades hace que el riesgo de picadura aumente al aumentar el número de individuos, y lo que es más importante, al aumentar su agresividad como mecanismo de defensa del nido, ya que los himenópteros pican para defender su comida o sus crías.
¿Es usted alérgico a la proteína de leche de vaca o intolerante a la lactosa?: La pregunta que salva vidas
Y es que la diferencia es ciertamente importante. Tan importante como que una de ellas puede ser potencialmente mortal. ¿Sabrías decir a cuál de las dos nos referimos?
Comencemos por los términos importantes:
- Leche: según la definición de la RAE:
- Líquido blanco que segregan las mamas de las hembras de los mamíferos para alimento de sus crías.
- Leche de algunos animales que se emplea como alimento de las personas.
- Jugo blanco obtenido de algunas plantas, frutos o semillas.
- Es decir, CUIDADO, la leche puede ser de origen ANIMAL (vaca, oveja, cabra, búfala…) o VEGETAL (soja, arroz, avena, almendra, coco…).
- Lactosa: según la definición de la RAE:
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Presente en leches de mamíferos.
- La lactosa se “destruye” (es decir, se separa en glucosa y galactosa) mediante la acción de una enzima digestiva llamada lactasa.
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Leche de vaca (composición): agua, proteínas (beta-lactoglobulina, alfa-lactoalbúmina, caseína…), grasas, vitaminas, hidratos de carbono (entre ellos, la lactosa) y minerales.
- Yogures y quesos de origen animal: producto lácteo obtenido al fermentar la leche de animales mediante bacterias que transforman la lactosa en ácido láctico, por tanto, el contenido de lactosa en estos productos es menor. Pero siguen conteniendo lactosa (salvo aquellos específicos sin lactosa) y proteínas de leche de animales.
- Leche/yogures/quesos sin lactosa: leche de animales a los que se ha añadido lactasa de forma artificial (pero siguen conteniendo proteínas de leche).
- Leches/yogures vegetales (composición): NO contienen Contienen proteínas diferentes a las de la leche de animales.
DIFERENCIAS FUNDAMENTALES ENTRE AMBAS (ver cuadro)
 Cargando...
Cargando...
La alergia a las proteínas de la leche de vaca:
- Los pacientes pueden tener reacción con leches de otros mamíferos (vaca, cabra, oveja…).
- Reaccionan con pequeñas cantidades (el 50% con menos de 4.1 ml de leche).
- Pueden detectar trazas (menos de 0.1 ml de leche). Los pacientes altamente sensibilizados pueden reaccionar con mínimas cantidades e incluso con contaminaciones indirectas.
- Toleran leches vegetales (excepto si tienen además de su APLV, alergia a alguna de éstas).
- Las reacciones aparecen generalmente en las 2 primeras horas tras la ingesta.
- Los síntomas pueden ser cutáneos (habones, hinchazón de labios…), respiratorios (congestión nasal, dificultad para respirar…), digestivos (dolor abdominal, vómitos, diarrea…) y/o cardiovasculares (mareo, pérdida de conocimiento…).
- Las reacciones pueden ser potencialmente mortales en el caso de afectar a 2 o más órganos o sistemas (ANAFILAXIA).
- Requieren tratamiento urgente específico (por ejemplo, si la afectación es exclusivamente cutánea puede ser tratada con antihistamínicos y corticoides en caso de edema asociado, si los síntomas son respiratorios habrá que utilizar broncodilatadores de rescate y si estamos ante una anafilaxia, el tratamiento de elección será la adrenalina intramuscular).
La intolerancia a lactosa:
- Los pacientes toleran leche sin lactosa.
- Pueden consumir yogures sin lactosa y quesos con bajo contenido en lactosa (queso curado, parmesano, gruyere, mozzarella…). Pero es recomendable preguntar si pueden consumirlo.
- Pueden toleran leche y derivados lácteos con lactosa si toman previamente comprimidos de lactasa.
- Toleran leches vegetales.
- Suelen tener reacciones de tipo digestivo (dolor abdominal, diarrea, flatulencias…).
La cantidad SÍ importa:
3.2 mg de proteína de leche (unos 0.1 ml de leche de vaca) pueden desencadenar una reacción alérgica en al menos el 5% de los pacientes alérgicos a proteínas de leche de vaca. Al menos el 50% reaccionan con 133 mg de proteína de leche (unos 4.1 ml de leche).
EN RESUMEN: el conocimiento es poder. Y en este caso, el uso correcto del lenguaje es de vital importancia.
Grabémonos la pregunta clave:
¿Es usted alérgico a la proteína de la leche de vaca o intolerante a la lactosa?
- Si la respuesta es SOY ALÉRGICO: CUIDADO, pueden tener reacciones alérgicas potencialmente mortales, incluso con trazas, que requieran tratamiento urgente. Tendremos que evitar cualquier contacto con leche de mamíferos y aquellos productos que puedan contenerla.
- Si la respuesta es SOY INTOLERANTE: podemos dar leche y productos lácteos SIN lactosa. Podemos también preguntar por el grado de tolerancia, es decir, si tolera yogures o quesos.
- Si tenemos DUDAS: es mejor SER PRECAVIDOS y EVITAR cualquier contacto con leche de mamíferos o aquellos productos que puedan contenerlos.
Porque hay preguntas que salvan vidas. Usémoslas.
Dra. Laura Argiz Álvarez. Clínica Universidad de Navarra (Madrid).
Bibliografía:
- Turner PJ, d’Art YM, Duca B, et al. Single-dose oral challenges to validate eliciting doses in children with cow’s milk allergy. Pediatr Allergy Immunol. 2021;32(5):1056-1065. doi:10.1111/pai.13482
- Blom WM, Westerhout J, Baumert JL, et al. Updated full range of Eliciting Dose values for Cow’s milk for use in food allergen risk assessment. Food Chem Toxicol. 2022;168:113381. doi:10.1016/j.fct.2022.113381