resultados de la búsqueda: asma/wp-content/uploads/logos/Sitio web no disponible/profesionales/aviso-importante/Hospital Universitario Fundación Jiménez Díaz/inicio/wwwww
Comunicación
| Coordinación general, página web, boletín y medios: | Dr. Pedro Ojeda Fernández |
| Coordinación general, página web, RRSS y NNTT: | Ángela Meijide Calderón |
| Comunicación interna: | Dr. Darío Antolín Amérigo |
| NNTT-App | Dr. José Luis Cubero Saldaña Dra. Paloma Poza Guedes |
| NNTT-App-enlace Junta Directiva | Dr. Antonio Letrán Camacho |
| RRSS | Dra. Isabel Fernández de Alba Dra. Mónica Fernández Rodríguez Dra. Paula Galván Blasco |
| Página web | Dra. Alicia Gallardo Higueras Dr. Jesús Jurado Palomo |
| Boletín industria informa | Dra. Mercedes Ramírez Hernández |
Actualizado el día 10/03/2025
Labor social
La Fundación SEAIC desempeña una amplia labor social. Durante su trayectoria ha puesto en marcha actividades de carácter educativo, de divulgación, de ayuda y de promoción de conocimiento a la población. Y no solo eso, además ha sido medio de colaboración de recursos humanos y materiales en la investigación e intercambio de ideas y actividades científicas.
Por un lado, se ha llevado a cabo la distribución de ayudas económicas a campamentos de niños con asma y alergias alimentarias organizados por otras entidades. Además, se ha colaborado económicamente con proyectos educativos para pacientes o de concienciación social sobre enfermedades alérgicas. La Fundación de la SEAIC ha creado una red de Aerobiología para ofrecer datos de las tasas de pólenes atmosféricas, ha disposición de los pacientes.
DESAFÍO DIAGNÓSTICO DE LA ALERGIA A AINE EN NIÑOS
Según Alergológica 2015, un estudio epidemiológico de referencia sobre las enfermedades alérgicas en España la alergia a medicamentos fue el motivo de consulta en el 18,7% de los casos, y en particular en niños en el 9%. En los niños, las enfermedades exantemáticas son frecuentes y muchas veces no se puede discernir que la causa de las lesiones cutáneas sean los fármacos o la propia enfermedad. Siendo los antiinflamatorios no esteroideos (AINE) los segundos medicamentos que más frecuentemente causan reacciones alérgicas en niños. Un alto porcentaje de niños que han presentado alguna reacción donde hubiese implicado un AINE, los evitan sin ningún estudio.
Las reacciones asociadas a los AINE se dividen principalmente en dos tipos: agudas (reacción inmediata o reacción hasta varias horas después de la exposición) y retardadas (más de 24 horas después de la exposición). Las reacciones agudas a los AINE pueden ser selectivas (mecanismo inmunológico) o inducidas por múltiples AINE (reactividad cruzada, no inmunológicas), siendo estas últimas las más comunes en niños.
Hasta la fecha los estudios relacionados con reacciones alérgicas a los AINE en niños son limitados. Como variables predictoras encontramos una reacción sugestiva en los primeros 60 minutos y 2 o más reacciones con distintos AINE implicados. No queda claro si se podría involucrar a la genética como variable: algunos estudios apuntan el antecedente de padres alérgicos a AINE como un factor de riesgo.
En niños, entre los fármacos más frecuentemente implicados se encuentran el Ibuprofeno y derivados del ácido propiónico, junto al Paracetamol por ser los más utilizados. Las reacciones adversas a AINE en lactantes y preescolares son menos frecuentes, lo que se atribuye a su menor consumo.
Para no catalogar a los niños de alérgicos a fármacos que le serán imprescindibles en el futuro es importante realizar un estudio alergológico, en el que la prueba definitiva es la prueba de exposición controlada para determinar el tipo de alergia selectiva o reactividad múltiple, y en caso de confirmarse ésta última probar otros AINE alternativos. Las pruebas cutáneas solo son de utilidad en determinados casos de alergia selectiva.
Recientemente se ha publicado un trabajo interesante que insiste en la importancia de la valoración alergológica, sobre todo de cara a la evolución de la alergia ya que una proporción importante de niños con reacciones por reactividad múltiple tolera los AINE tras ser reevaluados a los 6 años (Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs). Dicha reevaluación es crucial considerando el gran número de niños que podrían estar evitando los AINE. Esto unido a que condiciones comórbidas como infecciones, fiebre o el uso concomitante de otros fármacos podrían causar los síntomas en estos pacientes nos hacen concluir que la historia detallada y las pruebas de provocación farmacológica son fundamentales para un diagnóstico definitivo de alergia a los AINE en niños.
Paula Méndez. Complexo Hospitalario Universitario de Santiago de Compostela. Comité de Alergia Infantil SEAIC
Biliografía:
- Erdem Topal 1, Mehmet Halil Celiksoy, Ferhat Catal, Yekbun Gamze Sayan, Recep Sancak The value of the clinical history for the diagnosis of immediate nonsteroidal anti-inflammatory drug hypersensitivity and safe alternative drugs in children.. Allergy Asthma Proc. Jan-Feb 2016;37(1):57-63. doi: 10.2500/aap.2016.37.3917.
- Yilmaz I. H. Ertoy Karagol A. Bakirtas E. Topal G. E. Celik M. S. Demirsoy I. Turktas Challenge‐proven nonsteroidal anti‐inflammatory drug hypersensitivity in children. Allergy. 2013 Dec;68(12):1555-61. doi: 10.1111/all.12266. Epub 2013 Oct 11.
- Hakan Guvenir 1, Emine Dibek Misirlioglu, Emine Vezir, Muge Toyran, Tayfur Ginis, Ersoy Civelek, Can N Kocabas Nonsteroidal anti-inflammatory drug hypersensitivity among children. Allergy Asthma Proc. Sep-Oct 2015;36(5):386-93. doi: 10.2500/aap.2015.36.3858.
- Sánchez-Borges M, Kidon M.Reactions to nonsteroidal anti-inflammatory drugs in children. J Allergy Clin Immunol Pract. 2018; 6(4):1236-7.
- Kidon M, Blanca-López N, Gomes E, Terreehorst I, et al.EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal antiinflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018; 29(5):469-80
- J Quiralte 1, R Avila-Castellano, S Cimbollek. A phenotype‐based classification of NSAIDs hypersensitivity: new patients, new challenges. Allergy 2014 Jun;69(6):814-5. doi: 10.1111/all.12377
- Inmaculada Doña, Natalia Pérez-Sánchez, Ibon Eguiluz-Gracia, Rosa Muñoz-Cano, Joan Bartra, María José Torres, José Antonio Cornejo-García. Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Allergy. 2020 Mar;75(3):561-575.
Histórico de congresos y simposios
En 1949, un año después de su fundación, la Sociedad celebró el primer congreso Nacional de Alergia en el Hospital Provincial de Madrid (actual Centro de Arte Reina Sofía). A partir de entonces se han celebrado congresos nacionales cada tres o cuatro años. A partir de 1978 la periodicidad pasa a ser bienal.
Actualmente de forma anual se celebran Congresos y Simposios (de forma consecutiva) para que todos los alergólogos puedan actualizarse en esta especialidad.
CONGRESOS
2021: 33º Congreso Nacional de la Sociedad Española de Alergología e Inmunología Clínica 2020 - Zaragoza.
2020: 32º Congreso Virtual de la Sociedad Española de Alergología e Inmunología Clínica 2020.
2018: XXXI Congreso Nacional de la SEAIC - Valencia
2016: XXX Congreso Nacional de la SEAIC - San Sebastián
2014: XXIX Congreso Nacional de la SEAIC - Salamanca
2012: XXVIII Congreso Nacional de la SEAIC - Pamplona
2010: XXVII Congreso Nacional de la SEAIC - Madrid
2008: XXVI Congreso Nacional de la SEAIC - Bilbao
2006: XXV Congreso Nacional de la SEAIC - Valencia
2004: XXIV Congreso Nacional de la SEAIC - Marbella
2002: XXIII Congreso Nacional de la SEAIC - Madrid
2000: XXII Congreso Nacional de la SEAIC - Pamplona
1998: XXI Congreso Nacional de la SEAIC - Barcelona
1996: XX Congreso Nacional de la SEAIC - Granada
1994: XIX Congreso Nacional de la SEAIC - Santa Cruz de Tenerife
1992: XVIII Congreso Nacional de la SEAIC - Sevilla
1990: XVII Congreso Nacional de la SEAIC - Valencia
1988: XVI Congreso Nacional de la SEAIC - Murcia
1986: XV Congreso Nacional de la SEAIC - Madrid
1984: XIV Congreso Nacional de la SEAIC - Santiago de Compostela
1982: XIII Congreso Nacional de la SEAIC - Sevilla
1980: XII Congreso Nacional de la SEAIC - Palma de Mallorca
1978: XI Congreso Nacional de la SEAIC - Las Palmas de Gran Canaria
1975: X Congreso Nacional de la SEAIC - Granada
1972: IX Congreso Nacional de la SEA - Zaragoza
1969: VIII Congreso Nacional de la SEA - Valencia
1966: VII Congreso Nacional de la SEA - Palma de Mallorca
1962: VI Congreso Nacional de la SEA - Oporto(Reunión conjunta con la Sociedad Portuguesa de Alergia)
1959: V Congreso Nacional de la SEA - Salamanca1956IV Congreso Nacional de la SEA - Barcelona
1954: III Congreso Nacional de la SEA - Santa Cruz de Tenerife
1951: II Congreso Nacional de la SEA - Sevilla
1949: I Congreso Nacional de la SEA - Madrid
SIMPOSIOS
2024: Simposio Internacional de "Enfermedades Alérgicas de Riesgo Vital", Bilbao.
2019: Simposio Internacional. "Avances y Perspectivas en Alergia Cutánea e Inmunología", Gran Canaria.
2017: Symposium Internacional de "Aerobiología, Contaminación y Cambio Climático", Murcia.
2015: Symposium Internacional de "Vía Respiratoria Única", Sevilla.
2013: Symposium Internacional de "Alergia a Himenópteros", Granada.
2011: Symposium Internacional de "Alergia Alimentaria" / «100 años de Inmunoterapia» Barcelona.
2009: Symposium Internacional de “Alergia a medicamentos”, Logroño.
2007: Symposium Internacional de “Alergia cutánea” Santander.
2005: Symposium Internacional de “Rinoconjuntivitis” Sevilla.
2003: Symposium Internacional “Aerobiología y Polinosis”, Zaragoza.
2001: Symposium Internacional de “Alergia a alimentos”, Bilbao.
1999: Symposium Internacional 50º Aniversario de la SEAIC, La Coruña.
1997: Symposium Internacional sobre “Reacciones adversas a fármacos con base inmunológica” Puerto de Santamaría (Cádiz)
1995: Symposium Internacional de “Asma bronquial” Barcelona.
1993: Symposium de “Inmunoterapia” Torremolinos (Málaga).
1991: Symposium de “Asma bronquial” Cáceres.
1989: Symposium de “Inmunoterapia” Madrid.
1989: Symposium de “Alergia a medicamentos” Palma de Mallorca.
1987 : Symposium de “Provocaciones bronquiales no inhalativas” Madrid.
1985: Symposium de “Alergia ocupacional”, Sevilla.
1983: Symposium de “Alergia a medicamentos”, Palma de Mallorca.
1977: Symposium de “Alergia a medicamentos”, Benidorm (Alicante).
1974: Symposium de “Mecanismos efectores de las reacciones alérgicas”, Madrid.
1974: Symposium de “Asma bronquial”, Palma de Mallorca.
1971: Symposium de “Alergia a medicamentos”, Benidorm (Alicante).
Nuevos horizontes en la alergia a alimentos: el rol de los biológicos
La prevalencia de alergia a alimentos ha ido en aumento en las últimas décadas tanto en España como a nivel global, hasta hace unos años no existía otra recomendación más que la de evitar el alimento al que el paciente es alérgico, lo cual en ocasiones lleva a una dieta muy restrictiva y un empeoramiento en la calidad de vida. Por lo tanto, existe la necesidad de ofrecer nuevos tratamientos más allá de las dietas de evitación.
Una alternativa de tratamiento en auge es la inmunoterapia oral (ITO), la cual consiste en administrar dosis crecientes del alimento al que el paciente es alérgico para aumentar su tolerancia. Esta es generalmente efectiva, pero tiene varias limitaciones como la larga duración del tratamiento durante el cual se pueden presentar reacciones graves y otros efectos adversos, ser específica para cada alimento, no estar estandarizada y no estar disponible en todos los centros ni para todos los alimentos.
Otra alternativa emergente en la alergia a alimentos es el uso de fármacos biológicos. Un fármaco biológico es un medicamento producido a partir de organismos vivos o componentes de estos, como células, tejidos, proteínas o anticuerpos. Estos medicamentos están diseñados para actuar sobre procesos biológicos específicos. Ejemplos comunes incluyen vacunas, hormonas y moduladores inmunitarios. En el campo de la alergología se dirigen contra moléculas concretas de la respuesta inmune de tipo alérgico, es por este motivo que los fármacos biológicos han revolucionado el manejo de enfermedades alérgicas e inflamatorias como el asma, urticaria y la dermatitis atópica, especialmente en casos severos que no responden a terapias convencionales y se muestran prometedores en el tratamiento de alergia alimentaria.
Una aplicación destacada es el uso del biológico Omalizumab, que bloquea la IgE, utilizado desde hace años en asma y urticaria y recientemente aprobado por la FDA para reducir las reacciones alérgicas a alimentos en pacientes con múltiples alergias alimentarias (febrero de 2024), basado en estudios como el OUTMATCH. Aunque no está aprobado específicamente para su uso en combinación con la ITO, múltiples ensayos clínicos han explorado esta combinación con resultados alentadores. Incluso consensos de expertos recomiendan el uso de Omalizumab como adyuvante de la ITO. Esta combinación permitiría aumentar las dosis del alimento en ITO de manera más rápida y segura.
Otro biológico en investigación en alergia alimentaria es el Dupilumab que bloquea ciertas moléculas que participan en la señalización de la respuesta alérgica (IL4 e IL13) y que cuenta ya con eficacia demostrada en múltiples patologías alérgicas como dermatitis atópica, asma grave, poliposis nasosinusal y este mes de noviembre ha sido aprobado por la EMA como el primer y único tratamiento biológico para la esofagitis eosinofílica en pacientes de >1 año de edad. En alergia alimentaria su uso sólo o en combinación con ITO aún está en etapas iniciales de investigación, pero los resultados preliminares son prometedores.
Actualmente están en investigación varios fármacos biológicos dirigidos frente a diferentes moléculas involucradas en la respuesta alérgica y su posible uso en alergia alimentaria, sin embargo, se encuentran todavía en etapas preliminares.
El desarrollo de terapias biológicas ofrece esperanza para muchos pacientes que hasta hace poco no tenían opciones viables pero hace falta más investigación para optimizar su aplicación y establecer guías clínicas claras.
María Carabel Lahera. Clínica Universidad de Navarra (Madrid).
Rosialzira Vera Berrios. Hospital Clínico San Carlos, IdISSC (Madrid).
Bibliografía:
Mutarelli A, Giavina-Bianchi B, Arasi S, Cafarotti A, Fiocchi A. Biologicals in IgE-mediated food allergy. Curr Opin Allergy Clin Immunol. 2023 Jun 1;23(3):205-209. doi: 10.1097/ACI.0000000000000900. Epub 2023 Mar 28. PMID: 37185824.
Sindher SB, Hillier C, Anderson B, Long A, Chinthrajah RS. Treatment of food allergy: Oral immunotherapy, biologics, and beyond. Ann Allergy Asthma Immunol. 2023 Jul;131(1):29-36. doi: 10.1016/j.anai.2023.04.023. Epub 2023 Apr 25. PMID: 37100276; PMCID: PMC10330596.
Sindher SB, Fiocchi A, Zuberbier T, Arasi S, Wood RA, Chinthrajah RS. The Role of Biologics in the Treatment of Food Allergy. J Allergy Clin Immunol Pract. 2024 Mar;12(3):562-568. doi: 10.1016/j.jaip.2023.11.032. Epub 2023 Nov 25. PMID: 38013157; PMCID: PMC11104487.
Wood RA, Chinthrajah RS, Rudman Spergel AK, Babineau DC, Sicherer SH, Kim EH, Shreffler WG, Jones SM, Leung DYM, Vickery BP, Bird JA, Spergel JM, Kulis M, Iqbal A, Kaufman D, Umetsu DT, Ligueros-Saylan M, Uddin A, Fogel RB, Lussier S, Mudd K, Poyser J, MacPhee M, Veri M, Davidson W, Hamrah S, Long A, Togias A; OUtMATCH study team. Protocol design and synopsis: Omalizumab as Monotherapy and as Adjunct Therapy to Multiallergen OIT in Children and Adults with Food Allergy (OUtMATCH). J Allergy Clin Immunol Glob. 2022 Jul 21;1(4):225-232. doi: 10.1016/j.jacig.2022.05.006. PMID: 37779534; PMCID: PMC10509974.
Zuberbier T, Muraro A, Nurmatov U, Arasi S, Stevanovic K, Anagnostou A, Bonaguro R, Chinthrajah S, Lack G, Fiocchi A, Le TM, Turner P, Lozano MA, Angier E, Barni S, Bégin P, Ballmer-Weber B, Cardona V, Bindslev-Jensen C, Cianferoni A, de Jong N, de Silva D, Deschildre A, Galvin AD, Ebisawa M, Fleischer DM, Gerdts J, Giovannini M, Gradman J, Halken S, Arshad SH, Khaleva E, Lau S, Loh R, Mäkelä MJ, Marchisotto MJ, Morandini L, Mortz CG, Nilsson C, Nowak-Wegrzyn A, Podestà M, Poulsen LK, Roberts G, Rodríguez Del Río P, Sampson HA, Sánchez A, Schnadt S, Smith PK, Szajewska H, Mitrevska NT, Toniolo A, Venter C, Warner A, Wong GWK, Wood R, Worm M. GA2LEN ANACARE consensus statement: Potential of omalizumab in food allergy management. Clin Transl Allergy. 2024 Nov;14(11):e70002. doi: 10.1002/clt2.70002. PMID: 39506193; PMCID: PMC11540805.
Invitación a participar: Alergodata
Estimado socio,
Nos gustaría invitarle a participar en el Proyecto ALERGODATA.
![]() Contenido disponible sólo para socios
Contenido disponible sólo para socios
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
La alfa triptasemia hereditaria es un rasgo genético que ha supuesto un nuevo biomarcador a tener en cuenta, sobre todo entre los pacientes que tienen anafilaxia.
Sin embargo, su diagnóstico está limitado a algunos centros especializados y sus implicaciones clínicas continuan en exploración.
- TRIPTASA.
La actividad tripsina-like se describió por primera vez en mastocitos (MC) en 1960 empleando técnicas histoenzimáticas.(1) Posteriormente, en 1981, se demostró esta misma actividad en los MC humanos de tejido pulmonar,(2) se aisló la enzima con una pureza en torno al 90% y se denominó triptasa (EC 3.4.21.59). La triptasa es producida y almacenada principalmente por los MC, y en una mínima cantidad por los basófilos.(3)
Las protriptasas (α y β) son enzimáticamente inactivas y se liberan de forma constitutiva al plasma, constituyen lo que se determina como triptasa sérica basal (sBT). Tras un proceso de maduración, se producen las triptasas maduras (tetrámeros enzimáticamente activos que forman complejos con la heparina), que se acumulan en los gránulos de los MC. Los tetrámeros activos de β-triptasa y α/β triptasa, se liberan al medio extacelular tras la desgranulación secundaria a la activación mastocitaria, y su determinación resulta de gran utilidad en el diagnóstico de anafilaxia.(4)
Los tetrámeros de β-triptasa madura se comportan como serín proteasas, que actuando sobre el complemento, algunas citoquinas, el fibrinógeno, el cininógeno, prostromelisina y los receptores activados por proteasas (PAR), pueden inducir los siguientes efectos: la proliferación de fibroblastos y músculo liso, la degradación de la matriz extracelular, el reclutamiento de eosinófilos y neutrófilos, la estimulación de células nerviosas y epiteliales, la angiogénesis y la fibrinogenolisis.(5) Sin embargo, los tetrámeros de α-triptasa madura son inactivos.(5,6)
Los heterotetrámeros de α/β triptasa madura, también tienen actividad peptidolítica, siendo su diana los PAR2 presentes en células endoteliales e induciendo extravasación in vitro; y los EMR2 (like module–containing mucin-like hormone receptor-like 2) receptores (proteínas G mecanosensitivas) presentes en la superficie de los MC. La unión de los heterotetrámeros de triptasa madura a este receptor inducen la escisión de la subunidad α del EMR2, y desencadenan la desgranulación mastocitaria(5), mecanismo que se ha relacionado con la urticaria vibratoria.(7) El incremento del número de copias de α-triptasa aumenta la proporción de heterotetrámeros frente a los homotetrámeros llevando a una sobre activación de estos receptores.(8)
La técnica comercial actualmente disponible para la detección de triptasa (ThermoFisher Scientific) es un inmunoensayo que utiliza dos anticuerpos anti-triptasa (el B12 que se emplea para la captura y el G4 para el revelado) siendo el límite inferior de detección de la técnica de 0,5 ng/mL. Esta técnica cuantifica la triptasa total sin distinguir entre formas maduras o precursores, ni isoformas α y β en los fluidos biológicos. El punto de corte establecido para los valores séricos basales de triptasa (sBT) en sujetos sanos es de 11.4 ng/mL.(4)
- ALFA TRIPTASEMIA HEREDITARIA (HαT).
La triptasa en humanos se codifica por 4 genes parálogos TPSG1 (alelos γ), TPSB2 (alelos β2 y β3), TPSAB1 (alelos α y β1), y TPSD1 (alelos δ) localizados en el cromosoma 16p13.3. Presenta diferentes isoformas: α-triptasa, β-triptasa, δ-triptasa y γ-triptasa. El genotipo normal para α y β triptasa contiene 4 copias de los genes, incluyendo estas variaciones 0α:4β, 1α:3β y 2α:2β.(4,9)
También se han descrito variaciones en el número de copias que codifican la β-triptasa, sobre todo en algunos grupos raciales, pero estas variaciones no se asocian con elevaciones de la sBT en las familias. Mientras que, los valores elevados de sBT heredados con patrón dominante en una familia, se asocian con un alelo portador de un gen TPSAB1 que codifica α-triptasa, y se trata de HαT incluso aunque se detecten copias extra de β-triptasa. (4) (Figura 1).
La alfa triptasemia hereditaria (HaT) fue descrita en 2016.(10) Se caracteriza por presentar un número aumentado de copias del gen TPSAB1 que codifica la α-triptasa, tiene un patrón autosómico dominante, se ha descrito en el 4-7% de donantes sanos,(4,6) y asocia un leve predominio entre el género femenino.(11) Los pacientes con HαT suelen tener cifras basales de triptasa (sBT) >11.4 ng/mL; aunque existen casos con valores normales de triptasa (raramente <8 ng/mL). Se recomienda realizar el estudio de HaT en aquellos individuos con sBT >8 ng/mL;(12–14) este punto de corte ha demostrado una sensibilidad del 94% y una especificidad del 100% para detectar copias extra del gen TPSAB1.(12)
Se ha detectado una relación entre el número de copias extra del alelo α del gen TPSAB1 (hasta 4 copias extra) y los niveles de sBT, en familias con HαT+. Parece seguir un patrón por el cual las duplicaciones implican unos niveles de sBT de 15 ± 5 ng/mL, las triplicaciones de 24 ± 6 ng/mL, y las cuadruplicaciones de 37 ± 14 ng/mL.(4)
Además, los valores elevados de sBT se pueden encontrar en otras patologías como las mastocitosis sistémicas (MS), neoplasias mieloides e insuficiencia renal.(7) También se ha publicado en varios estudios, la relación entre los niveles elevados de sBT con la prevalencia y la gravedad de anafilaxia, sin embargo, estos datos deben interpretarse con cautela ya que en muchos de ellos no se ha valorado la presencia concomitante de MC clonales ni de HαT+.(4) En cambio, sí que resulta clara la relación entre HαT+ y las anafilaxias graves desencadenadas por veneno de himenóptero, otras alergias IgE mediadas, así como la asociación con MS.(4)
- GENOTIPADO DE HαT MEDIANTE PCR DIGITAL.
Las PCR (reacción en cadena de la polimerasa) digital, es una tecnología de última generación que se emplea para la cuantificación de ADN de forma reproducible y sensible, y se recomienda para analizar la variación del número de copias. Para llevar a cabo las mediciones, la muestra se divide en particiones, de forma que en cada una de ellas haya cero, una o varias moléculas diana presentes en cada reacción individual. Cada partición es analizada después de un ciclado de PCR en punto final para detectar la presencia (reacción positiva) o ausencia (reacción negativa) de una señal de fluorescencia. Finalmente, se calcula el número absoluto de moléculas presentes en la muestra, sin que los resultados dependan de una curva estándar, de este modo se reduce el error y se incrementa la precisión.(15) Existen en el mercado dos tipos de PCR digital: “Dropled digital PCR (ddPCR)” y “arraybased PCR”. La diferencia principal entre los dos modelos se debe a la estrategia diseñada para la división de la muestra: mediante la formación de gotas tipo emulsión, o mediante el uso de chips compuestos por micropocillos.(16)
Esta técnica detecta las secuencias α y β en los locus de TPSAB1 y TPSB2, a partir de DNA genómico (gDNA) se puede extraer tanto de sangre periférica como de MO.(6) Existe un KIT comercial para conseguir el DNA a partir de un “swab bucal”(17) y posteriormente proceder al estudio de las variaciones en el número de copias de TPSAB1; sin embargo, puede ocurrir que este método se encuentre limitado por problemas de daños y contaminación de las muestras.
- FENOTIPOS DE HαT.(18)
La expresión clínica de HαT puede ser muy variable, desde sujetos asintomáticos (descrito en el 4% de donantes sanos de población española(6), y 1/3 de los portadores) hasta cuadros de anafilaxia grave.(11)
En una reciente revisión, se ha descrito que los síntomas que con mayor frecuencia presentan los pacientes con HαT incluyen: 1) síntomas neuropsiquiátricos (depresión 59%, alteraciones del sueño 69% y alteraciones de memoria 59-68%); 2) síntomas gastrointestinales (colon irritable 30%-60%, nauseas 51%, y reflujo 49%-77%); 3) síntomas secundarios a la liberación de mediadores mastocitarios (flushing 47%, prurito 69%, urticaria 37%, y anafilaxia 14-28%); 4) hiperlaxitud articular 28%; 5) disfunción del sistema autónomo 34% (hipotensión ortostática, palpitaciones, taquicardia, presincope, síncope), y 6) síntomas constitucionales (dolor crónico, astenia 85%).(18,19)
Algunos de los síntomas descritos, aunque se encuentren con una elevada prevalencia, son difíciles de validar como secundarios a HαT+.(18)
Además, los síntomas de HαT+, en muchas ocasiones se pueden superponer con lo que se producen por activación mastocitaria. En este sentido, hay que tener en cuenta que los fenotipos hasta ahora asociados a HαT+ son muy heterogéneos, y que la mayoría de los casos descritos provienen de centros monográficos en patología mastocitaria y/o síndromes genéticos, por lo que es probable la existencia de sesgos en los datos obtenidos a partir de estas poblaciones.(4)
Sí que ha sido validado que los individuos con HαT+ tienen una mayor prevalencia de reacciones de hipersensibilidad inmediata sistémicas. (18)
4.1 HαT Y ANAFILAXIA
La elevación aguda de triptasa es un biomarcador de anafilaxia. El aumento de los valores de sBT triptasa en un 20 % + 2 ng/ml sobre el valor basal de cada individuo en el periodo comprendido entre 1-4 horas desde el inicio del cuadro agudo, es el criterio para confirmar activación mastocitaria y anafilaxia.(20) Esta fórmula tiene una elevada sensibilidad y es útil para identificar anafilaxia en los individuos con exposición parenteral al alérgeno.(21) Sin embargo, se encuentra limitada en algunas circunstancias como en la población pediátrica con alergia a alimentos, y pacientes con reacciones no IgE mediadas. Además, la variabilidad de los niveles de sBT en cada individuo a lo largo del tiempo no está bien estudiada.(22)
Por otra parte, diferentes estudios han identificado los niveles de sBT como un biomarcador asociado con el aumento en la prevalencia y la gravedad de la anafilaxia tras picaduras de insectos (sobre todo himenópteros),(4) y en alergia alimentaria infantil.(23)
HαT+ es el primer modificador genético hereditario descrito para la anafilaxia, que se asocia con un incremento en el riesgo para reacciones alérgicas graves al veneno de himenóptero con un riesgo relativo=2; así como un incremento del riesgo para la anafilaxia idiopática grave(12) y la anafilaxia grave desencadenada por alimentos en niños.(24)
Se ha estimado una prevalencia de HαT+ ≥8.5% en los pacientes con anafilaxia por veneno de himenóptero (HVA) en los que se ha descartado una patología mastocitaria clonal. Además, HαT+ no parece influir en la frecuencia de sensibilización al veneno de himenóptero, sólo influye en la gravedad de la reacción entre los individuos sensibilizados.(25)
También se ha descrito una mayor prevalencia de HαT+ en la anafilaxia idiopática (17%)(25) y en la anafilaxia desencadenada por alimentos en población infantil.(24)
4.2 HαT Y PATOLOGÍA MASTOCITARIA.
HαT+ está asociado a la presencia de patología mastocitaria clonal, encontrándose entre el 12-21% de los pacientes con síndrome de activación mastocitaria clonal (cSAM) y/o MS, sobre todo con formas no avanzadas de la enfermedad -MS indolentes (MSI) y MS quiescentes-.(11)
Un estudio realizado en población adulta española, ha descrito la prevalencia de HαT+ en el 29% de SAM no clonales (ncSAM) y el 18% de las mastocitosis. Entre los casos con mastocitosis, la detección de HαT+ es significativamente más frecuente (21% vs. 10%) entre los casos con la mutación D816V de KIT restringida a mastocitos vs. los casos con la mutación D816V de KIT multilineal. Además, entre los pacientes con mastocitosis, su cuadro clínico debutó con anafilaxia en el 76% vs. 65% (p = 0.18) de los HαT+ vs. HαT–.(6)
El mecanismo subyacente entre ambas entidades no es conocido, pero se ha planteado la hipótesis de que pudiera ser secundario al efecto de mitógeno del exceso de triptasa sobre el microambiente de la médula ósea (MO), promoviendo la selección de los clones aberrantes de MC.(11)
Los pacientes HαT+ con MS tienen una frecuencia de HVA del 30%, y una prevalencia de anafilaxia grave con síntomas cardiovasculares del 35.5%.(11) Así mismo, en población española se ha descrito que los pacientes con mastocitosis tienen una frecuencia de anafilaxia por alimentos del 15% en HαT+ vs. 5% en HαT– (p=0.013).(6)
Si se valora la patología mastocitaria global (clonal y no clonal), se ha descrito que la frecuencia de anafilaxia aumenta progresivamente desde los casos que no tienen alelos para α-triptasa (58%), los que tienen 1 alelo (65%), quienes tienen 2 alelos (72%) y aquellos que tienen ≥3 copias de este alelo (84%). En este estudio, también se describe, que si se analizan sólo los casos HαT+, la frecuencia de anafilaxia es mayor en los que tienen ≥3 copias vs. 2 copias de α-triptasa (82% vs. 61%; p=.017).(6)
- MANEJO DE HAT
Actualmente, para controlar los síntomas que habitualmente presentan los pacientes HAT+, se recomienda emplear el tratamiento antimediador que se suele emplear en la patología mastocitaria.(4) Se ha empleado con éxito el Omalizumab en casos plurisintomáticos complejos, consiguiendo la resolución de la urticaria y de la anafilaxia en el 94% de los pacientes.(13)
MTPS9579A, es un anticuerpo monoclonal humanizado IgG4 anti-triptasa, que inhibe selectivamente la actividad de la triptasa al disociar los tetrámeros activos en monómeros. Este anticuerpo anti-triptasa reduce la gravedad de la anafilaxia IgE mediada en un modelo murino humanizado.(26) Además, se ha desarrollado un modelo farmacocinético/farmacodinámico (PK/PD) para elegir la dosis de anticuerpo anti-triptasa MTPS9579A en pacientes con asma moderado-grave que permite predecir el nivel de exposición y de supresión de la triptasa en los tejidos diana.(27)
Otros estudios, describen anticuerpos monoclonales dirigidos a los receptores inhibidores de los mastocitos, como Siglec-8 (sialic acid-binding immunoglobulin-like lectin 8) [Lirentelimab/AK002], Siglec-6 [AK006], y CD200R [LY3454738].(28)
La eficacia y seguridad de Lirentelimab ha sido evaluado en ensayos clínicos con diferentes patologías en las que participan los mastocitos (incluyendo MSI, urticaria crónica espontanea, dermografismo sintomático, y conjuntivitis alérgica); en todos ellos los pacientes refieren mejoría se los síntomas.(28)
LY3454738 no demostró superioridad frente a placebo en un estudio fase II de urticaria crónica, por lo que esta línea de investigación se ha cerrado. Sin embargo, está pendiente de publicarse sus resultados en un estudio fase I en dermatitis atópica.(28)
AK006 inhibe la anafilaxia IgE mediada en modelos murinos.(28)
Todos estos anticuerpos, podrían abrir líneas de tratamiento de la anafilaxia y de los síntomas de HαT+ en el futuro.
FIGURAS.
Figura. Genotipos de triptasa codificados por TPSAB1 y TPSB2. (18)
BIBLIOGRAFÍA
- Glenner GG, Cohen LA. Histochemical demonstration of a species-specific trypsin-like enzyme in mast cells. Nature. 19 de marzo de 1960;185:846-7.
- Schwartz LB, Lewis RA, Seldin D, Austen KF. Acid hydrolases and tryptase from secretory granules of dispersed human lung mast cells. J Immunol Baltim Md 1950. abril de 1981;126(4):1290-4.
- Castells MC, Irani AM, Schwartz LB. Evaluation of human peripheral blood leukocytes for mast cell tryptase. J Immunol Baltim Md 1950. 1 de abril de 1987;138(7):2184-9.
- Wu R, Lyons JJ. Hereditary Alpha-Tryptasemia: a Commonly Inherited Modifier of Anaphylaxis. Curr Allergy Asthma Rep. 10 de mayo de 2021;21(5):33.
- Lyons JJ. Inherited and acquired determinants of serum tryptase levels in humans. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. octubre de 2021;127(4):420-6.
- González-de-Olano D, Navarro-Navarro P, Muñoz-González JI, Sánchez-Muñoz L, Henriques A, de-Andrés-Martín A, et al. Clinical impact of the TPSAB1 genotype in mast cell diseases: A REMA study in a cohort of 959 individuals. Allergy. 11 de octubre de 2023;
- Khoury P, Lyons JJ. Mast cell activation in the context of elevated basal serum tryptase: genetics and presentations. Curr Allergy Asthma Rep. 27 de noviembre de 2019;19(12):55.
- Zhang H, Zeng X, He S. Evaluation on potential contributions of protease activated receptors related mediators in allergic inflammation. Mediators Inflamm. 2014;2014:829068.
- Caughey GH. Tryptase genetics and anaphylaxis. J Allergy Clin Immunol. junio de 2006;117(6):1411-4.
- Lyons JJ, Yu X, Hughes JD, Le QT, Jamil A, Bai Y, et al. Elevated basal serum tryptase identifies a multisystem disorder associated with increased TPSAB1 copy number. Nat Genet. diciembre de 2016;48(12):1564-9.
- Kačar M, Rijavec M, Šelb J, Korošec P. Clonal mast cell disorders and hereditary α-tryptasemia as risk factors for anaphylaxis. Clin Exp Allergy. 2023;53(4):392-404.
- Robey RC, Wilcock A, Bonin H, Beaman G, Myers B, Grattan C, et al. Hereditary Alpha-Tryptasemia: UK Prevalence and Variability in Disease Expression. J Allergy Clin Immunol Pract. 2020;8(10):3549-56.
- Giannetti MP, Weller E, Bormans C, Novak P, Hamilton MJ, Castells M. Hereditary alpha-tryptasemia in 101 patients with mast cell activation-related symptomatology including anaphylaxis. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. junio de 2021;126(6):655-60.
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 27 de noviembre de 2020;21(23):9030.
- dPCR para principiantes [Internet]. Disponible en: https://www.qiagen.com/es-es/applications/digital-pcr/beginners
- Pérez-Barrios, C. PCR digital en la monitorización de la respuesta al tratamiento del paciente oncológico. En: Aplicaciones clínicas de lsa técnicas actuales de Biología Molecular. Cont. Lab. Clin.; 2018. p. 52-8.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, et al. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol. 2019;144(4):883-96.
- Lyons JJ. Hereditary Alpha Tryptasemia: Genotyping and Associated Clinical Features. Immunol Allergy Clin North Am. 2018;38(3):483-95.
- von Bubnoff D, Koch D, Stocker H, Ludwig RJ, Wortmann F, von Bubnoff N. The Clinical Features of Hereditary Alpha-Tryptasemia—Implications for Interdisciplinary Practice. Dtsch Arzteblatt Int. 22 de marzo de 2024;(Forthcoming):arztebl.m2023.0287.
- Valent P, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, Butterfield JH, et al. Why the 20% + 2 Tryptase Formula Is a Diagnostic Gold Standard for Severe Systemic Mast Cell Activation and Mast Cell Activation Syndrome. Int Arch Allergy Immunol. 2019;180(1):44-51.
- Baretto RL, Beck S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: A perioperative perspective. Allergy. diciembre de 2017;72(12):2031-4.
- Mateja A, Wang Q, Chovanec J, Kim J, Wilson KJ, Schwartz LB, et al. Defining baseline variability of serum tryptase levels improves accuracy in identifying anaphylaxis. J Allergy Clin Immunol. marzo de 2022;149(3):1010-1017.e10.
- Sahiner UM, Yavuz ST, Buyuktiryaki B, Cavkaytar O, Yilmaz EA, Tuncer A, et al. Serum basal tryptase may be a good marker for predicting the risk of anaphylaxis in children with food allergy. Allergy. febrero de 2014;69(2):265-8.
- Lang A, Kubala S, Grieco MC, Mateja A, Pongracic J, Liu Y, et al. Severe food allergy reactions are associated with α-tryptase. J Allergy Clin Immunol. octubre de 2023;152(4):933-9.
- Lyons JJ, Chovanec J, O’Connell MP, Liu Y, Šelb J, Zanotti R, et al. Heritable risk for severe anaphylaxis associated with increased α-tryptase-encoding germline copy number at TPSAB1. J Allergy Clin Immunol. febrero de 2021;147(2):622-32.
- Maun HR, Jackman JK, Choy DF, Loyet KM, Staton TL, Jia G, et al. An Allosteric Anti-tryptase Antibody for the Treatment of Mast Cell-Mediated Severe Asthma. Cell. 3 de octubre de 2019;179(2):417-431.e19.
- Rymut SM, Henderson LM, Poon V, Staton TL, Cai F, Sukumaran S, et al. A mechanistic PK/PD model to enable dose selection of the potent anti-tryptase antibody (MTPS9579A) in patients with moderate-to-severe asthma. Clin Transl Sci. abril de 2023;16(4):694-703.
- Metz M, Kolkhir P, Altrichter S, Siebenhaar F, Levi-Schaffer F, Youngblood BA, et al. Mast cell silencing: A novel therapeutic approach for urticaria and other mast cell-mediated diseases. Allergy. enero de 2024;79(1):37-51.
Banco de Imágenes en Alergología
El próximo 14 de septiembre concluye el plazo de participación en el proyecto BIA (Banco de Imágenes en Alergología), iniciativa que, bajo el formato de concurso, tiene como objetivo crear una colección de imágenes seleccionadas por su calidad e interés demostrativo aportadas por los alergólogos.
Valoramos tu opinión
Arranca el proyecto «Valoramos tu opinión», con el fin de que las opiniones, sugerencias y peticiones de los socios nos permitan responder a sus necesidades. Si no dispone de su código solicítelo a mariajesus.hernandez@seaic.org.
Acceda al sitio desde aquí.
¿Qué es la Esofagitis Eosinofílica?
¿Qué es la esofagitis eosinofílica (EoE)?
– Es una enfermedad inflamatoria del esófago de carácter crónico, mediada por mecanismos inmunológicos, que se caracteriza por la presencia de infiltración de eosinófilos en mucosa esofágica. Se puede observar eosinofilia en sangre periférica entre aproximadamente el 10 y el 50% de los casos.
– En la actualidad, es la segunda causa de esofagitis crónica tras la enfermedad por reflujo gastroesofágico (ERGE) y la principal causa de disfagia e impactación de alimentos en niños y adultos jóvenes
– Fue descrita en los años 90, actualmente con un aumento dramático en la prevalencia hasta afectar al menos a un habitante por cada 2.000 en Europa y Norteamérica.
– Es más frecuente en varones y puede manifestarse a cualquier edad
– En la mayoría de los casos, la inflamación esofágica está desencadenada por alimentos, aunque es posible que también influyan factores ambientales. Los alimentos más frecuentes implicados son: leche de vaca, gluten y huevo.
– Puede ser causada por mecanismos de sensibilización alimentaria mediados por inmunoglobulina E (IgE), no mediados por IgE o mixtos.
– Un problema importante es la falta de correlación entre la intensidad de los síntomas y la inflamación del tejido ya que actualmente el único método diagnóstico y de seguimiento es la gastroscopia con toma de biopsias.
¿Cuándo se debe sospechar una esofagitis eosinofílica?
• Ingiere muchos líquidos con las comidas para lubricar los alimentos
• Modifica la comida (cortarla en pequeños trozos)
• Tiempos de comida prolongados
• Evita alimentos de textura dura (pan, carnes)
• Mastica excesivamente
• Rechaza pastillas/comprimidos
• Dolor en el pecho
¿Cuáles son los síntomas?
– Depende de la edad:
• Preescolares: fallo de medro, rechazo del alimento, dolor abdominal, vómitos, trastornos del sueño, etc.
• Escolares, adolescentes y adultos: disfagia, impactación, odinofagia, regurgitación.
¿Cómo se diagnostica?
– Gastroscopia con toma de biopsias de esófago proximal y distal
El diagnóstico etiológico o causal se realiza:
– Pruebas cutáneas con batería extensa de alérgenos.
– Determinación de IgE específicas
– Dieta de evitación y valoración de la respuesta de la mucosa esofágica
¿Cuál es el tratamiento?
– Dieta de eliminación
– Inhibidores de la bomba de protones (IBP)
– Corticoides deglutidos
– En casos de estenosis o estrechamiento importante del esófago: Dilatación esofágica
– Terapias en trámites de aprobación en Europa: anti IL4 y IL13 (Dupilumab)
IMPORTANTE: La EoE no es una enfermedad mortal pero su carácter crónico y agresivo afectan la calidad de vida de los que la padecen y de sus familias. Recuerda consultar con tu alergólogo/a, si presentas síntomas descritos.
Bibliografía:
1. Attwood SE, Smyrk TC, Demeester TR, Jones JB. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci. 1993 Jan;38(1):109-16. doi: 10.1007/BF01296781. PMID: 8420741.
2. Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. Idiopathische, eosinophile Osophagitis: eine häufig verkannte Krankheit mit typischer Klinik und diskretem endoskopischem Bild [Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings]. Schweiz Med Wochenschr. 1994 Aug 20;124(33):1419-29. German. PMID: 7939509.
3. Spergel JM, Beausoleil JL, Mascarenhas M, Liacouras CA. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol. 2002 Feb;109(2):363-8. doi: 10.1067/mai.2002.121458. PMID: 11842310.
4. Sampson HA. Update on food allergy. J Allergy Clin Immunol. 2004 May;113(5):805-19; quiz 820. doi: 10.1016/j.jaci.2004.03.014. PMID: 15131561. 5. Arias Á, Pérez-Martínez I, Tenías JM, Lucendo AJ. Systematic review with meta analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016 Jan;43(1):3-15. doi: 10.1111/apt.13441. Epub 2015 Oct 28. PMID: 26510832. 6. Lucendo AJ, Arias-González L, Molina-Infante J, Arias Á. Systematic review: health-related quality of life in children and adults with eosinophilic oesophagitis-instruments for measurement and determinant factors. Aliment Pharmacol Ther. 2017 Aug;46(4):401-409. doi: 10.1111/apt.14194. Epub 2017 Jun 22. PMID: 28639700.
7. Molina infante J, Corti R, Doweck J, Lucendo AJ. Actualización terapéutica en esofagitis eosinofílica. Acta Gastroenterol Latinoam 2018; 48(3): 242-252 8. Molina-Infante J, Gonzalez-Cordero PL, Ferreira-Nossa HC, Mata-Romero P, Lucendo AJ, Arias A. Rising incidence and prevalence of adult eosinophilic esophagitis in midwestern Spain (2007-2016). United European Gastroenterol J. 2018 Feb;6(1):29-37. doi: 10.1177/2050640617705913. Epub 2017 Apr 21. PMID: 29435311; PMCID: PMC5802667.
9. Arias Á, Lucendo AJ. Incidence and prevalence of eosinophilic oesophagitis increase continiously in adults and children in Central Spain: A 12-year population-based study. Dig Liver Dis. 2019 Jan;51(1):55-62. doi:
10.1016/j.dld.2018.07.016. Epub 2018 Jul 31. PMID: 30115573.
10. Gupta M, Grinman M. Diagnosis and management of eosinophilic esophagitis. CMAJ. 2024 Feb 4;196(4):E121-E128. doi: 10.1503/cmaj.230378. PMID: 38316452; PMCID: PMC10843442.
11. Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, Amil Dias J, Bove M, González-Cervera J, Larsson H, Miehlke S, Papadopoulou
A, Rodríguez-Sánchez J, Ravelli A, Ronkainen J, Santander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017 Apr;5(3):335-358. doi: 10.1177/2050640616689525. Epub 2017 Jan 23. PMID: 28507746; PMCID: PMC5415218.
12. Joan Domenech Witek, Vicente Jover Cerda, Zahira Maria Franzon Laz, et al.. (2020-04-14). «Study and Follow-Up of Patients with Allergic Eosinophilic Esophagitis Phenotype.» *Volume 3*, 1, 7-17
13. Gómez Torrijos E, González-Mendiola R, Alvarado M, Ávila R, Prieto-Garcia A, Valbuena T, Borja J, Infante S, López MP, Marchan E, Prieto P, Moro M, Rosado A, Saiz V, Somoza ML, Uriel O, Vásquez A, Mur P, Poza-Guedes P, Bartra J. Eosinophilic Esophagitis: Review and Update. Front Med (Laussanne). 2018 Oct 9;5:247. doi: 10.3389/fmed.2018.00247. PMID: 30364207; PMCID: PMC6192373.
14. Domenech Witek J, González Mendiola R, Jover Cerdá V, Pereira González J, Carballas Vásquez C, Villas Martínez F, Rodríguez Pacheco R. Description of allergic phenotype in patients with eosinophilic oesophagitis: management protocol proposal. Sci Rep. 2023 Feb 8;13(1):2226. doi: 10.1038/s41598-023- 29602-z. PMID: 36755125; PMCID: PMC9906574
Los Aditivos Alimentarios: El mal de todo paciente, el olvido de todo alergólogo.
Los aditivos alimentarios son sustancias que habitualmente no se consumen como producto alimentario. No obstante, tienen un papel fundamental a la hora de mantener la calidad y las características de los alimentos que exigen los consumidores y hacen que estos alimentos sigan siendo seguros, nutritivos y deseables. De este modo, los aditivos no son alimentos en sí, sinó sustancias que se añaden a los alimentos para mejorar su conservación, color, sabor o consistencia.
A este grupo de sustancias se les ha atribuído con bastante frecuencia la capacidad de producir reacciones adversas, e incluso alérgicas. No obstante, en la actualidad se desconoce la prevalencia exacta de reacciones adversas frente aditivos, si bien sabemos y se ha demostrado que los aditivos alimentarios muy raramente provocan auténticas reacciones inmunológicamente mediadas (hecho poco creíble entre la población general).
A continuación se describen los grupos de aditivos existentes en el mercado actual, sus características fundamentales y algunas de las principales reacciones adversas descritas hasta el momento debido a estas sustancias:
Antioxidantes y conservantes: Son aditivos que mantienen la frescura e impiden su deterioro. Contribuyen a qué los alimentos se puedan conservar durante más tiempo protegiéndolos contra el daño ocasionado por la oxidación o los microrganismos. Los antioxidantes evitan la oxidación de las grasas de los alimentos e impiden que se decoloren y se vuelvan rancios. Los conservantes limitan, retrasan o previenen la proliferación de los microorganismos.
Antioxidantes: Ácido ascórbico E300, Ascorbato De Sodio E301, Ascorbato De Calcio E302, Ascorbato De Potáseo E303, palmitato ascorbil E304, estearato ascorbil E305, Extractos Naturales Ricos En Tocoferol E306, Alfa Tocoferol E307, gamma tocoferol E308, delta tocoferol E309, Galato De Propil E310, Galato De Octil E311, Galato De Dodecil E312, Ácido Eritórbico E315, Eritorbato Sódico E316, Butilhidroquinona (Bhq) E319, Butilhidroxianisol (Bha) E320, Butilhidroxitolueno (Bht) E321, lactato de sodio E325, lactato de potáseo E326, lactato de calcio E327, etileno diamino tetra acetato E385, ácido etilendiaminotetracético E386, extracto de romero E392, Tocoferoles (E306-307-308-309), Ácido ascórbico (E300), BHA (butilhidroxianisol o E320) y BHT (butilhidroxitoluol o E321). La incidencia de broncoespasmo debido a estos aditivos es realmente muy baja. Se han descrito casos de urticaria de contacto, urticaria crónica y dermatitis atópica debido a estos antioxidantes.
Los conservantes físicos son muy efectivos, pero, en muchos casos, tienen una duración muy corta y un elevado coste. Los conservantes físicos serían el frío (refrigeración o congelación), la liofilización y el envasado al vacío. Existen también los conservantes químicos que según su origen pueden dividirse en:
- Minerales
- Cloruros: cloruro sódico o sal común, es el primer conservante químico utilizado y un eficaz agente antimicrobiano.
- El dióxido de azufre y los sulfitos (E220 hasta 228): Anhídrico sulforoso y sulfitos con concentraciones superiores a 10 mg/l expresados como SO2: Los sulfitos y bisulfitos son sustancias derivadas del azufre y se utilizan como antioxidantes o conservantes. La normativa europea obliga a etiquetar cualquier alimento que contenga sulfitos a concentraciones superiores a 10 mg/kg o 10 mg/l, y estos productos han de ser declarados con el término sulfito o dióxido de azufre (E-220, E-221, E-222, E-223, E-224, E-225, E-226, E-227 i E-228). Los sulfitos pueden ser responsables de reagudizaciones asmáticas en pacientes con asma. Los principales alimentos que contiene sulfitos son: el vino (que contiene sulfitos producidos durante la fermentación) y otras bebidas alcohólicas o no alcohólicas envasadas (zumos, mosto, sidra), alimentos envasados, alimentos pre-cocinados, conservas, alimentos ultracongelados y vinagre. A parte de síntomas respiratorios bronquiales, los sulfitos también pueden ocasionar molestias nasales (rinitis), digestivas y/o cutáneas (urticaria, angioedema y dermatitis de contacto).
- Nitratos y nitritos (sales potásicas y sódicas) (desde E249 a 252). Se utilizan como conservantes en el procesado de carnes como el jamón y otros embutidos con la finalidad de garantizar la seguridad de los productes e inhibir el crecimiento de la bacteria botulínica. Los nitritos y los nitratos se encuentran en productos cárnicos curados, derivados del pescado y los quesos. La formación de nitrosamina se considera cancerígena. Pueden ser responsables de agravar la clínica de dermatitis atópica en algunos pacientes. También se han descrito casos de reacciones alérgicas graves (anafilaxia) debido a estos conservantes.
- Orgánicos:
- Ácidos grasos saturados y sus derivados: Ácido acético y acetatos, ácido fórmico y formiatos, ácido propiónico y propionatos.
- Ácido sórbico y sorbatos. Tienen actividad frente Clostridium botulinum. Se han descrito casos de urticaria de contacto perioral debida a estos conservantes.
- Ácido benzoico y benzoatos. Los benzoatos se encuentran de manera natural en las cerezas y la canela. Son unos de los aditivos más relacionados con reacciones alérgicas. Pueden ser responsables de agravar la clínica de dermatitis atópica en algunos pacientes. También se han descrito casos de urticaria, urticaria de contacto, angioedema, rinitis y asma debido a estos conservantes si bien la incidencia es muy baja. Los benzoatos también se han asociado a otras reacciones como por ejemplo el dolor de cabeza, la migraña, la dificultad de concentración, la hiperactividad y las artralgias, si bien la incidencia es también muy baja.
- Antioxidantes fenólicos.
- Antibióticos. Se utilizan poco por el riesgo de producir efectos indeseables así como por la posibilidad de producir cepas microbianas resistentes. La nisina es el más utilizado ya que inhibe el crecimiento de
Aditivos que aumentan o potencian las cualidades sensoriales.
- Modificadores del sabor y la textura:
- Emulsionantes y estabilitzantes: se utilizan para mantener la consistencia de la textura y evitar que los ingredientes se disgreguen. La lecitina (E322), los monoglicéridos y los diglicéridos, entre otros pertenecen a este grupo. Entre los estabilizantes destaca la metilcelulosa (E461), habiéndose descrito sobre todo reacciones adversas gastrointestinales debidas a este estabilizante (predominantemente dolor, distensión abdominal y en algunos casos incluso obstrucción intestinal). De entre los emulsionantes, destaca el triestearato de sorbitán (E492), el cual puede incrementar la absorción de sustancias solubles en grasas.
- Espesantes: ayudan a incrementar la viscosidad de los alimentos. Habitualmente se utilizan como espesantes sustancias naturales como la gelatina (E441: se han descrito reacciones alérgicas graves –anafilaxia- debidas a la gelatina) o la pectina [E440a: grandes cantidades pueden producir síntomas gastrointestinales (sobre todo dolor y distensión abdominal)]. Otros espesantes son el ácido algínico (E400), el alginato de sodio (E401), el alginato de potáseo (E402), el alginato de amonio (E403), el alginato de calcio (E404) o el agar-agar (E406). A pequeñas cantidades no se les conocen efectos adversos atribuíbles. No obstante, grandes cantidades pueden inhibir la absorción de algunos nutrientes y ocasionar patología gastrointestial. Las gomas naturales también se utilizan como espesantes. Pertenecen a la familia de las legumbres la goma arábiga (E414), la goma de algarroba (E410), la goma guar (E412), la goma de tara (E417) y la goma de tragacanto (E413). La goma guar (E412) es una goma natural proviniente de la semilla de la planta Cyamopsis tetragonoloba (familia Fabaceae). Este aditivo se encuentra casi siempre en forma de polvo, pero, cuando se combina con otros ingredientes también puede verse en forma líquida o de gel. Debido a qué es una fibra soluble en agua, la goma guar puede tener un efecto laxante en aquellas personas que la consuman. Muy frecuentemente también es la responsable de ocasionar patología gastrointestinal (diarrea, dolor abdominal, distensión abdominal), habiéndose incluso descrito casos de obstrucción intestinal debido a su consumo. Al igual que la goma de algarroba puede incrementar los niveles de colesterol. La goma de tragacanto (E413) se obtiene de diversas especies de Astragalus. Se han descrito reacciones alérgicas por contacto (dermatitis de contacto y/o urticaria).
- Edulcorantes: proporcionan un sabor dulce a los alimentos y se utilizan en productos bajos en calorías. Son edulcorantes intensos el acesulfam K (E950), el aspártamo (E951) y la sacarina (E954). También son edulcorantes la taumatina (E957), que es una proteína edulcorante natural que se extrae de la planta Thaumatococcus danielli (es 2.500 veces más dulce que el azúcar), el sorbitol (E420), la isomaltosa (E953), el maltitol (E965i), el ciclamato E 952, la sucralosa E955, la glicirricina E958, la neohesperidina (Nhdc) E959, la estevia (extracto de stevia) E960, el jarabe de maltitol E965ii, el lactitol E966, el xilitol E967, el eritritol E968, el advantamo E969, el sorbitol (E420), el manitol (E421) y el glicerol (E422). Principalmente pueden producir trastornos gástricos (náuseas, vómitos y diarreas).
- Potenciadores del sabor: El más conocido es el glutamato monosódico (se identifica con los códigos GMS o E621). Se utiliza sobre todo en productos salados, alimentos de sobre y en una gran variedad de platos orientales. Es la sal sódica del ácido glutámico. Originariamente se extraía de las algas y del trigo. Se utiliza sobre todo para la preparación de alimentos de sobre y en las cocinas orientales. Las manifestaciones clínicas más características de las reacciones adversas por glutamato se engloban dentro del «síndrome del restaurante chino» que se describe como la aparición de dolor de cabeza, sensación de ardor en la piel (sobre todo en escote y cara) que posteriormente afecta al resto del cuerpo y se acompaña de náuseas, palpitaciones y en ocasiones incluso pérdida de conocimiento. El cuadro se inicia a los pocos minutos de la ingesta de una alta cantidad de glutamato y cede en 2-3 horas. Actualmente está todavía en controversia el papel del glutamato monosódico como desencadenante de crisis de asma o de patología cutánea (urticaria y/o angioedema). Parece que sí que podría estar relacionado con la clínica de rinitis.
- Acidulantes: Un acidulante es un aditivo alimentario que incrementa la acidez de un alimento o le da un sabor ácido. Entre los diversos acidulantes que se utilizan están los ácidos orgánicos y los ácidos inorgánicos.
- Otros: antiaglomerantes, antiespumantes, gases de envasado, midones, disolventes, entre otros.
- Colorantes: Los colorantes se utilizan en los alimentos para añadir o restaurar el color con el objetivo de mejorar su aspecto visual. Pueden inducir reacciones de urticaria, angioedema (hinchazón), asma, rinitis, eczemas cutáneos, dermatitis de contacto e incluso anafilaxia. Parece que también pueden inducir reacciones pseudoalergicas o anafilactoides. Los colorantes también se han involucrado en otras reacciones afortunadamente bastante infrecuentes tales como dolor de cabeza, migraña, hiperactividad, dificultad de concentración y atención así como artralgias. Desde el punto de vista de su origen, los colorantes alimentarios se pueden clasificar en colorantes naturales [extracto de pimiento (paprika)], minerales y de síntesis. Dentro de los colorantes de síntesis encontramos dos grupos principales:
- Azoicos: Los colorantes azoicos son los que más frecuentemente se han implicado en reacciones adversas. Tartrazina: La tartrazina puede provocar clínica de urticaria en algunos pacientes aunque la prevalencia en la actualidad se sabe que es realmente muy baja. Tampoco queda claro su posible papel como desencadenante de crisis de asma. Sí parece que podría ser responsable de agravar la clínica de dermatitis atópica en algunos pacientes. Amarillo naranja: Se han descrito casos de urticaria, angioedema, eczemas y clínica gastrointestinal debidas a este colorante. Rojo de cochinilla: Es un colorante de síntesis muy utilizado en la industria, sobre todo para la conservación del color de los frutos rojos y de las conservas de marisco. Se han descrito casos de anafilaxia debido a este colorante en los que se ha podido demostrar un mecanismo alérgico mediado por anticuerpos IgE. Rojo carmín o ácido carmínico: Se obtiene a partir de la maceración de las hembras del insecto conocido popularmente como cochinilla (Dactylopius coccus). Es un colorante de color rojo intenso y no debe confundirse con el mismo colorante de origen sintético llamado rojo de cochinilla. Se ha implicado en casos de reacciones adversas y en muchos casos se ha podido demostrar un mecanismo alérgico mediado por anticuerpos IgE. Se han descrito reacciones de urticaria, asma, rinitis e incluso anafilaxia debidas a este colorante. Amarillo tartrazina: Este colorante se ha involucrado en reacciones alérgicas cruzadas con los derivados pirazolónicos (grupo de medicamentos antiinflamatorios donde pertenece el metamizol) así como con múltiples reacciones alérgicas.
- No azoicos: eritrosina, amarillo quinoleína e indigosina. Eritrosina: Es un polvo de color marrón que disuelto proporciona una tonalidad roja y puede presentar reactividad cruzada con la eosina. Según el lugar donde se añadan pueden ser de dos tipos:
- Los que se añaden directamente al alimento y se pueden consumir con ellos. En la Unión Europea se identifican con la letra E seguida de un número de 3 cifras.
- Los que se utilizan para dar un determinado color en el exterior de algunos alimentos y que no se suelen consumir. En la Unión Europea se identifican con la letra C, seguida de un número.
Aditivos que pueden contener trigo:
Almidones modificados: 1400, 1401a, 1402, 1403, 1404, 1405, 1410, 1412, 1414, 1420, 1.422, 1440, 1442, 1450, 1451. Los almidones abundan en los alimentos amiláceos (cereales y patata). El almidón más utilizado es el que se obtiene del maíz.
Polidextrosa E-1200.
E-306 Vitamina E. Son extractos de origen natural ricos en tocoferoles. Pueden ser de trigo, de arroz, de maíz o de soja.
Aditivos que contienen proteína de leche de vaca:
H-4511 caseinato cálcico
H-4512 caseinato sódico
H-4513 caseinato potásico
Aditivos que pueden contener proteína de leche de vaca:
E-101 Riboflavina o lactoflavina: Se utiliza como colorante. Actualmente casi siempre es de origen sintético.
E-270 Ácido láctico, E-325 Lactato sódico, E-326 Lactato potásico, E-327 Lactato cálcico: Tanto el ácido láctico como los lactatos se producen comercialmente a partir de la fermentación bacteriana del almidón y melazas, sin embargo, es posible que el cultivo para iniciar la producción de ácido láctico pueda contener leche.
E-966 Lactitol: Es un azúcar-alcohol sintético producido a partir de la lactosa que es un azúcar que contiene la leche de vaca. Aunque es bastante improbable que este aditivo contenga proteína de leche de vaca, el hecho de provenir de la lactosa hace que no se pueda descartar alguna posible contaminación.
E-472b Ésteres lácticos de los mono y diglicéridos de ácidos grasos, E-481 Estearoil-2-lactilat sódico, E-482 Estearoil-2-lactilat cálcico: Generalmente se producen a partir de grasas vegetales. Sin embargo, también pueden provenir de grasas animales por lo que en caso de provenir de grasas animales bovinos podrían contener proteína de leche de vaca.
Aditivos que contienen huevo:
E-161B Luteína, E-1105 Lisozima
Aditivos que pueden contener huevo:
E-101 Riboflavina: Se utiliza como colorante. Actualmente casi siempre es de origen sintético.
E-322 Lecitina: Actualmente casi siempre se obtiene de la soja, pero, en caso de duda se debe consultar al fabricante.
Aditivos que pueden contener pescado:
Potenciadores del sabor (E-626, E-627, E-628, E-629, E-630, E-631, E-632, E-633, E-634, E-635): Se obtienen a partir de levaduras o de extractos de carne o de peces.
Dra. Teresa Garriga Baraut
Bienvenidos
Primera comunicación a los miembros de comité de asma
LEER POR FAVOR COMO SE REALIZAN LAS COLABORACIONES Y COMUNICADOS
Enlace de presentación: Presentacion1 (1143 descargas )
Premio Dr Ricardo Palacios Mejor Tesis en Alergología
PREMIO NACIONAL «Dr. Ricardo Palacios» a la MEJOR TESIS en ALERGOLOGÍA convocado por la Fundación SEAIC y Diater Laboratorio, año 2024.
Plazo de inscripción: hasta el 30 de septiembre de 2024.
ABIERTO PARA SOCIOS PRE-NUMERARIOS Y NUMERARIOS.
Nos complace anunciar la convocatoria del Premio Nacional «Dr. Ricardo Palacios» a la mejor tesis doctoral en Alergología, organizado por la Fundación de la Sociedad Española de Alergología e Inmunología Clínica (FSEAIC) y el Laboratorio DIATER, que tiene como objetivo fomentar la excelencia en la investigación en Alergología, reconociendo anualmente la tesis doctoral más destacada en este campo, ya sea realizada dentro o fuera de España.
Premio: diploma acreditativo y 5,000 € (importe en bruto sujeto a retenciones fiscales vigentes).
Requisitos: médicos especialistas o residentes en Alergología, miembros de la SEAIC (únicamente), con tesis defendida y calificada entre el 1 de septiembre de 2023 y el 30 de julio de 2024.
La convocatoria está abierta a todos los médicos especialistas y residentes en Alergología miembros de la SEAIC, te invitamos a que le des difusión.
Descarga toda la información y la convocatoria a continuación:
Premio mejor TFG en Alergología
PREMIO NACIONAL al MEJOR TFG en ALERGOLOGÍA convocado por la Fundación SEAIC y Diater Laboratorio, año 2024.
Plazo de inscripción: hasta el 30 de septiembre de 2024.
Nos complace anunciar la convocatoria del Premio Nacional al Mejor TFG en Alergología, organizado por la Fundación de la Sociedad Española de Alergología e Inmunología Clínica (FSEAIC) y el Laboratorio DIATER. Este premio tiene como objetivo fomentar la excelencia en la investigación en Alergología, reconociendo anualmente el mejor Trabajo de Fin de Grado (TFG) en este campo, presentado, defendido y aprobado en cualquier universidad española durante el curso académico 2023-2024.
Premio: diploma acreditativo y 1,500€ (importe en bruto sujeto a retenciones fiscales vigentes). Se podrá conceder un accésit de 300€ brutos y diploma.
Requisitos: estudiantes matriculados en cualquier universidad española, con TFG defendido y aprobado en el curso académico 2023-2024 (septiembre 2023 a julio 2024), que aborde cuestiones relacionadas con la Alergología.
Descarga toda la información y la convocatoria a continuación:
![]() Bases Premio mejor TFG en Alergología 2024 (1332 descargas )
Bases Premio mejor TFG en Alergología 2024 (1332 descargas )
Los abejorros, culpables del aumento de alérgicos
Fuente: SALUD REVISTA.ES | Granada
La preocupación de los alergólogos radica en la gravedad que pueden alcanzar los posibles síntomas tras su picadura
La utilización de abejorros o Bombus en los invernaderos para la polinización de hortalizas , debido a que trabajan más rápido y a que pueden acarrear cargas más pesadas que otros polinizadores, ha provocado en los últimos años un aumento en el número de pacientes alérgicos a las picaduras de estos insectos himenópteros. «Los trabajadores de los invernaderos son muy susceptibles de hacerse alérgicos a las picaduras de estos insectos: al estar más expuestos el número de picaduras aumenta y en consecuencia también han aumentado las reacciones alérgica», explica la doctora Sergia Cruz, alergóloga del Hospital Torrecárdenas en Almería. Pero la preocupación de los alergólogos no radica en la prevalencia de este tipo de alergia, sino en la gravedad que pueden alcanzar los posibles síntomas. «Las reacciones alérgicas que pueden producir al picar son similares a las causadas por otros himenópteros comunes. Pueden provocar desde reacciones locales extensas que cursan con enrojecimiento, picor e hinchazón intenso en la zona afectada, hasta reacciones generalizadas que pueden llegar a ser realmente graves», alerta la alergóloga. Diagnóstico y tratamiento Por ello, los especialistas recomiendan no minimizar los síntomas que se puedan sentir con una primera picadura y acudir siempre al alergólogo. El objetivo es realizar un diagnóstico para establecer un tratamiento mediante inmunoterapia (vacunación) y dotar al paciente de un tratamiento de emergencia, como inyecciones de adrenalina, por si vuelve a ser picado por uno de estos insectos. Otras picaduras Existen insectos no himenópteros (ni abejorros, avispas, hormigas u abejas, por ejemplo) cuyas picaduras también pueden producir reacciones generalizadas por la picadura de estos son poco frecuentes, siendo los insectos implicados mosquitos, chinches, pulgas, moscas y la oruga procesionaria. En casos menos habituales, se han observado reacciones graves por cucaracha y tetraníquidos (ácaros y arañas rojas). Por la importancia de sus picaduras, y a pesar de pertenecer al orden Hymenoptera, las hormigas rojas se incluyen en este apartado. «Cuando hablamos de los riesgos de las picaduras pensamos solo en trabajos al aire libre, pero olvidamos que con la globalización recibimos a través del transporte múltiples mercancías de países lejanos que llegan a nuestros almacenes», afirma el doctor Darío Antolín, miembro del Comité Científico del Simposio Internacional de Alergia a Himenópteros y alergólogo del Hospital Universitario Príncipe de Asturias en Madrid. Test de repicadura La mayoría de los apicultores reciben picaduras de himenópteros a diario y no presentan diagnóstico de alergia a su veneno. Algunos estudios realizados en esta población sugieren que al estar sometidos al estímulo desarrollan cierta inmunidad. «La exposición mantenida y persistente al estímulo alergénico podría inducir un estatus de tolerancia inmunológica que afectaría a la respuesta inmunológica general de estas personas, explica el doctor Francisco Carballada, del Hospital Lucus Augusti, en Lugo. Esta es la base del test de repicadura que se practica a los pacientes que reciben tratamiento con inmunoterapia en los hospitales o que están en seguimiento. El test consiste en que la abeja pique al paciente, mediante una exposición controlada, para corroborar la efectividad de la vacuna. En la mayoría de los casos se confirma la inmunotolerancia, lo que mejora la adhesión al tratamiento por parte de los propios afectados. «En realidad, las vacunas para himenópteros están fabricadas con veneno puro de distintos tipos de avispas y abejas. Lo que se busca es que sea el propio sistema inmunológico del paciente el que se haga tolerante al veneno», concluye Carballada.
Aragón
Aragón
Centros con actividad asistencial pública en Alergología
Teruel
Hospital Obispo Polanco
- http://www.opolanco.es
- Avda. Ruiz Jarabo, s/n. 44002 Teruel
- 978621150
Zaragoza
Hospital Clínico Universitario Lozano Blesa
- http://www.hcuz.es
- Avda San Juan Bosco, 15. 50009 Zaragoza
- 976765700
Hospital Royo Villanova
- Avda San Juan Bosco, 15. 50009 Zaragoza
- 976765700
Asturias
Asturias
Centros con actividad asistencial pública en Alergología
Hospital de la Cruz Roja Española de Gijón
- http://www.hospitalcrgijon.com
- C/ Uría, 37. 33202 Gijón
- 985195000
Hospital Monte Naranco
- Avda. Dres. Fernández-Vega, 107. 33012 Oviedo
- 985106900
Hospital Universitario Central de Asturias
- http://www.hca.es
- C/ Celestino Villamil, s/n. 33006 Oviedo
- 985108000
Monografía de alergia cutánea
Ya está disponible para los socios registrados la monografía de la Fundación SEAIC sobre alergia cutánea. Acceda desde la Biblioteca Virtual.
V Congreso Nacional sobre Esofagitis Eosinofílica
El 18 de octubre de 2025 se celebrará en Sevilla el V Congreso Nacional sobre Esofagitis Eosinofílica (EoE), organizado por:
- European Consortium for Eosinophilic Diseases of the Gastrointestinal Tract (EUREOS)
- Asociación Española de Esofagitis Eosinofílica (AEDESEO)
- Hospital Universitario Virgen Macarena de Sevilla
- Asociación de Investigación Biomédica La Mancha Centro
Información útil:
- Modalidad: presencial y online en directo.
- Inscripción: gratuita para profesionales de la salud → Formulario de inscripción
- Acreditación: solicitada ante la Comisión de Formación Continuada del Sistema Nacional de Salud.
- Facilidades: el Congreso cuenta con la autorización de Farmaindustria para que los profesionales presenciales puedan gestionar con sus compañías farmacéuticas la cobertura de desplazamiento y alojamiento.
- Más información: web del Congreso
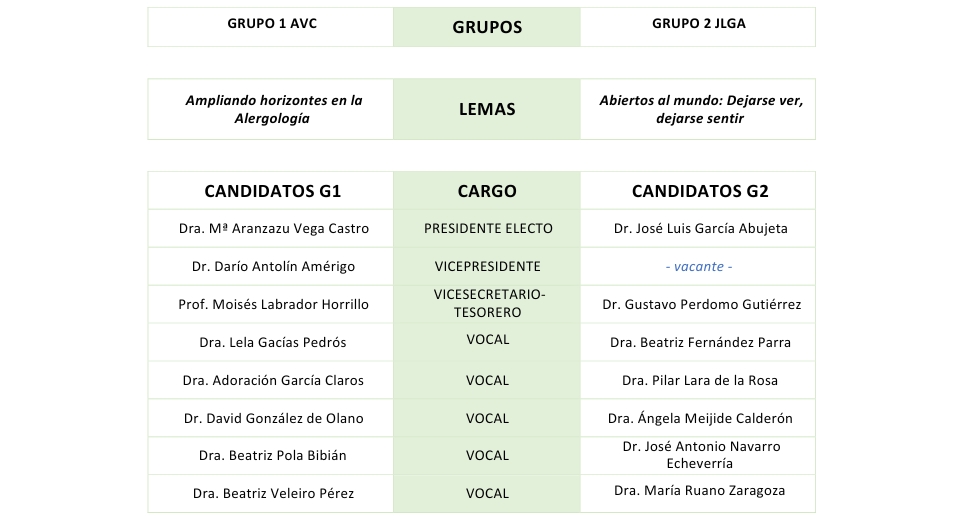
Campaña electoral 2024
Las elecciones SEAIC comienzan el 1 de octubre de 2024.
La Junta Directiva ha decidido extender la campaña electoral hasta finales de septiembre para que los socios tengan más tiempo para informarse e involucrarse en las distintas propuestas.
Aquí encontrarás información sobre el proceso de votación, los grupos electorales y aquello que los candidatos consideren relevante compartir sobre la campaña (la SEAIC facilita la difusión de mensajes electorales de los candidatos de ambas candidaturas).
PROCESO DE VOTACIÓN
Las votaciones online comenzarán el 1 de octubre. Recuerden que, aquellos que no voten online, podrán hacerlo en persona durante el simposio SEAIC en Bilbao.
La votación es de carácter voluntario y está abierta a todos los socios de la SEAIC.
⚠️ Se podrá elegir a toda la candidatura completa o bien seleccionar personas concretas de dicha candidatura.⚠️
Importante: solo se podrá optar por una modalidad de votación (online o presencial). Es decir, no se puede votar en algunas categorías online y en otras de forma presencial. Aquellos que voten online no podrán votar en persona en Bilbao.
- ONLINE: desde la web de la SEAIC - accediendo con el usuario y clave de socio. Permanecerá abierta durante 66 días.
Apertura: martes 1 de octubre a las 9:00 am
Cierre: 6 de noviembre a las 15:30 horas - PRESENCIAL: se podrá votar en el stand de la SEAIC en el marco del Simposio Internacional de la SEAIC en Bilbao (con DNI). Permanecerá abierta durante 2 días.
Apertura: jueves 7 de noviembre a las 9 a.m
Cierre: viernes 8 de noviembre a las 14:00 horas