resultados de la búsqueda: asma/wp-content/uploads/logos/Sitio web no disponible/Hospital Universitario Fundación Jiménez Díaz/profesionales/aviso-importante
Aragón
Aragón
Centros con actividad asistencial pública en Alergología
Teruel
Hospital Obispo Polanco
- http://www.opolanco.es
- Avda. Ruiz Jarabo, s/n. 44002 Teruel
- 978621150
Zaragoza
Hospital Clínico Universitario Lozano Blesa
- http://www.hcuz.es
- Avda San Juan Bosco, 15. 50009 Zaragoza
- 976765700
Hospital Royo Villanova
- Avda San Juan Bosco, 15. 50009 Zaragoza
- 976765700
Asturias
Asturias
Centros con actividad asistencial pública en Alergología
Hospital de la Cruz Roja Española de Gijón
- http://www.hospitalcrgijon.com
- C/ Uría, 37. 33202 Gijón
- 985195000
Hospital Monte Naranco
- Avda. Dres. Fernández-Vega, 107. 33012 Oviedo
- 985106900
Hospital Universitario Central de Asturias
- http://www.hca.es
- C/ Celestino Villamil, s/n. 33006 Oviedo
- 985108000
Alergia Cutánea
El Comité de Alergia Cutánea estudia las afecciones de la piel motivadas por los mecanismos inmunológicos de hipersensibilidad, entre las que caben destacar la dermatitis atópica, las dermatitis alérgicas por contacto y la urticaria, y el angioedema. El tratamiento de estas afecciones está asistiendo a una verdadera revolución en los últimos años lo que incrementa la relevancia de los proyectos de investigación, formación y educación sanitaria que lidera este comité. Por sus características, este comité tiene importantes relaciones con los comités de Alergia Infantil, de Alergia a los Alimentos, Alergia a los Medicamentos y de Angioedema.
Actualizado el día 26/09/2025
Monografía de alergia cutánea
Ya está disponible para los socios registrados la monografía de la Fundación SEAIC sobre alergia cutánea. Acceda desde la Biblioteca Virtual.
V Congreso Nacional sobre Esofagitis Eosinofílica
El 18 de octubre de 2025 se celebrará en Sevilla el V Congreso Nacional sobre Esofagitis Eosinofílica (EoE), organizado por:
- European Consortium for Eosinophilic Diseases of the Gastrointestinal Tract (EUREOS)
- Asociación Española de Esofagitis Eosinofílica (AEDESEO)
- Hospital Universitario Virgen Macarena de Sevilla
- Asociación de Investigación Biomédica La Mancha Centro
Información útil:
- Modalidad: presencial y online en directo.
- Inscripción: gratuita para profesionales de la salud → Formulario de inscripción
- Acreditación: solicitada ante la Comisión de Formación Continuada del Sistema Nacional de Salud.
- Facilidades: el Congreso cuenta con la autorización de Farmaindustria para que los profesionales presenciales puedan gestionar con sus compañías farmacéuticas la cobertura de desplazamiento y alojamiento.
- Más información: web del Congreso
Campaña electoral 2024
Las elecciones SEAIC comienzan el 1 de octubre de 2024.
La Junta Directiva ha decidido extender la campaña electoral hasta finales de septiembre para que los socios tengan más tiempo para informarse e involucrarse en las distintas propuestas.
Aquí encontrarás información sobre el proceso de votación, los grupos electorales y aquello que los candidatos consideren relevante compartir sobre la campaña (la SEAIC facilita la difusión de mensajes electorales de los candidatos de ambas candidaturas).
PROCESO DE VOTACIÓN
Las votaciones online comenzarán el 1 de octubre. Recuerden que, aquellos que no voten online, podrán hacerlo en persona durante el simposio SEAIC en Bilbao.
La votación es de carácter voluntario y está abierta a todos los socios de la SEAIC.
⚠️ Se podrá elegir a toda la candidatura completa o bien seleccionar personas concretas de dicha candidatura.⚠️
Importante: solo se podrá optar por una modalidad de votación (online o presencial). Es decir, no se puede votar en algunas categorías online y en otras de forma presencial. Aquellos que voten online no podrán votar en persona en Bilbao.
- ONLINE: desde la web de la SEAIC - accediendo con el usuario y clave de socio. Permanecerá abierta durante 66 días.
Apertura: martes 1 de octubre a las 9:00 am
Cierre: 6 de noviembre a las 15:30 horas - PRESENCIAL: se podrá votar en el stand de la SEAIC en el marco del Simposio Internacional de la SEAIC en Bilbao (con DNI). Permanecerá abierta durante 2 días.
Apertura: jueves 7 de noviembre a las 9 a.m
Cierre: viernes 8 de noviembre a las 14:00 horas
Atención del niño alérgico en Urgencias: El Papel del Triaje
Cuando diagnosticamos a un paciente de anafilaxia, le indicamos una serie de medidas de actuación en caso de que presente un nuevo episodio que incluyen la autoadministración de adrenalina y la necesidad de acudir a un centro médico para ser evaluado y tratado. Es más, asumimos que ese paciente será atendido correcta y rápidamente en Urgencias.
Somos poco conscientes del papel que han cobrado los sistemas de Triaje en la mayoría de los servicios de urgencias para hacer frente a la creciente presión asistencial. En los últimos 25 años se han implantado progresivamente múltiples sistemas de triaje hospitalario1, en base a los que se decide cuándo (tiempo de espera), quién (según la organización propia del centro) y dónde (Consulta o Sala de Exploración, Sala de Reanimación…) se atiende a los pacientes. La sala de triaje es donde debe identificarse al paciente con anafilaxia.
Nuestro hospital utiliza el Canadian Paediatric E.D. TRIAGE and Acuity Scale (PaedCTAS)2, con 5 posibles niveles de prioridad (I: Reanimación, de atención inmediata; II: Emergencia, con un tiempo de espera de atención inferior a 15 minutos; III: Urgencia, con un tiempo de espera de unos 30 minutos; IV: Semi urgencia, con tiempo de espera de 1 hora y finalmente, la No Urgencia, con una espera de hasta 2 horas). Estos tiempos recomendados para atender a los pacientes se cumplen en mejor o en peor medida según la afluencia. Según este sistema de triaje una anafilaxia es una patología de prioridad I.
Nos planteamos evaluar la calidad del triaje del niño alérgico a raíz del comentario de un paciente en la Consulta. Nuestro paciente, con anafilaxia previa por alergia a alimentos, siguió todos los pasos indicados en consulta y en su informe clínico, incluidos el uso de su autoinyector y traslado a Urgencias de nuestro hospital. Una vez allí, y tras el triaje, se le envió a la Sala de Espera y fue dado de alta en menos de 2 horas.
Al evaluar triaje en urgencias de pediatría de otros niños atendidos por alergia encontramos que más de la mitad de los niños con diagnóstico de anafilaxia habían recibido una prioridad III (categoría: urgente; prioridad intermedia; tiempo de espera estimado: 30 minutos). En la práctica, una prioridad intermedia supone esperar en la Sala de Espera el mismo tiempo que niños con enfermedades tan frecuentes como la fiebre, gastroenteritis y bronquiolitis. En periodos epidémicos esto se traduce en retrasos de horas por el gran aumento de la demanda asistencial. Además, este retraso podría condicionar peor respuesta a la adrenalina (por su administración más tardía), y aumentar el riesgo de mortalidad. En nuestro centro Sólo un caso de cada 3 fue identificado correctamente como prioridad I-II3.
El siguiente paso fue proponer medidas de mejora de 2 tipos:
- Formación del personal de enfermería que realiza labores de Triaje: Se destacaron la importancia del tiempo de evolución y la duración de síntomas, la importancia de la anamnesis obtenida de los padres sobre la apariencia del paciente al llegar a Urgencias….
- Modificaciones en el propio Sistema de Triaje (no fue posible la implementación de modificaciones en el Soporte informático, por lo que se introdujo material de apoyo (chuleta) al personal encargado del triaje): Se destacó la importancia de la afectación multisistémica, la prescripción y/o el uso de dispositivos de adrenalina autoinyectable y la duración de síntomas.
Al reevaluar el funcionamiento de nuestra urgencia 12 meses después de estas medidas, encontramos que el número de niños correctamente triados había pasado del 36.2 % al 72.2 % y lo que es más importante, que el tiempo de espera medio se había reducido de 8 min a 1 min. También se observaron modificaciones en la ubicación de los pacientes, que, en lugar de ser enviados a la sala de espera, quedaron en observación4.
Nuestros resultados no son extrapolables a otros hospitales dado que en nuestro país se utilizan varios sistemas de triaje distintos, incluyendo, entre otros, el Sistema Canadiense de Triaje Pediátrico, Sistema Estructurado de Triaje-Modelo Andorrano de Triaje, Sistema Manchester de Triaje5. Cada uno de estos sistemas consta de procesos propios en su aplicación e idiosincrasia a la hora de gestionar la prioridad de los pacientes y de las patologías. Además, precisan de formación específica para su aplicación.
Como alergólogos:
- Debemos ser conscientes de que el triaje del servicio de urgencias es clave para que el paciente diagnosticado de anafilaxia reciba el tratamiento adecuado en el momento preciso.
- Deberíamos conocer el sistema de triaje que se utiliza en nuestros hospitales y saber si tiene (o no) problemas en la identificación de los pacientes con anafilaxia.
- Debemos colaborar con el personal de urgencias para, desde nuestro conocimiento de las peculiaridades de la anafilaxia, proponer medidas de mejora que faciliten la identificación precoz y por tanto, la atención correcta de los pacientes.
Dra. Esozia Arroabarren Alemán, Servicio de Alergia, Complejo Hospitalario de Navarra, Pamplona. Comité de Alergia Infantil SEAIC
Bibliografía
- Mínguez Navarro MC, Guerrero Márquez G, Ignacio Cerro MC, editores. Manual de Clasificación y Triage del paciente Pediátrico en Urgencias. Primera Edición. Majadahonda (Madrid): Ergon; 2015.
- Warren DW, Jarvis A, LeBlanc L, Gravel J; CTAS National Working Group; Canadian Association of Emergency Physicians; National Emergency Nurses Affiliation; Association des Médecins d’Urgence du Québec; Canadian Paediatric Society; Society of Rural Physicians of Canada. Revisions to the Canadian Triage and Acuity Scale paediatric guidelines (PaedCTAS). CJEM. 2008; 10(3):224-43.
- Arroabarren E, Alvarez-Garcia J, Anda M, de Prada M, Ponce MC, Palacios M. Quality of the Triage of Children With anaphylaxis at the Emergency Department. Pediatr Emerg Care. 2018 May 15. doi: 10.1097/PEC.0000000000001442
- Arroabarren E, Alvarez-García J, Anda M, de Prada M, Ponce C, Alvarez-Puebla MJ. Impact of specific training in anaphylaxis of the Triage nursing staff in a Tertiary Hospital’s Paediatric Emergency Department. J Investig Allergol Clin Immunol. 2018 May 2:0. doi: 10.18176/jiaci.0271.
- https://www.aetsa.org/download/publicaciones/antiguas/AETSA_2011-4_Triage_def.pdf (ultimo acceso: junio 2019)
LAS INMUNODEFICIENCIAS ASOCIADAS A AGENTES BIOLÓGICOS INMUNOMODULADORES COMO FENOCOPIAS DE LAS INMUNODEFICIENCIAS PRIMARIAS
http://www.thehistoryblog.com/archives/14881
En nuestro sistema sanitario, las consultas de Inmunología atienden principalmente pacientes con una respuesta inmunitaria deficiente. Las inmunodeficiencias primarias (IDP) asociadas a errores innatos de la inmunidad son una causa importante de estas consultas, pero no la única. En la práctica clínica, en la mayoría de los casos, habrá que buscar una causa secundaria de la misma.
Las inmunodeficiencias primarias se incluyen bajo el concepto más global de errores innatos de la inmunidad (EII), que representa un grupo de más de 485 enfermedades definidas genéticamente (1). La inmunodeficiencia secundaria (IDS) podría definirse como una alteración transitoria o persistente de la función de las células o tejidos del sistema inmunitario, causada por factores extrínsecos al mismo (2). Estos grupos de factores incluyen agentes ambientales, malnutrición, trastornos metabólicos, uso de medicamentos inmunosupresores e inmunomoduladores, infecciones crónicas, neoplasias malignas, traumatismos graves o simplemente el envejecimiento. El enfoque inicial recomendado para la valoración de una IDS sigue las mismas directrices que en el caso de las IDP. Los hallazgos de la historia clínica, en particular los patrones de infecciones, y los hallazgos en la exploración física son esenciales para guiar la evaluación del sistema inmunitario.
Dentro de las causas de IDS, la generalización del uso de agentes biológicos inmunomoduladores para tratar enfermedades autoinmunes, inflamatorias o neoplasias hematológicas en las últimas dos décadas, se ha acompañado de un mayor riesgo de infecciones e inmunodeficiencias secundarias (3); el abordaje de este importante tema en una entrada a un blog es complicado como revisión sistemática, así que optaré por una exposición narrativa.
Examinar qué enfermedades infecciosas acompañan a una determinada inmunodeficiencia primaria ha permitido obtener información valiosa sobre los componentes del sistema inmunológico que son claves en la respuesta frente a microrganismos particulares. Gracias a ello sabemos que los defectos en moléculas críticas en la ontogenia, activación y proliferación de los linfocitos T, como las mutaciones en el gen IL2RG del cromosoma X humano, que codifica la cadena gamma común (γc) del receptor de interleucina-2 (IL-2R), o una inactivación mutación en la quinasa Jak3, que se asocia físicamente con γc, causan una depleción profunda en la función del sistema inmune, que de forma sindrómica se denomina Inmunodeficiencia combinada severa. Los defectos en el desarrollo de las células B, como la mutación en el gen que codifica una proteína tirosina quinasa llamada BTK (tirosina quinasa de Bruton), que transduce la señal a través del receptor de células pre-B, provocan deficiencias en la producción de anticuerpos que causan una incapacidad para eliminar bacterias extracelulares y algunos virus cuya eliminación eficaz requiere anticuerpos específicos.
Es instructivo considerar los defectos inmunológicos en el contexto de los principales tipos de inmunidad afectada, ya que estos pueden conducir a distintos patrones de infección y enfermedad clínica.
Las terapias biológicas no causan La inmunosupresión global característica de la terapias inmunosupresoras clásicas como los glucocorticoides, azatioprina, metotrexato o ciclosporina (4). Del mismo modo a cómo actúan las mutaciones específicas en cada IDP, las terapias biológicos se dirigen selectivamente a células y vías del sistema inmunitario para lograr efectos terapéuticos específicos, pudiéndose comportar en ciertos casos como fenocopias de la IDP original.
Por ejemplo, el OKT3 (muromonab-CD3) es un anticuerpo monoclonal IgG2 murino que se une a la cadena CD3-epsilon del complejo receptor de células T-CD3 y produce una linfopenia rápida y profunda de las células T (4). Como cabría esperar, la inmunosupresión asociada provoca una mayor susceptibilidad a las infecciones, en particular por virus herpes y bacterias. Igualmente, Alemtuzumab (anti-CD52) es un anticuerpo monoclonal humanizado utilizado para la terapia de inducción del trasplante de órganos sólidos, depletor de células T.
Basiliximab es un monoclonal contra la cadena alfa del receptor de la interleucina (IL)-2 (CD25). La activación de las células T conduce normalmente a una regulación al alza del receptor de IL-2 de alta afinidad que implica la expresión de la cadena alfa del receptor de IL-2 (CD25) que se asocia con las cadenas beta y gamma del receptor de IL-2. Basiliximab inhibe la generación de células T citotóxicas antígeno-específicas.
Las células T necesitan dos señales para activarse. La primera implica la unión directa del receptor de antígeno de la célula T (TcR) con el complejo formado por el péptido antigénico y determinadas moléculas de superficie (moléculas HLA), presentado por las células presentadoras de antígeno (APC). La segunda señal implica vías coestimuladoras específicas. El CD28 de las células T se une a sus ligandos, el CD80 (B7-1) y el CD86 (B7-2), en las APC. La presencia de ambas señales proporciona una señal de activación a las células T. Por el contrario, la molécula CTLA-4 en las células T compite por la unión a las mismas moléculas CD80/CD86, y esta interacción provoca la supresión de la activación. Abatacept y Belatacept son proteínas de fusión del dominio extracelular de CTLA-4 humano unido a una porción Fc modificada de IgG1 humana (CTLA-4-Ig), que interfieren la activación de las células T interrumpiendo la coestimulación CD28. Abatacept no obstante tiene un perfil de seguridad bien establecido en diferentes ensayos y metanálisis. Belatacept por su parte, con mayor capacidad de unión a CD80/CD86, no debe administrarse a pacientes con serología de VEB negativa candidatos a trasplante de un donante con serología VEB positiva, por el mayor riesgo de desarrollar trastornos linfoproliferativos asociados a VEB (4).
Las Janus quinasas (JAK) son una familia de tirosina quinasas no receptoras, cruciales en el desencadenamiento de las señales generadas por el receptor de diversas citoquinas y transducidas aguas abajo a través de las proteínas STAT (transductoras de señales y activadoras de la transcripción). Las STAT fosforiladas se disocian de sus subunidades receptoras y se translocan al núcleo celular para regular la transcripción génica. La familia JAK se compone de cuatro miembros: JAK1, JAK2, JAK3 y tirosina quinasa 2 (Tyk2). Tofacitinib, inhibidor JAK aprobado para la artritis reumatoide que actúa principalmente sobre JAK1 y JAK3, se ha asociado con un mayor riesgo de infección por herpes zoster (4).
Con respecto a las células B, Ibrutinib es una pequeña molécula inhibidora de la tirosina quinasa de Bruton (BTK). El ibrutinib se une a la actividad de la BTK y la inhibe de forma irreversible, impidiendo así tanto la activación de las células B como la señalización mediada por éstas. La BTK es necesaria para la señalización del receptor de células B, desempeña un papel clave en la maduración de las células B. Se han descrito casos de neutropenia e hipogammaglobulinemia. Igualmente, Idelalisib interrumpe la señalización del receptor de células B, de forma similar a ibrutinib, aunque a través de la inhibición de la isoforma delta de la fosfatidilinositol 3-cinasa. Idelalisib se asocia a un aumento de las infecciones oportunistas (4). Belimumab por su parte, es un anticuerpo monoclonal humano que se une al BlyS humano soluble e inhibe su actividad biológica. Está aprobado para el tratamiento de pacientes con LES. La celulitis y la neumonía son las infecciones graves más frecuentes (4).
Pero sin duda, la familia de biológicos con más impacto en la casuística de las consultas de inmunodeficiencias son los anti CD20 y en particular, rituximab. Este anticuerpo monoclonal quimérico (Ig)G1 CD20 específico actúa sobre las células B desde la fase pre-célula B hasta la fase pre-célula plasmática. Rituximab agota las células B de la sangre periférica, y su normalización posterior suele requerir de seis a nueve meses o más, con una variabilidad significativa entre pacientes. Con las células B deplecionadas, la capacidad del paciente para responder a las vacunas, en particular de polisacáridos, se ve afectada. Además, es frecuente cierto grado de hipogammaglobulinemia transitoria, que en algunos pacientes es persistente y significativa clínicamente, dando lugar a infecciones que requieren profilaxis antibiótica y/o terapia sustitutiva (4).
Así, hasta un largo etcétera de terapias biológicas que actúan selectivamente sobre la vía de diferentes citoquinas (interleuquina 6, interleuquina 1, factor de necrosis tumoral alfa, interleuquinas 4 y 13, interleuquina 17), integrinas (alfa-4 integrinas, CD11 alfa), o proteínas del complemento, entre otros, bloqueando con una precisión quirúrgica el normal funcionamiento del sistema inmune.
Disponemos de evidencias y de herramientas para tratar de disminuir el riesgo de IDS asociado al uso de medicamentos biológicos. Este riesgo se debe prevenir con profilaxis antibiótica adecuada, y se debe prever mediante una planificación del programa de vacunación adaptada al tipo de defecto en la respuesta inmune descrito para el fármaco.
Igualmente, las recomendaciones en cuanto a vacunación de pacientes en grupos de riesgo, tanto centrales como de las comunidades autónomas, deberían estar actualizadas acorde a la evidencia disponible e integrar la opinión de expertos con conocimiento en el funcionamiento del sistema inmune y en el mecanismo de acción de estos fármacos.
REFERENCIAS
- Tangye SG, Al-Herz W, Bousfiha A, Cunningham-Rundles C, Franco JL, Holland SM, Klein C, Morio T, Oksenhendler E, Picard C, Puel A, Puck J, Seppänen MRJ, Somech R, Su HC, Sullivan KE, Torgerson TR, Meyts I. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022 Oct;42(7):1473-1507. doi: 10.1007/s10875-022-01289-3. Epub 2022 Jun 24. PMID: 35748970; PMCID: PMC9244088.
- Tuano KS, Seth N, Chinen J. Secondary immunodeficiencies: An overview. Ann Allergy Asthma Immunol. 2021 Dec;127(6):617-626. doi: 10.1016/j.anai.2021.08.413. Epub 2021 Sep 3. PMID: 34481993.
- Cannon L, Pan A, Kovalick L, Sarkissian A, Wu EY. Secondary immunodeficiencies and infectious considerations of biologic immunomodulatory therapies. Ann Allergy Asthma Immunol. 2023 Jun;130(6):718-726. doi: 10.1016/j.anai.2023.02.010. Epub 2023 Feb 18. PMID: 36801438; PMCID: PMC10247415.
- https://www.uptodate.com/contents/secondary-immunodeficiency-induced-by-biologic-therapies (acceso abril/2024).
Docencia
| Presidenta: | Dra. Marta Ferrer Puga |
| Secretaria: | Dra. Carmen D’Amelio Garófano |
| Vocales: | 1. Dra. Carmen Andreu Balaguer 2. Dra. Mónica Antón Gironés 3. Dra. Alicia Armentia Medina 4. Dra. Teresa Carrillo Díaz 5. Dr. Tomás Chivato Perez 6. Dr. Carlos Colás Sanz 7. Dr. Ignacio Dávila González 8. Dr. Francisco Javier Fernández Sánchez 9. Dr. Gabriel Gastaminza Lazarte 10. Dra. María José Goikoetxea Lapresa 11. Dra. Valentina Gutiérrez Vall de Cabres 12. Dr. Luis Pietro Andrés 13. Dra. María José Torres Jaén 14. Dra. Carmen Vidal Pan 15. Dr. José Manuel Zubeldia Ortuño |
Actualizado el día 04/12/2023
De la Especialidad y Tutores de Residentes
| Presidenta: | Dra. Teresa Carrillo Díaz |
| Secretaria: | Dra. Olga Luengo Sánchez |
| Vocales: | 1. Dra. Nagore Bernedo Belar 2. Dra. Nieves Cabañes Higuero 3. Dra. Miriam Clar Castelló 4. Dra. Leticia Domínguez Cereijo 5. Dra. Rosario López Rico 6. Dra. Ana Morales Hidalgo 7. Dra. Cristina Navarro Garrido 8. Dr. José María Olaguibel Rivera 9. Dra. Mariona Pascal Capdevila 10. Dra. Mª del Pilar Serrano Delgado |
Documentación de la Comisión
![]() Información exclusiva para socios de la SEAIC. Si no lo ha hecho, identifíquese aquí.
Información exclusiva para socios de la SEAIC. Si no lo ha hecho, identifíquese aquí.
Actualizado el día 19/11/2025
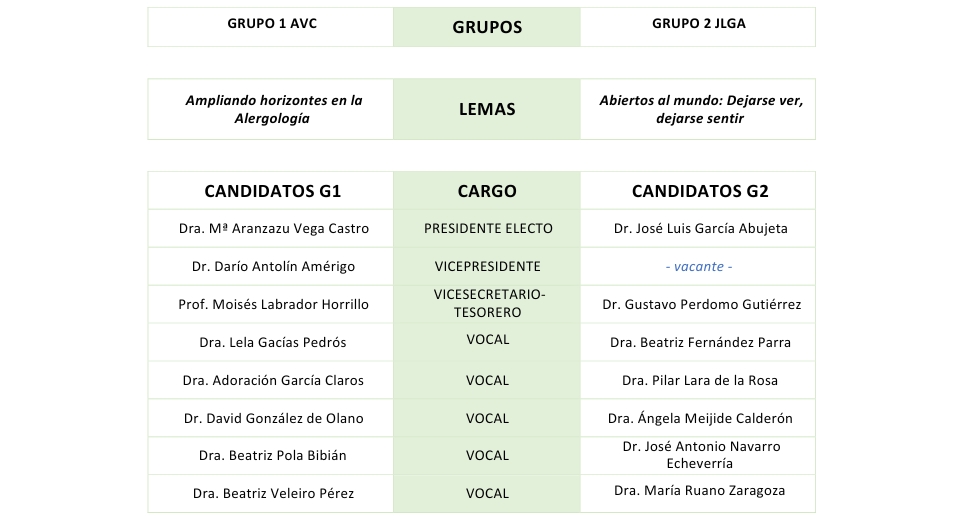
Junta Directiva
La Junta Directiva de la SEAIC representa, dirige y administra la sociedad. En la actualidad se estructura de la siguiente manera:
| Presidente: | Prof. Ignacio Jesús Dávila González (Salamanca) |
| Presidenta electa: | Dra. Arantza Vega Castro (Guadalajara) |
| Vicepresidente: | Dr. Darío Antolín Amérigo (Madrid) |
| Secretaria: | Prof.a Carmen Andreu Balaguer (Alicante) |
| Vicesecretario-tesorero: | Prof. Moisés Labrador Horrillo (Barcelona) |
| Vocales: | Dra. Beatriz Fernández Parra (Ponferrada)
Dra. Beatriz Pola Bibián (Zaragoza) Dra. Beatriz Veleiro Pérez (A Coruña) Dra. Inmaculada Sánchez Machín (Tenerife) Dra. Mónica Venturini Díaz (La Rioja) Dra. Nagore Bernedo Belar (Álava) Dra. Rosa Miriam Blanco Pérez (Cáceres) Dr. Antonio Letrán Camacho (Cádiz) Dr. David González de Olano (Madrid) Dr. José Antonio Navarro Echeverría (San Sebastián) |
Actualizado el día 12/11/2022
Influencia del Clima sobre la Alergia
Cruz Auñon J, Diaz Rubio M, Farrerons Co F. Influencia del Clima sobre la Alergia. 1ª edición. Sevilla: Graficas Tirvia; 1951.
Angioedema
Al igual que el Comité de Anafilaxia, el Comité de Angioedema es de los últimos en haberse creado, formando parte anteriormente como grupo de trabajo dentro del Comité de Alergia Cutánea. El avance y la mayor abundancia de los conocimientos científicos sobre el angioedema motivan la creación de este comité, cuyos objetivos principales son dar visibilidad a una enfermedad poco conocida, así como seguir investigando en sus causas y mecanismos, lo que permite mejorar la calidad de vida y la atención sanitaria de las personas que la padecen.
Actualizado el día 09/01/2025
XIX Allergy Review
El día 9 de mayo de 2020 tendrá lugar en Madrid la XIX edición de la reunión Allergy Review, convocada por la Fundación de la Sociedad Española de Alergología e Inmunología Clínica, con el apoyo de Mundipharma.
Micrófono Abierto en Investigación 2025
¡En mayo se abre el plazo para participar del III Micrófono Abierto en Investigación!
Del 15 de mayo al 30 de junio de 2025 estará abierta la convocatoria para participar en la 3ª edición del Micrófono Abierto en Investigación de la Fundación SEAIC, en el marco del 35º Congreso Nacional de la SEAIC que se celebrará en Granada.
Una oportunidad única para presentar tu proyecto de investigación en un formato breve, dinámico… ¡Y con un premio de 10.000 € al mejor proyecto!
¿Quién puede participar?
- Socios numerarios o adheridos de la SEAIC.
- Con proyectos sin financiación previa y de duración máxima de 2 años.
- Con preferencia para alergólogos jóvenes y predoctorales ≤ 40 años.
Cuando se abra el plazo, deberás presentar:
- Una memoria breve de tu proyecto (máximo de 3 páginas).
- Tu CV resumido (formato libre o CVA-ISCIII).
¿Cómo presentar tu solicitud?
- El enlace al formulario se publicará en la web de la SEAIC y en los canales habituales de comunicación, en los días previos a la apertura de la convocatoria.
Becas de asistencia al Simposio Murcia 2017
Estimados socios,
La Fundación de la SEAIC envía los boletines de solicitud de becas de asistencia al Simposio de Murcia de la Fundación de la SEAIC (inscripción+alojamiento+transporte), con el patrocinio de GSK, para Seniors y para Juniors. Las becas Junior llevan unida la asistencia a la II Escuela de Asma, que se celebrará el Jueves 26 de Octubre, previo al inicio del Simposio. Adjuntos podéis encontrar los formularios y los criterios para solicitarlas. Fecha límite para envío de solicitudes: 1 de Julio.
El boletín relleno, será enviado a silvina.wenk@seaic.org con copia a seaic@seaic.org.
Esperamos sea de vuestro interés.
![]() Solicitud II Escuela de Asma-CAJMIR (3050 descargas )
Solicitud II Escuela de Asma-CAJMIR (3050 descargas )
![]() Solicitud beca senior 2017 (3022 descargas )
Solicitud beca senior 2017 (3022 descargas )
Actualización Tratado de Alergología
Ya está disponible en nuestra web la 2ª edición del Tratado de Alergología de la SEAIC. Los capítulos se pueden consultar y descargar en PDF con las credenciales de socio.
Curso on-line artículos científicos
Se encuentra disponible el curso on-line «Como escribir y publicar un artículo de calidad: el proceso editorial». Su objetivo es que el facultativo cuente con las habilidades necesarias para afrontar la preparación de la publicación de su experiencia clínica o investigadora. El curso está acreditado con 3,9 créditos y cuenta con el aval de SEAIC.
Acta Reunión Comité Alergia Cutánea. San Sebastián 2016
![]() Contenido disponible sólo para socios.
Contenido disponible sólo para socios.
La anafilaxia, alergia “letal”, aumenta en España por alimentos y medicinas
La anafilaxia o reacción alérgica grave potencialmente mortal es causada por picaduras de insectos, pero también por alimentos y fármacos, dos factores estos últimos que provocan cada vez más casos en España, han alertado los expertos con motivo de la Semana Mundial de la Alergia
Bajo el lema “Anafilaxia: cuando la alergia es letal”, médicos y pacientes han destacado la importancia de dar a conocer los síntomas de esta reacción que puede afectar a personas de todas las edades y, según una de las pocas estadísticas que existen sobre este tema, una vez en su vida a tres de cada mil habitantes. Las alergias han sido calificadas como “la epidemia del siglo XXI” por el expresidente de la Sociedad Española de Alergología e Inmunología Clínica (Seaic) y decano de la Facultad de Medicina de la Universidad San Pablo CEU, Tomás Chivato. En concreto, la anafilaxia es “una explosión alérgica que afecta a todo el organismo y que se produce de forma muy rápida, brusca y que puede ser fatal”, ha resaltado la jefa del Servicio de Alergia del Hospital Clínico San Carlos (Madrid), Montserrat Fernández. Esta doctora, una de las pocas profesoras de alergias -es una asignatura que no se imparte en todas las universidades-, ha subrayado la “dificultad” de definir la anafilaxia, pues puede presentarse con un cuadro clínico complejo, desde síntomas a nivel cutáneo (enrojecimiento, picor, hinchazón) hasta respiratorios (ahogo), digestivos (náuseas, diarrea) y circulatorios (mareo, baja de tensión). Se da la circunstancia de que muchas personas sufren alguno de esos síntomas de manera leve y no llegan a acudir a un médico o a un hospital, por lo que las estadísticas sobre alergias son complicadas de hacer, aunque España y una decena de países europeos participan desde hace poco en un registro online. En España se cuenta, además, con la realizada por el Hospital Fundación Alcorcón (Madrid), cuyos datos pueden extrapolarse al resto de España, según Fernández, y que nos dicen que 113 personas sufren al año una anafilaxia por cada 100.000 habitantes; que de cada 1.000 personas que acuden a urgencias una es por ello; o que de cada 5.000 ingresos hospitalarios 1,5 es por esta “alergia letal”. En España, los casos más habituales no son por picaduras de abejas o avispas (5/10 % frente al 25 % de la UE), sino por alimentos (especialmente entre niños y jóvenes) y medicamentos (adultos), según se recoge en la nueva guía para pacientes “¿Qué es la Anafilaxia?”. Frutos secos, leche, huevo, frutas, pescados y mariscos son los alimentos que más alergias provocan, y los antibióticos y antiinflamatorios entre los medicamentos. “La pregunta del millón”, ha reconocido Montserrat Fernández, es saber por qué está aumentando el número de casos de anafilaxia, aunque ha apuntado que puede deberse a un “cambio de respuesta inmunológica” ante el tipo de vida occidental, y por “una mezcla de factores genéticos y ambientales”.