resultados de la búsqueda: profesionales/cme-jiaci/wp-content/uploads/logos/Hospital Universitario Fundación Jiménez Díaz
Alergia a las carnes
El valor nutricional de la carne se debe a que está formada por proteínas de alto valor biológico como fuente de aminoácidos esenciales, vitamina B y hierro, muy aprovechables por nuestro organismo.
La alergia a las carnes es una alergia alimentaria poco frecuente en los países desarrollados, a pesar de su elevado consumo. En la infancia, suele asociarse con dermatitis atópica y tiende a desaparecer en los primeros años de vida. No obstante, la alergia a la carne también puede aparecer “de novo” en la edad adulta.
En la actualidad, se desconoce la incidencia general y la prevalencia de la alergia a las carnes en la población general. Entre los pacientes con alergia alimentaria, se ha informado de alergia a la carne en el 3-15% de casos pediátricos y en el 3% de casos adultos.
Su baja prevalencia puede atribuirse, en parte, al hecho de que la mayoría de las carnes se consumen cocidas, y cocinarlas, normalmente aunque no siempre, reduce su alergenicidad.
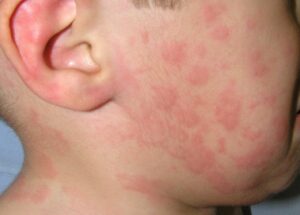
Las reacciones pueden ser muy variables, desde un cuadro leve de picor en la boca y garganta o algunos habones aislados, pasando por angioedema (inflamación) de labios, párpados… hasta urticaria más extensa, rinoconjuntivitis, asma, síntomas digestivos, y/o cuadros muy graves de anafilaxia.
El tipo de carne que causa la alergia, presenta variabilidad geográfica, en relación con los diferentes hábitos de consumo. En nuestro medio, la alergia a las carnes de mamíferos es más frecuente que la alergia a las aves de corral. De acuerdo con esto, se ha descrito alergia a carne de canguro en Australia y a carne foca y ballena en Alaska.
La alergia a carne de vaca es la más comúnmente reportada, con una prevalencia que oscila entre el 1,5 y el 6,5% entre los niños con dermatitis atópica o con alergia alimentaria. Sin embargo, la alergia a carne de ternera, puede llegar al 20% en niños con alergia a leche de vaca. También se han informado casos de alergia a carne de cerdo, cordero, conejo, pollo y pavo, pudiendo ser alérgico a la carne de una especie o de varias.
- Alergia a carne de vacuno: frecuentemente debida a una proteína (albúmina sérica bovina), que se inactiva con el calor, pudiendo producir reacciones si la carne está cruda o poco cocinada, tolerándose perfectamente cuando la carne está bien cocinada. Se ha demostrado que la homogeneización y liofilización (empleadas en la producción de alimentos para bebés) disminuyen el contenido de albúminas e inmunoglobulinas en la carne, al igual que la digestión con pepsina. Algunos niños con alergia a proteínas de leche de vaca pueden presentar también reacciones con ternera e incluso con otras carnes, pero esto solo ocurre en un pequeño número de casos, generalmente cuando el alérgeno responsable de su alergia es la albúmina sérica bovina.
- Alergia a carne de cerdo: se pueden producir sensibilizaciones primarias a la albúmina sérica y a las inmunoglobulinas por vía inhalada o cutánea, que en primer lugar ocasionan alergia respiratoria y, de forma secundaria, y por reactividad cruzada, reacciones alérgicas tras la ingestión de carne de cerdo poco cocinada. El denominado “síndrome gato-cerdo” es la asociación de alergia respiratoria a gato y alergia alimentaria a la carne de cerdo. Característicamente, estos pacientes pueden no tener síntomas de rinitis al contacto con gatos, ya que la mayoría de los pacientes con síntomas alérgicos a la caspa de gato están sensibilizados a un alérgeno diferente. Se ha descrito también una asociación entre la alergia respiratoria a gato y la carne de cordero o de caballo, y una alergia respiratoria a hámster y alergia a carne de caballo.
- Alergia a carne de cordero: es la más infrecuente aunque, en ocasiones, se asocia a alergia a carne de ternera y cerdo.
- Alergia a carne de pollo: aunque la alergia a huevo es muy frecuente en la infancia, casi todos los niños alérgicos a huevo toleran la carne de pollo. Por otro lado, se han descrito adultos alérgicos a la carne de ave, con tolerancia de huevo y sin alergia a plumas o caspa de ave, cuyos alérgenos responsables, no han sido identificados. Por otra parte existe un síndrome poco frecuente, el “síndrome pescado-pollo”, donde las personas presentan síntomas alérgicos tanto con carne de pollo como pescado y en el que los alérgenos principalmente responsables son las parvalbúminas.
- Síndrome ave-huevo: debido al contacto frecuente con pájaros en el domicilio o en criaderos, hay un grupo minoritario de alérgicos que se sensibilizan por vía inhalada a proteínas de las plumas y/o excrementos de las aves y posteriormente desarrollan alergia al huevo y a la carne de pollo u otras aves (loros, periquitos, canarios, palomas, aves de corral, etc.). Afecta a personas adultas que presentan síntomas con la yema de huevo cruda o poco cocinada, a diferencia de lo que ocurre con la forma de alergia más habitual al huevo que se produce en la infancia y es por sensibilización a proteínas de la clara.
- Síndrome Alfa-gal: en general, las reacciones alérgicas a las carnes suelen ser reacciones de hipersensibilidad inmediata, que ocurren en la primera hora tras la ingesta. En este síndrome, las reacciones tras ingerir carnes de mamíferos (ternera, cerdo, cordero) tienen lugar más tarde de lo habitual, entre 3, 6 y hasta 8 horas después de haberlas ingerido, debido a la unión del alérgeno alfa-gal a los lípidos, que se absorben más lentamente y mediante mecanismos diferentes en comparación con las proteínas. Pueden producirse desde urticarias más o menos extensas hasta cuadros graves de anafilaxia. Estas personas reaccionan a un carbohidrato presente en las carnes de mamíferos no primates llamado galactosa alfa 1-3 galactosa (alfa-gal), al que se han sensibilizado. La sensibilización se ha producido en algún momento, tras la picadura de garrapatas que llevan alfa-gal en su saliva y la inoculan con la picadura. Además de reaccionar a los alimentos, los pacientes sensibilizados a alfa-gal también pueden tener reacciones al anticuerpo monoclonal cetuximab, gelatinas, coloides intravenosos, heparina, válvulas cardiacas de origen bovino o porcino y otros agentes hemostáticos derivados de productos animales.
En la alergia a las carnes, a diferencia de lo que sucede con otros alimentos, se han identificado alérgenos tanto de proteínas como de carbohidratos. Las albúminas séricas y las inmunoglobulinas parecen ser las principales proteínas alergénicas en la carne de ternera y otras carnes de mamíferos (cerdo, cordero, conejo), con una gran homología entre sí, lo que explicaría la alta reactividad cruzada entre carnes de mamíferos. Estas proteínas también podemos encontrarlas en aves como el pollo, aunque con una menor homología con las de los mamíferos, lo que explicaría que los individuos tiendan a reaccionar a carnes de mamíferos o aves pero rara vez a ambas.
El diagnóstico general de alergia a las carnes se realizará en base a la historia clínica y mediante la realización de pruebas cutáneas (prick-test) con extractos de las distintas carnes y la medición en sangre de los niveles de anticuerpos IgE específicos para cada uno de ellos. En ocasiones es necesaria la realización de una prueba cutánea con el alimento en freso (prick-prick) y si hay dudas, también puede ser necesario realizar un test de exposición oral controlada, siempre bajo supervisión del especialista.
En las reacciones con preparados cárnicos, como embutidos o salchichas, habrá que descartar una alergia a algún alimento o compuesto añadido o en el proceso de elaboración, como las proteínas de la leche, el huevo o los hongos.
Ante un diagnóstico confirmado, hoy por hoy, el tratamiento es evitar la ingesta de la carne responsable y los productos elaborados con ella (embutidos, salchichas, gelatinas,…). No obstante, conocer los alérgenos responsables, puede permitir una dieta más flexible, de manera que hay pacientes, cuya alergia depende de las albúminas séricas, que toleran la carne bien cocinada, y otros, presentan síntomas o no dependiendo del grado de cocinado y otro grupo no la tolera de ninguna forma. En algunos casos, se deberán eliminar de la dieta varios tipos de carnes, en cuyo caso, podría ser necesario aportar a la dieta suplementos de hierro y vitamina B.
Dra. Angélica Feliú Vila. Hospital Universitario del Tajo, Madrid. Comité de Alergia Infantil. SEAIC
Bibliografía
- Scott P Commins, MD, PhD. Allergy to meats. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed),Up To Date, Anna M Feldweg, MD. (Accessed on april of 2024).
- Scott H Sicherer, MD, FAAAAI. Food allergens: Clinical aspects of cross-reactivity. In: UpToDate, Robert A Wood, MD (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april of 2024).
- Julie Wang, MD. Component testing for animal-derived food allergies. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april 2024).
- García Figueroa, B.E, Mateo Borrega, M.B, 2021. Alergia a las carnes. Zubeldia, J.M, Baeza, M.L, Chivato, T, Jáuregui, I, Senent, C.J. Libro de las enfermedades alérgicas (287-292).
XXV Reunión Anual AEDAF
El próximo 22 de abril de 2023 tendrá lugar la XXV edición de la Reunión Anual de pacientes con Angioedema Hereditario AEDAF en el Hospital Universitario La Paz, en Madrid. Aquellas personas interesadas en asistir, pueden comunicarlo al e-mail dir@angioedema-aedaf.org.
Estudio de alergia a betalactámicos en niños
La sospecha de alergia a betalactámicos es un motivo frecuente de consulta en niños, descartándose en la mayoría de los casos tras el estudio alergológico. Seguir el mismo algoritmo diagnóstico que en el adulto consume tiempo y pruebas que son molestas para el niño. En los últimos años diferentes grupos han investigado el valor de las pruebas cutáneas y serológicas, recomendándose en algunos casos la prueba de exposición oral directa.
El grupo de trabajo de la EAACI ha publicado una revisión valorando el diagnóstico de alergia a betalactámicos en niños. Diferencia las formas clínicas en función del mecanismo inmunológico y la cronología de la reacción:
- Reacciones cutáneas benignas de aparición inmediata mediadas por IgE.
Las más frecuentes son leves con urticaria y/o angioedema, causadas en muchos casos por la infección subyacente. Diferenciarlas es difícil a pesar de la historia clínica, siendo necesario el estudio alergológico mediante pruebas cutáneas, seguidas de una prueba de exposición. Algunos autores proponen realizar la exposición oral sin pruebas cutáneas previas en las reacciones leves. A pesar de los estudios publicados, la evidencia para realizar prueba de exposición directa en niños con reacción inmediata es limitada.
- Reacciones sistémicas de aparición inmediata mediadas por IgE.
Los fármacos son una posible causa de anafilaxia en niños, pero el riesgo de reacción mortal es extremadamente bajo. El diagnóstico precisa un estudio alergológico completo, que incluya pruebas in vitro (IgE específica, prueba de activación de basófilos) y pruebas cutáneas. Cuando estas pruebas son positivas, el riesgo de reacción con la prueba de exposición es alto. En los casos graves esta prueba solo se realizará si no hay alternativa terapéutica segura, comenzando por dosis muy bajas, estando contraindicada si durante la reacción índice se produjo un shock anafiláctico.
- Reacciones no inmediatas leves, urticaria no inmediata/exantema maculopapular.
Las pruebas cutáneas en estos casos tienen muy baja sensibilidad y no están bien estandarizadas, pero el valor predictivo positivo es alto. Por otro lado, para las pruebas in vitro (prueba de transformación de linfocitos) se dispone de una evidencia limitada. Dada su baja sensibilidad, algunos autores realizan una prueba exposición oral directa, confirmando la seguridad del procedimiento. No hay acuerdo en el protocolo a seguir, administrándose generalmente la dosis fraccionada seguida de uno o varios días de administración domiciliaria. Haciendo referencia a un estudio que sugiere que los niños con reacción no inmediata leve podrían superar su alergia, podría indicarse la realización de una prueba de exposición tras al menos un año de la prueba de exposición positiva.
- Enfermedad del suero-like.
Se observa generalmente en niños menores de 5 años, especialmente con cefaclor. El diagnóstico es fundamentalmente clínico. En estos pacientes se debe evaluar la tolerancia a otros betalactámicos que, generalmente, son bien tolerados.
- Reacciones graves no inmediatas.
Incluyen el síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, reacción a fármaco con eosinofilia y síntomas sistémicos, y la pustulosis exantemática aguda generalizada. El diagnóstico es fundamentalmente clínico, junto a pruebas histológicas y analíticas. Se pueden realizar pruebas epicutáneas tras 6 meses de la reacción a pesar de tener una sensibilidad baja. Si estas son negativas, se pueden realizar pruebas intradérmicas, estando contraindicadas si durante la reacción índice hubo riesgo vital. En general, la prueba de exposición se realiza para excluir el diagnóstico de alergia en los casos de baja sospecha.
El grupo de trabajo concluye que hay una amplia variabilidad clínica en las reacciones a betalactámicos en niños, siendo la más común la reacción cutánea leve no inmediata con exantema maculopapular o urticaria tardía. En estos casos se recomienda el diagnóstico mediante la prueba de exposición, existiendo suficiente evidencia para realizarla sin pruebas cutáneas previas. Para poder definir una reacción como leve o de bajo riesgo hay que tener en cuenta la fiabilidad de los datos obtenidos de la historia clínica, la edad del niño, el tiempo transcurrido hasta realizar el estudio y las comorbilidades que pueda presentar el paciente. No hay un protocolo óptimo para la realización de la prueba de exposición ni consenso en su duración, por lo que es imperativo establecer un protocolo unificado.
Con respecto a las reacciones inmediatas leves, es necesario realizar más estudios para poder confirmar la seguridad de realizar la exposición sin pruebas cutáneas previas.
Finalmente, en relación con la posibilidad de que los niños con reacción no inmediata leve puedan superar su alergia, el consenso se recomienda la realización de estudios multicéntricos que incluyan un gran número de niños para investigar la historia natural de la alergia a betalactámicos.
Dos trabajos realizados en nuestro país repiten el estudio con prueba de exposición en niños tras el diagnóstico de alergia a betalactámico con reacción no inmediata leve. En ellos, el 50% y el 80% de los pacientes toleran el betalactámico en la segunda prueba de exposición controlada, realizada al menos 6-12 meses tras una primera prueba de exposición positiva. Todos los pacientes incluidos son menores de 8 años, predominando preescolares en los que en muchos casos un cuadro viral subyacente podría ser la causa de la reacción. Ante estos resultados y dado que los betalactámicos son de primera elección en la mayoría de los procesos infecciosos de origen bacteriano en el niño, se podría proponer repetir la prueba de exposición controlada tras un año de evitación, al menos en los niños de menor edad, siempre que la reacción inicial al betalactámico sea no inmediata y leve.
Candelaria Muñoz Román. Alergología Pediátrica, UGC Pediatría, H. Materno Infantil, Hospital Regional Universitario de Málaga. Comité de Alergia Infantil SEAIC.
Bibliografía
- Blanca-López N, Atanaskovic-Markovid M, Gomes ER, Kidon M, Kuyucu S, Mori F, et al. An EAACI Task Force report on allergy to beta-lactams in children: Clinical entitisand diagnostico procedures. Pediatr Allergy Immunol. 2021; 32: 1426-1436.
- Tonson la Tour A, Michelet M, Eigenmann P, Caubet JC. Natural history of benign nonimmeediate allergy to beta-lactams in children: a prospective study in retreated patiens after a positive and a negative provocation test. J Allergy Clin Immunol Pract. 2018; 6: 1321-1326.
- Berroa F, Callero A, Fuentes-Aparicio V, Infante S, Alonso-Lebrero E, Zapatero L. Rechallenge in Pediatric Patients Diagnosed with delayed hypersensitivity to penicillins. J Investig Allergol Clin Immunol. 2013; 23: 369-370.
- Sánchez de Toro MA, Muñoz Román C, Corzo Higueras JL. Negativización de estudio alérgológico en pacientes en edad pediátrica diagnosticados de reacción alérgica no inmediata frente a amoxicilina. Allergol et Immunopathol Proceedings. 2017; 166. ISSN 2014-9859. 41º Congreso SEICAP.
- Ibáñez MD, Rodríguez del Río P, Lasa EM, Joral A, Ruiz-Hornillos J, Muñoz, C, et al. Prospective assessment of diagnostic tests for pediatric penicillin allergy: From clinical history to challenge tests. Ann Allergy Asthma Immunol. 2018;121(2):235-244.
Día Mundial de la Esofagitis Eosinofílica
Mañana, 22 de mayo, se celebra el primer Día Mundial de la Esofagitis Eosinofílica.
Además de diversas acciones para dar visibilidad social a esta enfermedad de prevalencia creciente, la Asociación de Pacientes con Esofagitis Eosinofílica (ADESEO) ha organizado un interesante seminario web con ponentes de talla internacional:
Día 22 de mayo:
14:00 – 15:30 horas | Webinar «Día Mundial de la EoE!». Centrado en el ámbito médico, habrá tres ponencias especializadas a cargo de reconocidos expertos internacionales que compartirán los últimos avances en el diagnóstico y tratamiento de la enfermedad:
- Dr. Alfredo Lucendo (EUREOS)
- Dra. Carolina Gutiérrez (Hospital Universitario Puerta de Hierro)
- Dr. Javier Chahuan (Pontificia Universidad Católica de Chile)
Te puedes inscribir aquí
Más información sobre el Día Mundial en la página web de ADESEO
La evolución de la hipersensibilidad a AINEs en el tiempo, ¿podrán algunos pacientes tolerar estos fármacos en el futuro?
Los antiinflamatorios no esteroideos (AINEs) son los fármacos más frecuentemente implicados en las reacciones de hipersensibilidad. Estas reacciones son muy complejas, ya que pueden estar producidas por mecanismos diferentes: por un lado, pueden ser reacciones de intolerancia cruzada (IC), en las que el paciente reacciona a varios AINEs pertenecientes a grupos químicos diferentes en ausencia de un mecanismo inmunológico específico; y por otro, reacciones selectivas, que están inducidas por uno o más AINEs del mismo grupo químico por un mecanismo inmunológico específico (IgE o células T). Las reacciones de IC son las más frecuentes y con un mayor impacto en la calidad de vida de los pacientes ya que, al estar implicados diferentes grupos químicos, se reducen de manera significativa las alternativas terapéuticas. Estas reacciones pueden clasificarse en diferentes categorías en función de los síntomas clínicos manifestados y la presencia o ausencia de enfermedades subyacentes: (i) Enfermedad respiratoria exacerbada por AINEs (EREA); (ii) Enfermedad cutánea exacerbada por AINEs (ECEA); (iii) Urticaria/angioedema inducido por AINE (UAIA).
La hipersensibilidad a los AINEs puede aparecer en cualquier momento de la vida, y aunque se han realizado pocos estudios para analizar la historia natural de esta afección, los datos disponibles son diferentes dependiendo de la entidad clínica.
En las reacciones mediadas por IgE, al igual que ocurre con otros medicamentos como las penicilinas, se ha descrito una pérdida de sensibilidad con el paso del tiempo cuando los pacientes no están expuestos al fármaco. Esta pérdida de sensibilidad se ha visto que ocurre en más de la mitad de los pacientes con reacciones por metamizol tras 6 meses de seguimiento. Sin embargo, hoy en día se desconoce si estos pacientes tolerarían el fármaco y si una nueva exposición daría lugar a que las pruebas resultasen otra vez positivas.
Por otro lado, en las reacciones de IC, hay estudios publicados donde se ha comprobado que a lo largo del tiempo algunos pacientes pueden adquirir de nuevo tolerancia a estos fármacos.
En la ECEA, en la que los pacientes presentan urticaria crónica de base que se exacerba tras la toma del AINE, se ha observado que la intensidad de la reacción a estos medicamentos puede fluctuar dependiendo de la actividad de la urticaria crónica subyacente, y que incluso en hasta un tercio de los pacientes, la hipersensibilidad a los AINEs puede resolverse durante los periodos de remisión de la urticaria crónica.
En la UAIA, se ha descrito que más del 60% de los pacientes pueden tolerar los AINEs en los 6 años siguientes a su última reacción.
Estos resultados ponen de manifiesto la importancia del seguimiento de los pacientes con IC a AINEs y la necesidad de ser reevaluados periódicamente por un alergólogo tras el diagnóstico inicial, ya que un gran número de pacientes podrían estar evitando los AINEs a pesar de no ser ya hipersensibles. Esta cuestión es importante porque los AINEs son uno de los fármacos más consumidos en todo el mundo y en algunos casos son la única opción terapéutica disponible. Sin embargo, a día de hoy no se sabe cuánto tiempo mantendrán los pacientes la tolerancia a los antiinflamatorios y si el contacto repetido con los mismos podría volver a inducir hipersensibilidad a estos fármacos.
Inmaculada Doña
Hospital Regional Universitario de Málaga
Bibliografía:
- Doña I, Barrionuevo E, Salas M, et al. Natural evolution in patients with nonsteroidal anti‐inflammatory drug‐induced urticaria/angioedema. Allergy 2017;72(9):1346‐1355.
- Doña I, Pérez-Sánchez N, Eguiluz-Gracia I,et al. Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs.Allergy 2020;75(3):561-575.
- Gomez E, Blanca‐Lopez N, Torres MJ, et al. Immunoglobulin E‐mediated immediate allergic reactions to dipyrone: value of basophil activation test in the identification of patients. Clin Exp Allergy 2009;39(8):1217‐1224.
- Setkowicz M, Mastalerz L, Podolec‐Rubis M,et al. Clinical course and urinary eicosanoids in patients with aspirin induced urticaria followed up for 4 years. J Allergy Clin Immunol 2009;123(1):174‐178.
Mi niño tiene urticaria. ¿La urticaria es igual a alergia?
La urticaria es una enfermedad de la piel muy común. Consiste en la aparición de ronchas/habones y/o hinchazón/angioedema, que habitualmente se acompañan de picor. Si dura menos de 6 semanas se clasifica como urticaria aguda y si dura más de 6 semanas como urticaria crónica. Las ronchas aparecen y desaparecen con rapidez, cambian de localización y duran menos de 24 horas y puedes reaparecer en los días siguientes. La hinchazón puede afectar a la cara, las manos, los pies, los genitales y suele ser pruriginoso.
La mayoría de las urticarias en la edad infantil son agudas y no tienen relación con la alergia. La infección parece ser la causa predisponente más frecuente (más del 40%) de urticaria en lactantes y niños en comparación con los adultos. Suelen ser infecciones víricas leves y el niño mantiene buen estado general a pesar de que la urticaria afecte a gran parte de la superficie corporal. Los síntomas de la infección viral pueden estar presentes o no.
¿La urticaria es igual a alergia? En pocas ocasiones la urticaria que dura varios días o semanas es producida por una alergia alimentaria; medicamentosa o por una picadura de insecto. En estos casos, es habitual que la urticaria aparezca antes de que pasen dos horas tras la ingesta del alimento/medicamento o haya antecedente de picadura de insecto en los minutos previos (muy inusual en niños). En ocasiones, pueden asociarse síntomas respiratorios, digestivos, mareos, el niño podría estar mucho más nervioso y afectado. En estos casos, podría tratarse de una reacción alérgica generalizada (anafilaxia) y se debe instaurar tratamiento con adrenalina y solicitar asistencia sanitaria de inmediato.
La urticaria crónica es mucho menos frecuente en niños y en la práctica, la mayoría de los pacientes no tienen una causa identificable. Se clasifica como urticaria crónica espontánea. En un pequeño porcentaje la urticaria crónica en niños se asocia a presencia de anticuerpos autoinmunes. Los medicamentos antiinflamatorios no esteroideos (ibuprofeno, metamizol, paracetamol, etc.) se han identificado como principales factores agravantes de la urticaria crónica espontánea en niños.
En conclusión, la urticaria aguda (<6 semanas de duración) es más frecuente en niños que la urticaria crónica (>6 semanas de duración) y suele ser un proceso benigno, transitorio, y que no se asocia a patología grave subyacente en la la gran mayoría de los casos.
Autora:
Krasimira Baynova, MD. Comité de Alergia Infantil SEAIC. CSUR Angioedema. UGC Alergología. Hospital Universitario Virgen del Rocío. Sevilla.
Bibliografía
1) Meeyong Shin et al. Prevalence and Causes of Childhood Urticaria Allergy Asthma Immunol Res. 2017 May; 9(3): 189–190.
2) Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et all. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018 Jul;73(7):1393-1414. doi: 10.1111/all.13397. PMID: 29336054.
3) Brüske I, Standl M, Weidinger S, et al. Epidemiology of urticaria in infants and young children in Germany–results from German LISAplus and GINIplus Birth Cohort Studies. Pediatr Allergy Immunol 2014;25:36 –42.
4) Cornillier, H., Giraudeau, B., Munck, S., Hacard, F., Jonville-Bera, A.-P., d’ Acremont, G., … Maruani, A. (2018). Chronic spontaneous urticaria in children – a systematic review on interventions and comorbidities. Pediatric Allergy and Immunology, 29(3), 303–310.
Enlace de interés práctico:
https://enfamilia.aeped.es/temas-salud/decalogo-urticaria-infantil
Dr. Fernández Crespo, director ISCIII
Estimados socios,
El Consejo de Ministros, a propuesta del Ministerio de Sanidad, Servicios Sociales e Igualdad y con la conformidad del Ministerio de Economía y Competitividad, ha acordado el día 6 de Marzo del presente el nombramiento de Jesús Fernández Crespo, especialista en Alergología, como director del Instituto de Salud Carlos III (ISCIII) en sustitución de Antonio L. Andreu Périz. El Dr. Fernández Crespo ha desempeñado los cargos de subdirección médica de Investigación y Docencia del Hospital Universitario 12 de Octubre de Madrid y desde Septiembre de 2014 era subdirector general de Evaluación y Fomento de la Investigación. Desde SEAIC queremos expresar nuestra más sincera enhorabuena por el nombramiento.
Podéis consultar la noticia en este link.
Un cordial saludo,
Darío Antolín
Secretario de la Junta Directiva de la SEAIC
Nuevo presidente de SEAIC
El Profesor Ignacio Dávila fue ratificado como nuevo presidente de SEAIC en el Simposio Internacional en Palma de Mallorca. Es jefe de Sección de Alergología del Hospital Universitario y catedrático de la Facultad de Medicina de Salamanca y ocupará el cargo durante los próximos cuatro años.
¿Si he tenido una reacción con Amoxicilina, qué antibióticos podría utilizar hasta ser valorado por alergología?
La amoxicilina es uno de los antibióticos más utilizados para el tratamiento de infecciones respiratorias, urinarias, dentales, de la piel, etc. También se utilizan para prevenir infecciones, o antes de algunos procedimientos diagnósticos o intervenciones quirúrgicas.
Pertenece a la familia de los antibióticos betalactámicos, y a este grupo pertenece también la penicilina, que es el antibiótico más antiguo conocido, así como otros muchos antibióticos pertenecientes a diferentes subfamilias como cefalosporinas, carbapenems o monobactams.
Cualquier antibiótico puede producir diferentes tipos de reacciones adversas, algunas conocidas y relacionadas con la dosis del antibiótico, por ejemplo, dolor abdominal, deposiciones diarreicas o infecciones por hongos en mucosa oral o genital. Tras este tipo de reacciones, y según la intensidad de la sintomatología, puede ser necesario suspender el tratamiento. Hay otro tipo de reacciones no predecibles, como son las reacciones alérgicas o de hipersensibilidad, que pueden aparecer incluso a dosis mínimas, y pueden ser desde muy leves a graves.
Cuando un paciente en tratamiento con amoxicilina presenta síntomas no relacionados con la infección que está tratando, debe consultar en un centro sanitario. Si los síntomas que presenta son efectos secundarios conocidos, será su médico el que valore la continuación de ese antibiótico, o el cambio a uno de la misma familia o de otra familia, según la infección que esté tratando. En estos casos se podría seguir tomando antibióticos de la familia de los betalactámicos.
Cuando su médico considere que presenta síntomas sugestivos de una reacción alérgica a la amoxicilina siempre debe ser valorado y estudiado en una Unidad de Alergología, y hasta entonces no debe tomar ningún antibiótico de la familia de los antibióticos betalactámicos. Hoy en día existen múltiples alternativas como antibióticos del grupo quinolonas, macrólidos, lincosamidas, aminoglucósidos, tetraciclinas y sulfamidas entre otros.
Es muy importante que este tipo de reacciones sean estudiadas ya que la sospecha de ser alérgico a antibióticos betalactámicos implica la evitación de un gran número de fármacos que son muy utilizados en la actualidad, y tras el estudio nos podrán dar alternativas dentro de este mismo grupo terapéutico.
María Salas Cassinello
Hospital Regional Universitario de Málaga
Durante el verano: ¿Cómo diferenciar una reacción alérgica a un medicamento de una reacción por fototoxicidad?
Con el buen tiempo y las vacaciones de verano, todos pasamos mucho más tiempo al aire libre y aumenta la exposición de nuestra piel al sol, pudiéndose producir algunas reacciones cutáneas no deseadas que conviene diferenciar:
Las erupciones solares o polimorfas ocurren sin relación con la toma de medicamentos, en aquellas zonas de piel que no han recibido sol durante el año. Tienen un aspecto variable, como manchas, granitos, etc… y producen picor, apareciendo a las pocas horas de la exposición en ambas partes del cuerpo (simétricas). Es típico en los primeros días de sol, y algunos pacientes las pueden presentar cada año. Estas reacciones pueden ser evitables utilizando las medidas de fotoprotección adecuadas.
Las reacciones fototóxicas son reacciones de la piel con aspecto de quemadura solar sobre la zona que ha recibido la exposición. Respetan la piel cubierta por ropa, y zonas típicas como el mentón, detrás de las orejas o debajo de la nariz. Se provoca por el uso de algunos productos sobre la piel o medicamentos, como algunos antiinflamatorios, antihipertensivos o antibióticos. Empiezan a los pocos minutos/horas de la exposición solar y se resuelven habitualmente en unos días, dejando en ocasiones marcas durante meses. Aunque no son reacciones alérgicas, son frecuentes, y pueden aparecer en cualquier persona que los utilice, incluso la primera vez que se usa un producto o medicamento a dosis altas.
Las reacciones alérgicas por exposición solar o fotoalergia son reacciones mucho menos frecuentes. Son causadas sobre todo por medicamentos pero también por perfumes, algunos cosméticos e incluso por los protectores solares. Tienen un aspecto de eccema o ampolla, con picor, que afecta a las zonas que han recibido el sol, aunque también puede extenderse a otras zonas con menos intensidad. Aparecen más tarde que las anteriores, a partir de 24-48 horas tras la exposición solar, y mejoran a partir de 5-6 días, sin dejar lesiones residuales. Este tipo de reacciones ocurren en personas con predisposición, que ya han utilizado estos productos previamente sin reacción anterior, y pueden condicionar reacciones cruzadas con otros medicamentos o productos similares.
Si presenta una reacción cutánea, conviene hacer fotografías, y recuerde acudir a su médico de atención primaria para recibir tratamiento, además de contar con el asesoramiento de un Alergólogo para realizar los estudios necesarios.
Bibliografía:
1. Dávila I, Jáuregui, I, Olaguibel, J.M., et al. Tratado de Alergología. 2a Edición. Ergon, 2016.
2. Gruber-Wackernagel A, Byrne SN, Wolf P. Polymorphous light eruption: clinic aspects and pathogenesis. Dermatol Clin. 2014 Jul;32(3):315-34.
3. Montgomery S, Worswick S. Photosensitizing drug reactions. Clin Dermatol. 2022 Jan-Feb;40(1):57-63.
María del Valle Campanón Toro
Hospital Universitario de Burgos
Telealergia: ¿vino para quedarse?
Artículo: Teleallergy: Where Have We Been and Where Are We Going? Ramsey A, Chen Wu A, Bender B, Portnoy J. J Allergy Clin Immunol Pract 2023;11:126-31.
La telemedicina se puede definir, como el uso de las tecnologías de la información, por medio de los sistemas telemáticos, para proporcionar asistencia médica, independientemente de la distancia que separa al paciente del profesional médico.
Los primeros datos de telemedicina aplicados al campo de la Alergología son muy escasos a partir de los años 90. Sin embargo, el uso de la telemedicina se incrementa de forma exponencial a partir del año 2020. Este año, queda marcado en la historia por la extensión de la enfermedad provocada por el virus SARS-CoV-2019 (COVID-19), lo que condicionó un cierre de la actividad socioeconómica mundial casi global. Tras declararse la pandemia por la Organización Mundial de la Salud en marzo de 2020, el gobierno español decretó el estado de alarma con el consiguiente confinamiento domiciliario, que se prolongó hasta junio de 2020. Posteriormente se han sucedido diversas olas pandémicas que han ido afectando de forma diversa la asistencia médica.
El modelo de acceso y prestación de la asistencia sanitaria cambió bruscamente, primero en la Atención Primaria, y posteriormente en las diferentes especialidades médicas. El patrón clásico de asistencia presencial, ha sido sustituido por un patrón mixto, en el que las herramientas de telemedicina han desempeñado un papel determinante. Centrándonos en el campo de la Alergología, investigadores norteamericanos dirigidos por Ramsey y cols., han llevado a cabo una revisión sobre el impacto de la telemedicina en la satisfacción de los pacientes alérgicos, en el coste de la asistencia, así como en el entorno normativo que debe regular en el futuro la telemedicina.
1.- Satisfacción del paciente
- Satisfacción del paciente antes de la epidemia COVID:
Hay diversos estudios en los primeros años del siglo XXI. Así, en 2015, Portnoy y cols., compararon las visitas presenciales frente a la teleasistencia, en 169 pacientes pediátricos con asma bronquial. El 90% de los pacientes consideraban satisfactoria la asistencia sanitaria, y un 88% la recomendaría para las revisiones médicas.
- Satisfacción durante la epidemia COVID:
Diversos estudios muestran una opinión favorable. En el estudio de Mustafa y cols., con 251 pacientes alérgicos, la satisfacción fue general para todos los tipos de enfermedades alérgicas, salvo en la alergia a alimentos, donde los pacientes consideraron óptima la visita presencial. En otro estudio dirigido por Emory con 269 pacientes, la satisfacción fue plena con la consulta telemática para el 79% de los pacientes, siendo el dato mas relevante la facilidad para poder asistir a la cita. No obstante, incluso con datos satisfactorios, los investigadores refieren que determinados procedimientos en el campo de la Alergología, como la realización de las pruebas cutáneas o los estudios de pruebas de tolerancia con alimentos o medicamentos requieren de la visita presencial. Otros estudios, sin embargo, muestran una mayor satisfacción con las visitas presenciales, especialmente en pacientes con dermatitis atópica, múltiples alergias a alimentos o pacientes pediátricos con asma bronquial.
2.- Satisfacción del médico
Tradicionalmente los alergólogos no han utilizado la telemedicina, por lo que se les deben facilitar herramientas que permitan su uso. Sin embargo, salvo en algunos países, no se han desarrollado programas de formación para los especialistas ni tampoco la asistencia mediante aplicaciones informáticas.
La principal ventaja de utilizar la telemedicina en la práctica clínica habitual es el ahorro de tiempo que supone para el médico disminuir las horas de consulta dedicadas a labores burocráticas. Este tiempo podría reinvertirse en reducir las listas de espera dedicadas a dar resultados analíticos, resolver dudas a pacientes a cerca de tratamientos de una forma más rápida, así como conseguir una comunicación más fluida con pacientes y médicos de Atención Primaria. De esta manera, se agilizarían procedimientos ordinarios y mejoraría la calidad asistencial del paciente.
3.- Coste socioeconómico de la telemedicina
Por un lado, la telemedicina puede reducir los costes de las enfermedades alérgicas ya que disminuye los gastos en el transporte hasta la consulta médica, así como el absentismo escolar y laboral. Sin embargo, tiene otras desventajas que pueden incrementar el coste como es la falta de acceso directo al profesional sanitario y su supervisión, lo que puede implicar una peor evolución clínica de la enfermedad. Existen pocos estudios durante la pandemia Covid de telemedicina y coste sanitario. En un estudio sobre pacientes pediátricos diagnosticados de asma bronquial, se observó que tras realizar un programa de telemedicina en el primer año de la pandemia Covid, hubo una reducción en las reagudizaciones asmáticas. Este hecho puede ser atribuible no a la telemedicina en si misma, sino a la escolarización en casa durante los primeros meses Covid, así como el uso de la mascarilla, ya que ambas situaciones redujeron la exposición a diferentes virus durante ese periodo de tiempo, lo que puede explicar la reducción en las exacerbaciones asmáticas. Por otro lado, es conocido que la telealergia tiene su mayor potencial de mejora del gasto sanitario en las zonas rurales o áreas que no disponen de alergólogo cercano, por lo que requieren un desplazamiento importante para la asistencia médica. Así, en un estudio alemán hecho con 112 pacientes con rinitis alérgica, la telemedicina generó un ahorro de 60.000 euros por año y redujo en 2.3 los días perdidos de trabajo o escuela, por paciente y año.
4.- Cambios en el marco regulatorio
La introducción y el uso progresivo de la telemedicina aplicado al campo de la Alergología, debe acompañarse de una actualización en el marco legislativo, así como de la cobertura y coste de los seguros de asistencia médica, tanto en la Sanidad Privada como Pública, que deben ir acometiéndose durante los próximos años.
CONCLUSIONES
Tras la pandemia Covid, la telemedicina aplicada al campo de la Alergología es una realidad. Esta herramienta ofrece ventajas, las principales, la reducción de absentismo laboral/escolar y transporte, la mejor adherencia en el seguimiento y la mayor agilidad en las revisiones médicas. Ofrece también una posible mejoría en la educación continuada del paciente alérgico con las diferentes herramientas informáticas, así como en el seguimiento del cumplimiento terapéutico. Sin embargo, pese a estas ventajas, la asistencia presencial seguirá siendo vital en nuestra especialidad, para la realización de muchos de nuestros procedimientos diagnósticos y terapéuticos, así como para aquellos pacientes que requieran un diagnóstico inicial, una valoración directa por parte del alergólogo o cuando la gravedad o el control de la enfermedad así lo requiera.
Marta Reche. Servicio de Alergología. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid. Comité de Alergia Infantil
Campamentos de Verano para niños con Asma y Alergia en tiempos de Pandemia COVID-19
Desde hace unos 20 años, diferentes Sociedades Regionales de Alergología implantadas en el territorio nacional, han venido organizando de forma ininterrumpida en los meses de verano campamentos para niños con asma y alergia en colaboración con la Sociedad Española de Alergología e Inmunología Clínica.
La situación actual de pandemia por COVID 19, declarada por la OMS el día 11 de marzo de 2020 (1) supuso un cambio radical en la atención sanitaria a nivel mundial. Desde el inicio se han alcanzado más de 170 millones de casos notificados en todo el mundo y casi 4 millones en España. En esta situación, el pasado verano y por razones obvias, la totalidad de campamentos de verano para niños alérgicos y/o asmáticos fueron suspendidos.
Si bien los niños son capaces de contraer el virus que causa COVID-19, no se enferman con tanta frecuencia como los adultos. La mayoría presentan síntomas leves o no presentan síntomas. No obstante, algunos con afecciones subyacentes como obesidad, diabetes y asma, pueden tener un mayor riesgo de padecer formas graves de la enfermedad. Los niños que tienen enfermedades cardíacas congénitas, afecciones genéticas o afecciones que afectan el sistema nervioso o el metabolismo también pueden tener un mayor riesgo de padecer enfermedades graves con COVID-19.
Recientemente Castro-Rodríguez y Forno (2), tras realizar una revisión sistemática sobre Asma y COVID-19 en niños, sólo encontraron un estudio que relacionaba el asma como factor de riesgo potencial para la gravedad del COVID-19, pero no para su mortalidad. La mayoría de los trabajos se basan en la descripción de número de casos de COVID-19 por grupos de edad, por lo que aún no queda claro si el asma infantil u otras enfermedades respiratorias pediátricas están asociadas con el riesgo o la gravedad de COVID-19.
En España se han administrado hasta la fecha más de 30 millones de dosis de vacuna frente al coronavirus SARS-CoV-2, por lo que se augura alcanzar la ansiada inmunidad de grupo en los próximos meses. En esta situación, se plantea ya la posibilidad de retomar en este o próximos veranos aquellas actividades de educación sanitaria dirigidas a niños alérgicos y asmáticos que los alergólogos veníamos realizando, en forma de campamentos u otras actividades que, respetando escrupulosamente las recomendaciones sanitarias, nos permitan alcanzar el control clínico actual y evitar las consecuencias a futuro de la enfermedad.
Los Centros para el Control y la Prevención de Enfermedades (CDC) han redactado y actualizado la Guía para la apertura de campamentos juveniles y de verano durante la pandemia del COVID-19 (3).
Resumen de los cambios recientes:
- Se añadieron:
- una sección sobre promover la vacunación.
- una sección sobre planificar y preparar el campamento.
- información sobre optar por actividades más seguras.
- un enlace a información para personal y campistas con mayor riesgo de enfermarse gravemente a causa del COVID-19.
- una guía para los campamentos en los que todos están completamente vacunados.
- información sobre el uso comunitario de mascarillas de tela para controlar la propagación del SARS-CoV-2.
- Se actualizaron:
- las guías para los campamentos en los que no todos están completamente vacunados.
- la guía sobre uso de mascarillas al aire libre.
- la información sobre excursiones fuera del campamento.
Puntos clave de la guía:
En esta guía se describen las estrategias que los programas de campamentos deben utilizar para mantener el funcionamiento y los entornos saludables, reducir el riesgo de propagación del COVID-19 en sus programas, prepararse para cuando alguien se enferme a causa del COVID-19 y brindar apoyo para sobrellevar la situación y desarrollar resiliencia.
El uso sistemático y estratificado de varias estrategias de prevención puede servir para que los campamentos abran de forma segura para la realización de actividades presenciales, proteger a los niños, las familias y al personal y desacelerar la propagación del virus que causa el COVID-19.
Fernando Florido López. Servicio de Alergología. Hospital Universitario Clínico San Cecilio. Granada. Comité de Alergia Infantil SEAIC
Biobligrafía:
- Organization, W.H. WHO Director-General’s opening remarks at the media briefing onCOVID-19: 11 March 2020. 2020 05/01/2020]; Available from:https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-themedia-briefing-on-covid-19—11-march-2020
- Castro-Rodriguez JA, Forno E. Asthma and COVID-19 in children: A systematic review and call for data. Pediatr Pulmonol 2020. PMCID 7323291.
- https://espanol.cdc.gov/coronavirus/2019-ncov/community/schools-childcare/summer-camps.html
Seminarios de Medicina Evolucionista
Apreciados socios:
Os dejamos la relación de seminarios sobre Medicina evolucionista que organiza nuestro compañero, el Dr. Álvaro Dashner. Esperamos resulten de vuestro interés.
Un cordial saludo
Dr. Pedro Ojeda
Secretario General de la Sociedad Española de Alergología e Inmunología Clínica
Primavera/ otoño 2013:
Este año se organiza el cuarto ciclo de
Seminarios interdisciplinares en Medicina Evolucionista
Los seminarios trataran los siguientes aspectos:
Martes, 21 de mayo: La evolución de la dentición en el ser humano. ¿Cómo ha influido en nuestra forma de vida? DIETA vs. ESTÉTICA.
Martes, 11 de junio: La pigmentación de la piel. Variabilidad y patología. Adaptación al medio.
Martes, 15 de octubre: Mecanismos inmunitarios con potencial antitumoral: lo que podría funcionar
Martes, 12 de noviembre: Cereales: domesticación, adaptación y enfermedad.
Hospital Universitario de la Princesa, Madrid
Aula de docencia (Primera planta). Horario 16 a 19 horas
Actividad docente de formación continuada con acreditación solicitada
Mas información e inscripción en www.medicinayevolucion.com
Correo: seminarios@medicinayevolucion.com
Día internacional de concienciación de la Enterocolitis Inducida por Proteínas de la Dieta (FPIES).
El pasado 4 de mayo se celebró el día de Star Wars (May the 4th) que coincidió con el día internacional de concienciación de la Enterocolitis Inducida por Proteínas de la Dieta (FPIES).
La FPIES es una alergia a alimentos no mediada por IgE, que típicamente comienza en la infancia, y que se caracteriza por vómitos repetidos, prolongados en el tiempo, que comienzan entre 1 y 4 horas tras la ingesta del alimento y que a menudo se acompañan de decaimiento, letargia o palidez y deposiciones diarreicas.
Los datos epidemiológicos referentes a esta enfermedad son escasos y variables, esto es debido a que, hasta finales de los años 70 no se había reconocido ni definido formalmente este síndrome y también a que no ha recibido una codificación adecuada hasta octubre de 2015 cuando se implementó el código K52.2 en la décima revisión de la Clasificación Internacional de las Enfermedades (CIE-10).
El diagnóstico de FPIES se basa fundamentalmente en la presencia de síntomas característicos que mejoran tras la retirada del alimento causal de la dieta. Estos criterios se han ido modificando según ha ido avanzando el conocimiento y reconocimiento de esta enfermedad. Actualmente están en vigor los propuestos por el Consenso Internacional para el Diagnóstico y Manejo de la Enterocolitis Inducida por Proteínas de la Dieta, elaborado por el grupo de trabajo de reacciones adversas a alimento de la Academia Americana de Alergia, Asma e Inmunología (AAAAI).
Actualmente se reconocen dos presentaciones clínicas:
- FPIES aguda.- Que se manifiesta por los síntomas típicos previamente mencionados.
- FPIES crónica.- Peor caracterizada que la FPIES aguda, descrita fundamentalmente en lactantes menores de 4 meses alimentados con fórmula adaptada de proteínas de leche de vaca o de soja. Las manifestaciones clínicas incluyen vómitos intermitentes, diarrea acuosa y fallo de medro. Los síntomas se producen a lo largo de varios días o semanas y no tienen una clara relación causal con el alimento.
Cualquier alimento es susceptible de producir FPIES, los alimentos más frecuentemente implicados son las proteínas de leche de vaca, y en nuestro medio el pescado. El alimento implicado varia en función de la localización geográfica y no resultan extrapolables las series anglosajonas o japonesas publicadas. En el área mediterránea no es tan frecuente la asociación de FPIES por leche de vaca y la FPIES por soja, por lo que la evitación de este último alimento es discutible y debe ser evaluarse de manera individual. En cuanto a los alimentos sólidos, el pescado es si duda el principal agente causal de FPIES en el área mediterránea. En estos casos se pueden evitar dietas restrictivas innecesarias testando pescados alternativos, minimizando los riesgos de déficits nutricionales en nuestros pacientes para mas información sobre este punto: Infante et al. Food protein-induced enterocolitis syndrome by fish: Not necessarily a restricted diet. Allergy. 2017;00:1-5.
Dado que las manifestaciones clínicas son exclusivamente gastrointestinales y la edad más frecuente de presentación es la infancia, el retraso diagnóstico o un diagnóstico erróneo suele ser habitual. La mayoría de los niños sufren mas de una reacción, en ocasiones grave y con necesidad de acudir a Urgencias, antes de que sean correctamente diagnosticados. Por ello es importante tener presente esta patología ante cuadros exclusivamente digestivos y con resolución en las siguientes 24 horas.
Para un mejor conocimiento de esta patología recomendamos la lectura de:
- International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma and Immunology. Nowak-Wegryzn et al. J Allergy Clin Immunol. 2017 Apr;139(4):1111-1126.e4. doi: 10.1016/j.jaci.2016.12.966
- Food Protein-Induced Enterocolitis Syndrome. Nowak-Wegryzn A et al. J Investig Allergol Clin Immunol 2017;27(1):1-18. Doi: 10.18176/jiaci.0135.
Ambos artículos, de acceso libre, resumen de manera práctica y didáctica el conocimiento actual de FPIES. “Aquello que no se conoce no se diagnostica”
Sonsoles Infante Herrero. Médico Adjunto. Unidad de Alergia Pediátrica. Hospital General Universitario Gregorio Marañón. Madrid.
¿Corticoides inhalados a altas dosis para prevenir exacerbaciones en asma infantil?
Una situación común con la que nos encontramos en nuestra práctica clínica con los niños asmáticos, son las agudizaciones que presentan a pesar de realizar un tratamiento de mantenimiento con corticoides inhalados. En muchas ocasiones las exacerbaciones son graves y requieren tratamiento con corticoides sistémicos. Para prevenir estas crisis, ante los primeros signos de menor control del asma, tenemos tendencia a aumentar la dosis de corticoides inhalados durante un periodo de tiempo. En este sentido, según la recomendación de la estrategia de la GINA (Global Iniciative for Asthma), en los pacientes asmáticos que reciben corticoides inhalados de forma continua, estaría indicado aumentar su dosis durante un periodo corto de tiempo ante los primeros indicios de pérdida de control del asma.
Sin embargo, esta estrategia actualmente es controvertida en niños, y existen varios trabajos que han puesto en duda la eficacia de esta actuación en este grupo de edad en lo que se refiere a la prevención de exacerbaciones asmáticas, así como a su seguridad. Hay que tener en cuenta que el 70-80 % de las veces esos primeros indicios no se convierten en verdaderas exacerbaciones, por lo que se podría haber creado la falsa idea de que aumentar la dosis del corticoide tendría un efecto protector de exacerbaciones. Recientemente, se ha publicado un artículo en el N Engl J Med que va en esta línea.
Quintupling Inhaled Glucocorticoids to Prevent Childhood Asthma Exacerbations. Jackson DJ, Bacharier LB, Mauger DT, Boehmer S, Beigelman A, Chmiel JF, Fitzpatrick AM, et al.N Engl J Med. 2018 Mar 8;378(10):891-901. doi: 10.1056/NEJMoa1710988. Epub 2018 Mar 3.
El trabajo fue financiado por el National Heart, Lung, and Blood Institute, y realizado por investigadores de diferentes centros de USA. Se trata de un ensayo de grupos paralelos, doble ciego y randomizado. Estudiaron a 254 niños, de 5 a 11 años de edad, que padecían asma bronquial leve-moderado persistente y que habían presentado al menos una exacerbación tratada con corticoides sistémicos en el último año. Todos los pacientes realizaron tratamiento de mantenimiento con dosis bajas de propionato de fluticasona inhalada (44 µg por inhalación, dos inhalaciones dos veces al día) durante 48 semanas. Ante los primeros signos de pérdida de control del asma (zona amarilla) se dividió a los pacientes en dos grupos de forma randomizada, de manera que una parte de los niños quintuplicaba la dosis de fluticasona durante 7 días (220 µg por inhalación, dos inhalaciones dos veces al día) y la otra parte continuaba con la misma dosis. En esta fase, en ambos grupos la terapia era doble ciego.
En el estudio no se encontraron diferencias significativas entre los dos grupos respecto al número de exacerbaciones asmáticas graves que requirieron corticoides sistémicos. Tampoco hubo diferencias en otros resultados secundarios como el número de visitas a urgencias por asma, el número de hospitalizaciones, el fracaso del tratamiento en el control del asma, la puntuación de síntomas y el uso de salbutamol durante los episodios de la «zona amarilla», el porcentaje de días con control del asma o los valores del flujo espiratorio máximo.
No hubo diferencias tampoco respecto a los eventos adversos, aunque en el grupo que quintuplicó la dosis de fluticasona mostró una tasa de crecimiento 0,23 cm menor por año respecto al grupo que no aumentó la dosis (diferencia no significativa, p=0.06). El primer grupo tuvo un 16% más exposición total a corticoides.
Aunque algunos aspectos metodológicos del estudio, como el tamaño la muestra y la heterogeneidad de la población en que se ha realizado, no permiten obtener conclusiones definitivas, parece que el empleo de corticoides inhalados a dosis altas, con intención de prevenir las exacerbaciones asmáticas, hoy día es controvertido en este grupo de edad (5-11 años, niños no preescolares). Se requieren más estudios que confirmen o no su beneficio clínico.
Autor: José Carlos García Ortiz. Médico adjunto del Servicio de Alergología del Hospital Universitario Río Hortega, Valladolid. Comité de Alergia Infantil SEAIC.
¡Tengo alergia al sol!
¡Cuántas veces escuchamos esta frase en esta época del año en la que nuestra exposición solar ha sido máxima! Son muchos los pacientes que ante reacciones cutáneas coincidiendo con la exposición solar se refieren a ellas como “alergia al sol”. Aunque es un término científicamente incorrecto, se refiere a aquellas fotodermatosis (reacciones anormales o adversas de la piel a la luz ultravioleta o la radiación visible) en las que subyace un mecanismo inmunológico.
Entre ellas, la erupción polimorfa lumínica es la entidad más frecuente, afectando al 10-20% de la población occidental. Aparece sobre todo en mujeres jóvenes y es más típico en las primeras exposiciones solares del año (primavera), mejorando a medida que la estación soleada avanza (tras exposiciones repetidas al sol y la progresiva melanización de la piel).
Se caracteriza por brotes repetidos de lesiones cutáneas pruriginosas con localización predominante en aquellas zonas de mayor exposición solar: cara, cuello, zona alta del tórax, caras laterales de antebrazos y cara anterior de las piernas.
Las lesiones pueden ser de distinto tipo (de ahí el término polimorfismo): pápulas, pápulo-vesículas, eccema, placas, erosiones o costras; aunque, en un paciente individual, las lesiones son normalmente monomórficas y simétricas, apareciendo habitualmente a las pocas horas de exposición al sol.
Las reacciones agudas requerirán el tratamiento sintomático acorde con la gravedad del cuadro. Los antihistamínicos ayudarán a controlar el prurito; aunque, en ocasiones, puede ser necesario el uso de corticoides sistémicos. Sin embargo, lo más importante es prevenir la aparición de la erupción mediante fotoprotección adecuada (ropa, protección solar UVA y UVB). Si con ello no se consigue evitar la aparición de los brotes, se puede llevar a cabo una terapia de “desensibilización mediante fototerapia” con radiación UVB de banda estrecha (UVB-BE) para conseguir el endurecimiento (hardening) de la piel. Se basa en ir acostumbrando poco a poco a nuestra piel a la exposición al sol (fototolerancia), mediante la aplicación de cursos cortos de UVB-BE desde principios de la primavera y durante varias semanas, hasta alcanzar niveles que permitan al paciente tolerar exposiciones solares diarias de 15-20min de duración. Además, en adultos jóvenes, que viajan de vacaciones a zonas soleadas, se ha comprobado que la realización de ciclos cortos (6-7 días) de corticoides sistémicos (prednisona 0,6-0,8 mg/kg/día) es útil en la prevención de aparición de brotes.
Entre las fotodermatosis que afectan con más frecuencia a población infantil, se encuentra la erupción primaveral juvenil, considerada una variedad localizada de la erupción polimorfa lumínica, de origen desconocido y que afecta más frecuentemente a varones entre 5 y 12 años. Cursa con pápulas eritematosas pruriginosas que aparecen típicamente durante la primavera en el hélix de las orejas que no está cubierto por pelo. Pueden evolucionar a vesículas y costras sin dejar lesiones residuales o solo mínimas cicatrices.
También el hidroa vacciniforme, aunque es una afección rara, se suele dar en niños menores de 10 años, mejorando hacia la edad adulta. Algunos autores consideran que se trata de una variante cicatricial de la erupción polimorfa lúminica. Consiste en brotes recurrentes de lesiones vesiculosas, de contenido viscoso, seroso o hemorrágico, que evolucionan a costras y escaras negruzcas que se desprenden, dejando lesiones cicatriciales varioliformes, deprimidas e hipopigmentadas. Suelen darse cada verano en las partes descubiertas del cuerpo tras la exposición a la luz solar. Su localización más frecuente es en orejas, nariz, dedos, mejillas, dorso de manos o antebrazos y, a veces, puede afectar también a ojos y cuero cabelludo, con efectos adversos importantes sobre la calidad de vida de los niños. Se desconoce la patogenia, aunque se ha asociado a infecciones por virus de Epstein-Barr, y puede evolucionar a linfoma.
Otras fotodermatosis menos frecuentes en niños son el prurigo actínico, la dermatitis actínica crónica o la urticaria solar.
Todas ellas se engloban dentro de este grupo de fotodermatosis inmunológicamente mediadas conocido coloquial- y erróneamente bajo el único nombre de “alergia solar”. Sin embargo la patogenia y clínica de cada una de ellas es diferente y por tanto su tratamiento. Por ello es importante acudir al especialista quien establecerá un diagnóstico preciso y con ello el tratamiento más adecuado.
Dra. Paula Cabrera Freitag, Hospital Universitario Gregorio Marañón de Madrid. Comité de Alergia Infantil SEIAC
Bibiliografía:
- Barceló JM, Rosillo MR, Muñoz C. Fotodermatosis. En IJ Dávila, I Jáuregui, JM Olaguibel y JM Zubeldia, eds. Tratado de Alergología. 2ª ed. Madrid: Ergon, 2016, 889-912.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses. Part 1: pathophysiology and technical aspects of photobiologic studies. Actas Dermosifiliogr. 2014 Mar;105(2):112-21.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses, part II: photobiologic testing. Actas Dermosifiliogr. 2014 Apr;105(3):233-42.
- Gruber-Wackernagel A, Byrne SN, Wolf P. Polymorphous light eruption: clinic aspects and pathogenesis. Dermatol Clin. 2014 Jul;32(3):315-34
Anafilaxia en niños y adolescentes
La anafilaxia, como extremo más grave del espectro de las reacciones alérgicas, de afectación sistémica, aguda y potencialmente mortal, representa una patología de especial interés en pediatría.
En Europa, la anafilaxia es un problema común que afecta aproximadamente a 1 de cada 300 habitantes en algún momento de su vida. Según datos de la red europea de reacciones alérgicas graves, el 27% de los casos de anafilaxia se produce en menores de 18 años. Además, se ha descrito un incremento de su incidencia, especialmente en niños y preescolares.
Causas/desencadenantes
La causa más común de anafilaxia en niños son los alimentos (75%), seguida a distancia por los medicamentos (11%). Estudios epidemiológicos de la SEAIC* señalan a la alergia alimentaria como tercer motivo de consulta a los servicios de Alergología en edad pediátrica, con una tendencia al alza. La anafilaxia representa el 7,5% de los casos diagnosticados, siendo la leche de vaca, el huevo, los frutos secos y las frutas, los alimentos implicados más frecuentemente.
Los desencadenantes alimentarios varían según la edad y el área geográfica. En los dos primeros años de vida, la leche de vaca y el huevo son los desencadenantes más habituales; posteriormente, los frutos secos en edad preescolar, siendo el cacahuete el más común en todas las edades. En ciertos países europeos, particularmente en el área mediterránea, el melocotón tiene especial relevancia.
La anafilaxia inducida por ejercicio y dependiente de alimentos también debe ser considerada en los niños. Es un tipo especial de alergia mediada por IgE en la que el ejercicio o el consumo de un alimento causante no inducen síntomas por sí solos, pero el ejercicio tras la ingestión del alimento desencadena anafilaxia.
Por último, los padres con frecuencia expresan su preocupación sobre el riesgo de anafilaxia por vacunas; sin embargo, son una causa excepcional en niños.
Factores de riesgo y casos fatales
Las muertes por anafilaxia son raras. En aquellas relacionadas con alimentos, el 73% son debidas a frutos secos o cacahuete, siendo la leche de vaca responsable del 21% de las muertes en <16 años. El riesgo de muerte por anafilaxia aumenta dos veces entre adolescentes en comparación con los niños de 0-2 años. En general, los factores de riesgo identificados para la anafilaxia fatal por alimentos en niños incluyen asma coexistente, edad >10 años, alergia al cacahuete o frutos secos y la falta o la administración tardía de adrenalina.
Un tercio de los casos de anafilaxia ocurren en casa, el 25% en restaurantes y un 15% en la escuela.
Diagnóstico de anafilaxia
La anafilaxia es un diagnóstico predominantemente clínico, con afectación de varios sistemas y de inicio rápido tras la exposición al desencadenante. En los niños muy pequeños, el diagnóstico puede presentar algunos desafíos por la dificultad para describir ciertos síntomas como el prurito o la opresión faríngea; y ciertos signos, como la irritabilidad y los cambios de comportamiento, pueden ser difíciles de interpretar. La anafilaxia en los lactantes suele afectar a la piel (98%), al sistema respiratorio (59%), al aparato digestivo (56%) y, con menos frecuencia, al sistema cardiovascular. Cuando se produce hipotensión, en niños <10 años se define como una tensión arterial sistólica inferior a <70mmHg + (2 x edad en años) o un descenso >30% respecto a un registro basal.
Los síntomas respiratorios aparecen con frecuencia en los niños, especialmente en aquellos que padecen asma. Por otro lado, la anafilaxia puede suceder sin afectación de la piel, de tal forma que los signos cutáneos están ausentes en 10-20% de las anafilaxias. Este hecho afecta de manera crítica a su diagnóstico y tratamiento precoces.
Manejo
Para el autocuidado temprano de los pacientes con anafilaxia es fundamental educar a los padres, cuidadores y a los niños sobre el riesgo de anafilaxia, el control de las enfermedades concomitantes y sus desencadenantes y el autotratamiento de cualquier recurrencia. Durante la infancia, el cuidado/responsabilidad en la aplicación de medidas de evitación, reconocimiento de reacciones y tratamiento de las mismas recae inicialmente en padres y cuidadores. A medida que el niño crece se le enseña a evitar los desencadenantes, reconocer los síntomas y tratar futuras reacciones. Se ha estimado por encuestas que los niños de 9-11 años podrían reconocer síntomas y utilizar correctamente un AIA*.
A los pacientes se les deben recetar uno o más AIA*. Se recomienda que lleven siempre consigo un plan de acción de emergencia escrito y personalizado que ilustre cómo reconocer los síntomas e instruya sobre cómo inyectar rápidamente la adrenalina. Esta debe ser administrada por vía intramuscular en la parte anterolateral media del muslo manteniendo el AIA durante aproximadamente 3-10 segundos. La administración de adrenalina es el tratamiento de primera línea y no existen contraindicaciones absolutas para su administración. La dosis debe repetirse cada 5-15 minutos si los síntomas persisten y tras su administración se debe solicitar asistencia médica. Estas medidas preparan a los padres y a los niños para afrontar una reacción y evitar que se agrave.
Durante una anafilaxia es crucial evaluar periódicamente las vías respiratorias, la respiración, la circulación, el estado mental y la piel, posicionar al paciente según sus características y simultáneamente llamar a los servicios de emergencia. La mayoría de los niños deben colocarse tumbados boca arriba, a menos que haya dificultad respiratoria, en cuyo caso una posición sentada optimiza el esfuerzo respiratorio; si está inconsciente, el niño puede colocarse en posición de recuperación. Al mismo tiempo, y si es posible, se debe eliminar la exposición al desencadenante (p. ej., suspender la administración de medicamentos/agentes terapéuticos).
El tratamiento de la anafilaxia continúa con el traslado a un entorno de atención sanitaria, idealmente en ambulancia. En niños con anafilaxia y síntomas de broncoespasmo, se pueden administrar agonistas beta-2 de acción corta inhalados (p. ej., salbutamol); sin embargo, en presencia de síntomas persistentes no son alternativa a la administración repetida de adrenalina intramuscular. En caso de obstrucción de las vías respiratorias superiores debe considerarse nebulizar adrenalina. Los medicamentos de segunda línea incluyen agonistas beta2-adrenérgicos, glucocorticoides y antihistamínicos. Es necesario observar a los niños durante varias horas, siendo especialmente importante en reacciones graves y en aquellas que requieren varias dosis de adrenalina.
Conclusiones
La anafilaxia es una patología de especial relevancia en edad pediátrica, siendo los alimentos su causa más común. En los niños, los síntomas respiratorios y la ausencia de afectación cutánea son características que deben ser consideradas en su presentación. El asma, la adolescencia, la alergia al cacahuete o los frutos secos y la falta o la administración tardía de adrenalina son factores asociados a mayor gravedad. La educación periódica de niños y familias, sobre cómo identificar los episodios, responder adecuadamente y emplear el AIA son vitales y deben ser revisados regularmente.
Dr. Carmelo Escudero Díez. Servicio de Alergología Hospital Infantil Universitario Niño Jesús (Madrid). Comité de Alergia Infantil.
*SEAIC: Sociedad Española de Alergología e Inmunología Clínica.
*AIA: Auto-inyector de adrenalina.
Referencias recomendadas
- Turner PJ, Campbell DE, Motosue MS, Campbell RL. Global Trends in Anaphylaxis Epidemiology and Clinical Implications. J Allergy Clin Immunol Pract. 2020;8:1169-76.
- Wang Y, Allen KJ, Suaini NHA, McWilliam V, Peters RL, Koplin JJ. The global incidence and prevalence of anaphylaxis in children in the general population: A systematic review. Allergy. 2019;74:1063-80.
- Ojeda P, Ibáñez MD, Olaguibel JM, Sastre J, Chivato T. Alergológica 2015: A National Survey on Allergic Diseases in the Spanish Pediatric Population. J Investig Allergol Clin Immunol 2018;28(5):321-329. doi: 10.18176/jiaci.0308.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
- MS Shaker, DV Wallace, DBK Golden, J Oppenheimer, JA Bernstein, RL Campbell, et al. Anaphylaxis—a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020;145:1082–1123.
- Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020 Jun;8(6):1854-1864. doi: 10.1016/j.jaip.2020.02.010.
XXI Reunión AEDAF
Hoy se celebra la XXI Reunión Anual y Asamblea General de la Asociación Española de Angioedema Familiar (AEDAF) celebrada en el Hospital Universitario La Paz de Madrid. El Angioedema Hereditario es una enfermedad rara de origen genético, que tarda años en ser diagnosticada.
Nuevos alimentos, viejos alérgenos
Los insectos forman parte de la cocina de muchos países del mundo y su consumo dentro de Europa va avanzando en últimos años. Aproximadamente dos mil millones de personas en todo el mundo consumen insectos especialmente en países como Asia, América Latina y África1.
El consumo de insectos es en la actualidad una tendencia alimentaria en auge. Desde el 1 de enero de 2018 la legislación europea cataloga a los insectos como “nuevo alimento” y según la Organización para la Agricultura y la Alimentación de las Naciones Unidas (FAO), les considera “el alimento del futuro”.
Hoy en día, son cuatro los insectos autorizados en el mercado europeo: las larvas del gusano de la harina (en forma congelada, desecada y en polvo), la langosta migratoria (en forma congelada, desecada y en polvo), el grillo doméstico (en forma congelada, desecada, en polvo y polvo parcialmente desgrasado) y las larvas del escarabajo del estiércol (en forma congelada, en pasta, desecada y en polvo) 2. Aunque a nivel general este habito de consumo no está muy extendido, en nuestra dieta, consumimos de forma inadvertida el componente “E12” o carmín, una sustancia que se obtiene del insecto cochinilla, que se utiliza para teñir diversos alimentos de confiterías, pasteles y mermeladas, jarabes, yogures, bebidas y carnes.
Además, hay ocho solicitudes pendientes para insectos destinados a ser comercializados en diferentes formas que actualmente están siendo objeto de una evaluación de seguridad2.
Los insectos representan una alternativa a la carne y el pescado para satisfacer la creciente demanda de fuentes sostenibles de nutrición 1.
Desde el punto de vista nutricional, los estudios científicos avalan que los insectos son una fuente de nutrientes muy saludables con alto contenido en proteínas, vitaminas B1, B2 y B3, contienen omega 3 y 6, todos los aminoácidos esenciales y son una fuente importante de minerales como el hierro.
Hay otro factor que debe tenerse en cuenta y que juega a favor del consumo de insectos: el impacto medioambiental. La producción de proteína de insectos supone una importante reducción de gases de efecto invernadero y supone una menor contaminación respecto a otras proteínas de origen animal.
Respecto a la seguridad de su consumo, la Comisión Europea con el reglamento sobre nuevos alimentos, asegura que se disponga de la información alimentaria obligatoria para que sean seguros para los consumidores y estén debidamente etiquetados, incluyendo la identificación correcta de alérgenos.
Al igual que las proteínas de otros alimentos, las contenidas en los insectos, son susceptibles de desencadenar reacciones alérgicas graves. Cada vez son más los pacientes que llegan a nuestras consultas por reacciones alérgicas, incluyendo reacciones anafilácticas, tras la ingestión de insectos.
Se han identificado varios alérgenos implicados en la alergia a insectos, entre ellos la tropomiosina y la arginina quinasa, ambos panalérgenos conocidos por su reactividad cruzada con proteínas homólogas en crustáceos y ácaros del polvo doméstico. Se ha demostrado reactividad cruzada y/o cosensibilización de la tropomiosina de insectos y la arginina quinasa en pacientes alérgicos a los ácaros del polvo doméstico y a los mariscos (p. ej., langostinos, gambas). También se ha demostrado que el procesamiento térmico y la digestión no eliminaron la alergenicidad de las proteínas de insectos1.
Algunos estudios señalan que la proteína de la cutícula de la larva del gusano, podría ser un alérgeno importante en la sensibilización primaria al gusano de la harina. Otros alérgenos, como la actina,insectoo la cadena ligera similar a la miosina, también se identifican como factor de riesgo de reactividad cruzada entre crustáceos y gusanos de la harina 3.
La disponibilidad de este tipo de alimentos en supermercados y su venta on-line, esta haciendo que cada vez su consumo sea más frecuente.
Es importante el papel que juega el alergólogo en este momento en el que el consumo de insectos empieza a instaurarse poco a poco en nuestra dieta para poder asesorar adecuadamente a los pacientes.
Rocío Candón Morillo. Hospital Universitario de Jerez. Comité de Alergia Infantil SEAIC.
Bibliografía
1.-Insect (food) allergy and allergens. Steffie de Gier , Kitty Verhoeckx .Molecular Immunology. Volume 100, August 2018, Pages 82-106
2.- Los insectos como nuevos alimentos: claves para asesorar adecuadamente a la población sobre su consumo. Diario medico.
3.-Mankouri F1, Sereme Y2,3, Michel M2,3, Piarroux R4, Pahus , Chanez P1,6, Vitte J2,3, Gouitaa MJ Investig . Immediate Hypersensitivity to Mealworm and Cricket: Beyond Shrimp and House Dust Mite
Cross-Reactivity. Allergol Clin Immunol 2022; Vol. 32(1): 56-78
ESOFAGITIS EOSINOFÍLICA EN PACIENTES PEDIÁTRICOS
La esofagitis eosinofílica (EoE) se considera una enfermedad crónica emergente; en la actualidad, ha pasado a ser una de las condiciones más comunes en la valoración y diagnóstico de problemas alimentarios en niños así como en la evaluación de disfagia y/o impactación en la edad adulta.
Se ha estudiado más extensamente en países occidentales, pero, aunque existen datos de prevalencia, se precisan estudios más amplios para consensuar datos epidemiológicos reales. Una revisión sistemática reciente mostró que la prevalencia poblacional de esofagitis eosinofílica en niños es 19,1 casos por 100.000 niños/año (1), con gran variabilidad de los datos según la localización geográfica y, probablemente, de otros factores como el diseño del estudio, los criterios diagnósticos utilizados, etc.
Fisiopatogénicamente se caracteriza por una inflamación Th2 en la que intervienen mecanismos mixtos mediados y/o no mediados por IgE dando lugar a una inflamación eosinofílica en el epitelio esofágico que origina una disfunción del mismo, dando lugar a los síntomas clínicos característicos.
En la población pediátrica los síntomas más prevalentes son los vómitos, dolor abdominal, disfagia, odinofagia e impactación del bolo alimenticio. Estas características clínicas difieren también según la edad del niño, siendo en niños más pequeños (2-8 años) más frecuente: el fallo de medro, rechazo del alimento, dolor abdominal, vómitos, trastornos del sueño, etc. En niños mayores y adolescentes los síntomas se asemejan más a los adultos, presentando disfagia, impactación, odinofagia, regurgitación, etc.
La prueba de oro para el diagnóstico es la toma de biopsias tanto de esófago proximal como distal (aumentando así el rendimiento del estudio) mediante una endoscopia digestiva. Esta técnica precisa de la sedación del paciente, lo que supone un “inconveniente” sobre todo en población pediátrica. Por ello se están estudiando otras técnicas menos invasivas como:
– Prueba del hilo esofágico (EST: esophageal string test), técnica basada en cápsulas que capturan las proteínas asociadas a los eosinófilos de la luz esofágica.
–Citoesponja: tecnología basada también en cápsulas, diseñada originalmente para la evaluación de la mucosa esofágica en el esófago de Barrett.
– Endoscopia transnasal sin sedación.
Estas técnicas y algunas otras en estudio también, podrían tener un papel importante en el control regular de la esofagitis, pero es muy poco probable que reemplacen la confirmación de un diagnóstico dudoso y/o actos terapéuticos realizables durante una endoscopia convencional como una dilatación.
Las opciones terapéuticas, ambas consideradas de primera línea son: tratamiento dietético y farmacológico:
– Terapias dietéticas: la fórmula de aminoácidos se describe como una terapia eficaz en niños con EoE, lo que indica la implicación de antígenos dietéticos en su patogenia. Se han descrito diversos enfoques dietéticos: dieta elemental, dieta dirigida según sensibilización alergénica, dietas empíricas, etc. La dieta de eliminación es una opción no farmacológica de primera línea para el manejo de la EoE; sin embargo, el orden y el número de antígenos específicos a evitar, así como su posterior reintroducción sigue siendo un área activa de investigación.
– Corticoides tópicos: este tipo de fármaco actúa a diversos niveles en esta patología: vías/genes inducidos por IL-13, reducción de la eosinofilia esofágica e infiltración mastocitaria, regulación a la baja de los genes de los mastocitos, reducción de células T y citocinas proinflamatorias como el factor de necrosis tumoral (TNF), etc. Los metanálisis realizados utilizando fluticasona o budesonida demuestran la superioridad de los corticoides frente a placebo para la eosinofilia esofágica, los hallazgos endoscópicos y los síntomas tanto en pacientes adultos como pediátricos. No están exentos de efectos adversos como puede ser la candidiasis, insuficiencia suprarrenal, etc. Los estudios abogan por una terapia que debe ser mantenida a largo plazo por la alta tasa de recaídas tras su retirada. Sigue en estudio la dosis y duración óptima de cada terapia.
– Tratamiento con inhibidores de la bomba de protones (IBP): la tasa de respuesta varía ampliamente desde un 30 a un 70%.Están en estudio las posibles diferencias fisiopatológicas entre la EoE sensible y/o resistente a los IBP. Algunos ejemplos incluyen:
– Técnicas de biología molecular demuestran que la expresión del transcrito para el canal de potasio Kir2.1 (gen KCNJ2) es menor en los pacientes que responden a los IBP. Si se valida, esto podría proporcionar una detección potencial para terapias personalizadas.
– Los pacientes con rinitis alérgica y metabolizadores rápidos CYP2C19 tienen un mayor riesgo de pérdida del control de la EoE a pesar de la terapia continua con IBP.
– Dilatación esofágica: destinada a aliviar complicaciones como la estenosis; técnica destinada a modificar cambios estructurales sin alivio histológico.
– Terapias emergentes:
* Nuevas formulaciones de esteroides: budesonida viscosa, budesonida en comprimidos bucodispersables, etc.
* Tratamientos biológicos: ANTICUERPOS MONOCLONALES
Anti-L5: benralizumab, mepolizumab, reslizumab. Se están realizando estudios para valorar la mejoría tanto clínica como histológica de estos tratamientos, por la involucración de la IL-5 en la infiltración y supervivencia del eosinófilo, sin resultados científicamente concluyentes aún.
Anti-IL13: la IL-13 es un mediador claramente implicado en la patogénesis de la EoE, mediante la activación y quimiotaxis de los eosinófilos a través del aumento de los niveles de eotaxina-3 y periostina. El anticuerpo QAX576 parece reducir los síntomas pero no se ha demostrado efecto significativo en la actividad clínica de la enfermedad; mientras que RPC4046 consigue una reducción significativa de la eosinofilia esofágica y la actividad de la enfermedad endoscópica así como en la reducción de síntomas.
Anti-IL4 y Anti-IL-13: Dupilumab (aprobado por la FDA en > 12 años). Se están llevando a cabo ensayos que parecen demostrar mejoría sintomática, endoscópica e histológica significativa.
Anti-IgE (omalizumab) y Anti-TNF (infliximab). No existe ningún ensayo clínico con evidencia científica que apoye su uso en la EoE.
*Otras dianas moleculares en estudio: Integrina α4β7, Siglec 8, TSLP, TGFβ, canales de calcio, IL- 9, 15 y 33, receptor de eotaxina anti CCR3.
Dra. Guacimara Hernández Santana, Hospital Universitario Nuestra Señora de la Candelaria en Santa Cruz de Tenerife. Comité de Alergia Infantil SEAIC
BIBLIOGRAFÍA:
- Arias A, Perez-Martinez I, Tenias JM, Lucendo AJ. Systematic review with meta-analysis: the incidence and prevalence of eosinophilicesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2016; 43(1): 3-15.
- Alfredo J Lucendo (2019): Pharmacological treatments for eosinophilic esophagitis: current options and emerging therapies, Expert Review of Clinical Immunology, DOI:10.1080/1744666X.2019.1705784
- Nirmala P. Gonsalves, Seema S. Aceves. Diagnosis and Treatment of Eosinophilic Esophagitis. J Allergy Clin Immunol. 2020 January ; 145(1): 1–7.
- Thomas Greuter, Ikuo Hirano, Evan S. Dellon. Emerging therapies for eosinophilic esophagitis. J Allergy Clin Immunol. 2020 January ; 145(1): 38–45.
- Arianna De Matteis et al. Eosinophilic Esophagitis in Children: Clinical Findings and Diagnostic Approach.Current Pediatric Reviews, 2020, 16, 206-214.