resultados de la búsqueda: cme-jiaci/wp-content/uploads/logos/Hospital Universitario Fundación Jiménez Díaz/wwwww/profesionales/aviso-importante/inicio/prensa
Procedimientos diagnósticos
El diagnóstico alergológico
Las pruebas cutáneas son diversas y su indicación depende, entre otros datos, del tipo de enfermedad que se estudia y de la sospecha del agente causal implicado (alérgeno). De ahí que antes de realizar cualquier prueba cutánea es necesario conocer la situación del paciente. Es decir, el alergólogo ha emitido un diagnóstico clínico que indica la confirmación de la sensibilización como causa de la enfermedad (diagnóstico etiológico).
Las pruebas cutáneas de mayor utilidad alergológica son tres: prick test, prueba intradérmica y prueba epicutánea.
El prick test (prueba intraepidérmica) consiste en la aplicación sobre la superficie cutánea de una pequeña cantidad de un extracto alergénico (habitualmente una gota) sobre la que se efectúa una leve punción con una lanceta de punta corta. Se puede realizar con extractos de aeroalérgenos, alimentos, medicamentos, himenópteros y cualquier otro alérgeno que requiera la confirmación de hipersensibilidad inmediata.
La prueba intradérmica consiste en la administración en la dermis superficial de un extracto alergénico en dilución acuosa, introduciendo una cantidad aproximada de 0,1 ml mediante una aguja de calibre fino. Mediante esta prueba se puede realizar una lectura inmediata (antes de 30 min) y retardada (a partir de 24 horas), para catalogar la sensibilización en función del resultado. La indicación es más específica que en el caso anterior y, salvo algunas excepciones, no debe realizarse con alimentos ni con la mayoría de los inhalantes.
Estas pruebas no están exentas de riesgos, ya que pueden desencadenar una reacción más intensa de lo habitual. Por este motivo deben realizarse bajo la supervisión de un alergólogo.
La prueba epicutánea (test del parche) consiste en la aplicación sobre la piel de uno o varios agentes responsables de reacciones cutáneas de contacto, con el fin de confirmar una respuesta de hipersensibilidad retardada. Por esto el parche se mantiene durante 48 horas y la respuesta se observa hasta 2 días después de su retirada. También se puede realizar con medicamentos, ante la sospecha de reacciones retardadas.
Las pruebas de exposición son el último recurso en el diagnóstico alergológico y muchas veces constituyen un procedimiento necesario para aclarar un diagnóstico de sospecha. Están indicadas para confirmar la tolerancia del supuesto causante de una reacción alérgica, cuando el resto de las pruebas no son concluyentes. En todo caso, corresponde al alergólogo la valoración y el control de estos procedimientos, dado el riesgo de reacción que conllevan.
Según la vía de exposición, estas pruebas pueden ser oculares, nasales, bronquiales, orales o parenterales. Estas últimas (inyectadas por vía subcutánea, intramuscular o intravenosa) se restringen al estudio de alergia a medicamentos.
Todo paciente que vaya a ser sometido a pruebas de exposición debe tener en cuenta que, atendiendo a su derecho de autonomía, debe firmar un consentimiento informado.
Última edición: 01/07/2019
———————————————–
Resumen de Actividades del Comité de Alergia Cutánea 2011-2012:
- Se ha elaborado la Cartera de Formación Continuada
- Se han puesto en marcha para el congreso de la SEAIC en Pamplona:
– Taller de identificación de lesiones cutáneas: impartido por el Director del Departamento de Dermatología de la Clínica Universitaria, en él se van a repasar las lesiones elementales y patologías más relevantes en sesión iconográfica
– Taller de curas en dermatitis atópica severa: impartido por dos enfermeras de la Clínica Universitaria, se enseñará de una forma práctica realización de curas para tratamientos tópicos de las lesiones de dermatitis atópica severa, fundamentalmente en niños
- Se ha elaborado y distribuido a los miembros de la SEAIC un cuestionario sobre petición de pruebas complementarias en urticaria crónica. Este cuestionario tiene el objetivo de elaborar un estudio del número de pruebas, gasto que supone y adherencia en la vida real a las guías de urticaria.
- Se está elaborando un protocolo del manejo práctico de un paciente con sospecha de alergia a corticoides tópicos.
- Se está elaborando un protocolo para el estudio de posible dermatitis por Betadine en enfermos con erupciones postquirúrgicas o similares con sospecha de alergia a antisépticos, con el objeto de conocer concentraciones irritativas, vehículos idóneos, reactividades cruzadas con otros productos yodados y/o con polivinilpirrolidona.
- Estudio de la idoneidad de los 5 nuevos contactantes (aureotiocolato, bacitracina, bronopol, Disperse Blue #106 y partenolide) recientemente aprobados por la FDA e incorporados en las baterías standard del TRUE-Test, e inicio de un registro de positivos en nuestros Servicios
- Se está validando los test diagnósticos de urticarias físicas.
- Iniciadas las gestiones para incluir un registro de enfermedades autoinflamatorias con urticaria por frío.
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
La alfa triptasemia hereditaria es un rasgo genético que ha supuesto un nuevo biomarcador a tener en cuenta, sobre todo entre los pacientes que tienen anafilaxia.
Sin embargo, su diagnóstico está limitado a algunos centros especializados y sus implicaciones clínicas continuan en exploración.
- TRIPTASA.
La actividad tripsina-like se describió por primera vez en mastocitos (MC) en 1960 empleando técnicas histoenzimáticas.(1) Posteriormente, en 1981, se demostró esta misma actividad en los MC humanos de tejido pulmonar,(2) se aisló la enzima con una pureza en torno al 90% y se denominó triptasa (EC 3.4.21.59). La triptasa es producida y almacenada principalmente por los MC, y en una mínima cantidad por los basófilos.(3)
Las protriptasas (α y β) son enzimáticamente inactivas y se liberan de forma constitutiva al plasma, constituyen lo que se determina como triptasa sérica basal (sBT). Tras un proceso de maduración, se producen las triptasas maduras (tetrámeros enzimáticamente activos que forman complejos con la heparina), que se acumulan en los gránulos de los MC. Los tetrámeros activos de β-triptasa y α/β triptasa, se liberan al medio extacelular tras la desgranulación secundaria a la activación mastocitaria, y su determinación resulta de gran utilidad en el diagnóstico de anafilaxia.(4)
Los tetrámeros de β-triptasa madura se comportan como serín proteasas, que actuando sobre el complemento, algunas citoquinas, el fibrinógeno, el cininógeno, prostromelisina y los receptores activados por proteasas (PAR), pueden inducir los siguientes efectos: la proliferación de fibroblastos y músculo liso, la degradación de la matriz extracelular, el reclutamiento de eosinófilos y neutrófilos, la estimulación de células nerviosas y epiteliales, la angiogénesis y la fibrinogenolisis.(5) Sin embargo, los tetrámeros de α-triptasa madura son inactivos.(5,6)
Los heterotetrámeros de α/β triptasa madura, también tienen actividad peptidolítica, siendo su diana los PAR2 presentes en células endoteliales e induciendo extravasación in vitro; y los EMR2 (like module–containing mucin-like hormone receptor-like 2) receptores (proteínas G mecanosensitivas) presentes en la superficie de los MC. La unión de los heterotetrámeros de triptasa madura a este receptor inducen la escisión de la subunidad α del EMR2, y desencadenan la desgranulación mastocitaria(5), mecanismo que se ha relacionado con la urticaria vibratoria.(7) El incremento del número de copias de α-triptasa aumenta la proporción de heterotetrámeros frente a los homotetrámeros llevando a una sobre activación de estos receptores.(8)
La técnica comercial actualmente disponible para la detección de triptasa (ThermoFisher Scientific) es un inmunoensayo que utiliza dos anticuerpos anti-triptasa (el B12 que se emplea para la captura y el G4 para el revelado) siendo el límite inferior de detección de la técnica de 0,5 ng/mL. Esta técnica cuantifica la triptasa total sin distinguir entre formas maduras o precursores, ni isoformas α y β en los fluidos biológicos. El punto de corte establecido para los valores séricos basales de triptasa (sBT) en sujetos sanos es de 11.4 ng/mL.(4)
- ALFA TRIPTASEMIA HEREDITARIA (HαT).
La triptasa en humanos se codifica por 4 genes parálogos TPSG1 (alelos γ), TPSB2 (alelos β2 y β3), TPSAB1 (alelos α y β1), y TPSD1 (alelos δ) localizados en el cromosoma 16p13.3. Presenta diferentes isoformas: α-triptasa, β-triptasa, δ-triptasa y γ-triptasa. El genotipo normal para α y β triptasa contiene 4 copias de los genes, incluyendo estas variaciones 0α:4β, 1α:3β y 2α:2β.(4,9)
También se han descrito variaciones en el número de copias que codifican la β-triptasa, sobre todo en algunos grupos raciales, pero estas variaciones no se asocian con elevaciones de la sBT en las familias. Mientras que, los valores elevados de sBT heredados con patrón dominante en una familia, se asocian con un alelo portador de un gen TPSAB1 que codifica α-triptasa, y se trata de HαT incluso aunque se detecten copias extra de β-triptasa. (4) (Figura 1).
La alfa triptasemia hereditaria (HaT) fue descrita en 2016.(10) Se caracteriza por presentar un número aumentado de copias del gen TPSAB1 que codifica la α-triptasa, tiene un patrón autosómico dominante, se ha descrito en el 4-7% de donantes sanos,(4,6) y asocia un leve predominio entre el género femenino.(11) Los pacientes con HαT suelen tener cifras basales de triptasa (sBT) >11.4 ng/mL; aunque existen casos con valores normales de triptasa (raramente <8 ng/mL). Se recomienda realizar el estudio de HaT en aquellos individuos con sBT >8 ng/mL;(12–14) este punto de corte ha demostrado una sensibilidad del 94% y una especificidad del 100% para detectar copias extra del gen TPSAB1.(12)
Se ha detectado una relación entre el número de copias extra del alelo α del gen TPSAB1 (hasta 4 copias extra) y los niveles de sBT, en familias con HαT+. Parece seguir un patrón por el cual las duplicaciones implican unos niveles de sBT de 15 ± 5 ng/mL, las triplicaciones de 24 ± 6 ng/mL, y las cuadruplicaciones de 37 ± 14 ng/mL.(4)
Además, los valores elevados de sBT se pueden encontrar en otras patologías como las mastocitosis sistémicas (MS), neoplasias mieloides e insuficiencia renal.(7) También se ha publicado en varios estudios, la relación entre los niveles elevados de sBT con la prevalencia y la gravedad de anafilaxia, sin embargo, estos datos deben interpretarse con cautela ya que en muchos de ellos no se ha valorado la presencia concomitante de MC clonales ni de HαT+.(4) En cambio, sí que resulta clara la relación entre HαT+ y las anafilaxias graves desencadenadas por veneno de himenóptero, otras alergias IgE mediadas, así como la asociación con MS.(4)
- GENOTIPADO DE HαT MEDIANTE PCR DIGITAL.
Las PCR (reacción en cadena de la polimerasa) digital, es una tecnología de última generación que se emplea para la cuantificación de ADN de forma reproducible y sensible, y se recomienda para analizar la variación del número de copias. Para llevar a cabo las mediciones, la muestra se divide en particiones, de forma que en cada una de ellas haya cero, una o varias moléculas diana presentes en cada reacción individual. Cada partición es analizada después de un ciclado de PCR en punto final para detectar la presencia (reacción positiva) o ausencia (reacción negativa) de una señal de fluorescencia. Finalmente, se calcula el número absoluto de moléculas presentes en la muestra, sin que los resultados dependan de una curva estándar, de este modo se reduce el error y se incrementa la precisión.(15) Existen en el mercado dos tipos de PCR digital: “Dropled digital PCR (ddPCR)” y “arraybased PCR”. La diferencia principal entre los dos modelos se debe a la estrategia diseñada para la división de la muestra: mediante la formación de gotas tipo emulsión, o mediante el uso de chips compuestos por micropocillos.(16)
Esta técnica detecta las secuencias α y β en los locus de TPSAB1 y TPSB2, a partir de DNA genómico (gDNA) se puede extraer tanto de sangre periférica como de MO.(6) Existe un KIT comercial para conseguir el DNA a partir de un “swab bucal”(17) y posteriormente proceder al estudio de las variaciones en el número de copias de TPSAB1; sin embargo, puede ocurrir que este método se encuentre limitado por problemas de daños y contaminación de las muestras.
- FENOTIPOS DE HαT.(18)
La expresión clínica de HαT puede ser muy variable, desde sujetos asintomáticos (descrito en el 4% de donantes sanos de población española(6), y 1/3 de los portadores) hasta cuadros de anafilaxia grave.(11)
En una reciente revisión, se ha descrito que los síntomas que con mayor frecuencia presentan los pacientes con HαT incluyen: 1) síntomas neuropsiquiátricos (depresión 59%, alteraciones del sueño 69% y alteraciones de memoria 59-68%); 2) síntomas gastrointestinales (colon irritable 30%-60%, nauseas 51%, y reflujo 49%-77%); 3) síntomas secundarios a la liberación de mediadores mastocitarios (flushing 47%, prurito 69%, urticaria 37%, y anafilaxia 14-28%); 4) hiperlaxitud articular 28%; 5) disfunción del sistema autónomo 34% (hipotensión ortostática, palpitaciones, taquicardia, presincope, síncope), y 6) síntomas constitucionales (dolor crónico, astenia 85%).(18,19)
Algunos de los síntomas descritos, aunque se encuentren con una elevada prevalencia, son difíciles de validar como secundarios a HαT+.(18)
Además, los síntomas de HαT+, en muchas ocasiones se pueden superponer con lo que se producen por activación mastocitaria. En este sentido, hay que tener en cuenta que los fenotipos hasta ahora asociados a HαT+ son muy heterogéneos, y que la mayoría de los casos descritos provienen de centros monográficos en patología mastocitaria y/o síndromes genéticos, por lo que es probable la existencia de sesgos en los datos obtenidos a partir de estas poblaciones.(4)
Sí que ha sido validado que los individuos con HαT+ tienen una mayor prevalencia de reacciones de hipersensibilidad inmediata sistémicas. (18)
4.1 HαT Y ANAFILAXIA
La elevación aguda de triptasa es un biomarcador de anafilaxia. El aumento de los valores de sBT triptasa en un 20 % + 2 ng/ml sobre el valor basal de cada individuo en el periodo comprendido entre 1-4 horas desde el inicio del cuadro agudo, es el criterio para confirmar activación mastocitaria y anafilaxia.(20) Esta fórmula tiene una elevada sensibilidad y es útil para identificar anafilaxia en los individuos con exposición parenteral al alérgeno.(21) Sin embargo, se encuentra limitada en algunas circunstancias como en la población pediátrica con alergia a alimentos, y pacientes con reacciones no IgE mediadas. Además, la variabilidad de los niveles de sBT en cada individuo a lo largo del tiempo no está bien estudiada.(22)
Por otra parte, diferentes estudios han identificado los niveles de sBT como un biomarcador asociado con el aumento en la prevalencia y la gravedad de la anafilaxia tras picaduras de insectos (sobre todo himenópteros),(4) y en alergia alimentaria infantil.(23)
HαT+ es el primer modificador genético hereditario descrito para la anafilaxia, que se asocia con un incremento en el riesgo para reacciones alérgicas graves al veneno de himenóptero con un riesgo relativo=2; así como un incremento del riesgo para la anafilaxia idiopática grave(12) y la anafilaxia grave desencadenada por alimentos en niños.(24)
Se ha estimado una prevalencia de HαT+ ≥8.5% en los pacientes con anafilaxia por veneno de himenóptero (HVA) en los que se ha descartado una patología mastocitaria clonal. Además, HαT+ no parece influir en la frecuencia de sensibilización al veneno de himenóptero, sólo influye en la gravedad de la reacción entre los individuos sensibilizados.(25)
También se ha descrito una mayor prevalencia de HαT+ en la anafilaxia idiopática (17%)(25) y en la anafilaxia desencadenada por alimentos en población infantil.(24)
4.2 HαT Y PATOLOGÍA MASTOCITARIA.
HαT+ está asociado a la presencia de patología mastocitaria clonal, encontrándose entre el 12-21% de los pacientes con síndrome de activación mastocitaria clonal (cSAM) y/o MS, sobre todo con formas no avanzadas de la enfermedad -MS indolentes (MSI) y MS quiescentes-.(11)
Un estudio realizado en población adulta española, ha descrito la prevalencia de HαT+ en el 29% de SAM no clonales (ncSAM) y el 18% de las mastocitosis. Entre los casos con mastocitosis, la detección de HαT+ es significativamente más frecuente (21% vs. 10%) entre los casos con la mutación D816V de KIT restringida a mastocitos vs. los casos con la mutación D816V de KIT multilineal. Además, entre los pacientes con mastocitosis, su cuadro clínico debutó con anafilaxia en el 76% vs. 65% (p = 0.18) de los HαT+ vs. HαT–.(6)
El mecanismo subyacente entre ambas entidades no es conocido, pero se ha planteado la hipótesis de que pudiera ser secundario al efecto de mitógeno del exceso de triptasa sobre el microambiente de la médula ósea (MO), promoviendo la selección de los clones aberrantes de MC.(11)
Los pacientes HαT+ con MS tienen una frecuencia de HVA del 30%, y una prevalencia de anafilaxia grave con síntomas cardiovasculares del 35.5%.(11) Así mismo, en población española se ha descrito que los pacientes con mastocitosis tienen una frecuencia de anafilaxia por alimentos del 15% en HαT+ vs. 5% en HαT– (p=0.013).(6)
Si se valora la patología mastocitaria global (clonal y no clonal), se ha descrito que la frecuencia de anafilaxia aumenta progresivamente desde los casos que no tienen alelos para α-triptasa (58%), los que tienen 1 alelo (65%), quienes tienen 2 alelos (72%) y aquellos que tienen ≥3 copias de este alelo (84%). En este estudio, también se describe, que si se analizan sólo los casos HαT+, la frecuencia de anafilaxia es mayor en los que tienen ≥3 copias vs. 2 copias de α-triptasa (82% vs. 61%; p=.017).(6)
- MANEJO DE HAT
Actualmente, para controlar los síntomas que habitualmente presentan los pacientes HAT+, se recomienda emplear el tratamiento antimediador que se suele emplear en la patología mastocitaria.(4) Se ha empleado con éxito el Omalizumab en casos plurisintomáticos complejos, consiguiendo la resolución de la urticaria y de la anafilaxia en el 94% de los pacientes.(13)
MTPS9579A, es un anticuerpo monoclonal humanizado IgG4 anti-triptasa, que inhibe selectivamente la actividad de la triptasa al disociar los tetrámeros activos en monómeros. Este anticuerpo anti-triptasa reduce la gravedad de la anafilaxia IgE mediada en un modelo murino humanizado.(26) Además, se ha desarrollado un modelo farmacocinético/farmacodinámico (PK/PD) para elegir la dosis de anticuerpo anti-triptasa MTPS9579A en pacientes con asma moderado-grave que permite predecir el nivel de exposición y de supresión de la triptasa en los tejidos diana.(27)
Otros estudios, describen anticuerpos monoclonales dirigidos a los receptores inhibidores de los mastocitos, como Siglec-8 (sialic acid-binding immunoglobulin-like lectin 8) [Lirentelimab/AK002], Siglec-6 [AK006], y CD200R [LY3454738].(28)
La eficacia y seguridad de Lirentelimab ha sido evaluado en ensayos clínicos con diferentes patologías en las que participan los mastocitos (incluyendo MSI, urticaria crónica espontanea, dermografismo sintomático, y conjuntivitis alérgica); en todos ellos los pacientes refieren mejoría se los síntomas.(28)
LY3454738 no demostró superioridad frente a placebo en un estudio fase II de urticaria crónica, por lo que esta línea de investigación se ha cerrado. Sin embargo, está pendiente de publicarse sus resultados en un estudio fase I en dermatitis atópica.(28)
AK006 inhibe la anafilaxia IgE mediada en modelos murinos.(28)
Todos estos anticuerpos, podrían abrir líneas de tratamiento de la anafilaxia y de los síntomas de HαT+ en el futuro.
FIGURAS.
Figura. Genotipos de triptasa codificados por TPSAB1 y TPSB2. (18)
BIBLIOGRAFÍA
- Glenner GG, Cohen LA. Histochemical demonstration of a species-specific trypsin-like enzyme in mast cells. Nature. 19 de marzo de 1960;185:846-7.
- Schwartz LB, Lewis RA, Seldin D, Austen KF. Acid hydrolases and tryptase from secretory granules of dispersed human lung mast cells. J Immunol Baltim Md 1950. abril de 1981;126(4):1290-4.
- Castells MC, Irani AM, Schwartz LB. Evaluation of human peripheral blood leukocytes for mast cell tryptase. J Immunol Baltim Md 1950. 1 de abril de 1987;138(7):2184-9.
- Wu R, Lyons JJ. Hereditary Alpha-Tryptasemia: a Commonly Inherited Modifier of Anaphylaxis. Curr Allergy Asthma Rep. 10 de mayo de 2021;21(5):33.
- Lyons JJ. Inherited and acquired determinants of serum tryptase levels in humans. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. octubre de 2021;127(4):420-6.
- González-de-Olano D, Navarro-Navarro P, Muñoz-González JI, Sánchez-Muñoz L, Henriques A, de-Andrés-Martín A, et al. Clinical impact of the TPSAB1 genotype in mast cell diseases: A REMA study in a cohort of 959 individuals. Allergy. 11 de octubre de 2023;
- Khoury P, Lyons JJ. Mast cell activation in the context of elevated basal serum tryptase: genetics and presentations. Curr Allergy Asthma Rep. 27 de noviembre de 2019;19(12):55.
- Zhang H, Zeng X, He S. Evaluation on potential contributions of protease activated receptors related mediators in allergic inflammation. Mediators Inflamm. 2014;2014:829068.
- Caughey GH. Tryptase genetics and anaphylaxis. J Allergy Clin Immunol. junio de 2006;117(6):1411-4.
- Lyons JJ, Yu X, Hughes JD, Le QT, Jamil A, Bai Y, et al. Elevated basal serum tryptase identifies a multisystem disorder associated with increased TPSAB1 copy number. Nat Genet. diciembre de 2016;48(12):1564-9.
- Kačar M, Rijavec M, Šelb J, Korošec P. Clonal mast cell disorders and hereditary α-tryptasemia as risk factors for anaphylaxis. Clin Exp Allergy. 2023;53(4):392-404.
- Robey RC, Wilcock A, Bonin H, Beaman G, Myers B, Grattan C, et al. Hereditary Alpha-Tryptasemia: UK Prevalence and Variability in Disease Expression. J Allergy Clin Immunol Pract. 2020;8(10):3549-56.
- Giannetti MP, Weller E, Bormans C, Novak P, Hamilton MJ, Castells M. Hereditary alpha-tryptasemia in 101 patients with mast cell activation-related symptomatology including anaphylaxis. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. junio de 2021;126(6):655-60.
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 27 de noviembre de 2020;21(23):9030.
- dPCR para principiantes [Internet]. Disponible en: https://www.qiagen.com/es-es/applications/digital-pcr/beginners
- Pérez-Barrios, C. PCR digital en la monitorización de la respuesta al tratamiento del paciente oncológico. En: Aplicaciones clínicas de lsa técnicas actuales de Biología Molecular. Cont. Lab. Clin.; 2018. p. 52-8.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, et al. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol. 2019;144(4):883-96.
- Lyons JJ. Hereditary Alpha Tryptasemia: Genotyping and Associated Clinical Features. Immunol Allergy Clin North Am. 2018;38(3):483-95.
- von Bubnoff D, Koch D, Stocker H, Ludwig RJ, Wortmann F, von Bubnoff N. The Clinical Features of Hereditary Alpha-Tryptasemia—Implications for Interdisciplinary Practice. Dtsch Arzteblatt Int. 22 de marzo de 2024;(Forthcoming):arztebl.m2023.0287.
- Valent P, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, Butterfield JH, et al. Why the 20% + 2 Tryptase Formula Is a Diagnostic Gold Standard for Severe Systemic Mast Cell Activation and Mast Cell Activation Syndrome. Int Arch Allergy Immunol. 2019;180(1):44-51.
- Baretto RL, Beck S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: A perioperative perspective. Allergy. diciembre de 2017;72(12):2031-4.
- Mateja A, Wang Q, Chovanec J, Kim J, Wilson KJ, Schwartz LB, et al. Defining baseline variability of serum tryptase levels improves accuracy in identifying anaphylaxis. J Allergy Clin Immunol. marzo de 2022;149(3):1010-1017.e10.
- Sahiner UM, Yavuz ST, Buyuktiryaki B, Cavkaytar O, Yilmaz EA, Tuncer A, et al. Serum basal tryptase may be a good marker for predicting the risk of anaphylaxis in children with food allergy. Allergy. febrero de 2014;69(2):265-8.
- Lang A, Kubala S, Grieco MC, Mateja A, Pongracic J, Liu Y, et al. Severe food allergy reactions are associated with α-tryptase. J Allergy Clin Immunol. octubre de 2023;152(4):933-9.
- Lyons JJ, Chovanec J, O’Connell MP, Liu Y, Šelb J, Zanotti R, et al. Heritable risk for severe anaphylaxis associated with increased α-tryptase-encoding germline copy number at TPSAB1. J Allergy Clin Immunol. febrero de 2021;147(2):622-32.
- Maun HR, Jackman JK, Choy DF, Loyet KM, Staton TL, Jia G, et al. An Allosteric Anti-tryptase Antibody for the Treatment of Mast Cell-Mediated Severe Asthma. Cell. 3 de octubre de 2019;179(2):417-431.e19.
- Rymut SM, Henderson LM, Poon V, Staton TL, Cai F, Sukumaran S, et al. A mechanistic PK/PD model to enable dose selection of the potent anti-tryptase antibody (MTPS9579A) in patients with moderate-to-severe asthma. Clin Transl Sci. abril de 2023;16(4):694-703.
- Metz M, Kolkhir P, Altrichter S, Siebenhaar F, Levi-Schaffer F, Youngblood BA, et al. Mast cell silencing: A novel therapeutic approach for urticaria and other mast cell-mediated diseases. Allergy. enero de 2024;79(1):37-51.
Novedades de la 5ª reunión Bianual centrada en alergia pediátrica de la EAACI, “The 5th Pediatric Allergy and Asthma Meeting (PAAM 2017)”
El Congreso PAAM (Pediatric Allergy and Asthma Meeting) se centra en alergia en población infantil y es la reunión más grande a nivel mundial sobre este tema. Recientemente se ha celebrado su quinta edición, en Londres, del 25 al 27 de Octubre.
Ha habido prácticamente 1300 participantes de 81 países distintos. Siguiendo la estructura habitual del congreso anual de la EAACI, el congreso se inició el jueves 26 a primera hora con cursos para posgraduados. Dichas sesiones se centraron en distintos aspectos (inmunología, patología digestiva no mediada por IgE, patología alérgica respiratoria, y ensayos clínicos en niños) de la alergia en población pediátrica. Dichas sesiones tuvieron un formato más extenso, con charlas de alrededor de 50 minutos, estructuradas a modo de clase magistral y aportando un repaso de la evidencia sobre cada uno de los temas.
Estas sesiones son especialmente recomendables para aquellos que deseen tener una panorámica general de los temas tratados. El congreso fue oficialmente inaugurado el jueves a las 13:00, con bienvenida y primera plenaria. A lo largo del congreso se impartieron tres sesiones plenarias, Asma en población pediátrica, Avances en alergia a alimentos, y Tratamiento y prevención de la alergia, todas ellas de gran interés e impartidas por especialistas de primera línea. La estructura del congreso permitió dar cabida a otros tipos de sesiones con formatos interesantes como simposios, talleres y debates pro y con, donde pudimos disfrutar de la visión de los expertos sobre temas actuales en la alergia de la población infantil.
Como viene siendo habitual, se creó un “Clinical Village” con distintos puestos dedicados a varios aspectos del niño alérgico, desde su nutrición, hasta la práctica de la inmunoterapia con aeroalérgenos pasando por calidad de vida y provocaciones orales con alimentos. Los miembros junior de la academia tuvieron la oportunidad de participar con sesiones especialmente dirigidas para ellos, manteniendo la apuesta que la EAACI hace para fomentar el desarrollo de jóvenes especialistas. A nivel académico, el protagonismo de la edición lo tuvieron las Guías de Consenso sobre inmunoterapia, recientemente publicadas por la EAACI. El último gran proyecto presidencial de la EAACI está siendo culminado en este 2017, y para la fecha del PAAM muchas de estas importantes guías ya estaban publicadas o están en vías de publicación. Los asistentes tuvimos la oportunidad de recibir de manos de sus propios autores la información más relevante de las mismas. Merece la pena, por último, hacer mención a la representación española (hasta 7 representantes en el programa) dentro de este congreso de la EAACI.
En los últimos años nuestro enfoque de la alergia y nuestros conocimientos tienen más cabida, gracias al esfuerzo de todos por mantener y aumentar nuestra representación en la Academia Europea. Queremos hacer una llamada a la participación en la EAACI a cualquier nivel, por los distintos cauces que existen, para que podamos tener el peso que la alergia y la inmunología clínica pediátricas en España merece. El alto nivel científico, así como su utilidad como punto de encuentro y de fomento de colaboraciones lo convierten en una cita imprescindible para los que tratamos niños alérgicos.
Para aquellos que pudieron asistir este año y quieran repetir, y los que se quedaron con ganas de haberlo hecho, es bueno ir reservando hueco en las agendas para la siguiente cita, que será en Florencia en 2019.
Pablo Rodríguez del Rio Miembro del“Pediatric Board de EAACI”
Montserrat Alvaro Lozano “Chair” del “Pediatric Board de EAACI”
Alergia ocular
Conjuntivitis alérgica
La conjuntiva es una membrana que recubre la parte visible del globo ocular y la parte interna de los párpados. Suele verse afectada en personas alérgicas a los alérgenos que se transmiten por vía aérea (pólenes, hongos, ácaros y animales domésticos), acompañándose en la mayoría de los casos de afectación de la mucosa nasal (rinitis).
Los síntomas característicos de la conjuntivitis alérgica son: picor o escozor, sensación de arenilla, lagrimeo y enrojecimiento de ambos ojos. En ocasiones afecta a un solo ojo, como por ejemplo ocurre en los casos de contactos aislados con animales.
Debe diferenciarse de otras causas conocidas de conjuntivitis, sobre todo las infecciosas y las causadas por irritantes ambientales o por sequedad ocular. El tratamiento consiste en prevenir el contacto con los agentes causales y en el empleo de colirios adecuados para aliviar los síntomas, en función del grado de intensidad y siempre bajo prescripción médica.
Otras enfermedades oculares
La blefaroconjuntivitis por contacto está causada por agentes que contactan directamente sobre la conjuntiva y el párpado. Habitualmente se produce por una reacción alérgica a los productos que contienen algunas preparaciones oftálmicas (colirios o pomadas). Se manifiesta con síntomas de conjuntivitis e inflamación del párpado (blefaritis).
La queratoconjuntivitis atópica ocurre en el contexto de una dermatitis atópica de base (ver alergia cutánea). Además de la conjuntiva, están afectados la córnea (queratitis) y los párpados (blefaritis). Produce un picor muy intenso y alteraciones en la visión por afectación corneal.
La queratoconjuntivitis vernal es una inflamación de la córnea y la conjuntiva de causa no aclarada. Se manifiesta típicamente en la infancia con síntomas estacionales (habitualmente en primavera y otoño), de forma que puede confundirse con una conjuntivitis alérgica. Produce picor y secreción intensas, así como malestar ocasionado por la luz (fotofobia).
La conjuntivitis papilar gigante es una reacción ocular que aparece en personas que utilizan lentes de contacto blandas. Se trata de un proceso irritativo ocasionado generalmente por depósitos de agentes inespecíficos que acumulan las lentes.
———————————————–
Contactantes
Los metales son la causa más frecuente de dermatitis alérgica de contacto.
El níquel es un metal ampliamente distribuido que forma parte de numerosos objetos metálicos de uso habitual: monedas, relojes, bisutería, hebillas, cremalleras, tijeras, cubiertos, utensilios de cocina, herramientas, etc. Prácticamente cualquier objeto con baño metálico puede contener níquel, que puede liberarse en mayor o menor proporción. El acero inoxidable, la plata alemana, la alpaca y el oro blanco también lo contienen. Es posible encontrarlo también en piezas ortopédicas y algunos pigmentos para pinturas y colorantes.
El cromo es un metal que se puede encontrar en muy diversos productos: metales cromados, cemento húmedo, cuero, pigmentos amarillo-anaranjados, cerillas de seguridad, productos de limpieza (detergentes, abrillantadores), reactivos de laboratorio, tintas de bolígrafos, papel carbón. Puede existir una exposición intensa en la industria metalúrgica y textil, así como en la elaboración de pinturas, cerámica y vidrio.
El cobalto es un metal que se encuentra en diversos objetos con baño metálico: hebillas, botones, cremalleras, monedas, bisutería, etc. Otras fuentes de exposición a cobalto pueden ser: cemento húmedo, pigmentos azulados (pinturas, tatuajes, etc.), prótesis metálicas dentales y ortopédicas. También puede existir una exposición intensa en la industria metalúrgica y textil, así como en las artes gráficas.
El mercurio es un metal de amplio uso como antiséptico y desinfectante. Se encuentra en varias formas: mercurocromo (merbromina), tiomersal (mertiolato), sales de fenilmercurio, etc. También se ha utilizado para la formación de amalgamas dentales y en termómetros. Otras fuentes de exposición a mercurio son: pinturas, pesticidas, reactivos de fotografía y litografía, reactivos de laboratorio, conservantes de la madera, fieltro, fabricación de baterías y catalizadores.
———————————————–
Humanidades
El Comité de Humanidades aporta a los socios de la SEAIC el entronque con el aspecto humanístico que la Medicina y el ejercicio de ésta nunca deberían perder, a pesar del avance imparable de la tecnificación y tecnologización de las ciencias de la salud. A través de la organización de coloquios y certámenes, el Comité de Humanidades posibilita la potenciación de las facetas artísticas de nuestros asociados.
| Presidente: | Ignacio Esteban Gorgojo (Madrid) |
| Vicepresidente: | Jesús Macías Iglesias (Madrid) |
| Secretario: | puesto vacante |
| Miembros estables: | Álvaro Amo Vázquez de la Torre (Córdoba) Tomás Chivato Pérez (Madrid) Ignacio Jesús Dávila González (Salamanca) Mónica Fernández Rodríguez (Vigo) Natalia Patricia Freundt Serpa (Madrid) Gabriel Gastaminza Lasarte (Navarra) María Luisa González Gutiérrez (Madrid) Maria Auxiliadora Hernández Pérez (Fuerteventura) Juan Manuel Igea Aznar (Salamanca) José Antonio Navarro Echeverría (Gipuzkoa) Alberto Oehling (Baleares) María José Pascual Miravalles (Baleares) Roberto Pelta Fernández (Madrid) Andrea Pereiro Villanueva (Madrid) Victoriano Javier Peralta Prieto (Jaén) Ignacio Javier Pérez Camo (Zaragoza) Yolanda Puente Crespo (Sevilla) Santiago Quirce Gancedo (Madrid) Virginia Reguera Parra (Jerez de la Frontera) Manuel Rial Prado (A Coruña) Mercedes Rodriguez Rodríguez (Madrid) Miriam Sobrino García (Salamanca) Marcela Valverde Monge (Madrid) María Esther Velázquez Amor (Sevilla) Rosialzira Natasha Vera Berrios (Madrid) Juan José Zapata Yébenes (Almería) Beatriz Moya Camacho (Madrid) |
Actualizado el día 04/04/2025
LA HISTORIA CLÍNICA
Se comienza realizando una historia clínica detallada, que consiste en un informe detallado en base a lo que cuenta el paciente, donde deben quedar reflejados los síntomas presentados por el paciente, lugar del cuerpo donde fue picado, el tiempo entre la picadura y el inicio de los síntomas, si había padecido antes reacciones similares, tratamiento que se le administró, etc.
Además debe dejarse constancia de las enfermedades que presente la persona, el tratamiento que realiza, así como del riesgo, bien por su profesión o por sus aficiones, de volver a ser picado.
La historia clínica orientará acerca del insecto responsable de la picadura: El lugar donde se encontraba cuando fue picado, las características del entorno (colmenas en la cercanía, nidos de avispa, presencia de alimentos, agua), etc… Si el paciente refiere que el insecto al picarle dejó el aguijón, es que se trata de una abeja, en caso contrario es más probable que se trate de un véspido. Dentro del grupo de avispas dependiendo del tamaño del insecto o de la localización del nido se podrá determinar si es polistes o véspula. Debe tenerse en cuenta que las dos especies más comunes de véspidos son la Véspula germánica (sobre todo en el norte) y la Polistes dominulus (sobre todo en el área mediterránea).
CAUSAL: INMUNOTERAPIA
Hoy en día disponemos de una herramienta eficaz para evitar estas reacciones ulteriores: la inmunoterapia (IT) con extracto purificado de venenos.
La IT es el tratamiento habitual de las enfermedades alérgicas mediadas por IgE. Su objetivo es modificar la respuesta inmunológica: producir una desensibilización.
Este tratamiento se realiza de forma preferente en los hospitales. Está indicado en adultos y niños con reacciones alérgicas generalizadas tras picaduras de abejas o avispas, junto con pruebas alérgicas positivas a dichos himenópteros tras valoración por alergólogo.
En líneas generales consiste en la administración subcutánea de dosis inicialmente muy bajas del extracto alergénico, que progresivamente se van incrementando a intervalos regulares hasta alcanzar una dosis máxima.
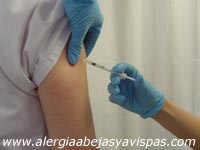
Una vez alcanzada ésta se continúa con una pauta de mantenimiento en la que se administra esta dosis máxima cada mes o cada dos meses durante un tiempo relativamente largo, que en la mayoría de los casos es de 3 a 5 años.
(Figura 20).
En el caso que nos ocupa la inmunoterapia se realiza inyectando cantidades crecientes de veneno del himenóptero escogido hasta llegar a 100 ó 200 μg. Su eficacia es alta: hay una curación en el 95% de los pacientes tratados con veneno de abeja y en el 98% de los tratados con veneno de avispa.
Historia de la Inmunoterapia
Los primeros intentos de tratamiento con vacunas de veneno se llevaron a cabo a finales de la década de 1920. Se utilizaron extractos de veneno y de vesículas de veneno (bolsas que contienen el veneno). Pero el alto porcentaje de reacciones adversas así como la publicación en 1.930 del éxito obtenido en la desensibilización de un apicultor usando extracto de cuerpo de abeja condujeron al uso generalizado de estos extractos, mucho mejor tolerados que los de veneno.
En 1.965 se demostró que el veneno contenía alérgenos que no estaban presentes en los extractos de cuerpo. Por las mismas fechas se publicaron un par de trabajos que demostraron que los extractos de cuerpo no eran útiles en el diagnóstico de alergia a venenos. Posteriormente surgieron muchos estudios que demostraron la inutilidad de la IT con extractos de cuerpo.
Desde 1.974 quedó totalmente establecido que para el diagnóstico y tratamiento de la alergia a venenos de himenópteros había que usar extractos de veneno. Actualmente se han abandonado los extractos de cuerpo y contamos con multitud de trabajos que demuestran la alta eficacia (>98%) de esta IT.
Pautas de administración
La IT en general y también la IT con venenos puede administrarse con diferentes pautas de inicio según la rapidez con que se alcance la dosis de mantenimiento:
- Pauta clásica: Las dosis se administran semanalmente, una dosis a la semana, hasta llegar a los 100 µg. El tiempo empleado es de unas 14 semanas.
- Pauta agrupada: se administran varias dosis al día, un día a la semana. Permite llegar a la dosis máxima en un plazo mucho más breve, de una a tres semanas.
- Pautas rápidas y ultrarrápidas: Se llega a la dosis de 100 µg a lo largo de uno o dos días. Tienen más efectos adversos que las previas.
Actualmente la pauta recomendada es la agrupada porque las reacciones adversas son similares a las de la pauta clásica y el paciente queda protegido en sólo 7 a 21 días. Para que esa protección se mantenga en el tiempo y sea duradera es necesario que las dosis máximas se repitan inicialmente cada 4 semanas y progresivamente se espacian cada 8 semanas durante 5 años.
En algunos pacientes la dosis de mantenimiento se aumenta hasta 200µg para obtener mayor protección frente a nuevas picaduras. La pauta agrupada es la forma de administración que se realiza en gran número de servicios de alergia de nuestro país. Aunque tiene el mismo índice de reacciones adversas, cada día el riesgo es mayor por el número de dosis administradas, por lo que se recomienda que se realice con el paciente bajo control estricto.
Efectos adversos de la inmunoterapia
Las reacciones adversas que encontramos son similares a las respuestas ocasionadas por las picaduras naturales. Es decir, desde una reacción local en el lugar de la administración, hasta cuadros generalizados graves.
La frecuencia y gravedad de las reacciones dependen de múltiples factores pero en general puede establecerse que las reacciones más graves suelen aparecer en los pacientes que sufrían también cuadros más graves con las picaduras.
Se estima que entre el 12% y 20% de los pacientes pueden presentar reacciones generalizadas con la IT de veneno de himenópteros, generalmente durante la fase de iniciación y consiste en su mayoría en reacciones leves que no requieren tratamiento con adrenalina. Hay muchos factores que pueden influir en ello, tanto dependiente del individuo como del propio insecto.
Este tratamiento se realiza de forma preferente en los hospitales, donde el paciente permanece en observación (de 30 minutos a una hora según el la fase en la que se encuentre) tras cada dosis, por si se produjera alguna reacción severa. En muchos pacientes es un tratamiento vital e insustituible, y está indicada en personas de edad avanzada o con patología de base (EPOC, cardiopatía isquémica…) que aumentan el riesgo de reacción adversa.
Seguimiento
El 95% de los pacientes con reacciones sistémicas, sometidos a inmunoterapia, no experimentan nuevas reacciones generalizadas con las futuras picaduras. La inmunoterapia una vez conseguida la dosis de mantenimiento debe prolongarse al menos 5 años. Durante este período, anualmente se repiten las pruebas cutáneas y la IgE específica observando su disminución o negativización.
Estas pruebas diagnósticas no resultan definitivas a la hora de determinar el grado de protección de los pacientes ante una nueva picadura, aunque una negativización de las pruebas cutáneas, junto a la desaparición de la Ig E específica, pueden indicar protección clínica. En la mayoría de los pacientes, los efectos beneficiosos siguen persistiendo tras la suspensión del ciclo de inmunoterapia.
Prueba de picadura controlada

La picadura controlada es la prueba más fiable para valorar la eficacia de la ITE, comprobando la protección en los pacientes tratados con inmunoterapia e identificando a aquellos que no están adecuadamente protegidos. También se puede usar para valorar el grado de protección una vez que se ha interrumpido la inmunoterapia.
Consiste en someter al paciente a una picadura del insecto al que inicialmente era alérgico.
(Figura 21).
Al ser picada, la persona ya no experimenta la reacción alérgica inicial: aparecen solamente síntomas locales o síntomas generales leves. También tiene sus limitaciones y no puede considerarse de forma absoluta como un indicador seguro de protección. Una picadura espontánea bien tolerada puede también informar sobre la eficacia del tratamiento, pero la posibilidad de una falsa identificación del insecto responsable (cosa más probable en el caso de avispas) la hace menos fiable.
Se realiza en algunos servicios de alergia solamente. Debe ser siempre interpretada con cautela por el alergólogo y contar con la autorización del paciente.
Aerobiología Clínica
El Comité de Aerobiología Clínica estudia los alérgenos ambientales transportados por el aire, fundamentalmente los pólenes y las esporas de hongos. Este comité realiza una labor muy útil tanto para los alergólogos como para los pacientes a través de la Red de Aerobiología. Una red de estaciones con captadores de aire en cada una de las provincias españolas y que, gracias a la labor de los alergólogos y biólogos que leen a diario los recuentos de esporas y hongos retenidos en los captadores, proporciona una información permanentemente actualizada de las densidades de estos aeroalérgenos ambientales.
Actualizado el día 09/01/2025
Curso TRIPLE Asma
Os presentamos el curso TRIPLE ASMA, patrocinado por Chiesi y Avalado por la SEAIC, un programa online avanzado diseñado específicamente para especialistas en alergología,
neumología, medicina familiar y comunitaria. Este curso se centra en la actualización de conocimientos y el desarrollo de habilidades en el manejo del asma incluyendo la utilización de la triple terapia
Link al curso: https://www.tripleasma.com/#/public/inicio
Inmunoterapia
Actualizado el día 09/01/2025
Laboratorio en Alergología
Actualizado el día 07/07/2025
Ejercicio privado
Actualizado el día 09/01/2025
Foro de las Sociedades Regionales
| Presidenta: | Dra. Inmaculada Sánchez-Guerrero Villajos |
Actualizado el día 04/12/2023
Rinología y Conjuntivitis Alérgica
El Comité de Rinología y Conjuntivitis Alérgica, junto con el de Asma, es uno de los más antiguos de la SEAIC. Sus miembros focalizan sus proyectos de investigación y formación en las enfermedades alérgicas de la vía respiratoria alta, como la rinitis alérgica, la conjuntivitis y la rinosinusitis. Tiene estrechas relaciones científicas con los comités de Asma y Aerobiología, y ha realizado importantes proyectos científicos y epidemiológicos con otras sociedades científicas afines, como la SEORL.
Actualizado el día 09/01/2025
Test encuesta
Test escueta inicio
[paaaoll id=»15″]
FIn
Aval SEAIC
Directorio de productos avalados por SEAIC (en orden alfabético).
Allerban
Tratamiento anti-ácaro y antibacteriano integrado en las fibras para relleno de almohadas y edredones Hollofill, Qualofill y Comforel.Allerbran es una protección anti-ácaros y antimicrobiana que impide el desarrollo de los ácaros del polvo en las fibras textiles.Su mecanismo de acción es a través de una sustancia biológica activa incorporada en la fibra textil de polipropileno o de poliéster que elimina el hongo Aspergillus repens, esencial para que el aparato digestivo de los ácaros pueda asimilar los nutrientes habituales. Se registró en la EPA en 1976 y ha sido utilizada de forma segura durante más de 20 años en otros campos (ej. Ropa interior, pañales, gasas estériles). Su eficacia contra los microorganismos es de una naturaleza mecánica pura, mediante un método mecánico de rotura de la pared celular del mismo que conlleva la destrucción de la célula.
Filvit Alergenos
Filvit Alérgenos reduce hasta 6 meses la concentración de alérgenos de ácaros domésticos. Laborotario Ern.
Plasma Quad/Plasma Quad Plus
Mitsubishi Electric, fabricante de equipos de Aire Acondicionado, dispone del exclusivo sistema de filtrado de aire Plasma Quad y, su evolución Plasma Quad Plus. Una tecnología incorporada en los splits de aire acondicionado MSZ-FH Kirigamine y MSZ-LN Kirigamine Style capaz de eliminar eficazmente las partículas contaminantes del aire.
Según los estudios realizados por la marca japonesa, los filtros Plasma Quad y Plasma Quad Plus reducen hasta el 97% la exposición a partículas alergénicas, virus y bacterias, lo que puede contribuir a controlar los síntomas de alergia.
Gracias a esta elevada efectividad en la eliminación de contaminantes del aire, los filtros Plasma Quad son la nueva opción en Aire Acondicionado de Mitsubishi para personas alérgicas y/o asmáticas interesadas en crear un ambiente saludable y libre de impurezas en su hogar.
![]() Plasma Quad/Plasma Quad Plus(5186 descargas)
Plasma Quad/Plasma Quad Plus(5186 descargas)
Proyección y alianzas de la SEAIC con agentes de interés
- Alianza SEAIC-Pacientes. Establecer alianzas con asociaciones de pacientes y ofrecer ayudas educativas para contribuir a mejorar el manejo de las enfermedades alérgicas.
- Alianza SEIAC-Administradores y proveedores de salud. Promover a través de E-alergia equidad en la asistencia alergológica en todo territorio español.
- Alianza SEAIC-Industria farmacéutica. Establecer sinergias para mejorar la investigación y divulgación de las enfermedades alérgicas.
- Alianza SEAIC-Comisión Nacional de la Especialidad. Establecer un canal de comunicación entre SEAIC y los representantes de la especialidad ante la Administración Sanitaria.
- Alianza SEAIC-Universidad. Establecer alianzas que promuevan la enseñanza de la especialidad en las facultades de Medicina españolas.
- Alianza SEAIC-Sociedades Científicas. Establecer sinergias con otras sociedades científicas, a nivel global, ya sean de la misma especialidad o una especialidad afín a la alergología, para promover la investigación, el conocimiento y la divulgación de las enfermedades alérgicas.
Última edición: 29/04/2011
—————————————–
Polen Control
 Polen Control es una aplicación desarrollada conjuntamente por la SEAIC y Almirall que permite realizar el seguimiento de la evolución sintomática en pacientes, con la finalidad que el profesional médico pueda cruzar y relacionar dichos datos con los niveles polínicos existentes.
Polen Control es una aplicación desarrollada conjuntamente por la SEAIC y Almirall que permite realizar el seguimiento de la evolución sintomática en pacientes, con la finalidad que el profesional médico pueda cruzar y relacionar dichos datos con los niveles polínicos existentes.
 Polen Control le permitirá realizar un mejor seguimiento y diagnóstico de las alergias debidas al polen ambiental, especialmente en pacientes que presentan polinosis. El paciente podrá realizar el seguimiento diario de su patología a través de su móvil, para posteriormente enviarle un informe en el que los datos de su paciente se cruzarán automáticamente con los datos de los niveles polínicos ambientales.
Polen Control le permitirá realizar un mejor seguimiento y diagnóstico de las alergias debidas al polen ambiental, especialmente en pacientes que presentan polinosis. El paciente podrá realizar el seguimiento diario de su patología a través de su móvil, para posteriormente enviarle un informe en el que los datos de su paciente se cruzarán automáticamente con los datos de los niveles polínicos ambientales.
Beneficios de Polen Control
Con esta aplicación podrá:
- Llevar un mejor seguimiento y diagnóstico de sus pacientes con polinosis.
- Obtener un informe con el cruce de síntomas de sus pacientes y los niveles polínicos ambientales.
- Obtener información de los niveles polínicos diarios, ofrecidos por la SEAIC.



Solicite el código de activación
Si desea participar en el programa Polen Control, necesita disponer de un código de activación. Introduzca sus datos en www.polencontrol.com en el apartado soy médico, y nos pondremos en contacto con usted. Al darle de alta en el programa le facilitaremos un código que deberá entregar a sus pacientes para que le envíen el informe de seguimiento a través de la aplicación, directamente al e-mail que nos haya facilitado.
Sitio web de la aplicación:
Enlaces de descarga:
Documento informativo:
Actualizado el día 18/07/2013










