resultados de la búsqueda: asma/wp-content/uploads/logos/Sitio web no disponible/profesionales/aviso-importante/inicio/prensa/cme-jiaci
Alergológica 2005
Se ha publicado en la revista Journal of Investigational Allery and Clinical Immunology el Estudio sobre los factores epidemiológicos, clínicos y socioeconómicos de las enfermedades alérgicas en España.
Acceso online: www.jiaci.org
Administración de inmunoterapia subcutánea: mucho mas que una inyección subcutánea: La Enfermera de Alergología te lo explica.
Cuantas veces nos han preguntado “¿Eres la enfermera/o de alergia? ¿La que pone las vacunas no?”.
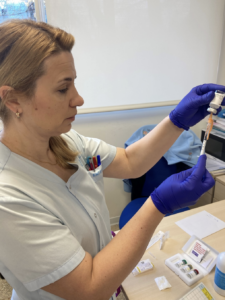 Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
El paciente acude a nuestra consulta con la incertidumbre ante lo desconocido, a pesar de haber recibido información el día de la prescripción del tratamiento por el alergólogo/a, sobre el procedimiento y sus riesgos.
Es importante que nos presentemos, que conozca nuestro nombre, y le indiquemos que somos las enfermeras/os responsables de la administración del tratamiento. Es muy importante que el paciente se encuentre tranquilo.
Así mismo, procederemos a resolver aquellas dudas que pueda tener acerca de la inmunoterapia (IT) específica de alergia, además de informarle que este tratamiento consta de dos fases:
- Fase de Inicio: Donde se irá incrementando de forma periódica la dosis/concentración de la vacuna, comprobando la tolerancia a la misma. En esta fase deberemos preguntar siempre si han tolerado bien la dosis anterior y si han sufrido algún tipo de reacción en su domicilio (reacción tardía).
- Fase de Mantenimiento: Donde se habrá alcanzado la dosis terapéutica que se continuará administrando de forma periódica.
Respecto a la administración del tratamiento, como responsables de su administración, deberemos comprobar siempre: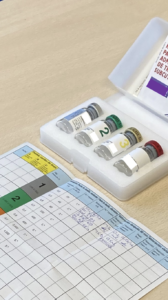
- Que la vacuna que nos entrega el paciente es la que ha prescrito su alergólogo.
- Que corresponde con el nombre del paciente, ya que están identificadas nominalmente.
- La fecha de caducidad.
- Que se ha conservado en nevera (entre 2 y 8 ºC teniendo especial cuidado que no se congele, pues se inactiva y pierde sus propiedades terapéuticas), y trasportada en bolsa térmica .
Procederemos a realizar la valoración de enfermería, recogiendo información sobre su estado de salud:
- Si se encuentra sin síntomas de infección activa (fiebre).
- Si no está presente un episodio agudo (crisis) de su enfermedad alérgica: asma mal controlada o rinoconjuntivitis alérgica.
- Si se encuentra en tratamiento con antibióticos. En cuyo caso se postpondrá la administración hasta su recuperación .
- Si ha recibido en los últimos 7-10 dias vacunas de virus atenuados (gripe, covid…). Como norma general es el intervalo de tiempo mínimo que se recomienda para la administración de la IT específica de alergia.
A continuación procederemos a la toma de constantes vitales (tensión arterial, frecuencia cardiaca, saturación de oxígeno y temperatura) y a la administración del tratamiento de IT específica de alergia siguiendo el protocolo establecido.
Los pacientes deben saber:
- Que tras la administración de su vacuna deben estar un tiempo mínimo de 30 minutos en nuestro servicio de alergia (o Centro de Salud), con el fin de comprobar que ha tolerado bien su IT, y que no han aparecido reacciones adversas inmediatas (por su seguridad).
- Que las reacciones adversas más frecuentes que pueden aparecer son: Enrojecimiento y picor (prurito) en la zona de administración.
- La presencia de síntomas como tos, falta de aire (disnea), aparición de eritemas (zonas enrojecidas en la piel), picor en palma de manos o síntomas exacerbados de su alergia deben ser comunicados inmediatamente para actuar de manera precoz.
- Que la IT especifica de alergia NO sustituye al tratamiento pautado por su alergólogo/a en referencia a antihistamínicos, colirios, inhaladores o nebulizadores nasales. Es un tratamiento conjunto.
- Que no deben practicar ejercicio físico intenso, coger peso, ir a saunas/piscinas cubiertas (ambientes húmedos y cargados) al menos en las 4 primeras horas de la administración de ITSC.
- Que deben informar de la aparición de reacciones tardías (en su domicilio): Aumento de eritema en zona de administración (recomendaremos que se realicen fotos), o cualquier otro síntoma que hayan podido experimentar.
- Que los beneficios de la IT específica de alergia se consiguen a medio/largo plazo y por ello, es necesario que los pacientes acudan a las revisiones programadas por sus alergólogos/as, para valorar la evolución con del tratamiento y si es oportuno continuar con el tratamiento o suspenderlo.
Anafilaxia en niños y adolescentes
La anafilaxia, como extremo más grave del espectro de las reacciones alérgicas, de afectación sistémica, aguda y potencialmente mortal, representa una patología de especial interés en pediatría.
En Europa, la anafilaxia es un problema común que afecta aproximadamente a 1 de cada 300 habitantes en algún momento de su vida. Según datos de la red europea de reacciones alérgicas graves, el 27% de los casos de anafilaxia se produce en menores de 18 años. Además, se ha descrito un incremento de su incidencia, especialmente en niños y preescolares.
Causas/desencadenantes
La causa más común de anafilaxia en niños son los alimentos (75%), seguida a distancia por los medicamentos (11%). Estudios epidemiológicos de la SEAIC* señalan a la alergia alimentaria como tercer motivo de consulta a los servicios de Alergología en edad pediátrica, con una tendencia al alza. La anafilaxia representa el 7,5% de los casos diagnosticados, siendo la leche de vaca, el huevo, los frutos secos y las frutas, los alimentos implicados más frecuentemente.
Los desencadenantes alimentarios varían según la edad y el área geográfica. En los dos primeros años de vida, la leche de vaca y el huevo son los desencadenantes más habituales; posteriormente, los frutos secos en edad preescolar, siendo el cacahuete el más común en todas las edades. En ciertos países europeos, particularmente en el área mediterránea, el melocotón tiene especial relevancia.
La anafilaxia inducida por ejercicio y dependiente de alimentos también debe ser considerada en los niños. Es un tipo especial de alergia mediada por IgE en la que el ejercicio o el consumo de un alimento causante no inducen síntomas por sí solos, pero el ejercicio tras la ingestión del alimento desencadena anafilaxia.
Por último, los padres con frecuencia expresan su preocupación sobre el riesgo de anafilaxia por vacunas; sin embargo, son una causa excepcional en niños.
Factores de riesgo y casos fatales
Las muertes por anafilaxia son raras. En aquellas relacionadas con alimentos, el 73% son debidas a frutos secos o cacahuete, siendo la leche de vaca responsable del 21% de las muertes en <16 años. El riesgo de muerte por anafilaxia aumenta dos veces entre adolescentes en comparación con los niños de 0-2 años. En general, los factores de riesgo identificados para la anafilaxia fatal por alimentos en niños incluyen asma coexistente, edad >10 años, alergia al cacahuete o frutos secos y la falta o la administración tardía de adrenalina.
Un tercio de los casos de anafilaxia ocurren en casa, el 25% en restaurantes y un 15% en la escuela.
Diagnóstico de anafilaxia
La anafilaxia es un diagnóstico predominantemente clínico, con afectación de varios sistemas y de inicio rápido tras la exposición al desencadenante. En los niños muy pequeños, el diagnóstico puede presentar algunos desafíos por la dificultad para describir ciertos síntomas como el prurito o la opresión faríngea; y ciertos signos, como la irritabilidad y los cambios de comportamiento, pueden ser difíciles de interpretar. La anafilaxia en los lactantes suele afectar a la piel (98%), al sistema respiratorio (59%), al aparato digestivo (56%) y, con menos frecuencia, al sistema cardiovascular. Cuando se produce hipotensión, en niños <10 años se define como una tensión arterial sistólica inferior a <70mmHg + (2 x edad en años) o un descenso >30% respecto a un registro basal.
Los síntomas respiratorios aparecen con frecuencia en los niños, especialmente en aquellos que padecen asma. Por otro lado, la anafilaxia puede suceder sin afectación de la piel, de tal forma que los signos cutáneos están ausentes en 10-20% de las anafilaxias. Este hecho afecta de manera crítica a su diagnóstico y tratamiento precoces.
Manejo
Para el autocuidado temprano de los pacientes con anafilaxia es fundamental educar a los padres, cuidadores y a los niños sobre el riesgo de anafilaxia, el control de las enfermedades concomitantes y sus desencadenantes y el autotratamiento de cualquier recurrencia. Durante la infancia, el cuidado/responsabilidad en la aplicación de medidas de evitación, reconocimiento de reacciones y tratamiento de las mismas recae inicialmente en padres y cuidadores. A medida que el niño crece se le enseña a evitar los desencadenantes, reconocer los síntomas y tratar futuras reacciones. Se ha estimado por encuestas que los niños de 9-11 años podrían reconocer síntomas y utilizar correctamente un AIA*.
A los pacientes se les deben recetar uno o más AIA*. Se recomienda que lleven siempre consigo un plan de acción de emergencia escrito y personalizado que ilustre cómo reconocer los síntomas e instruya sobre cómo inyectar rápidamente la adrenalina. Esta debe ser administrada por vía intramuscular en la parte anterolateral media del muslo manteniendo el AIA durante aproximadamente 3-10 segundos. La administración de adrenalina es el tratamiento de primera línea y no existen contraindicaciones absolutas para su administración. La dosis debe repetirse cada 5-15 minutos si los síntomas persisten y tras su administración se debe solicitar asistencia médica. Estas medidas preparan a los padres y a los niños para afrontar una reacción y evitar que se agrave.
Durante una anafilaxia es crucial evaluar periódicamente las vías respiratorias, la respiración, la circulación, el estado mental y la piel, posicionar al paciente según sus características y simultáneamente llamar a los servicios de emergencia. La mayoría de los niños deben colocarse tumbados boca arriba, a menos que haya dificultad respiratoria, en cuyo caso una posición sentada optimiza el esfuerzo respiratorio; si está inconsciente, el niño puede colocarse en posición de recuperación. Al mismo tiempo, y si es posible, se debe eliminar la exposición al desencadenante (p. ej., suspender la administración de medicamentos/agentes terapéuticos).
El tratamiento de la anafilaxia continúa con el traslado a un entorno de atención sanitaria, idealmente en ambulancia. En niños con anafilaxia y síntomas de broncoespasmo, se pueden administrar agonistas beta-2 de acción corta inhalados (p. ej., salbutamol); sin embargo, en presencia de síntomas persistentes no son alternativa a la administración repetida de adrenalina intramuscular. En caso de obstrucción de las vías respiratorias superiores debe considerarse nebulizar adrenalina. Los medicamentos de segunda línea incluyen agonistas beta2-adrenérgicos, glucocorticoides y antihistamínicos. Es necesario observar a los niños durante varias horas, siendo especialmente importante en reacciones graves y en aquellas que requieren varias dosis de adrenalina.
Conclusiones
La anafilaxia es una patología de especial relevancia en edad pediátrica, siendo los alimentos su causa más común. En los niños, los síntomas respiratorios y la ausencia de afectación cutánea son características que deben ser consideradas en su presentación. El asma, la adolescencia, la alergia al cacahuete o los frutos secos y la falta o la administración tardía de adrenalina son factores asociados a mayor gravedad. La educación periódica de niños y familias, sobre cómo identificar los episodios, responder adecuadamente y emplear el AIA son vitales y deben ser revisados regularmente.
Dr. Carmelo Escudero Díez. Servicio de Alergología Hospital Infantil Universitario Niño Jesús (Madrid). Comité de Alergia Infantil.
*SEAIC: Sociedad Española de Alergología e Inmunología Clínica.
*AIA: Auto-inyector de adrenalina.
Referencias recomendadas
- Turner PJ, Campbell DE, Motosue MS, Campbell RL. Global Trends in Anaphylaxis Epidemiology and Clinical Implications. J Allergy Clin Immunol Pract. 2020;8:1169-76.
- Wang Y, Allen KJ, Suaini NHA, McWilliam V, Peters RL, Koplin JJ. The global incidence and prevalence of anaphylaxis in children in the general population: A systematic review. Allergy. 2019;74:1063-80.
- Ojeda P, Ibáñez MD, Olaguibel JM, Sastre J, Chivato T. Alergológica 2015: A National Survey on Allergic Diseases in the Spanish Pediatric Population. J Investig Allergol Clin Immunol 2018;28(5):321-329. doi: 10.18176/jiaci.0308.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
- MS Shaker, DV Wallace, DBK Golden, J Oppenheimer, JA Bernstein, RL Campbell, et al. Anaphylaxis—a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020;145:1082–1123.
- Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020 Jun;8(6):1854-1864. doi: 10.1016/j.jaip.2020.02.010.
El fenómeno reagínico en el devenir de los héroes literarios medievales: mística, hechicería y leyenda
Álvaro Moreno-Ancillo
Servicio de Alergia. Hospital Nuestra Señora del Prado. Talavera de la Reina (Toledo), España
Talavera, 10 de abril de 2017
Introducción
Reagina fue un término propuesto por Coca y Grove en 1923 que define al anticuerpo de tipo IgE causante de la reacción de hipersensibilidad de tipo inmediato, la reacción alérgica clásica (1).
Podríamos pensar que cualquier categoría carece de aplicabilidad fuera de la experiencia, más allá de lo dado en el espacio y en el tiempo. Desde un punto de vista conceptual, un objeto y sus circunstancias, en tanto que aparecen y se conocen se etiquetan de «fenómeno», mientras el correlato del objeto, al margen de su relación con la percepción y la sensibilidad, se consideraría como «noúmeno», en la medida en que es algo solo inteligible pero no perceptible.
Si nos situamos en el sistema filosófico de Kant, el mismo concepto de noúmeno es dicotómico. Puede ser considerado negativamente, entendiendo noúmeno como materia que no puede ser reconocida por medio de la intuición sensible; o positivamente, como un objeto que puede ser conocido por medio de la intuición no sensible, que no es otra que la intuición intelectual. En tanto en cuanto carezcamos de intuición intelectual, y solo dispongamos de intuición sensible, nuestro conocimiento se hallará limitado a los fenómenos y, por consiguiente, el concepto de noúmeno quedará como algo negativo, como límite de la experiencia, como límite de lo que puede ser conocido (2).
Magia y Ciencia
Desde el principio de los tiempos, el ser humano ha tratado de explicar sus padecimientos desde una disyuntiva permanente entre la ciencia y la magia. Brujas, hechiceros y chamanes van transformándose a lo largo de los siglos en botánicos, alquimistas y galenos. Las enfermedades son consideradas, durante milenios, maldiciones diabólicas, castigos de los dioses o hechizos de nigromantes.
No obstante, mientras que la nigromancia parte de un enfoque espiritualista, la magia natural se fundamenta en las propiedades ocultas existentes en la naturaleza, que establecen una interrelación simpática entre todos los elementos del universo y que son causa de efectos portentosos en nuestro mundo, unos efectos que se corresponden con el gusto medieval por la maravilla.
Dentro de esos fenómenos patológicos, el hecho reagínico que caracteriza a las reacciones alérgicas puede ser de gran interés desde el punto de vista historiográfico y literario para cualquier humanista, especialmente si en él coinciden las profesiones de médico, alergólogo, escritor de novela y autor de teatro en busca de nuevos argumentos.
Por más que nos sorprendan, en los últimos años hemos sido capaces de dar explicaciones científicas de enfermedades alérgicas que se asocian a etiologías complejas y alérgenos ocultos, superando situaciones clínicas espeluznantes para nuestros pacientes, como las crisis anafilácticas o de asma súbita grave.
En otros tiempos, la incapacidad de darle explicación a esos trances alérgicos, la inmediatez de las reacciones y las características de la metamorfosis de los afectados podrían facilitar la confusión de los testigos ante estas visiones, y les llevaría a otras consideraciones alejadas de la medicina:
- Los que sufren la enfermedad han sido castigados, hechizados o sometidos por un poder humano -pero mágico-, o por un poder sobrehumano, opcionalmente diabólico o divino de acuerdo al enjuiciador del evento alérgico.
- Los que asisten al hecho alérgico como testigos principales pueden ser encumbrados como poseedores de poderes sobrenaturales que se descargan como una maldición sobre el ser afectado –siendo éste un enemigo de la comunidad-, y adquieren la etiqueta de héroes y son temidos por sus aparentes capacidades. Pero también pueden ser acusados de propiciar la maldad acontecida a personas amigas, con resultados menos halagüeños que la heroicidad.
- Es más, habría personas más observadoras e inteligentes, cuyos conocimientos de la enfermedad les permitiría “planear” las reacciones alérgicas –incluso las propias- con fines intrigantes.
No obstante, es de interés hablar del asma como algo diferenciado de la anafilaxia, puesto que los procesos alérgicos agudos graves con síntomas cutáneos eran más infrecuentes que patologías respiratorias con clínica similar al asma. Los héroes homéricos Áyax y Héctor, sufren un ahogo un jadeo que se nombra como asma. Héctor tras un golpe en el cuello, y Áyax tras el acoso de muchos enemigos troyanos. Son las circunstancias “naturales” las que causan esa asma. Pero cabe reseñar la descripción del ataque de asma de Areteo de Capadocia, pues lo súbito y grave siempre es susceptible de ser considerado extraterrenal.
Ricardo III de Inglaterra y Pedro I de Castilla
A través de Shakespeare nos encontramos con un hecho en la vida de Ricardo III que resultará el mejor paradigma de nuestra exposición, salvando las distancias con mis propios personajes. Ricardo III, era uno de los representantes de la casa de York, distinguida por el emblema de Rosa Blanca, en la Guerra de las Dos Rosas. Fue el último rey de la casa Plantagenet.
El relato de su vida es comparable por sus terribles acciones y su desenlace al de uno de nuestros reyes más controvertidos, Pedro I de Castilla, llamado el Cruel y el Justiciero por otros.
Pedro era hijo de Alfonso XI de Castilla y de María de Portugal. Durante toda su infancia y parte de la adolescencia fue prácticamente repudiado, porque el poder lo ostentaba la familia de la concubina de su padre, Leonor de Guzmán. A la muerte del rey, la rivalidad de las dos mujeres que compartieron la vida de Alfonso IX perdurará en sus descendientes con una prolongada guerra. El reinado de Pedro I fue una sucesión de batallas y ajusticiamientos, justos o crueles, que no acabó bien para él.
Pedro I sufrió una grave enfermedad al final de su adolescencia. Para muchos historiadores, la enfermedad del joven rey era recurrente y limitante, y pudo haber condicionado su respuesta histriónica ante las adversidades, provocando reacciones de ira y crueldad. Revisados todos los artículos y leídas las crónicas, las posibilidades diagnósticas están abiertas. No es descabellado pensar que algún escritor o dramaturgo busque la concordancia con alguna patología alérgica y la encaje en el relato histórico verdadero para mayor encumbramiento de la alergología literaria. El enfrentamiento entre Pedro y su hermanastro Enrique, conde de Trastámara, cobró dimensión internacional con la intervención de fuerzas militares de Inglaterra y Francia, que mantenían una contienda que conocemos como la Guerra de los 100 años. Enrique, que pugnaba por ser rey de Castilla, se alió con Francia, y Pedro, que era ya era el rey de Castilla, con Inglaterra. La guerra civil castellana fue un vaivén de victorias y derrotas para ambos bandos. El final de la guerra no pudo ser más literario, pues ve enfrentarse a ambos hermanos en un duelo fratricida. Fatalmente, Pedro acaba con su cabeza clavada en una pica después de sufrir la traición del mercenario francés Bertrand Dugasclein, que sujetó a Pedro I para que Enrique pudiera matarlo mientras exclamaba su célebre frase: “Ni quito ni pongo rey, pero ayudo a mi señor”.
Conocemos los problemas médicos y alérgicos de Ricardo III de la mano de Tomas Moro -el filósofo autor de Utopía- que compone un perfil del rey algo parcial, haciendo hincapié en sus defectos físicos (cojo, jorobado y medio manco) y sus comportamientos asesinos. También nos pone en la pista de la posible alergia del rey y de su implicación en la muerte de Lord Hastings, uno de los últimos obstáculos en su camino al trono. Shakespeare toma nota de lo que relata Tomás Moro y así lo incluye en la trama de su famosa obra de teatro.
Hasta ahora solo prevalecía ese retrato psicológico y físico de Ricardo III que Shakespeare nos mostró; el de un hombre intrigante y cruel, en una época en la que incluso su aspecto escoliótico le hace parecer más perverso. Su hermano, Eduardo IV, le confió al morir la tutela de sus hijos, pero Ricardo no dudó en adueñarse del trono inglés después de hacer asesinar a sus dos sobrinos en la Torre de Londres. Según Shakespeare “era un tirano sangriento y un homicida; alguien criado en sangre, y en sangre asentado”.
Pero en esa imagen hay cierta exageración teatral. Antes de que Ricardo tomara su camino hacia el trono, su hermano mayor Eduardo se convierte en rey tras su victoria en los campos de York. Ya como Eduardo IV, le encarga a Ricardo que se ocupe de las ejecuciones de sus opositores, lo que alcanza también a otro de los hermanos, Jorge, que acaba ahogado en un barril de vino. Al morir Eduardo IV, su hijo de 12 años se convierte en heredero bajo la custodia de Ricardo como regente. Ricardo, experto en intrigas y venganzas, teme ser asesinado por los partidarios de su cuñada, y decide pasar a la acción primero. Así, termina con la vida de los hermanos y aliados de la reina viuda, y al final también con sus sobrinos para convertirse en rey.
Tomás Moro nos cuenta que Ricardo utilizó su alergia a fresas como justificación en la condena a muerte de Lord Hastings, pero cuando estudiamos el texto de Shakespeare, comprobamos que solo se hace mención a las fresas en el contexto de la “sequedad del brazo del rey Ricardo”, lo cual, como reacción alérgica inmediata parece poco probable. Es cierto que Shakespeare no conocía la semiología alérgica, pero se esperaría una mejor descripción del genio literario inglés.
Revisando la literatura médica, comprobamos que estas mismas dudas las tuvo el Dr. J. Swift, un médico británico que publica una carta sencilla y clarificadora en 1956 en el British Medical Journal (4). Sus argumentos, básicamente se resumen en los siguientes párrafos.
Esta historia se conoce a través de Tomás Moro, que era un paje del Cardenal Morton, dueño del jardín de las fresas en cuestión. Pero hay algunas cosas que no tienen mucho sentido. Si Ricardo III hubiera tenido realmente un brazo “seco”, todos lo sabrían previamente, y no podría haber convencido al consejo de que ese mal era a causa de un hechizo inmediato. Y ¿por qué pidió las fresas? Se supone que sabía que era alérgico, y una urticaria que incluyera la afectación súbita de su brazo, sí justificaría la acusación de brujería; más aún si el exantema desapareciera al morir Hastings. De aquí la insistencia de que se ajusticiara a Hastings antes de la cena y le trajeran su cabeza en una bandeja. Un mínimo cambio en una palabra explicaría todo. Puede que Tomás Moro, que escuchó de soslayo la historia de los labios del cardenal, cometiera un pequeño error y no fuera “withered” (seco), sino algo como “tettered” (erupción pruriginosa).
El reciente y sorprendente hallazgo de los restos de Ricardo III en Inglaterra, y su posterior análisis forense, da la razón al Dr. Swift, puesto que no se ha encontrado ninguna alteración anatómica en ese brazo supuestamente seco (5).
Aunque Shakespeare describa el personaje como un intrigante malvado, si lo evaluamos con una mentalidad del siglo XV, no podemos descartar que, tal vez, creyera realmente que estaba hechizado, y no fuera una táctica vil para ajusticiar a Hastings. Esta posibilidad existe, pero revisando la vida del personaje y la historiografía al respecto, me parece menos probable.
El fenómeno reagínico en otras novelas históricas
Antes de que se supiera que alguno de mis personajes iba a emular a los de Shakespeare, estaba tan poseído por nuestra profesión que en cada uno de mis libros libraba una pequeña batalla para introducir eventos médicos –alergológicos especialmente- en el argumento de la historia narrada; y, si era posible, convertir tales eventos en casualidades que redirigían las vidas de los personajes y les hacían evolucionar a otras personalidades, a veces más proactivas, a veces más bondadosas y otras veces más canallas (6).
En la primera de mis historias medievales El Cantar de Arriaga, escrita en las madrugadas de mis últimos años de residencia, un par de monjes casi adolescentes viajan desde los Pirineos navarros hasta la Castilla del Conde Fernán González para participar sin comerlo ni beberlo en una conspiración contra el noble castellano. A lo largo de la intriga, uno de los monjes acaba encontrando su destino como héroe del relato gracias a eventos alérgicos sufridos por sus contrincantes. El monje lucha en clara desventaja contra un mercenario asesino junto a unas colmenas. El terrible shock anafiláctico que sufre el mercenario encumbra al monje como poderoso hechicero.
En El Enigma del Códice Bardulia se muestra una obsesión por hacer convivir los hechos mágicos, las brujerías y las pócimas antiguas con la medicina del mundo actual, que le transmite al lector la posibilidad de dar una explicación científica a los misterios y sucesos pasados, con la suficiente ambigüedad para que el propio lector elija qué versión desea creer. En esa novela, una joven lingüista recibe de sus ancestros la capacidad de manejar una pócima mortal. Tanto ella como su antepasado medieval toleran la toxicidad de una sustancia que al resto le provoca terribles visiones y una muerte atroz.
El Reino de la Espada se desarrolla en el siglo XIII, cuando el imperio Almohade presiona la frontera sur de los reinos cristianos hispánicos, llegando a recuperar casi la línea del río Tajo. Toledo está amenazado. Alfonso VIII de Castilla convoca a los reinos cristianos a una de las más decisivas batallas de la Reconquista. Un ejército se dirige al sur. Una intriga pretende acabar con la vida del rey de Castilla. Una comitiva de monjes y caballeros intentarán evitar el atentado. La paradoja asmático-reagínica viene de la mano de las humedades de los pasadizos y de la polvorienta materia orgánica que una valiente doncella le lanza a uno de los malvados conjurados, conduciéndole a una horrible y disneica muerte.
La convergencia de la medicina, la alergología y la literatura histórica en una misma persona obliga, sin lugar a dudas, a la búsqueda, investigación y descifrado de historias lejanas, textos antiguos y lugares inexplorados donde los hechos reagínicos complementen los argumentos de las obras literarias.
Bibliografía
- Coca AF, Cooke RA. On the classification of phenomena of hypersensitiveness. J Immunol 1923; 8: 163-182
- García Morente M. La filosofía de Kant. Espasa Libros SLU 1986.
- Valdeón Baruque J. La dinastía de los Trastámara. Fundación Iberdrola 2006.
- Swift J. Richard III and the Strawberries. Br Med J 1956 Jun 2; 1(4978):1301
- Appleby J, Rutty GN, Hainsworth SV, et al. Perimortem trauma in King Richard III: a skeletal analysis. Lancet 2015; 385: 253–59
- http://alvaromorenoancillo.blogspot.com.es/
Para citar este artículo:
Moreno-Ancillo, A. (10 de abril de 2017). El fenómeno reagínico en el devenir de los héroes literarios medievales: mística, hechicería y leyenda. [Mensaje en un blog]. Blog del Comité de Humanidades de la SEAIC. Recuperado de https://www.seaic.org/profesionales/blogs/humanidades
Por un cielo más seguro
La alergia es un problema de salud pública de que afecta a más de 150 millones de personas en Europa y su prevalencia va en aumento, sobre todo, en la población más joven. De todas ellas, la alergia alimentaria se sitúa como una de las alergias más frecuentes con más de 17 millones de europeos afectados, siendo de dos millones en España.
Las enfermedades alérgicas afectan en gran medida la calidad de vida de los pacientes que las padecen, limitando las actividades diarias como comer en un restaurante, ir a una fiesta o viajar, especialmente en avión por el miedo derivado de sufrir una reacción alérgica, por problemas relacionados con el transporte de su medicación o por no recibir una atención adecuada por parte del personal de la aerolínea.
Cada año, las compañías aéreas transportan en todo el mundo alrededor de 2,75 billones de pasajeros1. Muchas de estas personas padecen de enfermedades crónicas (cardiopatías, enfermedades neurológicas, enfermedades respiratorias o alérgicas) y viajar en avión supone pone un riesgo de padecer alguna emergencia médica durante el vuelo. En otras ocasiones, las urgencias médicas son incidentes que debutan de nuevo durante el viaje.
Cada año se producen hasta 44.000 emergencias médicas en vuelo, y los datos sugieren que alrededor del 17% de estos casos se transfieren a un hospital y el 4% resulta en hospitalización o muerte 1.
Las emergencias médicas en vuelo ocurren en 1 de cada 11.000 pasajeros2 o en 1 de cada 604 vuelos 3. Se proponen varias razones para explicar la incidencia de eventos médicos y alérgicos durante los vuelos. Los eventos médicos más comunes en vuelo incluyen síncope, problemas gastrointestinales y cardíacos 3,4,5.
Las reacciones alérgicas son responsables del 2-4% de todos los problemas médicos que suceden en los vuelos. Las reacciones alérgicas fueron la séptima causa más frecuente de problemas médicos y las manifestaciones dermatológicas, incluidas las erupciones cutáneas, la novena causa más común. Un análisis reciente de datos de reclamaciones a seguros de compañías médicas, reveló que éstos reclamaciones de seguro de salud por anafilaxia por alergia alimentaria habían aumentado un 377% y que los adultos requirieron atención para aproximadamente en un tercio de estos reclamaciones 6.
Existen varios factores relevantes que pueden afectar a los pacientes con enfermedades alérgicas y respiratorias cuando se viaja en avión:
-La disminución de la concentración de oxígeno en la cabina: hasta de un 25-30% más baja que al nivel del mar produciendo una ligera disminución de la concentración de oxígeno en la sangre, que va del 92 al 95%, seguida de hiperventilación compensatoria y taquicardia 7 .
-La sequedad atmosférica de la cabina entre 6 al 18% también puede irritar las membranas mucosas de la boca y el tracto respiratorio superior8 .
-La forma más común en que se desencadenan las alergias alimentarias es la ingesta del alérgeno, pero existen otras vías de exposición como el contacto con la piel o las mucosas o inhalar partículas. El hecho de que la cabina sea un habitáculo cerrado, favorece que las reacciones alérgicas que se producen por inhalación, se agraven en este medio de transporte.
En la actualidad se desconoce la incidencia real de las reacciones anafilácticas durante los vuelos porque en muchas ocasiones los síntomas no son reconocidos, porque no existen registros de las mismos o porque el paciente ha usado mediación de rescate sin notificarlo a personal de la aerolínea.
Las compañías aéreas reportan que las exacerbaciones de asma representan la patología más común y potencialmente más peligrosa para la vida durante los vuelos1. Los síntomas alérgicos más frecuentes documentados son las reacciones cutáneas (urticaria y angioedema) , respiratorias y con menor frecuencia la anafilaxia.
Las reacciones anafilácticas en los aviones se desencadenan con mayor frecuencia por alimentos, especialmente frutos secos. En segundo lugar, los medicamentos y exposición a epitelios también pueden ser causar reacciones alérgicas y muy raramente la causa son las picaduras de insectos o un insecticida en aerosol9.
Las reacciones anafilácticas inducidas por alimentos son cada vez más frecuentes. Las estrategias para reducir el riesgo de estás reacciones durante el viaje incluye la planificación temprana del viaje en avión, solicitando un informe por parte del médico alergólogo sobre las medidas preventivas a tomar y tratamiento que se debe administrar el paciente en caso de reacción durante el vuelo.
El Comité de Alergia a Himenópteros ha confeccionado un documento en diferentes idiomas ( castellano, inglés y francés) para acreditar la necesidad de portar adrenalina en medios de transporte (avión, tren, barco)10, éstos documentos están disponible en la pagina web de la Sociedad Española de Alergia e Inmunología Clínica (SEAIC) Descargar aquí
Por otra parte, también se recomienda consultar las dudas a los departamentos médicos de la aerolínea en las que se viajan. Cada aerolínea diseña sus propios planes para prevenir las reacciones alérgicas durante el viaje, como, por ejemplo:
-Posibilidad de identificar al paciente en el momento de la reserva de avión para poder elegir en el catering menú libre de alérgenos
-Permitir embarque prioritario, para limpiar e inspeccionar el asiento y alrededores
-Protocolo de limpieza de asientos y bandejas en “zona de amortiguamiento “(3 asientos antes y 3 asientos después del pasajero)
-Evitar almohadas o mantas
-Anuncios para informar al resto de pasajeros que viajan personas alérgicas
-Evitar refrigerios gratuitos con frutos secos (especialmente cacahuete y nuez)
-Recolocación del pasajero alérgico a zonas más seguras si se detecta algún posible alérgeno cercano al pasajero alérgico
-Maquinas desinfectantes de manos
Sin embargo, no hay medidas generales ni estandarizadas para hacerlo y cada operador tiene sus propias recomendaciones, llegando a ser difícil su implantación ya que pueden causar molestias a algunos pasajeros que sean reacios a cumplirlas y dar lugar a mayores costes de viaje a las aerolíneas. Por otra parte, hay compañías aéreas que ni siquiera contemplan ninguna medida, lo que volar en esas compañías se convierte en una situación angustiosa y peligrosa para el paciente alérgico.
Si finalmente las medidas preventivas fracasaran y se produce una reacción alérgica, la tripulación de la aerolínea debe contactar inmediatamente con cualquier médico que se encuentre a bordo para determinar qué tratamiento debe instituirse y si el avión debe desviarse al aeropuerto más cercano. La frecuencia desviación de aviones por razones médicas, ocurren en torno al 4,5%.
Además de los kits médicos a bordo y la capacitación especial de la tripulación en el manejo de emergencias médicas, las aerolíneas pueden tener acceso remoto a servicios médicos que pueden monitorear y dar instrucciones para el mejor tratamiento hasta que el avión llegue a un lugar donde el pasajero pueda ser tratado adecuadamente 1.
El tratamiento de urgencias médicas que debe llevar una aerolínea, es un aspecto de vital importancia, pero a menudo los recursos médicos para tratar emergencias alérgicas durante un vuelo son escasos. Los medicamentos que contiene el kit médico varían de unas compañías a otras y en ocasiones las aerolíneas no disponen de la medicación básica.
En Estados Unidos, la Administración Federal de Aviación requiere la inclusión de epinefrina en los kits médicos que se llevan a bordo11. Estos kits médicos de emergencia generalmente contienen los siguientes medicamentos 12:
- Epinefrina acuosa (adrenalina) 1: 10000 y dilución 1: 1000.
- Albuterol (salbutamol) para nebulización.
- Broncodilatador inhalador de aerosol.
- Cortisol (hidrocortisona).
- Antihistamínicos orales e inyectables (comúnmente difenhidramina).
Una recomendación de un grupo de expertos de la Organización Mundial de Alergia (WAO) para el tratamiento en vuelos de una reacción anafiláctica y exacerbaciones de asma, son 1:
1.-Para crisis asmáticas, broncodilatador inhalado y oxígeno. Hay que considerar un corticosteroide oral, intramuscular o intravenoso para síntomas moderados a severos y epinefrina intramuscular para síntomas severos.
2.- Para reacciones alérgicas sistémicas leve, moderada y severa, adrenalina intramuscular 0.01 mg / kg hasta 0.5 mg de solución 1: 1000 IM en el muslo lateral anterior. Repita según sea necesario.
El uso de los viales de adrenalina, requieren una experiencia médica para pautar la dosis correcta y administrar este medicamento que salva vidas, por lo que finalmente, están ampollas, son una barrera para su uso. Los autoinyectores de adrenalina (AIA) son fáciles de usar, así que se ha propuesto reemplazar las ampollas de epinefrina del kit de emergencia de los aviones por AIA.
Existen estudios en los que se ha analizado lo que supondría llevar a cabo este cambio en la presentación de la adrenalina, llegando a la conclusión que equipar todos los aviones comerciales con autoinyectores cuesta 2,470,422 dólares / año (0.08 dólares / pasajero en riesgo), cuando se distribuye entre todos los viajeros en riesgo, lo que lleva a pensar que se trata de una medica rentable 13.
En los casos en los que el paciente esté diagnosticado de anafilaxia idiopática, hay autores que recomiendan que no viajen dentro de una semana siguiente al episodio de anafilaxia y recomiendan en adultos la administración de prednisona 40-60 mg y un antihistamínico H1 por vía oral cada mañana durante 1 semana antes del viaje 1. Esto puede ayudar a reducir la frecuencia y la gravedad de los episodios 14.
Si el vuelo esta previsto para más tiempo de 1 semana después de un episodio de anafilaxia idiopática, se debe iniciar la terapia empírica consistente en un ciclo del a prednisona en días alternos hasta el día del viaje para reducir la probabilidad de un ataque durante el vuelo 1.
En la actualidad, existe una amplia oferta de vuelos a diversos destinos y a precios cada vez más bajos, lo que facilita la adquisición de billetes y que se realizan cada vez más viajes. El incremento de personas que vuelan, facilitará la probabilidad de que aumenten las reacciones alérgicas en el futuro.
Por lo tanto, las aerolíneas, deberán estar preparados para hacer frente estas posibles reacciones durante le vuelo mediante las siguientes medidas:
- Consulta médica para pasajeros de alto riesgo antes de viajar.
- Promover la prevención de enfermedades alérgicas a través de la educación de los pasajeros.
- Entrenar y reentrenar a las tripulaciones aéreas.
- Promover medidas preventivas generales durante el vuelo: hidratación, evitación de alérgenos alimentarios (especialmente cacahuetes y nueces )
- Proporcione un lugar apropiado para las mascotas peludas lejos de los sujetos con alergia a las mascotas
- Proporcione cantidades suficientes de medicamentos apropiados: epinefrina (adrenalina), agonistas β2 para inhalación y nebulización, corticosteroides orales e inyectables y antihistamínicos
- Oxigeno 15
Nos encontramos con una gran problemática en vuelos donde viajan pasajeros alérgicos, ya que, a día de hoy, no se disponen de protocolos ni de medidas de actuación ante reacciones alérgicas.
Por otra parte, encontramos rechazo del personal de vuelo en la administración de adrenalina, así que los equipos de tripulación deberían ser entrenados en reconocer los síntomas de la anafilaxia y en administrar AIA .
Las personas alérgicas deben llevar alimentos libres de alérgenos y medicamentos necesarios en sus viajes. Dada la alta prevalencia de alergias alimentarias tanto en niños como en adultos, y teniendo en cuenta las circunstancias únicas de los viajes aéreos, donde el tratamiento médico es limitado y de difícil acceso, las aerolíneas deben tomar conciencia de ello y crear un entorno de viaje más seguro donde todos los pasajeros puedan sentirse cómodos 6.
Los responsables de las aerolíneas, alergólogos e inmunólogos deberían trabajar de manera interdisciplinar en la elaboración de recomendaciones basadas en evidencia para prevenir reacciones alérgicas durante el vuelo. Así mismo deberían elaborarse planes de actuación concretos especialmente en caso de reacciones anafilácticas con el fin de mejorar la calidad de vida del paciente alérgico durante los viajes en avión.
Finalmente, la conciencia social sobre la importancia en las medidas de evitación en la alergia a alimentos, es fundamental para que un vuelo en avión no suponga un riesgo vital para el paciente alérgico.
Dra. Rocío Candón Morillo
Hospital General la Mancha Centro, Alcázar de San Juan (Ciudad Real)
Comité de Alergia infantil SEAIC – Grupo de interés anafilaxia
Bibliografía
1.Mario Sánchez-Borges,VictoriaCardona,MargittaWorm, Richard F. Lockey, AzizSheikh, PaulA. Greenberge,Ignacio J. Ansotegui ,MotohiroEbisawa, Yehia El-Gamal, Stanley Fineman, Mario Geller, Alexei Gonzalez-Estrada , Luciana Tanno, Bernard Y. In-flight allergic emergencies. Review Thong and on behalf of the WAO Anaphylaxis Committee.
2.Sicherer SH, Furlong TJ, DeSimone J, Sampson HA. Self-reported allergic reactions to peanut on commercial airliners. J Allergy Clin Immunol. 1999; 104:186–9.
3.Peterson DC, Martin-Gill C, Guyette FX. Outcomes of medical emergencies on commercial airline flights. N Engl J Med. 2013;368:2075–83.
4.Sand M, Bechara F-G, Sand D, Mann B. Surgical and medical emergencies on board European aircraft: A retrospective study of 10189 cases. Crit Care. 2009;13:R3.
5.- Nable JV, Tupe CL, Gehle BD, Brady WJ. In-flight medical emergencies during commercial travel. N Engl J Med. 2015;373:939–45.
6.https://blogs.scientificamerican.com/observations/the-dangers-of-flying-while-allergic/. The Dangers of Flying While Allergic.
7.American Medical Association Commission on Emergency Medical Services. Medical aspects of transportation aboard commercial aircraft. J Am Med Assoc. 1982; 217:1007–1.
8.-Goodwin T. In-flight medical emergencies: An overview. Br Med J. 2000; 321:1338–41.
9.Vanden Driessche KSJ, Sow A, Van Gompel A, Vandeurzen K. Anaphylaxis in an airplane after insecticide spraying. J Travel Med. 2010; 17:427–9.
10.https://www.seaic.org/documentos/adrenalina-en-medios-de-transporte.
11.Federal Aviation Administration (FAA), DOT. Emergency Medical Equipment: Final rule. Fed Regist. 2001; 66:19028–46.
- Graf J, Stüben U, Pump S. In-flight medical emergencies. Dtsch Arztebl Int. 2012; 109:591–602
- Marcus Shaker, MatthewGreenhawt. Cost-Effectiveness of Stock Epinephrine Autoinjectors on Commercial Aircraft. Volume 7, Issue 7, September–October 2019, Pages 2270-2276
14.Greenberger PA, Lieberman P. Idiopathic anaphylaxis. J Allergy Clin Immunol Pract. 2014; 2:243–50
15.Van Evra J, Bennet P, Wicker A. Allergic Living handy chart on the allergy policies of 13 major air carriers. Allergic Living magazine. Updated March 2016. Allergicliving.com. http://allergicliving.com/2010/08/30/comparing- airlines/. Accessed 18 Dec 2016
Congreso Nacional SEAIC 2025 en Granada
¡Prepárate para el Congreso Nacional de SEAIC 2025 en Granada!
- Fecha: 1-4 de octubre de 2025
- Lugar: Palacio de Congresos de Granada
- Fecha límite de recepción de comunicaciones: 11 de abril de 2025. Descarga normativa.
- Web oficial de congreso
Premios a las comunicaciones
Si tu comunicación es aceptada en el Congreso SEAIC, podrá participar de premios otorgados por la Fundación SEAIC o convocados por la Industria Farmacéutica con el aval de la SEAIC.
Para participar, solo debes indicarlo al final del formulario de envío.
PREMIOS AEHward - Behring. Programa de becas de investigación de Angioedema Hereditario (AEH)
![]() Folleto informativo AEHward 2025(1956 descargas)
Folleto informativo AEHward 2025(1956 descargas)
![]() Bases del Concurso AEHward 2025(1686 descargas)
Bases del Concurso AEHward 2025(1686 descargas)
Novartis UrtInnova Grants 2025. Urticaria Crónica.
![]() Bases Novartis UrtInnova Grants 2025(1491 descargas)
Bases Novartis UrtInnova Grants 2025(1491 descargas)
BEC-AT Allergy Allergy Therapeutics. Inmunoterapia.
Otros premios
Premios Nacionales Fundación SEAIC y DIATER Laboratorios 2025
Premio Fundación SEAIC al Mejor Expediente MIR con el patrocinio de API (Asac Pharmaceutical Immunology)
- Hasta el 31 de julio de 2025. Enlace a toda la información.
Nuevos descuentos
Nuevo descuento para investigadores en la inscripción al Congreso.
Con el objetivo de apoyar a los profesionales dedicados a la investigación en el ámbito de la Alergología, la SEAIC ha incorporado un descuento especial en la tarifa de inscripción al Congreso.
Este beneficio está dirigido a aquellos profesionales que se dediquen exclusivamente a la investigación y no desempeñen actividad asistencial, independientemente de su especialidad. Para acceder a esta tarifa, será necesario presentar un certificado firmado por el IP del proyecto que acredite dicha dedicación exclusiva.
Consulta las tarifas actualizadas y las inscripciones en la web del congreso.
Open Mic Investigación
Micrófono abierto en investigación 2025.
La Comisión de Fomento de la Investigación de la SEAIC convoca a la III edición del Micrófono Abierto en Investigación
- Fecha: viernes 3 de octubre
- Hora: 11:30 - 12:00
Del 15 de mayo al 30 de junio está abierta la convocatoria para participar. Toda la info.
Open Mic Humanidades
¡Vuelve el Micrófono Abierto en Humanidades!
Abierto a todos los congresistas inscritos. Una oportunidad para que los socios puedan expresarse libremente a través de la poesía, el canto, el humor o cualquier otra manifestación expresiva que deseen compartir. Un espacio distendido para pasar un buen rato y compartir con la comunidad de forma cercana y espontánea. Premio de 200 € y diploma para la intervención más votada por el público.
- Fecha: viernes 3 de octubre
- Hora: 17:00 - 18:00
- Las inscripciones se abrirán 24 h. antes para que puedas reservar tu espacio.
- Consulta las bases y condiciones
Certamen de humanidades
El Comité de Humanidades de la SEAIC convoca a una nueva edición del Certamen de humanidades.
Participa en el X Certamen de Poesía, Relato y Pintura y gana un premio de 400 € en cualquiera de sus tres modalidades: poesía, relato o pintura.
Plazo de inscripción: hasta el 15 de septiembre de 2025 a las 14:00 h.
![]() Bases Certamen Alergia y Humanidades 2025(2785 descargas)
Bases Certamen Alergia y Humanidades 2025(2785 descargas)
Convocatoria Asamblea de Socios Ordinaria y Extraordinaria
Convocatoria Asamblea de Socios Ordinaria y Extraordinaria SEAIC 2025
- Fecha: viernes 3 de octubre de 2025.
- Hora: 15:00 h en primera convocatoria, 15:30 h en segunda.
- Lugar: Auditorio Federico García Lorca, Palacio de Congresos de Granada (planta 0)
![]() Convocatoria Asamblea Ordinaria y extraordinaria GRANADA 2025(1309 descargas)
Convocatoria Asamblea Ordinaria y extraordinaria GRANADA 2025(1309 descargas)
Comunicación
| Coordinación general, página web, boletín y medios: | Dr. Pedro Ojeda Fernández |
| Coordinación general, página web, RRSS y NNTT: | Ángela Meijide Calderón |
| Comunicación interna: | Dr. Darío Antolín Amérigo |
| NNTT-App | Dr. José Luis Cubero Saldaña Dra. Paloma Poza Guedes |
| NNTT-App-enlace Junta Directiva | Dr. Antonio Letrán Camacho |
| RRSS | Dra. Isabel Fernández de Alba Dra. Mónica Fernández Rodríguez Dra. Paula Galván Blasco |
| Página web | Dra. Alicia Gallardo Higueras Dr. Jesús Jurado Palomo |
| Boletín industria informa | Dra. Mercedes Ramírez Hernández |
Actualizado el día 10/03/2025
Invitación a participar: Alergodata
Estimado socio,
Nos gustaría invitarle a participar en el Proyecto ALERGODATA.
![]() Contenido disponible sólo para socios
Contenido disponible sólo para socios
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
La alfa triptasemia hereditaria es un rasgo genético que ha supuesto un nuevo biomarcador a tener en cuenta, sobre todo entre los pacientes que tienen anafilaxia.
Sin embargo, su diagnóstico está limitado a algunos centros especializados y sus implicaciones clínicas continuan en exploración.
- TRIPTASA.
La actividad tripsina-like se describió por primera vez en mastocitos (MC) en 1960 empleando técnicas histoenzimáticas.(1) Posteriormente, en 1981, se demostró esta misma actividad en los MC humanos de tejido pulmonar,(2) se aisló la enzima con una pureza en torno al 90% y se denominó triptasa (EC 3.4.21.59). La triptasa es producida y almacenada principalmente por los MC, y en una mínima cantidad por los basófilos.(3)
Las protriptasas (α y β) son enzimáticamente inactivas y se liberan de forma constitutiva al plasma, constituyen lo que se determina como triptasa sérica basal (sBT). Tras un proceso de maduración, se producen las triptasas maduras (tetrámeros enzimáticamente activos que forman complejos con la heparina), que se acumulan en los gránulos de los MC. Los tetrámeros activos de β-triptasa y α/β triptasa, se liberan al medio extacelular tras la desgranulación secundaria a la activación mastocitaria, y su determinación resulta de gran utilidad en el diagnóstico de anafilaxia.(4)
Los tetrámeros de β-triptasa madura se comportan como serín proteasas, que actuando sobre el complemento, algunas citoquinas, el fibrinógeno, el cininógeno, prostromelisina y los receptores activados por proteasas (PAR), pueden inducir los siguientes efectos: la proliferación de fibroblastos y músculo liso, la degradación de la matriz extracelular, el reclutamiento de eosinófilos y neutrófilos, la estimulación de células nerviosas y epiteliales, la angiogénesis y la fibrinogenolisis.(5) Sin embargo, los tetrámeros de α-triptasa madura son inactivos.(5,6)
Los heterotetrámeros de α/β triptasa madura, también tienen actividad peptidolítica, siendo su diana los PAR2 presentes en células endoteliales e induciendo extravasación in vitro; y los EMR2 (like module–containing mucin-like hormone receptor-like 2) receptores (proteínas G mecanosensitivas) presentes en la superficie de los MC. La unión de los heterotetrámeros de triptasa madura a este receptor inducen la escisión de la subunidad α del EMR2, y desencadenan la desgranulación mastocitaria(5), mecanismo que se ha relacionado con la urticaria vibratoria.(7) El incremento del número de copias de α-triptasa aumenta la proporción de heterotetrámeros frente a los homotetrámeros llevando a una sobre activación de estos receptores.(8)
La técnica comercial actualmente disponible para la detección de triptasa (ThermoFisher Scientific) es un inmunoensayo que utiliza dos anticuerpos anti-triptasa (el B12 que se emplea para la captura y el G4 para el revelado) siendo el límite inferior de detección de la técnica de 0,5 ng/mL. Esta técnica cuantifica la triptasa total sin distinguir entre formas maduras o precursores, ni isoformas α y β en los fluidos biológicos. El punto de corte establecido para los valores séricos basales de triptasa (sBT) en sujetos sanos es de 11.4 ng/mL.(4)
- ALFA TRIPTASEMIA HEREDITARIA (HαT).
La triptasa en humanos se codifica por 4 genes parálogos TPSG1 (alelos γ), TPSB2 (alelos β2 y β3), TPSAB1 (alelos α y β1), y TPSD1 (alelos δ) localizados en el cromosoma 16p13.3. Presenta diferentes isoformas: α-triptasa, β-triptasa, δ-triptasa y γ-triptasa. El genotipo normal para α y β triptasa contiene 4 copias de los genes, incluyendo estas variaciones 0α:4β, 1α:3β y 2α:2β.(4,9)
También se han descrito variaciones en el número de copias que codifican la β-triptasa, sobre todo en algunos grupos raciales, pero estas variaciones no se asocian con elevaciones de la sBT en las familias. Mientras que, los valores elevados de sBT heredados con patrón dominante en una familia, se asocian con un alelo portador de un gen TPSAB1 que codifica α-triptasa, y se trata de HαT incluso aunque se detecten copias extra de β-triptasa. (4) (Figura 1).
La alfa triptasemia hereditaria (HaT) fue descrita en 2016.(10) Se caracteriza por presentar un número aumentado de copias del gen TPSAB1 que codifica la α-triptasa, tiene un patrón autosómico dominante, se ha descrito en el 4-7% de donantes sanos,(4,6) y asocia un leve predominio entre el género femenino.(11) Los pacientes con HαT suelen tener cifras basales de triptasa (sBT) >11.4 ng/mL; aunque existen casos con valores normales de triptasa (raramente <8 ng/mL). Se recomienda realizar el estudio de HaT en aquellos individuos con sBT >8 ng/mL;(12–14) este punto de corte ha demostrado una sensibilidad del 94% y una especificidad del 100% para detectar copias extra del gen TPSAB1.(12)
Se ha detectado una relación entre el número de copias extra del alelo α del gen TPSAB1 (hasta 4 copias extra) y los niveles de sBT, en familias con HαT+. Parece seguir un patrón por el cual las duplicaciones implican unos niveles de sBT de 15 ± 5 ng/mL, las triplicaciones de 24 ± 6 ng/mL, y las cuadruplicaciones de 37 ± 14 ng/mL.(4)
Además, los valores elevados de sBT se pueden encontrar en otras patologías como las mastocitosis sistémicas (MS), neoplasias mieloides e insuficiencia renal.(7) También se ha publicado en varios estudios, la relación entre los niveles elevados de sBT con la prevalencia y la gravedad de anafilaxia, sin embargo, estos datos deben interpretarse con cautela ya que en muchos de ellos no se ha valorado la presencia concomitante de MC clonales ni de HαT+.(4) En cambio, sí que resulta clara la relación entre HαT+ y las anafilaxias graves desencadenadas por veneno de himenóptero, otras alergias IgE mediadas, así como la asociación con MS.(4)
- GENOTIPADO DE HαT MEDIANTE PCR DIGITAL.
Las PCR (reacción en cadena de la polimerasa) digital, es una tecnología de última generación que se emplea para la cuantificación de ADN de forma reproducible y sensible, y se recomienda para analizar la variación del número de copias. Para llevar a cabo las mediciones, la muestra se divide en particiones, de forma que en cada una de ellas haya cero, una o varias moléculas diana presentes en cada reacción individual. Cada partición es analizada después de un ciclado de PCR en punto final para detectar la presencia (reacción positiva) o ausencia (reacción negativa) de una señal de fluorescencia. Finalmente, se calcula el número absoluto de moléculas presentes en la muestra, sin que los resultados dependan de una curva estándar, de este modo se reduce el error y se incrementa la precisión.(15) Existen en el mercado dos tipos de PCR digital: “Dropled digital PCR (ddPCR)” y “arraybased PCR”. La diferencia principal entre los dos modelos se debe a la estrategia diseñada para la división de la muestra: mediante la formación de gotas tipo emulsión, o mediante el uso de chips compuestos por micropocillos.(16)
Esta técnica detecta las secuencias α y β en los locus de TPSAB1 y TPSB2, a partir de DNA genómico (gDNA) se puede extraer tanto de sangre periférica como de MO.(6) Existe un KIT comercial para conseguir el DNA a partir de un “swab bucal”(17) y posteriormente proceder al estudio de las variaciones en el número de copias de TPSAB1; sin embargo, puede ocurrir que este método se encuentre limitado por problemas de daños y contaminación de las muestras.
- FENOTIPOS DE HαT.(18)
La expresión clínica de HαT puede ser muy variable, desde sujetos asintomáticos (descrito en el 4% de donantes sanos de población española(6), y 1/3 de los portadores) hasta cuadros de anafilaxia grave.(11)
En una reciente revisión, se ha descrito que los síntomas que con mayor frecuencia presentan los pacientes con HαT incluyen: 1) síntomas neuropsiquiátricos (depresión 59%, alteraciones del sueño 69% y alteraciones de memoria 59-68%); 2) síntomas gastrointestinales (colon irritable 30%-60%, nauseas 51%, y reflujo 49%-77%); 3) síntomas secundarios a la liberación de mediadores mastocitarios (flushing 47%, prurito 69%, urticaria 37%, y anafilaxia 14-28%); 4) hiperlaxitud articular 28%; 5) disfunción del sistema autónomo 34% (hipotensión ortostática, palpitaciones, taquicardia, presincope, síncope), y 6) síntomas constitucionales (dolor crónico, astenia 85%).(18,19)
Algunos de los síntomas descritos, aunque se encuentren con una elevada prevalencia, son difíciles de validar como secundarios a HαT+.(18)
Además, los síntomas de HαT+, en muchas ocasiones se pueden superponer con lo que se producen por activación mastocitaria. En este sentido, hay que tener en cuenta que los fenotipos hasta ahora asociados a HαT+ son muy heterogéneos, y que la mayoría de los casos descritos provienen de centros monográficos en patología mastocitaria y/o síndromes genéticos, por lo que es probable la existencia de sesgos en los datos obtenidos a partir de estas poblaciones.(4)
Sí que ha sido validado que los individuos con HαT+ tienen una mayor prevalencia de reacciones de hipersensibilidad inmediata sistémicas. (18)
4.1 HαT Y ANAFILAXIA
La elevación aguda de triptasa es un biomarcador de anafilaxia. El aumento de los valores de sBT triptasa en un 20 % + 2 ng/ml sobre el valor basal de cada individuo en el periodo comprendido entre 1-4 horas desde el inicio del cuadro agudo, es el criterio para confirmar activación mastocitaria y anafilaxia.(20) Esta fórmula tiene una elevada sensibilidad y es útil para identificar anafilaxia en los individuos con exposición parenteral al alérgeno.(21) Sin embargo, se encuentra limitada en algunas circunstancias como en la población pediátrica con alergia a alimentos, y pacientes con reacciones no IgE mediadas. Además, la variabilidad de los niveles de sBT en cada individuo a lo largo del tiempo no está bien estudiada.(22)
Por otra parte, diferentes estudios han identificado los niveles de sBT como un biomarcador asociado con el aumento en la prevalencia y la gravedad de la anafilaxia tras picaduras de insectos (sobre todo himenópteros),(4) y en alergia alimentaria infantil.(23)
HαT+ es el primer modificador genético hereditario descrito para la anafilaxia, que se asocia con un incremento en el riesgo para reacciones alérgicas graves al veneno de himenóptero con un riesgo relativo=2; así como un incremento del riesgo para la anafilaxia idiopática grave(12) y la anafilaxia grave desencadenada por alimentos en niños.(24)
Se ha estimado una prevalencia de HαT+ ≥8.5% en los pacientes con anafilaxia por veneno de himenóptero (HVA) en los que se ha descartado una patología mastocitaria clonal. Además, HαT+ no parece influir en la frecuencia de sensibilización al veneno de himenóptero, sólo influye en la gravedad de la reacción entre los individuos sensibilizados.(25)
También se ha descrito una mayor prevalencia de HαT+ en la anafilaxia idiopática (17%)(25) y en la anafilaxia desencadenada por alimentos en población infantil.(24)
4.2 HαT Y PATOLOGÍA MASTOCITARIA.
HαT+ está asociado a la presencia de patología mastocitaria clonal, encontrándose entre el 12-21% de los pacientes con síndrome de activación mastocitaria clonal (cSAM) y/o MS, sobre todo con formas no avanzadas de la enfermedad -MS indolentes (MSI) y MS quiescentes-.(11)
Un estudio realizado en población adulta española, ha descrito la prevalencia de HαT+ en el 29% de SAM no clonales (ncSAM) y el 18% de las mastocitosis. Entre los casos con mastocitosis, la detección de HαT+ es significativamente más frecuente (21% vs. 10%) entre los casos con la mutación D816V de KIT restringida a mastocitos vs. los casos con la mutación D816V de KIT multilineal. Además, entre los pacientes con mastocitosis, su cuadro clínico debutó con anafilaxia en el 76% vs. 65% (p = 0.18) de los HαT+ vs. HαT–.(6)
El mecanismo subyacente entre ambas entidades no es conocido, pero se ha planteado la hipótesis de que pudiera ser secundario al efecto de mitógeno del exceso de triptasa sobre el microambiente de la médula ósea (MO), promoviendo la selección de los clones aberrantes de MC.(11)
Los pacientes HαT+ con MS tienen una frecuencia de HVA del 30%, y una prevalencia de anafilaxia grave con síntomas cardiovasculares del 35.5%.(11) Así mismo, en población española se ha descrito que los pacientes con mastocitosis tienen una frecuencia de anafilaxia por alimentos del 15% en HαT+ vs. 5% en HαT– (p=0.013).(6)
Si se valora la patología mastocitaria global (clonal y no clonal), se ha descrito que la frecuencia de anafilaxia aumenta progresivamente desde los casos que no tienen alelos para α-triptasa (58%), los que tienen 1 alelo (65%), quienes tienen 2 alelos (72%) y aquellos que tienen ≥3 copias de este alelo (84%). En este estudio, también se describe, que si se analizan sólo los casos HαT+, la frecuencia de anafilaxia es mayor en los que tienen ≥3 copias vs. 2 copias de α-triptasa (82% vs. 61%; p=.017).(6)
- MANEJO DE HAT
Actualmente, para controlar los síntomas que habitualmente presentan los pacientes HAT+, se recomienda emplear el tratamiento antimediador que se suele emplear en la patología mastocitaria.(4) Se ha empleado con éxito el Omalizumab en casos plurisintomáticos complejos, consiguiendo la resolución de la urticaria y de la anafilaxia en el 94% de los pacientes.(13)
MTPS9579A, es un anticuerpo monoclonal humanizado IgG4 anti-triptasa, que inhibe selectivamente la actividad de la triptasa al disociar los tetrámeros activos en monómeros. Este anticuerpo anti-triptasa reduce la gravedad de la anafilaxia IgE mediada en un modelo murino humanizado.(26) Además, se ha desarrollado un modelo farmacocinético/farmacodinámico (PK/PD) para elegir la dosis de anticuerpo anti-triptasa MTPS9579A en pacientes con asma moderado-grave que permite predecir el nivel de exposición y de supresión de la triptasa en los tejidos diana.(27)
Otros estudios, describen anticuerpos monoclonales dirigidos a los receptores inhibidores de los mastocitos, como Siglec-8 (sialic acid-binding immunoglobulin-like lectin 8) [Lirentelimab/AK002], Siglec-6 [AK006], y CD200R [LY3454738].(28)
La eficacia y seguridad de Lirentelimab ha sido evaluado en ensayos clínicos con diferentes patologías en las que participan los mastocitos (incluyendo MSI, urticaria crónica espontanea, dermografismo sintomático, y conjuntivitis alérgica); en todos ellos los pacientes refieren mejoría se los síntomas.(28)
LY3454738 no demostró superioridad frente a placebo en un estudio fase II de urticaria crónica, por lo que esta línea de investigación se ha cerrado. Sin embargo, está pendiente de publicarse sus resultados en un estudio fase I en dermatitis atópica.(28)
AK006 inhibe la anafilaxia IgE mediada en modelos murinos.(28)
Todos estos anticuerpos, podrían abrir líneas de tratamiento de la anafilaxia y de los síntomas de HαT+ en el futuro.
FIGURAS.
Figura. Genotipos de triptasa codificados por TPSAB1 y TPSB2. (18)
BIBLIOGRAFÍA
- Glenner GG, Cohen LA. Histochemical demonstration of a species-specific trypsin-like enzyme in mast cells. Nature. 19 de marzo de 1960;185:846-7.
- Schwartz LB, Lewis RA, Seldin D, Austen KF. Acid hydrolases and tryptase from secretory granules of dispersed human lung mast cells. J Immunol Baltim Md 1950. abril de 1981;126(4):1290-4.
- Castells MC, Irani AM, Schwartz LB. Evaluation of human peripheral blood leukocytes for mast cell tryptase. J Immunol Baltim Md 1950. 1 de abril de 1987;138(7):2184-9.
- Wu R, Lyons JJ. Hereditary Alpha-Tryptasemia: a Commonly Inherited Modifier of Anaphylaxis. Curr Allergy Asthma Rep. 10 de mayo de 2021;21(5):33.
- Lyons JJ. Inherited and acquired determinants of serum tryptase levels in humans. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. octubre de 2021;127(4):420-6.
- González-de-Olano D, Navarro-Navarro P, Muñoz-González JI, Sánchez-Muñoz L, Henriques A, de-Andrés-Martín A, et al. Clinical impact of the TPSAB1 genotype in mast cell diseases: A REMA study in a cohort of 959 individuals. Allergy. 11 de octubre de 2023;
- Khoury P, Lyons JJ. Mast cell activation in the context of elevated basal serum tryptase: genetics and presentations. Curr Allergy Asthma Rep. 27 de noviembre de 2019;19(12):55.
- Zhang H, Zeng X, He S. Evaluation on potential contributions of protease activated receptors related mediators in allergic inflammation. Mediators Inflamm. 2014;2014:829068.
- Caughey GH. Tryptase genetics and anaphylaxis. J Allergy Clin Immunol. junio de 2006;117(6):1411-4.
- Lyons JJ, Yu X, Hughes JD, Le QT, Jamil A, Bai Y, et al. Elevated basal serum tryptase identifies a multisystem disorder associated with increased TPSAB1 copy number. Nat Genet. diciembre de 2016;48(12):1564-9.
- Kačar M, Rijavec M, Šelb J, Korošec P. Clonal mast cell disorders and hereditary α-tryptasemia as risk factors for anaphylaxis. Clin Exp Allergy. 2023;53(4):392-404.
- Robey RC, Wilcock A, Bonin H, Beaman G, Myers B, Grattan C, et al. Hereditary Alpha-Tryptasemia: UK Prevalence and Variability in Disease Expression. J Allergy Clin Immunol Pract. 2020;8(10):3549-56.
- Giannetti MP, Weller E, Bormans C, Novak P, Hamilton MJ, Castells M. Hereditary alpha-tryptasemia in 101 patients with mast cell activation-related symptomatology including anaphylaxis. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. junio de 2021;126(6):655-60.
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 27 de noviembre de 2020;21(23):9030.
- dPCR para principiantes [Internet]. Disponible en: https://www.qiagen.com/es-es/applications/digital-pcr/beginners
- Pérez-Barrios, C. PCR digital en la monitorización de la respuesta al tratamiento del paciente oncológico. En: Aplicaciones clínicas de lsa técnicas actuales de Biología Molecular. Cont. Lab. Clin.; 2018. p. 52-8.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, et al. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol. 2019;144(4):883-96.
- Lyons JJ. Hereditary Alpha Tryptasemia: Genotyping and Associated Clinical Features. Immunol Allergy Clin North Am. 2018;38(3):483-95.
- von Bubnoff D, Koch D, Stocker H, Ludwig RJ, Wortmann F, von Bubnoff N. The Clinical Features of Hereditary Alpha-Tryptasemia—Implications for Interdisciplinary Practice. Dtsch Arzteblatt Int. 22 de marzo de 2024;(Forthcoming):arztebl.m2023.0287.
- Valent P, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, Butterfield JH, et al. Why the 20% + 2 Tryptase Formula Is a Diagnostic Gold Standard for Severe Systemic Mast Cell Activation and Mast Cell Activation Syndrome. Int Arch Allergy Immunol. 2019;180(1):44-51.
- Baretto RL, Beck S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: A perioperative perspective. Allergy. diciembre de 2017;72(12):2031-4.
- Mateja A, Wang Q, Chovanec J, Kim J, Wilson KJ, Schwartz LB, et al. Defining baseline variability of serum tryptase levels improves accuracy in identifying anaphylaxis. J Allergy Clin Immunol. marzo de 2022;149(3):1010-1017.e10.
- Sahiner UM, Yavuz ST, Buyuktiryaki B, Cavkaytar O, Yilmaz EA, Tuncer A, et al. Serum basal tryptase may be a good marker for predicting the risk of anaphylaxis in children with food allergy. Allergy. febrero de 2014;69(2):265-8.
- Lang A, Kubala S, Grieco MC, Mateja A, Pongracic J, Liu Y, et al. Severe food allergy reactions are associated with α-tryptase. J Allergy Clin Immunol. octubre de 2023;152(4):933-9.
- Lyons JJ, Chovanec J, O’Connell MP, Liu Y, Šelb J, Zanotti R, et al. Heritable risk for severe anaphylaxis associated with increased α-tryptase-encoding germline copy number at TPSAB1. J Allergy Clin Immunol. febrero de 2021;147(2):622-32.
- Maun HR, Jackman JK, Choy DF, Loyet KM, Staton TL, Jia G, et al. An Allosteric Anti-tryptase Antibody for the Treatment of Mast Cell-Mediated Severe Asthma. Cell. 3 de octubre de 2019;179(2):417-431.e19.
- Rymut SM, Henderson LM, Poon V, Staton TL, Cai F, Sukumaran S, et al. A mechanistic PK/PD model to enable dose selection of the potent anti-tryptase antibody (MTPS9579A) in patients with moderate-to-severe asthma. Clin Transl Sci. abril de 2023;16(4):694-703.
- Metz M, Kolkhir P, Altrichter S, Siebenhaar F, Levi-Schaffer F, Youngblood BA, et al. Mast cell silencing: A novel therapeutic approach for urticaria and other mast cell-mediated diseases. Allergy. enero de 2024;79(1):37-51.
Pautas para una correcta transición del paciente niño-adolescente a adulto
Los adolescentes y adultos jóvenes alérgicos y/o asmáticos, representan un gran número de pacientes en la especialidad de Alergología. Por ello la Academia Europea de Alergología e Inmunología Clínica (EAACI) publicó en junio de 2020 unas pautas de manejo para este grupo de edad.
Este periodo de la vida es particularmente especial ya que tienen lugar numerosos cambios vitales en distintos ámbitos como educación, trabajo, viajes y establecimiento de relaciones personales más maduras. A esto se le suma el cambio de atención médica de la edad pediátrica a la adulta y una pérdida de miedo a lo desconocido, que puede conllevar un peor seguimiento médico y hospitalizaciones más frecuentes.
Por eso se recomienda una adquisición progresiva de conocimientos y habilidades sobre su enfermedad que permitan aumentar la responsabilidad en el autocuidado. Aunque está convenido que se empiece en la primera etapa de la adolescencia, este umbral ha de ser adaptado a las características del paciente: desarrollo físico y psicológico, coexistencia de varias enfermedades alérgicas, adherencia al tratamiento, circunstancias socio-económicas familiares y conocimientos sobre la enfermedad hasta ese momento.
En general se trata de:
- Inicio precoz entre los 11 y 13 años.
- Manejo multidisciplinar y estructurado.
- Asegurarse de que entienden su enfermedad y tienen recursos fácilmente disponibles a su alcance.
- Seguimiento activo por parte del clínico de su enfermedad y de la adherencia al tratamiento.
- Discutir las implicaciones para su educación y futuro trabajo.
Las recomendaciones específicas para alérgicos y asmáticos son:
- Simplificar las pautas de tratamiento y usar recordatorios (folletos, páginas web, audios).
- Centrarse en las áreas donde no se sientan seguros e involucrar a sus amigos en el entrenamiento.
- Identificar aspectos psicológicos y socioeconómicos que impacten negativamente en el control de la enfermedad y en su calidad de vida.
- Involucrar a la familia para que dé autonomía al paciente.
- Animar al paciente a que sus amigos sepan de su alergia y asma.
Roberts, G, Vazquez‐Ortiz, M, Knibb, R, et al. EAACI Guidelines on the effective transition of adolescents and young adults with allergy and asthma. Allergy. 2020; 75: 2734– 2752.
Si quieres leer el documento completo pincha Aquí (versión sólo en inglés).
Silvia Veza Perdomo. Médico Adjunto. Hospital Universitario de Getafe. Madrid. Comité de Alergia Infantil SEAIC.
Directorio de Centros
Alergología en el sector público
Puede consultar los hospitales en cada Comunidad Autónoma seleccionando el área geográfica correspondiente en el mapa del margen izquierdo. Para cada comunidad los centros se agrupan por provincias siguiendo un orden alfabético.
En caso de no encontrar un hospital que incluya asistencia alergológica le rogamos se ponga en contacto con el webmaster del sitio.
Publicado el día 1/8/2014
Actualizado el día 26/10/2014
Banco de Imágenes en Alergología
El próximo 14 de septiembre concluye el plazo de participación en el proyecto BIA (Banco de Imágenes en Alergología), iniciativa que, bajo el formato de concurso, tiene como objetivo crear una colección de imágenes seleccionadas por su calidad e interés demostrativo aportadas por los alergólogos.
Jornada de Clausura AVAIC 2014
El día 31 de mayo se celebra la Jornada de Clausura de la Asociación Valenciana de Alergología e Inmunología Clínica, que este año tendrá lugar en el Hospital Universitario de La Ribera en Alzira (Valencia). Para realizar la inscripción visite el sitio www.avaic.org.
Valoramos tu opinión
Arranca el proyecto «Valoramos tu opinión», con el fin de que las opiniones, sugerencias y peticiones de los socios nos permitan responder a sus necesidades. Si no dispone de su código solicítelo a mariajesus.hernandez@seaic.org.
Acceda al sitio desde aquí.
EAACI Allergy School
Del 19 al 21 de septiembre de 2013 se celebra en Málaga el próximo Allergy School de la Academia Europea de Alergología e Inmunología Clínica (EAACI), que organiza el Servicio de Alergia del Hospital Carlos Haya y trata sobre «reacciones alérgicas a fármacos, del fenotipo al genotipo».
¿Qué es la Esofagitis Eosinofílica?
¿Qué es la esofagitis eosinofílica (EoE)?
– Es una enfermedad inflamatoria del esófago de carácter crónico, mediada por mecanismos inmunológicos, que se caracteriza por la presencia de infiltración de eosinófilos en mucosa esofágica. Se puede observar eosinofilia en sangre periférica entre aproximadamente el 10 y el 50% de los casos.
– En la actualidad, es la segunda causa de esofagitis crónica tras la enfermedad por reflujo gastroesofágico (ERGE) y la principal causa de disfagia e impactación de alimentos en niños y adultos jóvenes
– Fue descrita en los años 90, actualmente con un aumento dramático en la prevalencia hasta afectar al menos a un habitante por cada 2.000 en Europa y Norteamérica.
– Es más frecuente en varones y puede manifestarse a cualquier edad
– En la mayoría de los casos, la inflamación esofágica está desencadenada por alimentos, aunque es posible que también influyan factores ambientales. Los alimentos más frecuentes implicados son: leche de vaca, gluten y huevo.
– Puede ser causada por mecanismos de sensibilización alimentaria mediados por inmunoglobulina E (IgE), no mediados por IgE o mixtos.
– Un problema importante es la falta de correlación entre la intensidad de los síntomas y la inflamación del tejido ya que actualmente el único método diagnóstico y de seguimiento es la gastroscopia con toma de biopsias.
¿Cuándo se debe sospechar una esofagitis eosinofílica?
• Ingiere muchos líquidos con las comidas para lubricar los alimentos
• Modifica la comida (cortarla en pequeños trozos)
• Tiempos de comida prolongados
• Evita alimentos de textura dura (pan, carnes)
• Mastica excesivamente
• Rechaza pastillas/comprimidos
• Dolor en el pecho
¿Cuáles son los síntomas?
– Depende de la edad:
• Preescolares: fallo de medro, rechazo del alimento, dolor abdominal, vómitos, trastornos del sueño, etc.
• Escolares, adolescentes y adultos: disfagia, impactación, odinofagia, regurgitación.
¿Cómo se diagnostica?
– Gastroscopia con toma de biopsias de esófago proximal y distal
El diagnóstico etiológico o causal se realiza:
– Pruebas cutáneas con batería extensa de alérgenos.
– Determinación de IgE específicas
– Dieta de evitación y valoración de la respuesta de la mucosa esofágica
¿Cuál es el tratamiento?
– Dieta de eliminación
– Inhibidores de la bomba de protones (IBP)
– Corticoides deglutidos
– En casos de estenosis o estrechamiento importante del esófago: Dilatación esofágica
– Terapias en trámites de aprobación en Europa: anti IL4 y IL13 (Dupilumab)
IMPORTANTE: La EoE no es una enfermedad mortal pero su carácter crónico y agresivo afectan la calidad de vida de los que la padecen y de sus familias. Recuerda consultar con tu alergólogo/a, si presentas síntomas descritos.
Bibliografía:
1. Attwood SE, Smyrk TC, Demeester TR, Jones JB. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci. 1993 Jan;38(1):109-16. doi: 10.1007/BF01296781. PMID: 8420741.
2. Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. Idiopathische, eosinophile Osophagitis: eine häufig verkannte Krankheit mit typischer Klinik und diskretem endoskopischem Bild [Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings]. Schweiz Med Wochenschr. 1994 Aug 20;124(33):1419-29. German. PMID: 7939509.
3. Spergel JM, Beausoleil JL, Mascarenhas M, Liacouras CA. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol. 2002 Feb;109(2):363-8. doi: 10.1067/mai.2002.121458. PMID: 11842310.
4. Sampson HA. Update on food allergy. J Allergy Clin Immunol. 2004 May;113(5):805-19; quiz 820. doi: 10.1016/j.jaci.2004.03.014. PMID: 15131561. 5. Arias Á, Pérez-Martínez I, Tenías JM, Lucendo AJ. Systematic review with meta analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016 Jan;43(1):3-15. doi: 10.1111/apt.13441. Epub 2015 Oct 28. PMID: 26510832. 6. Lucendo AJ, Arias-González L, Molina-Infante J, Arias Á. Systematic review: health-related quality of life in children and adults with eosinophilic oesophagitis-instruments for measurement and determinant factors. Aliment Pharmacol Ther. 2017 Aug;46(4):401-409. doi: 10.1111/apt.14194. Epub 2017 Jun 22. PMID: 28639700.
7. Molina infante J, Corti R, Doweck J, Lucendo AJ. Actualización terapéutica en esofagitis eosinofílica. Acta Gastroenterol Latinoam 2018; 48(3): 242-252 8. Molina-Infante J, Gonzalez-Cordero PL, Ferreira-Nossa HC, Mata-Romero P, Lucendo AJ, Arias A. Rising incidence and prevalence of adult eosinophilic esophagitis in midwestern Spain (2007-2016). United European Gastroenterol J. 2018 Feb;6(1):29-37. doi: 10.1177/2050640617705913. Epub 2017 Apr 21. PMID: 29435311; PMCID: PMC5802667.
9. Arias Á, Lucendo AJ. Incidence and prevalence of eosinophilic oesophagitis increase continiously in adults and children in Central Spain: A 12-year population-based study. Dig Liver Dis. 2019 Jan;51(1):55-62. doi:
10.1016/j.dld.2018.07.016. Epub 2018 Jul 31. PMID: 30115573.
10. Gupta M, Grinman M. Diagnosis and management of eosinophilic esophagitis. CMAJ. 2024 Feb 4;196(4):E121-E128. doi: 10.1503/cmaj.230378. PMID: 38316452; PMCID: PMC10843442.
11. Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, Amil Dias J, Bove M, González-Cervera J, Larsson H, Miehlke S, Papadopoulou
A, Rodríguez-Sánchez J, Ravelli A, Ronkainen J, Santander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017 Apr;5(3):335-358. doi: 10.1177/2050640616689525. Epub 2017 Jan 23. PMID: 28507746; PMCID: PMC5415218.
12. Joan Domenech Witek, Vicente Jover Cerda, Zahira Maria Franzon Laz, et al.. (2020-04-14). «Study and Follow-Up of Patients with Allergic Eosinophilic Esophagitis Phenotype.» *Volume 3*, 1, 7-17
13. Gómez Torrijos E, González-Mendiola R, Alvarado M, Ávila R, Prieto-Garcia A, Valbuena T, Borja J, Infante S, López MP, Marchan E, Prieto P, Moro M, Rosado A, Saiz V, Somoza ML, Uriel O, Vásquez A, Mur P, Poza-Guedes P, Bartra J. Eosinophilic Esophagitis: Review and Update. Front Med (Laussanne). 2018 Oct 9;5:247. doi: 10.3389/fmed.2018.00247. PMID: 30364207; PMCID: PMC6192373.
14. Domenech Witek J, González Mendiola R, Jover Cerdá V, Pereira González J, Carballas Vásquez C, Villas Martínez F, Rodríguez Pacheco R. Description of allergic phenotype in patients with eosinophilic oesophagitis: management protocol proposal. Sci Rep. 2023 Feb 8;13(1):2226. doi: 10.1038/s41598-023- 29602-z. PMID: 36755125; PMCID: PMC9906574
Recomendaciones para un Verano seguro con Niños con Alergia Alimentaria
Con la llegada del buen tiempo y las vacaciones son más frecuentes los viajes, así como las comidas fuera de casa, lo cual supone un cambio en las rutinas y una posible
relajación en las medidas de vigilancia recomendadas para aquellos niños con alergia alimentaria. Durante el curso escolar, con horarios y actividades rutinarias es más
sencillo establecer pautas y medidas de control tanto en casa como en el comedor escolar. Es en los momentos de relax o fuera del ambiente cotidiano donde pueden surgir situaciones inesperadas o exposiciones no controladas a aquellos alimentos que debemos evitar.
Para evitarlo y poder disfrutar de estos momentos tan esperados, desde el Comité de Alergia a Alimentos de SEAIC queremos ofrecerles unas sencillas pautas y consejos a tener en cuenta:
– Antes de viajar: es importante informarnos si el medio de transporte que usaremos puede suponer algún tipo de riesgo porque se repartan comidas en su interior, y si es
posible comunicar previamente a la compañía si es posible evitar ese alimento durante ese trayecto (por ejemplo: los frutos secos). En caso contrario, para llevar la medicación de rescate dentro del transporte puede ser necesario llevar un informe explícito para que nos lo autoricen (por ejemplo: adrenalina, inhaladores…). Además, algunas compañías ofrecen menús especiales. En los hoteles también es útil saber si ofrecen menús especiales o medidas de seguridad en el comedor para evitar contaminaciones cruzadas.
– Informe médico: es aconsejable siempre llevar no sólo la tarjeta sanitaria sino también un informe que describa el tipo de alergia alimentaria y el tratamiento recomendado en caso de reacción adversa. Puede ser útil para poder solicitar los menús especiales en los hoteles, así como si precisamos asistencia médica de cualquier tipo, no sólo en urgencias sino cualquier otra que suponga ingreso hospitalario.
– Botiquín: es imprescindible llevar siempre todo el tratamiento que necesitemos en caso de reacción alérgica (adrenalina, antihistamínicos, corticoides…) según la pauta del alergólogo. No sabemos cuándo nos puede hacer falta ni dónde, y si podremos conseguirlo allí donde estemos.
– Restaurantes: durante las vacaciones no sólo se frecuentan más los restaurantes, sino que suelen ser otros diferentes a los habituales que ya conocemos. El enfrentarnos a una carta diferente y con personal que no conocemos dificulta la seguridad de la selección, pero debemos tener la libertad de preguntar siempre cualquier duda para no cometer un error que puede tener consecuencias no deseables. Aunque existe una normativa que regula la declaración en la carta de la presencia de los 14 alergenos obligatorios, es importante comprobarlo preguntando al personal directamente. Además, en verano son más frecuentes las comidas con pescado o marisco, y no solo hay que tener en cuenta la comida que hemos elegido o prevenir la contaminación cruzada en cocina, sino la posible reacción por inhalación de partículas en los casos de alta sensibilidad. En los pescados debemos tener en cuenta que si somos alérgicos al Anisakis simplex debemos además preguntar si siguen las recomendaciones de congelación previa. No olvidemos hacer todas las preguntas necesarias antes de elegir la comida.
– Campamentos de verano: en esta época del año es cuando con más frecuencia se realizan este tipo de experiencias y generalmente son de larga duración. Es importante informarnos de las medidas de seguridad que nos ofrecen, si hay personas responsables de su vigilancia y si tienen algún protocolo o experiencia en el manejo de estos niños. La familia tiene que aportar el informe médico y la medicación para el botiquín de emergencia de la misma forma que lo ha hecho en el centro escolar.
– Viajes al extranjero: Además de todas las recomendaciones previas, en caso de que salgamos de España sería recomendable que sepamos el nombre de los alimentos a los cuales somos alérgicos en el idioma del país que vamos a visitar. Podemos llevarlos escritos en una tarjeta y enseñarlos allí donde vayamos a comer para asegurarnos que entiendan nuestras alergias alimentarias. En toda la Unión Europea es obligatorio informar si el alimento contiene alguno de los 14 alérgenos de declaración obligatoria.
María Teresa Valbuena Garrido. Hospital Universitario Infanta Sofía.
Paloma Poza Guedes. Hospital Universitario de Canarias.
Subcomité de Alergia Infantil del Comité de Alergia a Alimentos de SEAIC
XXXI Congreso Nacional de la SEAIC
Del 24 al 27 de Octubre de 2018 tiene lugar el XXXI Congreso Nacional de la Sociedad Española de Alergología e Inmunología Clínica en Valencia.
Las innovaciones en el tratamiento, diagnóstico y comunicación de la práctica alergológica contribuyen a la mejora de la calidad asistencial de los pacientes.
Dejamos a vuestra disposición las Notas de prensa acerca de lo que se tratará en nuestro XXXI Congreso:
![]() Nota de Prensa XXXI Congreso SEAIC (I) (5919 descargas )
Nota de Prensa XXXI Congreso SEAIC (I) (5919 descargas )
![]() Nota de Prensa XXXI Congreso SEAIC (II) (8364 descargas )
Nota de Prensa XXXI Congreso SEAIC (II) (8364 descargas )
![]() Nota de Prensa XXXI Congreso SEAIC (III) (7999 descargas )
Nota de Prensa XXXI Congreso SEAIC (III) (7999 descargas )
Los Aditivos Alimentarios: El mal de todo paciente, el olvido de todo alergólogo.
Los aditivos alimentarios son sustancias que habitualmente no se consumen como producto alimentario. No obstante, tienen un papel fundamental a la hora de mantener la calidad y las características de los alimentos que exigen los consumidores y hacen que estos alimentos sigan siendo seguros, nutritivos y deseables. De este modo, los aditivos no son alimentos en sí, sinó sustancias que se añaden a los alimentos para mejorar su conservación, color, sabor o consistencia.
A este grupo de sustancias se les ha atribuído con bastante frecuencia la capacidad de producir reacciones adversas, e incluso alérgicas. No obstante, en la actualidad se desconoce la prevalencia exacta de reacciones adversas frente aditivos, si bien sabemos y se ha demostrado que los aditivos alimentarios muy raramente provocan auténticas reacciones inmunológicamente mediadas (hecho poco creíble entre la población general).
A continuación se describen los grupos de aditivos existentes en el mercado actual, sus características fundamentales y algunas de las principales reacciones adversas descritas hasta el momento debido a estas sustancias:
Antioxidantes y conservantes: Son aditivos que mantienen la frescura e impiden su deterioro. Contribuyen a qué los alimentos se puedan conservar durante más tiempo protegiéndolos contra el daño ocasionado por la oxidación o los microrganismos. Los antioxidantes evitan la oxidación de las grasas de los alimentos e impiden que se decoloren y se vuelvan rancios. Los conservantes limitan, retrasan o previenen la proliferación de los microorganismos.
Antioxidantes: Ácido ascórbico E300, Ascorbato De Sodio E301, Ascorbato De Calcio E302, Ascorbato De Potáseo E303, palmitato ascorbil E304, estearato ascorbil E305, Extractos Naturales Ricos En Tocoferol E306, Alfa Tocoferol E307, gamma tocoferol E308, delta tocoferol E309, Galato De Propil E310, Galato De Octil E311, Galato De Dodecil E312, Ácido Eritórbico E315, Eritorbato Sódico E316, Butilhidroquinona (Bhq) E319, Butilhidroxianisol (Bha) E320, Butilhidroxitolueno (Bht) E321, lactato de sodio E325, lactato de potáseo E326, lactato de calcio E327, etileno diamino tetra acetato E385, ácido etilendiaminotetracético E386, extracto de romero E392, Tocoferoles (E306-307-308-309), Ácido ascórbico (E300), BHA (butilhidroxianisol o E320) y BHT (butilhidroxitoluol o E321). La incidencia de broncoespasmo debido a estos aditivos es realmente muy baja. Se han descrito casos de urticaria de contacto, urticaria crónica y dermatitis atópica debido a estos antioxidantes.
Los conservantes físicos son muy efectivos, pero, en muchos casos, tienen una duración muy corta y un elevado coste. Los conservantes físicos serían el frío (refrigeración o congelación), la liofilización y el envasado al vacío. Existen también los conservantes químicos que según su origen pueden dividirse en:
- Minerales
- Cloruros: cloruro sódico o sal común, es el primer conservante químico utilizado y un eficaz agente antimicrobiano.
- El dióxido de azufre y los sulfitos (E220 hasta 228): Anhídrico sulforoso y sulfitos con concentraciones superiores a 10 mg/l expresados como SO2: Los sulfitos y bisulfitos son sustancias derivadas del azufre y se utilizan como antioxidantes o conservantes. La normativa europea obliga a etiquetar cualquier alimento que contenga sulfitos a concentraciones superiores a 10 mg/kg o 10 mg/l, y estos productos han de ser declarados con el término sulfito o dióxido de azufre (E-220, E-221, E-222, E-223, E-224, E-225, E-226, E-227 i E-228). Los sulfitos pueden ser responsables de reagudizaciones asmáticas en pacientes con asma. Los principales alimentos que contiene sulfitos son: el vino (que contiene sulfitos producidos durante la fermentación) y otras bebidas alcohólicas o no alcohólicas envasadas (zumos, mosto, sidra), alimentos envasados, alimentos pre-cocinados, conservas, alimentos ultracongelados y vinagre. A parte de síntomas respiratorios bronquiales, los sulfitos también pueden ocasionar molestias nasales (rinitis), digestivas y/o cutáneas (urticaria, angioedema y dermatitis de contacto).
- Nitratos y nitritos (sales potásicas y sódicas) (desde E249 a 252). Se utilizan como conservantes en el procesado de carnes como el jamón y otros embutidos con la finalidad de garantizar la seguridad de los productes e inhibir el crecimiento de la bacteria botulínica. Los nitritos y los nitratos se encuentran en productos cárnicos curados, derivados del pescado y los quesos. La formación de nitrosamina se considera cancerígena. Pueden ser responsables de agravar la clínica de dermatitis atópica en algunos pacientes. También se han descrito casos de reacciones alérgicas graves (anafilaxia) debido a estos conservantes.
- Orgánicos:
- Ácidos grasos saturados y sus derivados: Ácido acético y acetatos, ácido fórmico y formiatos, ácido propiónico y propionatos.
- Ácido sórbico y sorbatos. Tienen actividad frente Clostridium botulinum. Se han descrito casos de urticaria de contacto perioral debida a estos conservantes.
- Ácido benzoico y benzoatos. Los benzoatos se encuentran de manera natural en las cerezas y la canela. Son unos de los aditivos más relacionados con reacciones alérgicas. Pueden ser responsables de agravar la clínica de dermatitis atópica en algunos pacientes. También se han descrito casos de urticaria, urticaria de contacto, angioedema, rinitis y asma debido a estos conservantes si bien la incidencia es muy baja. Los benzoatos también se han asociado a otras reacciones como por ejemplo el dolor de cabeza, la migraña, la dificultad de concentración, la hiperactividad y las artralgias, si bien la incidencia es también muy baja.
- Antioxidantes fenólicos.
- Antibióticos. Se utilizan poco por el riesgo de producir efectos indeseables así como por la posibilidad de producir cepas microbianas resistentes. La nisina es el más utilizado ya que inhibe el crecimiento de
Aditivos que aumentan o potencian las cualidades sensoriales.
- Modificadores del sabor y la textura:
- Emulsionantes y estabilitzantes: se utilizan para mantener la consistencia de la textura y evitar que los ingredientes se disgreguen. La lecitina (E322), los monoglicéridos y los diglicéridos, entre otros pertenecen a este grupo. Entre los estabilizantes destaca la metilcelulosa (E461), habiéndose descrito sobre todo reacciones adversas gastrointestinales debidas a este estabilizante (predominantemente dolor, distensión abdominal y en algunos casos incluso obstrucción intestinal). De entre los emulsionantes, destaca el triestearato de sorbitán (E492), el cual puede incrementar la absorción de sustancias solubles en grasas.
- Espesantes: ayudan a incrementar la viscosidad de los alimentos. Habitualmente se utilizan como espesantes sustancias naturales como la gelatina (E441: se han descrito reacciones alérgicas graves –anafilaxia- debidas a la gelatina) o la pectina [E440a: grandes cantidades pueden producir síntomas gastrointestinales (sobre todo dolor y distensión abdominal)]. Otros espesantes son el ácido algínico (E400), el alginato de sodio (E401), el alginato de potáseo (E402), el alginato de amonio (E403), el alginato de calcio (E404) o el agar-agar (E406). A pequeñas cantidades no se les conocen efectos adversos atribuíbles. No obstante, grandes cantidades pueden inhibir la absorción de algunos nutrientes y ocasionar patología gastrointestial. Las gomas naturales también se utilizan como espesantes. Pertenecen a la familia de las legumbres la goma arábiga (E414), la goma de algarroba (E410), la goma guar (E412), la goma de tara (E417) y la goma de tragacanto (E413). La goma guar (E412) es una goma natural proviniente de la semilla de la planta Cyamopsis tetragonoloba (familia Fabaceae). Este aditivo se encuentra casi siempre en forma de polvo, pero, cuando se combina con otros ingredientes también puede verse en forma líquida o de gel. Debido a qué es una fibra soluble en agua, la goma guar puede tener un efecto laxante en aquellas personas que la consuman. Muy frecuentemente también es la responsable de ocasionar patología gastrointestinal (diarrea, dolor abdominal, distensión abdominal), habiéndose incluso descrito casos de obstrucción intestinal debido a su consumo. Al igual que la goma de algarroba puede incrementar los niveles de colesterol. La goma de tragacanto (E413) se obtiene de diversas especies de Astragalus. Se han descrito reacciones alérgicas por contacto (dermatitis de contacto y/o urticaria).
- Edulcorantes: proporcionan un sabor dulce a los alimentos y se utilizan en productos bajos en calorías. Son edulcorantes intensos el acesulfam K (E950), el aspártamo (E951) y la sacarina (E954). También son edulcorantes la taumatina (E957), que es una proteína edulcorante natural que se extrae de la planta Thaumatococcus danielli (es 2.500 veces más dulce que el azúcar), el sorbitol (E420), la isomaltosa (E953), el maltitol (E965i), el ciclamato E 952, la sucralosa E955, la glicirricina E958, la neohesperidina (Nhdc) E959, la estevia (extracto de stevia) E960, el jarabe de maltitol E965ii, el lactitol E966, el xilitol E967, el eritritol E968, el advantamo E969, el sorbitol (E420), el manitol (E421) y el glicerol (E422). Principalmente pueden producir trastornos gástricos (náuseas, vómitos y diarreas).
- Potenciadores del sabor: El más conocido es el glutamato monosódico (se identifica con los códigos GMS o E621). Se utiliza sobre todo en productos salados, alimentos de sobre y en una gran variedad de platos orientales. Es la sal sódica del ácido glutámico. Originariamente se extraía de las algas y del trigo. Se utiliza sobre todo para la preparación de alimentos de sobre y en las cocinas orientales. Las manifestaciones clínicas más características de las reacciones adversas por glutamato se engloban dentro del «síndrome del restaurante chino» que se describe como la aparición de dolor de cabeza, sensación de ardor en la piel (sobre todo en escote y cara) que posteriormente afecta al resto del cuerpo y se acompaña de náuseas, palpitaciones y en ocasiones incluso pérdida de conocimiento. El cuadro se inicia a los pocos minutos de la ingesta de una alta cantidad de glutamato y cede en 2-3 horas. Actualmente está todavía en controversia el papel del glutamato monosódico como desencadenante de crisis de asma o de patología cutánea (urticaria y/o angioedema). Parece que sí que podría estar relacionado con la clínica de rinitis.
- Acidulantes: Un acidulante es un aditivo alimentario que incrementa la acidez de un alimento o le da un sabor ácido. Entre los diversos acidulantes que se utilizan están los ácidos orgánicos y los ácidos inorgánicos.
- Otros: antiaglomerantes, antiespumantes, gases de envasado, midones, disolventes, entre otros.
- Colorantes: Los colorantes se utilizan en los alimentos para añadir o restaurar el color con el objetivo de mejorar su aspecto visual. Pueden inducir reacciones de urticaria, angioedema (hinchazón), asma, rinitis, eczemas cutáneos, dermatitis de contacto e incluso anafilaxia. Parece que también pueden inducir reacciones pseudoalergicas o anafilactoides. Los colorantes también se han involucrado en otras reacciones afortunadamente bastante infrecuentes tales como dolor de cabeza, migraña, hiperactividad, dificultad de concentración y atención así como artralgias. Desde el punto de vista de su origen, los colorantes alimentarios se pueden clasificar en colorantes naturales [extracto de pimiento (paprika)], minerales y de síntesis. Dentro de los colorantes de síntesis encontramos dos grupos principales:
- Azoicos: Los colorantes azoicos son los que más frecuentemente se han implicado en reacciones adversas. Tartrazina: La tartrazina puede provocar clínica de urticaria en algunos pacientes aunque la prevalencia en la actualidad se sabe que es realmente muy baja. Tampoco queda claro su posible papel como desencadenante de crisis de asma. Sí parece que podría ser responsable de agravar la clínica de dermatitis atópica en algunos pacientes. Amarillo naranja: Se han descrito casos de urticaria, angioedema, eczemas y clínica gastrointestinal debidas a este colorante. Rojo de cochinilla: Es un colorante de síntesis muy utilizado en la industria, sobre todo para la conservación del color de los frutos rojos y de las conservas de marisco. Se han descrito casos de anafilaxia debido a este colorante en los que se ha podido demostrar un mecanismo alérgico mediado por anticuerpos IgE. Rojo carmín o ácido carmínico: Se obtiene a partir de la maceración de las hembras del insecto conocido popularmente como cochinilla (Dactylopius coccus). Es un colorante de color rojo intenso y no debe confundirse con el mismo colorante de origen sintético llamado rojo de cochinilla. Se ha implicado en casos de reacciones adversas y en muchos casos se ha podido demostrar un mecanismo alérgico mediado por anticuerpos IgE. Se han descrito reacciones de urticaria, asma, rinitis e incluso anafilaxia debidas a este colorante. Amarillo tartrazina: Este colorante se ha involucrado en reacciones alérgicas cruzadas con los derivados pirazolónicos (grupo de medicamentos antiinflamatorios donde pertenece el metamizol) así como con múltiples reacciones alérgicas.
- No azoicos: eritrosina, amarillo quinoleína e indigosina. Eritrosina: Es un polvo de color marrón que disuelto proporciona una tonalidad roja y puede presentar reactividad cruzada con la eosina. Según el lugar donde se añadan pueden ser de dos tipos:
- Los que se añaden directamente al alimento y se pueden consumir con ellos. En la Unión Europea se identifican con la letra E seguida de un número de 3 cifras.
- Los que se utilizan para dar un determinado color en el exterior de algunos alimentos y que no se suelen consumir. En la Unión Europea se identifican con la letra C, seguida de un número.
Aditivos que pueden contener trigo:
Almidones modificados: 1400, 1401a, 1402, 1403, 1404, 1405, 1410, 1412, 1414, 1420, 1.422, 1440, 1442, 1450, 1451. Los almidones abundan en los alimentos amiláceos (cereales y patata). El almidón más utilizado es el que se obtiene del maíz.
Polidextrosa E-1200.
E-306 Vitamina E. Son extractos de origen natural ricos en tocoferoles. Pueden ser de trigo, de arroz, de maíz o de soja.
Aditivos que contienen proteína de leche de vaca:
H-4511 caseinato cálcico
H-4512 caseinato sódico
H-4513 caseinato potásico
Aditivos que pueden contener proteína de leche de vaca:
E-101 Riboflavina o lactoflavina: Se utiliza como colorante. Actualmente casi siempre es de origen sintético.
E-270 Ácido láctico, E-325 Lactato sódico, E-326 Lactato potásico, E-327 Lactato cálcico: Tanto el ácido láctico como los lactatos se producen comercialmente a partir de la fermentación bacteriana del almidón y melazas, sin embargo, es posible que el cultivo para iniciar la producción de ácido láctico pueda contener leche.
E-966 Lactitol: Es un azúcar-alcohol sintético producido a partir de la lactosa que es un azúcar que contiene la leche de vaca. Aunque es bastante improbable que este aditivo contenga proteína de leche de vaca, el hecho de provenir de la lactosa hace que no se pueda descartar alguna posible contaminación.
E-472b Ésteres lácticos de los mono y diglicéridos de ácidos grasos, E-481 Estearoil-2-lactilat sódico, E-482 Estearoil-2-lactilat cálcico: Generalmente se producen a partir de grasas vegetales. Sin embargo, también pueden provenir de grasas animales por lo que en caso de provenir de grasas animales bovinos podrían contener proteína de leche de vaca.
Aditivos que contienen huevo:
E-161B Luteína, E-1105 Lisozima
Aditivos que pueden contener huevo:
E-101 Riboflavina: Se utiliza como colorante. Actualmente casi siempre es de origen sintético.
E-322 Lecitina: Actualmente casi siempre se obtiene de la soja, pero, en caso de duda se debe consultar al fabricante.
Aditivos que pueden contener pescado:
Potenciadores del sabor (E-626, E-627, E-628, E-629, E-630, E-631, E-632, E-633, E-634, E-635): Se obtienen a partir de levaduras o de extractos de carne o de peces.
Dra. Teresa Garriga Baraut
Bienvenidos
Primera comunicación a los miembros de comité de asma
LEER POR FAVOR COMO SE REALIZAN LAS COLABORACIONES Y COMUNICADOS
Enlace de presentación: Presentacion1 (1143 descargas )
