resultados de la búsqueda: asma/wp-content/uploads/logos/Hospital Universitario Fundación Jiménez Díaz/profesionales/wwwww
Nota de Prensa: Vuelta a la Rutina
Una vez llegado Septiembre es un buen momento para ponerse al día con las alergias. En Verano se relajan los hábitos de salud en muchas ocasiones porque patologías como la Dermatitis Atópica, la Rinitis o el Asma mejoran; por este motivo desde la Sociedad Española de Alergología e Inmunología Clínica os dejamos las siguientes recomendaciones para afrontar la Vuelta a la Rutina.
¿Qué es la alergia?
Conceptos básicos:
Alergia, atopia e hipersensibilidad
———————————————————————————————————————————–

El término alergia fue acuñado en 1906 por el Dr. Clemens Von Pirquet para definir un tipo especial de respuesta inmunológica o defensiva frente a sustancias que normalmente no inducen reacciones en la mayoría de las personas. El origen de una reacción alérgica no está por tanto en el agente que la produce, sino en el propio individuo.
Por ello se considera que la condición de ser alérgico tiene un importante componente constitucional, es decir, depende de una predisposición individual que frecuentemente es hereditaria. Para definir esta predisposición se emplea el término atopia (que literalmente significa “fuera de lugar”), propuesto por el Dr. Arthur Fernández-Coca en 1922. La atopia se define como un estado de hipersensibilidad en personas con enfermedades tales como asma, rinitis, conjuntivitis y algunas dermatitis, motivo por el cual los términos alergia y atopia se utilizan indistintamente para designar globalmente estas enfermedades.

Los conceptos de alergia y atopia están muy ligados al de hipersensibilidad, hasta el punto de que en ocasiones se consideran sinónimos. De hecho, al hablar de hipersensibilidad nos referimos a al mecanismo de respuesta inmunológica que conduce a la reacción alérgica, por lo que ambos conceptos están muy relacionados, aunque no son lo mismo.
Este mecanismo de hipersensibilidad no es único, ya que dentro de la complejidad de nuestro sistema inmunológico existen diversas formas de respuesta con distintas manifestaciones. En todos los casos debemos saber que cualquier respuesta alérgica implica un proceso inflamatorio en el que participan distintos tipos de células y una enorme diversidad de sustancias producidas por estas células.
.
Hipersensibilidad inmediata:
Alergia mediada por IgE
———————————————————————————————————————————–
Para comprender los mecanismos por los que se desarrolla una respuesta alérgica, describimos brevemente una de las formas más frecuentes de hipersensibilidad: la respuesta mediada por IgE o hipersensibilidad inmediata.
La inmunoglobulina E (IgE) es un tipo de anticuerpo presente en todas las personas. Al igual que otras inmunoglobulinas, interviene en la respuesta inmune específica al reconocer un agente extraño potencialmente peligroso sobre el que actúan nuestras defensas. Este agente se denomina antígeno.
En las personas atópicas, la IgE reacciona contra un agente generalmente inofensivo que al unirse a la IgE induce una serie de mecanismos que desencadenan la liberación de mediadores inflamatorios que producen la reacción alérgica. Este agente, que funciona como un antígeno, se denomina alérgeno.
Pero esta reacción no sucede repentinamente sin una fase previa denominada sensibilización. Como en toda respuesta inmune específica, los anticuerpos tienen que producirse tras una o varias exposiciones previas al alérgeno, durante las cuales se tolera su contacto. En esta fase se generan anticuerpos IgE que reconocen al alérgeno, de forma que en posteriores contactos se desencadena la reacción.
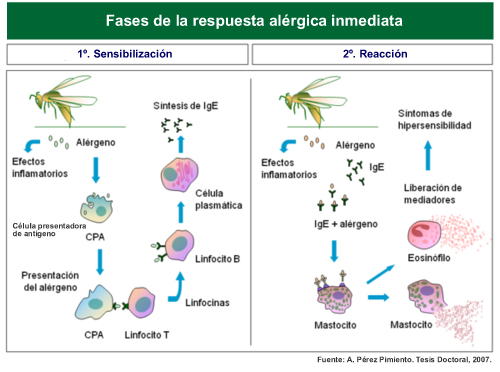
La reacción alérgica se produce por la liberación de sustancias procedentes de células inflamatorias. En el caso de las reacciones mediadas por IgE, la célula implicada se denomina mastocito. Esta célula se descarga bruscamente al ser activada por la IgE, con la consecuente liberación de los mediadores responsables de todas las manifestaciones de la reacción.
Última edición: 01/07/2019
———————————————–
Látex
El látex es la materia prima de la que se obtiene el caucho o la goma natural. Numerosos productos de uso habitual y del entorno sanitario están fabricados con látex, por lo que los alérgicos al látex deben conocer las posibles fuentes de exposición y mantener unas estrictas medidas de evitación, advirtiendo al personal sanitario antes de cualquier intervención
Originariamente, el látex es un fluido lechoso que se recoge a partir del sangrado de la corteza del árbol del caucho (Hevea brasiliensis). Para lograr su coagulación y facilitar su almacenamiento, el látex se mezcla con ácido acético. Para proporcionar resistencia y elasticidad se realiza un proceso de vulcanización, que consiste en el calentamiento en presencia de azufre. En el proceso de elaboración del producto final se añaden diversos aditivos: aceleradores de la vulcanización, antioxidantes, pigmentos, materiales de relleno y plastificantes.
Las reacciones alérgicas al látex ocurren por sensibilización previa a las proteínas que contiene. Se manifiestan con síntomas inmediatos, habitualmente por contacto directo con productos de uso común como los guantes, en forma de urticaria y angioedema. Las partículas que se respiran pueden causar conjuntivitis, rinitis y asma. En casos de exposición intensa al látex pueden ocurrir reacciones graves como la anafilaxia.
Es importante diferenciar estas reacciones inmediatas de otros cuadros que ocurren por sensibilización a los aditivos del caucho, generalmente aceleradores de la vulcanización (grupos “tiuram”, “mercapto”, “carbamatos”). Se manifiestan por eccema o dermatitis (picor y erupción exclusivamente en la zona de contacto). Estas reacciones, relativamente frecuentes y de mecanismo retardado, no conllevan riesgo de reacción inmediata. Por ello no contraindican un contacto esporádico con productos de látex.
———————————————–
Repercusión de la rinitis alérgica
El coste socioeconómico global de la rinitis alérgica supera al de otras enfermedades más graves como el asma o la EPOC, según se desprende de los resultados del Estudio FERIN. Se estima que más del 20% de la población española padece rinitis alérgica.
Conozca sus causas
Los alérgenos
Los agentes que producen enfermedades alérgicas se denominan alérgenos. Los alérgenos se pueden definir como sustancias inocuas que inducen reacciones de hipersensibilidad en personas susceptibles.
El sistema inmunitario del enfermo alérgico reconoce a estas sustancias como extrañas y potencialmente peligrosas, por lo que desencadena una serie de mecanismos de defensa que se manifiestan con los síntomas característicos de la reacción alérgica. Esta reacción es variable según el grado de respuesta y depende, entre otras cosas, de la susceptibilidad de cada persona, la intensidad de la exposición y la vía de exposición al alérgeno (respiratoria, cutánea, digestiva, etc.).
Los alérgenos respiratorios (aeroalérgenos) producen enfermedades por inhalación y posterior contacto con las vías respiratorias (asma, rinitis) y/o la conjuntiva ocular (conjuntivitis). Los aeroalérgenos más comunes son los pólenes, las esporas de hongos, los ácaros y los animales domésticos.
Los alérgenos alimentarios (trofoalérgenos) producen reacciones inmediatas por su consumo, con la aparición de síntomas digestivos, respiratorios y/o cutáneos. Los más frecuentes en los niños son las proteínas de la leche y del huevo, mientras que en los adultos predominan las frutas y los mariscos.
Los alérgenos de contacto (contactantes) producen reacciones cutáneas al contactar sobre la piel durante un tiempo más o menos prolongado, manifestándose en forma de eccema o dermatitis. Los alérgenos de contacto más comunes son los metales (sobre todo el níquel) y algunos medicamentos de uso tópico.
Otros alérgenos de interés son los medicamentos, el látex, el veneno de los himenópteros (abejas y avispas) y parásitos como el Anisakis.
En el menú de la izquierda puede encontrar algunas causas frecuentes de enfermedades alérgicas. Tenga en cuenta que esta información no pretende ser exhaustiva y tan sólo muestra unos conceptos básicos sobre cada grupo de alérgenos.
Última edición: 01/07/2019
———————————————–
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
La alfa triptasemia hereditaria es un rasgo genético que ha supuesto un nuevo biomarcador a tener en cuenta, sobre todo entre los pacientes que tienen anafilaxia.
Sin embargo, su diagnóstico está limitado a algunos centros especializados y sus implicaciones clínicas continuan en exploración.
- TRIPTASA.
La actividad tripsina-like se describió por primera vez en mastocitos (MC) en 1960 empleando técnicas histoenzimáticas.(1) Posteriormente, en 1981, se demostró esta misma actividad en los MC humanos de tejido pulmonar,(2) se aisló la enzima con una pureza en torno al 90% y se denominó triptasa (EC 3.4.21.59). La triptasa es producida y almacenada principalmente por los MC, y en una mínima cantidad por los basófilos.(3)
Las protriptasas (α y β) son enzimáticamente inactivas y se liberan de forma constitutiva al plasma, constituyen lo que se determina como triptasa sérica basal (sBT). Tras un proceso de maduración, se producen las triptasas maduras (tetrámeros enzimáticamente activos que forman complejos con la heparina), que se acumulan en los gránulos de los MC. Los tetrámeros activos de β-triptasa y α/β triptasa, se liberan al medio extacelular tras la desgranulación secundaria a la activación mastocitaria, y su determinación resulta de gran utilidad en el diagnóstico de anafilaxia.(4)
Los tetrámeros de β-triptasa madura se comportan como serín proteasas, que actuando sobre el complemento, algunas citoquinas, el fibrinógeno, el cininógeno, prostromelisina y los receptores activados por proteasas (PAR), pueden inducir los siguientes efectos: la proliferación de fibroblastos y músculo liso, la degradación de la matriz extracelular, el reclutamiento de eosinófilos y neutrófilos, la estimulación de células nerviosas y epiteliales, la angiogénesis y la fibrinogenolisis.(5) Sin embargo, los tetrámeros de α-triptasa madura son inactivos.(5,6)
Los heterotetrámeros de α/β triptasa madura, también tienen actividad peptidolítica, siendo su diana los PAR2 presentes en células endoteliales e induciendo extravasación in vitro; y los EMR2 (like module–containing mucin-like hormone receptor-like 2) receptores (proteínas G mecanosensitivas) presentes en la superficie de los MC. La unión de los heterotetrámeros de triptasa madura a este receptor inducen la escisión de la subunidad α del EMR2, y desencadenan la desgranulación mastocitaria(5), mecanismo que se ha relacionado con la urticaria vibratoria.(7) El incremento del número de copias de α-triptasa aumenta la proporción de heterotetrámeros frente a los homotetrámeros llevando a una sobre activación de estos receptores.(8)
La técnica comercial actualmente disponible para la detección de triptasa (ThermoFisher Scientific) es un inmunoensayo que utiliza dos anticuerpos anti-triptasa (el B12 que se emplea para la captura y el G4 para el revelado) siendo el límite inferior de detección de la técnica de 0,5 ng/mL. Esta técnica cuantifica la triptasa total sin distinguir entre formas maduras o precursores, ni isoformas α y β en los fluidos biológicos. El punto de corte establecido para los valores séricos basales de triptasa (sBT) en sujetos sanos es de 11.4 ng/mL.(4)
- ALFA TRIPTASEMIA HEREDITARIA (HαT).
La triptasa en humanos se codifica por 4 genes parálogos TPSG1 (alelos γ), TPSB2 (alelos β2 y β3), TPSAB1 (alelos α y β1), y TPSD1 (alelos δ) localizados en el cromosoma 16p13.3. Presenta diferentes isoformas: α-triptasa, β-triptasa, δ-triptasa y γ-triptasa. El genotipo normal para α y β triptasa contiene 4 copias de los genes, incluyendo estas variaciones 0α:4β, 1α:3β y 2α:2β.(4,9)
También se han descrito variaciones en el número de copias que codifican la β-triptasa, sobre todo en algunos grupos raciales, pero estas variaciones no se asocian con elevaciones de la sBT en las familias. Mientras que, los valores elevados de sBT heredados con patrón dominante en una familia, se asocian con un alelo portador de un gen TPSAB1 que codifica α-triptasa, y se trata de HαT incluso aunque se detecten copias extra de β-triptasa. (4) (Figura 1).
La alfa triptasemia hereditaria (HaT) fue descrita en 2016.(10) Se caracteriza por presentar un número aumentado de copias del gen TPSAB1 que codifica la α-triptasa, tiene un patrón autosómico dominante, se ha descrito en el 4-7% de donantes sanos,(4,6) y asocia un leve predominio entre el género femenino.(11) Los pacientes con HαT suelen tener cifras basales de triptasa (sBT) >11.4 ng/mL; aunque existen casos con valores normales de triptasa (raramente <8 ng/mL). Se recomienda realizar el estudio de HaT en aquellos individuos con sBT >8 ng/mL;(12–14) este punto de corte ha demostrado una sensibilidad del 94% y una especificidad del 100% para detectar copias extra del gen TPSAB1.(12)
Se ha detectado una relación entre el número de copias extra del alelo α del gen TPSAB1 (hasta 4 copias extra) y los niveles de sBT, en familias con HαT+. Parece seguir un patrón por el cual las duplicaciones implican unos niveles de sBT de 15 ± 5 ng/mL, las triplicaciones de 24 ± 6 ng/mL, y las cuadruplicaciones de 37 ± 14 ng/mL.(4)
Además, los valores elevados de sBT se pueden encontrar en otras patologías como las mastocitosis sistémicas (MS), neoplasias mieloides e insuficiencia renal.(7) También se ha publicado en varios estudios, la relación entre los niveles elevados de sBT con la prevalencia y la gravedad de anafilaxia, sin embargo, estos datos deben interpretarse con cautela ya que en muchos de ellos no se ha valorado la presencia concomitante de MC clonales ni de HαT+.(4) En cambio, sí que resulta clara la relación entre HαT+ y las anafilaxias graves desencadenadas por veneno de himenóptero, otras alergias IgE mediadas, así como la asociación con MS.(4)
- GENOTIPADO DE HαT MEDIANTE PCR DIGITAL.
Las PCR (reacción en cadena de la polimerasa) digital, es una tecnología de última generación que se emplea para la cuantificación de ADN de forma reproducible y sensible, y se recomienda para analizar la variación del número de copias. Para llevar a cabo las mediciones, la muestra se divide en particiones, de forma que en cada una de ellas haya cero, una o varias moléculas diana presentes en cada reacción individual. Cada partición es analizada después de un ciclado de PCR en punto final para detectar la presencia (reacción positiva) o ausencia (reacción negativa) de una señal de fluorescencia. Finalmente, se calcula el número absoluto de moléculas presentes en la muestra, sin que los resultados dependan de una curva estándar, de este modo se reduce el error y se incrementa la precisión.(15) Existen en el mercado dos tipos de PCR digital: “Dropled digital PCR (ddPCR)” y “arraybased PCR”. La diferencia principal entre los dos modelos se debe a la estrategia diseñada para la división de la muestra: mediante la formación de gotas tipo emulsión, o mediante el uso de chips compuestos por micropocillos.(16)
Esta técnica detecta las secuencias α y β en los locus de TPSAB1 y TPSB2, a partir de DNA genómico (gDNA) se puede extraer tanto de sangre periférica como de MO.(6) Existe un KIT comercial para conseguir el DNA a partir de un “swab bucal”(17) y posteriormente proceder al estudio de las variaciones en el número de copias de TPSAB1; sin embargo, puede ocurrir que este método se encuentre limitado por problemas de daños y contaminación de las muestras.
- FENOTIPOS DE HαT.(18)
La expresión clínica de HαT puede ser muy variable, desde sujetos asintomáticos (descrito en el 4% de donantes sanos de población española(6), y 1/3 de los portadores) hasta cuadros de anafilaxia grave.(11)
En una reciente revisión, se ha descrito que los síntomas que con mayor frecuencia presentan los pacientes con HαT incluyen: 1) síntomas neuropsiquiátricos (depresión 59%, alteraciones del sueño 69% y alteraciones de memoria 59-68%); 2) síntomas gastrointestinales (colon irritable 30%-60%, nauseas 51%, y reflujo 49%-77%); 3) síntomas secundarios a la liberación de mediadores mastocitarios (flushing 47%, prurito 69%, urticaria 37%, y anafilaxia 14-28%); 4) hiperlaxitud articular 28%; 5) disfunción del sistema autónomo 34% (hipotensión ortostática, palpitaciones, taquicardia, presincope, síncope), y 6) síntomas constitucionales (dolor crónico, astenia 85%).(18,19)
Algunos de los síntomas descritos, aunque se encuentren con una elevada prevalencia, son difíciles de validar como secundarios a HαT+.(18)
Además, los síntomas de HαT+, en muchas ocasiones se pueden superponer con lo que se producen por activación mastocitaria. En este sentido, hay que tener en cuenta que los fenotipos hasta ahora asociados a HαT+ son muy heterogéneos, y que la mayoría de los casos descritos provienen de centros monográficos en patología mastocitaria y/o síndromes genéticos, por lo que es probable la existencia de sesgos en los datos obtenidos a partir de estas poblaciones.(4)
Sí que ha sido validado que los individuos con HαT+ tienen una mayor prevalencia de reacciones de hipersensibilidad inmediata sistémicas. (18)
4.1 HαT Y ANAFILAXIA
La elevación aguda de triptasa es un biomarcador de anafilaxia. El aumento de los valores de sBT triptasa en un 20 % + 2 ng/ml sobre el valor basal de cada individuo en el periodo comprendido entre 1-4 horas desde el inicio del cuadro agudo, es el criterio para confirmar activación mastocitaria y anafilaxia.(20) Esta fórmula tiene una elevada sensibilidad y es útil para identificar anafilaxia en los individuos con exposición parenteral al alérgeno.(21) Sin embargo, se encuentra limitada en algunas circunstancias como en la población pediátrica con alergia a alimentos, y pacientes con reacciones no IgE mediadas. Además, la variabilidad de los niveles de sBT en cada individuo a lo largo del tiempo no está bien estudiada.(22)
Por otra parte, diferentes estudios han identificado los niveles de sBT como un biomarcador asociado con el aumento en la prevalencia y la gravedad de la anafilaxia tras picaduras de insectos (sobre todo himenópteros),(4) y en alergia alimentaria infantil.(23)
HαT+ es el primer modificador genético hereditario descrito para la anafilaxia, que se asocia con un incremento en el riesgo para reacciones alérgicas graves al veneno de himenóptero con un riesgo relativo=2; así como un incremento del riesgo para la anafilaxia idiopática grave(12) y la anafilaxia grave desencadenada por alimentos en niños.(24)
Se ha estimado una prevalencia de HαT+ ≥8.5% en los pacientes con anafilaxia por veneno de himenóptero (HVA) en los que se ha descartado una patología mastocitaria clonal. Además, HαT+ no parece influir en la frecuencia de sensibilización al veneno de himenóptero, sólo influye en la gravedad de la reacción entre los individuos sensibilizados.(25)
También se ha descrito una mayor prevalencia de HαT+ en la anafilaxia idiopática (17%)(25) y en la anafilaxia desencadenada por alimentos en población infantil.(24)
4.2 HαT Y PATOLOGÍA MASTOCITARIA.
HαT+ está asociado a la presencia de patología mastocitaria clonal, encontrándose entre el 12-21% de los pacientes con síndrome de activación mastocitaria clonal (cSAM) y/o MS, sobre todo con formas no avanzadas de la enfermedad -MS indolentes (MSI) y MS quiescentes-.(11)
Un estudio realizado en población adulta española, ha descrito la prevalencia de HαT+ en el 29% de SAM no clonales (ncSAM) y el 18% de las mastocitosis. Entre los casos con mastocitosis, la detección de HαT+ es significativamente más frecuente (21% vs. 10%) entre los casos con la mutación D816V de KIT restringida a mastocitos vs. los casos con la mutación D816V de KIT multilineal. Además, entre los pacientes con mastocitosis, su cuadro clínico debutó con anafilaxia en el 76% vs. 65% (p = 0.18) de los HαT+ vs. HαT–.(6)
El mecanismo subyacente entre ambas entidades no es conocido, pero se ha planteado la hipótesis de que pudiera ser secundario al efecto de mitógeno del exceso de triptasa sobre el microambiente de la médula ósea (MO), promoviendo la selección de los clones aberrantes de MC.(11)
Los pacientes HαT+ con MS tienen una frecuencia de HVA del 30%, y una prevalencia de anafilaxia grave con síntomas cardiovasculares del 35.5%.(11) Así mismo, en población española se ha descrito que los pacientes con mastocitosis tienen una frecuencia de anafilaxia por alimentos del 15% en HαT+ vs. 5% en HαT– (p=0.013).(6)
Si se valora la patología mastocitaria global (clonal y no clonal), se ha descrito que la frecuencia de anafilaxia aumenta progresivamente desde los casos que no tienen alelos para α-triptasa (58%), los que tienen 1 alelo (65%), quienes tienen 2 alelos (72%) y aquellos que tienen ≥3 copias de este alelo (84%). En este estudio, también se describe, que si se analizan sólo los casos HαT+, la frecuencia de anafilaxia es mayor en los que tienen ≥3 copias vs. 2 copias de α-triptasa (82% vs. 61%; p=.017).(6)
- MANEJO DE HAT
Actualmente, para controlar los síntomas que habitualmente presentan los pacientes HAT+, se recomienda emplear el tratamiento antimediador que se suele emplear en la patología mastocitaria.(4) Se ha empleado con éxito el Omalizumab en casos plurisintomáticos complejos, consiguiendo la resolución de la urticaria y de la anafilaxia en el 94% de los pacientes.(13)
MTPS9579A, es un anticuerpo monoclonal humanizado IgG4 anti-triptasa, que inhibe selectivamente la actividad de la triptasa al disociar los tetrámeros activos en monómeros. Este anticuerpo anti-triptasa reduce la gravedad de la anafilaxia IgE mediada en un modelo murino humanizado.(26) Además, se ha desarrollado un modelo farmacocinético/farmacodinámico (PK/PD) para elegir la dosis de anticuerpo anti-triptasa MTPS9579A en pacientes con asma moderado-grave que permite predecir el nivel de exposición y de supresión de la triptasa en los tejidos diana.(27)
Otros estudios, describen anticuerpos monoclonales dirigidos a los receptores inhibidores de los mastocitos, como Siglec-8 (sialic acid-binding immunoglobulin-like lectin 8) [Lirentelimab/AK002], Siglec-6 [AK006], y CD200R [LY3454738].(28)
La eficacia y seguridad de Lirentelimab ha sido evaluado en ensayos clínicos con diferentes patologías en las que participan los mastocitos (incluyendo MSI, urticaria crónica espontanea, dermografismo sintomático, y conjuntivitis alérgica); en todos ellos los pacientes refieren mejoría se los síntomas.(28)
LY3454738 no demostró superioridad frente a placebo en un estudio fase II de urticaria crónica, por lo que esta línea de investigación se ha cerrado. Sin embargo, está pendiente de publicarse sus resultados en un estudio fase I en dermatitis atópica.(28)
AK006 inhibe la anafilaxia IgE mediada en modelos murinos.(28)
Todos estos anticuerpos, podrían abrir líneas de tratamiento de la anafilaxia y de los síntomas de HαT+ en el futuro.
FIGURAS.
Figura. Genotipos de triptasa codificados por TPSAB1 y TPSB2. (18)
BIBLIOGRAFÍA
- Glenner GG, Cohen LA. Histochemical demonstration of a species-specific trypsin-like enzyme in mast cells. Nature. 19 de marzo de 1960;185:846-7.
- Schwartz LB, Lewis RA, Seldin D, Austen KF. Acid hydrolases and tryptase from secretory granules of dispersed human lung mast cells. J Immunol Baltim Md 1950. abril de 1981;126(4):1290-4.
- Castells MC, Irani AM, Schwartz LB. Evaluation of human peripheral blood leukocytes for mast cell tryptase. J Immunol Baltim Md 1950. 1 de abril de 1987;138(7):2184-9.
- Wu R, Lyons JJ. Hereditary Alpha-Tryptasemia: a Commonly Inherited Modifier of Anaphylaxis. Curr Allergy Asthma Rep. 10 de mayo de 2021;21(5):33.
- Lyons JJ. Inherited and acquired determinants of serum tryptase levels in humans. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. octubre de 2021;127(4):420-6.
- González-de-Olano D, Navarro-Navarro P, Muñoz-González JI, Sánchez-Muñoz L, Henriques A, de-Andrés-Martín A, et al. Clinical impact of the TPSAB1 genotype in mast cell diseases: A REMA study in a cohort of 959 individuals. Allergy. 11 de octubre de 2023;
- Khoury P, Lyons JJ. Mast cell activation in the context of elevated basal serum tryptase: genetics and presentations. Curr Allergy Asthma Rep. 27 de noviembre de 2019;19(12):55.
- Zhang H, Zeng X, He S. Evaluation on potential contributions of protease activated receptors related mediators in allergic inflammation. Mediators Inflamm. 2014;2014:829068.
- Caughey GH. Tryptase genetics and anaphylaxis. J Allergy Clin Immunol. junio de 2006;117(6):1411-4.
- Lyons JJ, Yu X, Hughes JD, Le QT, Jamil A, Bai Y, et al. Elevated basal serum tryptase identifies a multisystem disorder associated with increased TPSAB1 copy number. Nat Genet. diciembre de 2016;48(12):1564-9.
- Kačar M, Rijavec M, Šelb J, Korošec P. Clonal mast cell disorders and hereditary α-tryptasemia as risk factors for anaphylaxis. Clin Exp Allergy. 2023;53(4):392-404.
- Robey RC, Wilcock A, Bonin H, Beaman G, Myers B, Grattan C, et al. Hereditary Alpha-Tryptasemia: UK Prevalence and Variability in Disease Expression. J Allergy Clin Immunol Pract. 2020;8(10):3549-56.
- Giannetti MP, Weller E, Bormans C, Novak P, Hamilton MJ, Castells M. Hereditary alpha-tryptasemia in 101 patients with mast cell activation-related symptomatology including anaphylaxis. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. junio de 2021;126(6):655-60.
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 27 de noviembre de 2020;21(23):9030.
- dPCR para principiantes [Internet]. Disponible en: https://www.qiagen.com/es-es/applications/digital-pcr/beginners
- Pérez-Barrios, C. PCR digital en la monitorización de la respuesta al tratamiento del paciente oncológico. En: Aplicaciones clínicas de lsa técnicas actuales de Biología Molecular. Cont. Lab. Clin.; 2018. p. 52-8.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, et al. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol. 2019;144(4):883-96.
- Lyons JJ. Hereditary Alpha Tryptasemia: Genotyping and Associated Clinical Features. Immunol Allergy Clin North Am. 2018;38(3):483-95.
- von Bubnoff D, Koch D, Stocker H, Ludwig RJ, Wortmann F, von Bubnoff N. The Clinical Features of Hereditary Alpha-Tryptasemia—Implications for Interdisciplinary Practice. Dtsch Arzteblatt Int. 22 de marzo de 2024;(Forthcoming):arztebl.m2023.0287.
- Valent P, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, Butterfield JH, et al. Why the 20% + 2 Tryptase Formula Is a Diagnostic Gold Standard for Severe Systemic Mast Cell Activation and Mast Cell Activation Syndrome. Int Arch Allergy Immunol. 2019;180(1):44-51.
- Baretto RL, Beck S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: A perioperative perspective. Allergy. diciembre de 2017;72(12):2031-4.
- Mateja A, Wang Q, Chovanec J, Kim J, Wilson KJ, Schwartz LB, et al. Defining baseline variability of serum tryptase levels improves accuracy in identifying anaphylaxis. J Allergy Clin Immunol. marzo de 2022;149(3):1010-1017.e10.
- Sahiner UM, Yavuz ST, Buyuktiryaki B, Cavkaytar O, Yilmaz EA, Tuncer A, et al. Serum basal tryptase may be a good marker for predicting the risk of anaphylaxis in children with food allergy. Allergy. febrero de 2014;69(2):265-8.
- Lang A, Kubala S, Grieco MC, Mateja A, Pongracic J, Liu Y, et al. Severe food allergy reactions are associated with α-tryptase. J Allergy Clin Immunol. octubre de 2023;152(4):933-9.
- Lyons JJ, Chovanec J, O’Connell MP, Liu Y, Šelb J, Zanotti R, et al. Heritable risk for severe anaphylaxis associated with increased α-tryptase-encoding germline copy number at TPSAB1. J Allergy Clin Immunol. febrero de 2021;147(2):622-32.
- Maun HR, Jackman JK, Choy DF, Loyet KM, Staton TL, Jia G, et al. An Allosteric Anti-tryptase Antibody for the Treatment of Mast Cell-Mediated Severe Asthma. Cell. 3 de octubre de 2019;179(2):417-431.e19.
- Rymut SM, Henderson LM, Poon V, Staton TL, Cai F, Sukumaran S, et al. A mechanistic PK/PD model to enable dose selection of the potent anti-tryptase antibody (MTPS9579A) in patients with moderate-to-severe asthma. Clin Transl Sci. abril de 2023;16(4):694-703.
- Metz M, Kolkhir P, Altrichter S, Siebenhaar F, Levi-Schaffer F, Youngblood BA, et al. Mast cell silencing: A novel therapeutic approach for urticaria and other mast cell-mediated diseases. Allergy. enero de 2024;79(1):37-51.
Administración de inmunoterapia subcutánea: mucho mas que una inyección subcutánea: La Enfermera de Alergología te lo explica.
Cuantas veces nos han preguntado “¿Eres la enfermera/o de alergia? ¿La que pone las vacunas no?”.
 Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
El paciente acude a nuestra consulta con la incertidumbre ante lo desconocido, a pesar de haber recibido información el día de la prescripción del tratamiento por el alergólogo/a, sobre el procedimiento y sus riesgos.
Es importante que nos presentemos, que conozca nuestro nombre, y le indiquemos que somos las enfermeras/os responsables de la administración del tratamiento. Es muy importante que el paciente se encuentre tranquilo.
Así mismo, procederemos a resolver aquellas dudas que pueda tener acerca de la inmunoterapia (IT) específica de alergia, además de informarle que este tratamiento consta de dos fases:
- Fase de Inicio: Donde se irá incrementando de forma periódica la dosis/concentración de la vacuna, comprobando la tolerancia a la misma. En esta fase deberemos preguntar siempre si han tolerado bien la dosis anterior y si han sufrido algún tipo de reacción en su domicilio (reacción tardía).
- Fase de Mantenimiento: Donde se habrá alcanzado la dosis terapéutica que se continuará administrando de forma periódica.
Respecto a la administración del tratamiento, como responsables de su administración, deberemos comprobar siempre: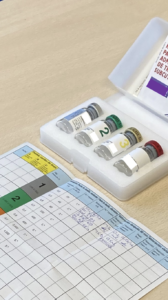
- Que la vacuna que nos entrega el paciente es la que ha prescrito su alergólogo.
- Que corresponde con el nombre del paciente, ya que están identificadas nominalmente.
- La fecha de caducidad.
- Que se ha conservado en nevera (entre 2 y 8 ºC teniendo especial cuidado que no se congele, pues se inactiva y pierde sus propiedades terapéuticas), y trasportada en bolsa térmica .
Procederemos a realizar la valoración de enfermería, recogiendo información sobre su estado de salud:
- Si se encuentra sin síntomas de infección activa (fiebre).
- Si no está presente un episodio agudo (crisis) de su enfermedad alérgica: asma mal controlada o rinoconjuntivitis alérgica.
- Si se encuentra en tratamiento con antibióticos. En cuyo caso se postpondrá la administración hasta su recuperación .
- Si ha recibido en los últimos 7-10 dias vacunas de virus atenuados (gripe, covid…). Como norma general es el intervalo de tiempo mínimo que se recomienda para la administración de la IT específica de alergia.
A continuación procederemos a la toma de constantes vitales (tensión arterial, frecuencia cardiaca, saturación de oxígeno y temperatura) y a la administración del tratamiento de IT específica de alergia siguiendo el protocolo establecido.
Los pacientes deben saber:
- Que tras la administración de su vacuna deben estar un tiempo mínimo de 30 minutos en nuestro servicio de alergia (o Centro de Salud), con el fin de comprobar que ha tolerado bien su IT, y que no han aparecido reacciones adversas inmediatas (por su seguridad).
- Que las reacciones adversas más frecuentes que pueden aparecer son: Enrojecimiento y picor (prurito) en la zona de administración.
- La presencia de síntomas como tos, falta de aire (disnea), aparición de eritemas (zonas enrojecidas en la piel), picor en palma de manos o síntomas exacerbados de su alergia deben ser comunicados inmediatamente para actuar de manera precoz.
- Que la IT especifica de alergia NO sustituye al tratamiento pautado por su alergólogo/a en referencia a antihistamínicos, colirios, inhaladores o nebulizadores nasales. Es un tratamiento conjunto.
- Que no deben practicar ejercicio físico intenso, coger peso, ir a saunas/piscinas cubiertas (ambientes húmedos y cargados) al menos en las 4 primeras horas de la administración de ITSC.
- Que deben informar de la aparición de reacciones tardías (en su domicilio): Aumento de eritema en zona de administración (recomendaremos que se realicen fotos), o cualquier otro síntoma que hayan podido experimentar.
- Que los beneficios de la IT específica de alergia se consiguen a medio/largo plazo y por ello, es necesario que los pacientes acudan a las revisiones programadas por sus alergólogos/as, para valorar la evolución con del tratamiento y si es oportuno continuar con el tratamiento o suspenderlo.
Alergia alimentaria en Halloween
Cada vez arraiga más en nuestro país la tradición americana de celebrar Halloween la noche del 31 de octubre. Niños y adultos con terroríficos y divertidos disfraces celebran fiestas, se divierten con la típica frase de “truco o trato” recogiendo en sus calabazas chuches, chocolatinas y otros dulces de casa en casa. Pero para las personas alérgicas a alimentos la diversión se puede transformar en una desagradable sorpresa. Y es que cualquier golosina puede contener algunos de los alérgenos más comunes como son leche, frutos secos, huevo entre otros.
Una persona con alergia a un alimento puede presentar picores, ronchas o habones en la piel, hinchazón de labios, vómitos, diarrea, síntomas respiratorios entre otros; pero en los casos más graves pueden experimentar una reacción anafiláctica. Una anafilaxia es el tipo de reacción alérgica más grave y que puede ser incluso mortal.
Desde el Comité de Alergia de Alimentos compartimos una serie de consejos para que todos, alérgicos y no alérgicos disfruten de la noche de Halloween:
1.-Organiza actividades alternativas que no incluyan comida, como juegos, concursos de disfraces, regala juguetes, lápices de colores u otros objetos divertidos y seguros.
2.- Si haces una fiesta en casa pregunta si entre los invitados hay algún alérgico a alimentos y consúltale qué alimentos, golosinas y bebidas son seguros para esa persona. Y si quieres que disfrute aun más de tu fiesta, dedícale unos minutos para que te explique qué hacer y cómo usar la medicación en caso de una reacción.
3.- Utiliza recipientes separados y bien identificados para evitar contaminación cruzada.
4.- Evita el látex: muchas personas alérgicas a alimentos también lo son al látex: evita el látex para preparar los alimentos, en el maquillaje y en los regalitos.
5- Asegúrate de que el niño o adulto con alergia alimentaria salga siempre acompañado de un adulto capaz de identificar y tratar una reacción alérgica.
6.- Comprueba antes de salir que llevas toda la medicación de rescate que tu alergólogo/a te ha recomendado, especialmente la adrenalina autoinyectable.
7.- Lee cuidadosamente el etiquetado de todos los productos antes de comerlos y deshecha aquellos sin etiqueta o si no está clara. Para evitar cestas sin chuches enel niño alérgico: lleva tus propias golosinas seguras.
8.- En el colegio: siempre deberían estar informados los profesores y monitores sobre la presencia de una alergia a alimentos y cómo actuar en caso de reacción. Si van a realizar alguna actividad relacionada con Halloween pide información,sugiere que sea libre de comidas, pero si es inevitable lleva tus propios productosbien identificados para evitar reacciones.
9.- Evitar disfraces con máscaras o maquillajes que oculten la cara: puedendificultar la identificación de una reacción alérgica, y empeorar los síntomas de asma o dificultad para respirar.
10.- En caso de reacción, mantén la calma y recuerda las instrucciones que tu especialista en Alergología te dio: pedir ayuda si estás solo, administrar la medicación, acudir al centro sanitario más próximo o llamar al 112. Si no sabes en ese momento cómo usar el autoinyector de adrenalina, tranquilo/a, llama al 112 explica la situación y te ayudarán.
Si quieres más información sobre la alergia a alimentos, los consejos de evitación y el uso de la adrenalina autoinyectable te recomendamos el curso gratuito de la SEAIC: Soyexpertoenalergia
FELIZ HALLOWEEN
Congreso Centroamericano y del Caribe de Alergia
Estimados socios,
Desde la Sociedad Cubana de Alergia, Asma e Inmunología Clínica, nos informan de la celebración del XIV Congreso centroamericano y del Caribe de Alergia, que se celebrará conjuntamente con el V Encuentro Iberoamericano y IX Congreso nacional de Alergología, Cuba Alergia 2017. Tendrá lugar del 4 al 7 de octubre de 2017 en el Palacio de Convenciones de La Habana.
![]() Información Congreso Cuba 2017 (2923 descargas )
Información Congreso Cuba 2017 (2923 descargas )
» Más información: web del XIV Congreso centroamericano y del Caribe de Alergia.
Darío Antolín
Presidente de la Junta Directiva de la SEAIC
Comisión de acreditación UAG
| Coordinador: | Juan Carlos Miralles López |
| Comité de Asma: | Julio Delgado Romero Alicia Habernau Mena Irina Bobolea Virginia Bellido Linares María Eugenia Mújica García |
| Comisión de Formación Continuada: | Eduardo Fernández Ibáñez |
| Comisión de Calidad Asistencial: | María Isabel Alvarado |
Premios videos SoyExpertoEnAlergia
Tras difíciles deliberaciones del jurado, se han fallado los premios del I Concurso de Videos Soy Experto en Alergia. Los ganadores son:
CATEGORIA 1: EL DIA A DIA CON ALERGIA ALERGIA Y ASMA
1º PREMIO
“Un llamado a la prevención”.
2º PREMIO
“Mi Compañero de vida”.
3º PREMIO
“Que es la Alergia “
CATEGORIA 2: LA COCINA Y LA ALERGIA A ALIMENTOS
1º PREMIO
“Desayunando veneno”.
2º PREMIO
“Crecer con Alergias Alimentarias”.
3º PREMIO
“Si quieres cambiar el mundo…¡Empieza hoy!”.
En breve, se difundirán los videos ganadores. ¡Enhorabuena a todos los participantes!
LA ATOPIA COMO PRIMERA MANIFESTACIÓN DE ERROR INNATO DE LA INMUNIDAD
Es importante iniciar por definir que es un error innato de la inmunidad (EII) siendo un grupo de enfermedades causadas por defectos genéticos que generan disfunción inmunitaria. 1
La alergia como manifestación inicial de EII se reporta con una media de hasta el 8 % de los pacientes con diagnostico de errores innatos de la inmunidad variando entre 5 al 25 % y se ha observado un retraso en el diagnóstico de hasta 6 a 10 años, las característica que comparte estos pacientes suele ser la triada típica de la alergia presentado eosinofilia+ igE elevada + Eccemas, por ende estos paciente suele debutar con diagnósticos en un mayor porcentaje de dermatitis atópica en un 21.38% asociadose principalmente inmunodeficiencias combinadas como síndrome de hiper Ig-E (HIES), la deficiencia de DOCK 8, el síndrome de Omenn (OS) y el síndrome de Wiskott-Aldrich (WAS). Sin embargo, otros estudios reportan una mayor asocia con alergia a nivel de vías respiratorias relacionándose con el asma bronquial hasta el 46.90%, en cuanto a rinitis alérgica su frecuencia fue de 8.2 %, presentándose una mayor asociación en paciente con deficiencias en anticuerpos, y en especial con inmunodeficiencia selectiva de IgA. Las alergias alimentarias se presentaron en menor prevalencia (0.10%) y se asocia con inmunodeficiencia selectiva de IgA. 2
A nivel fisiopatológica se ha observado que en los pacientes con función normal de sistema inmune, las infecciones activan los linfocitos Th1 y Th2, estas infecciones también favorecen al desarrollo de los linfocitos Tregs, que ayudan mantener el equilibrio entre los Th1 y Th2, y prevenir sus efectos nocivos, en el caso de los pacientes con errores innatos de la inmunidad se observa que las linfocitos Tregs pueden estar ausentes o deficientes a nivel funcional, desencadenando una mayor activación de Th1 y Th2 y por ende una susceptibilidad mayor a desarrollar alergias o cuadros de autoinmunidad.
La asociación entre alergia y error innato de la inmunidad puede representar una alteración del equilibrio complejo dentro del sistema inmunológico de células efectoras y reguladoras, quizás también contribuida por diferencias en la colonización microbiana y patrones de infección, muy probablemente debido a falla de tolerancia, defectos de señalización del receptor de células T, falla de producción de interferón-gamma contrarregulador y exceso de producción de citocinas como IL-13 que interfieren con los péptidos antimicrobianos de la piel , así como alteración de la barrera cutánea. 3
- El aumento de la permeabilidad de la piel por el eccema lleva a que las células presentadoras de antígenos (CPA) cutáneas se expongan a mayores cantidades de antígenos ambientales habitualmente inocuos. Esto conduce a la sensibilización y la producción de citocinas proinflamatorias asociadas a Th2, lo que inicia en consecuencia la respuesta alérgica 4,5. La alteración de la barrera cutánea junto con la regulación negativa de los péptidos antimicrobianos protectores aumenta el riesgo de infección 5.
- Las citocinas proinflamatorias de tipo 2 también regulan negativamente la filagrina, una proteína importante para la integridad de la barrera cutánea, lo que aumenta la permeabilidad de la piel, permitiendo una mayor exposición a los antígenos y por ende una mayor respuesta inflamatoria 4,5
Los defectos a nivel de barrera cutánea y el desarrollo de dermatitis atópica en estos pacientes se relación con alteraciones en la barrera, defectos genéticos como la producción de filagrina, spink 5, anomalías del citoesqueleto; señalización aberrante del TCR; señalización interrumpida de citocinas; disminución de la diversidad del repertorio de células T y trastornos del desarrollo tímico; mecanismos efectores de células innatas; y trastornos metabólicos.
Es importante tener en cuenta que los pacientes con deficiencia selectiva de IgA pueden desarrollar un gran espectro de enfermedades desde ser asintomáticos a debutar con infecciones recurrente, enfermedades de autoinmunidad y enfermedades alérgicas hasta en el 13- 84%, en el caso de la patología alérgicas estas sueles ir disminuyendo con la edad. 6
Existen características con las cuales podemos sospechar de una probable asociación con errores innatos de la inmunidad :
- Biomarcadores elevados de TH2 (eosinofilia: 1500, IgE elevado: >2000 en los 3 primeros meses)
- Antecedentes familiares: Consanguinidad, antecedentes muertes tempranas familia.
- Cutáneo: disposición de eccemas en regiones poco frecuentes de neonatos, eritrodermia, ictositosis al nacimiento, alteraciones a nivel de dentición, alteraciones a nivel de tejido conectivo (hiperlaxitud). DOCK8: Eccemas severos predominantemente a nivel de zona de flexuras, facial, zona del pañal, liquenificaciones, infecciones virales.
- Hematológico: Pancitopenia, anemia hemolítica, purpura
- Infecciosos: Infecciones severas y recurrentes especialmente por CMV, EBV, HHV6 y patógenos de la familia Herspesviridae, candidiasis mucocutánea, eccema herpeticum.
- Gastroenterológico: falla de medro, diarreas y vómitos persistente
- Endocrinopatías: Diabetes tipo I, Tiroiditis autoinmune.
- Respiratorio: presencia de bronquiectasias, mala respuesta a tratamiento.
Sin embargo es importante tener en consideración que los niveles de IgE no siempre se correlacionan con cuadros de errores innatos de inmunidad, por lo que se debe descartar otras patologías que puedan elevar tanto IgE como eosinófilos entre estas tenemos diferentes causas como:
INFECCIOSAS
- Parásitos: Helmintos como Toxocaria, Strongyloides, Trichuris, Áscaris.
- Bacterias: Mycobacterium Tuberculosis
- Virales: CMV, VEB, VIH
ONCOLÓGICAS
- Gammapatías o síndromes paraneoplásicos
- Linfoma cutáneo de células T
- Enfermedad de Sézary
- Linfoma de Hodking y no Hodking
ENFERMEDADES INFLAMATORIAS
- Granulomatosis eosinofílica con poli angeítis (EGPA)
BIBLIOGRAFIA
1.Tangye, S.G.; Al-Herz, W.; Bousfiha, A.; Cunningham-Rundles, C.; Franco, J.L.; Holland, S.M.; Klein, C.; Morio, T.; Oksenhendler, E.; Picard, C.; et al. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J. Clin. Immunol. 2022, 42, 1473–1507. [CrossRef] [PubMed]
- El-Sayed et al. World Allergy Organization Journal (2022) 15:100657 http://doi.org/10.1016/j.waojou.2022.100657
3.Sokol, K.; Milner, J.D. The overlap between allergy and immunodeficiency. Curr. Opin. Pediatr. 2018, 30, 848–854. [CrossRef] [PubMed]
4.Facheris, P.; Jeffery, J.; Del Duca, E.; Guttman-Yassky, E. The translational revolution in atopic dermatitis: The paradigm shift from pathogenesis to treatment. Cell. Mol. Immunol. 2023, 20, 448–474. [CrossRef] [PubMed]
- Lyons JJ, Milner JD. Primary atopic disorders. J Exp Med 2018; 215:1009–1022. 6. & Nelson RW, Geha RS, McDonald DR. Inborn errors of the immune system associated with atopy. Front Immunol 2022; 13:860821. This article provides a comprehensive overview of atopy in relation to IEIs.
- Boyarchuk, o. (2018). Allergic manifestations of primary immunodeficiency diseases and its . Asian journal of pharmaceutical and clinical research, 1-8.
Videos premiados SoyExpertoEnAlergia
Ya se encuentran disponibles para su visionado los videos premiados en el I Concurso de Videos Soy Experto en Alergia. Recuerda que nuestros cursos on-line gratuitos para pacientes con enfermedades alérgicas siguen disponibles en https://soyexpertoenalergia.es/.
CATEGORIA 1: EL DIA A DIA CON ALERGIA ALERGIA Y ASMA
1º PREMIO
“Un llamado a la Prevención”. Autora: Sandra Patricia Cardona García, Alicante.
2º PREMIO
“Mi Compañero de Vida”. Autora: Julia González Gómez, Sevilla.
3º PREMIO
“Qué es la Alergia”. Autora: Beatriz Muñoz, Alcalá de Henares.
CATEGORIA 2: LA COCINA Y LA ALERGIA A ALIMENTOS
1º PREMIO
“Desayunando Veneno”. Autora: Beatriz Balseiro, Madrid.
2º PREMIO
“Crecer con Alergias Alimentarias”. Autor: Álvaro Cereceda Prieto, Madrid.
3º PREMIO
“Si Quieres Cambiar el Mundo, ¡Empieza Hoy!”. Autor: Emilio Muñoz Aguado, Granada.
¿Puede hacer deporte un asmático?
En general, el ejercicio físico moderado es recomendable en personas asmáticas, aunque siempre bajo un control médico adecuado. En el caso particular del asma inducida por ejercicio debe tenerse en cuenta la necesidad de unas medidas preventivas adecuadas, siguiendo las recomendaciones del médico especialista.
Aerobiología Clínica
El Comité de Aerobiología Clínica estudia los alérgenos ambientales transportados por el aire, fundamentalmente los pólenes y las esporas de hongos. Este comité realiza una labor muy útil tanto para los alergólogos como para los pacientes a través de la Red de Aerobiología. Una red de estaciones con captadores de aire en cada una de las provincias españolas y que, gracias a la labor de los alergólogos y biólogos que leen a diario los recuentos de esporas y hongos retenidos en los captadores, proporciona una información permanentemente actualizada de las densidades de estos aeroalérgenos ambientales.
Actualizado el día 09/01/2025
Jack Pepys Workshop 2013
Apreciados socios:
Adjuntamos información sobre un curso de asma en el lugar de trabajo, organizado por el Dr. Malo, de Canadá. El curso tendrá lugar en Montreal el 17 de mayo de 2013.
Un cordial saludo
Dr. Pedro Ojeda
Secretario de la Junta Directiva de la Sociedad Española de Alergología e Inmunología Clínica
—————————————–
Documento para la descarga:
¿Qué diferencia existe entre alergia e intolerancia a la leche?
Se puede establecer que la alergia es una forma particular de intolerancia. Sin embargo, ambos términos definen reacciones a diferentes componentes de la leche. La alergia a la leche de vaca consiste en una hipersensibilidad a las proteínas que contiene y se manifiesta con erupción cutánea, edema facial e incluso asma. Por otro lado, el término intolerancia se emplea para describir una deficiente asimilación de un carbohidrato, la lactosa, que nada tiene que ver con las proteínas y se manifiesta principalmente con síntomas digestivos (distensión abdominal y diarrea).
La urticaria por el frío afecta principalmente a adultos jóvenes
Con la llegada del frío, la SEAIC alerta sobre el empeoramiento de las alergias comunes en invierno y subraya que:
- La urticaria por frío se intensifica en invierno debido a las bajas temperaturas, provocando desde habones hasta reacciones graves como anafilaxia.
- La rinitis alérgica, el asma y la urticaria por frío son las reacciones alérgicas más afectadas por las bajas temperaturas.
- La contaminación del aire, el uso excesivo de calefacción y la escasa ventilación en los hogares agravan considerablemente las alergias respiratorias durante la temporada invernal.
![]() La urticaria por el frío afecta principalmente a adultos jóvenes (2619 descargas )
La urticaria por el frío afecta principalmente a adultos jóvenes (2619 descargas )
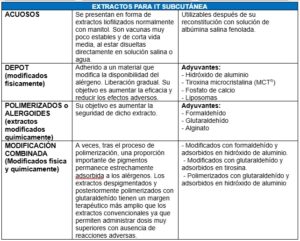
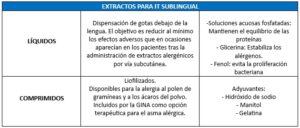
CLASIFICACIÓN DE LA IT SEGÚN SU FORMULACIÓN LA IMPORTANCIA DE LOS EXTRACTOS
La Organización Mundial de la Salud (OMS) define la Inmunoterapia (IT) con alergenos como el único tratamiento que puede alterar el curso natural de la patología alérgica y prevenir el desarrollo del asma en pacientes con rinitis alérgica. Es el único tratamiento dirigido a la causa de la patología, a diferencia de los tratamientos de los síntomas, siendo fundamental que los extractos de las vacunas sean de alta calidad para que sean efectivas.1
Es importante cuando administremos dichos tratamientos tener una noción básica de los tipos de vacunas específicas de alergia. Con este documento tratamos de mostrar una clasificación breve de los tipos de IT especifica de alergia que en este momento se utilizan en su uso clínico en los servicios de alergología de nuestro país.
Los extractos para inmunoterapia subcutánea (ITSC) pueden ser acuosos, depot, polimerizados o modificación combinada. En la inmunoterapia sublingual (ITSL) la composición del extracto alergénico es la misma que en la ITSC, pero se modifica el excipiente. Los excipientes pueden ser líquidos o comprimidos liofilizados.
Se debe seguir las indicaciones realizadas por los laboratorios fabricantes en su forma de administración y las posibles modificaciones de la pauta que realice el clínico en atención a las características específicas de cada paciente.
Bibliografía:
- Abramson M, Puy R and Weiner J Inmunotherapy in Asthma; an update systematic review. Allergy 1999,54, 1022-1041.
XXXIX Congreso SEICAP
Estimados socios
Se adjunta programa preliminar del XXXIX Congreso SEICAP- Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica, así como la VII Jornada de Enfermería, que se celebrará en Alicante del 21 al 23 de Mayo de 2015, por si fuera de vuestro interés. Más información en su web.
Un saludo,
Darío Antolín Amérigo
Secretario de la Junta Directiva de SEAIC