resultados de la búsqueda: asma/cme-jiaci/wp-content/uploads/logos/page/www.asocepa.org
Cataluña
Cataluña
Centros con actividad asistencial pública en Alergología
Barcelona
Althaia Red Asistencial de Manresa
Centro Hospitalario de Manresa
- https://www.althaia.cat/althaia/ca
- Avda. Bases de Manresa, 6-8. 08242 Manresa
- 938732550
Hospital Sant Joan de Déu de Manresa
- https://www.althaia.cat/althaia/ca
- C/ Dr. Joan Soler, 1-3, 08243 Manresa
- 938742112
Hospital Clínic de Barcelona
- http://www.hospitalclinic.org
- C/ Villarroel, 170. 08036 Barcelona
- 932275400
Hospital de Igualada
- http://hospitaligualada.csa.cat
- Avda. Catalunya, 11. 08700 Igualada
- 938075500
Hospital de Terrassa
- http://www.cst.cat
- Ctra. Torrebonica, s/n. 08227 Terrassa
- 937310007
Hospital Dos de Maig
- https://www.csi.cat/hospital-dos-de-maig/
- C/ Dos de Maig, 301. 08025 Barcelona
- 935072700
Hospital General de Granollers
- http://www.fhag.es
- Avda. Frances Ribas, s/n. 08400 Granollers
- 938425000
Hospital General de L'Hospitalet
Hospital Municipal de Badalona
- https://www.bsa.cat/ca/pacients/hospital-municipal-de-badalona
- Via Augusta 9-13. 08911 Badalona
- 934648394
Hospital de Sant Joan Despí Moisès Broggi
- https://www.csi.cat/hospital-sant-joan-despi/
- C/ Jacint Verdaguer, 90. 08970 Sant Joan Despí
- 935531200
Hospital de la Santa Creu i Sant Pau
- http://www.santpau.es/
- C/ Sant Quintí, 89. 08026 Barcelona
- 932919000
Hospital Universitario de Bellvitge
Hospital Universitario Germans Trias i Pujol
- http://www.gencat.cat/ics/germanstrias
- Ctra. de Canyet, s/n. 08916 Badalona
- 934651200
Hospital Universitario General Vall d'Hebron
- https://hospital.vallhebron.com/
- Pg. Vall d'Hebron, 119-129. 08035 Barcelona
- 934893000
Gerona / Girona
Hospital General Universitario Doctor Josep Trueta
- Avda. de Francia, s/n. 17007 Gerona
- 972940200
Lérida / Lleida
Hospital Universitario Santa María
- Avda. del Alcalde Rovira Roure, 44. 25198 Lérida /Lleida
- 973727222
Hospital Universitario Arnau de Vilanova - Lleida
- http://www.icslleida.cat/hospital
- Avda. del Alcalde Rovira Roure, 80. 25198 Lérida / Lleida
- 973248100
Tarragona
Hospital Sant Pau i Santa Tecla
- http://www.xarxatecla.cat/
- Rambla Vella, 14. 43003 Tarragona
- 977259900
Hospital Universitari Sant Joan
- http://www.hospitalsantjoan.cat/
- Av. del Dr. Josep Laporte, 2. 43204 Reus
- 977310300
Hospital de Tortosa Verge de la Cinta
- https://icsebre.cat/web/htvc/
- C/ Esplanetes, 14. 43500 Tortosa
- 977519100
Hospital Universitario de Tarragona Joan XXIII
- https://www.sanidad.gob.es/va/ciudadanos/centros.do?metodo=realizarDetalle&tipo=hospital&numero=430017
- C/ Dr. Mallafré i Guash, 4. 43005 Tarragona
- 977295800
Pius Hospital de Valls
- https://www.piushospital.cat/
- Plaça Sant Francesc, s/n. 43800 Valls
- 977613000
Tarragona
- Ctra. Barcelona, s/n. 43700 Vendrell
- 977257900
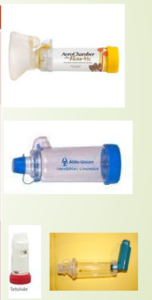
CÁMARAS DE INHALACIÓN
No son dispositivos de inhalación propiamente dichos, pero su utilización está ampliamente recomendada para evitar problemas relacionados con la técnica de los inhaladores de cartucho presurizado. Es un espaciador que separa la boquilla del cartucho presurizado de la boca del paciente. Por este motivo antiguamente se denominaban a estos aparatos “espaciadores” y hoy en día se utilizan ambos nombres de manera indistinta (cámaras de inhalación o cámaras espaciadoras)
Poseen una válvula en su boquilla habitualmente unidireccional que permite la inspiración del aire de la cámara, pero no la espiración dentro de ella.
Su uso enlentece la velocidad de salida del aerosol y evapora el propelente. Las partículas de aerosol pequeñas se mantienen unos segundos en suspensión en espera de ser inhaladas, y las grandes chocan con las paredes de la cámara y quedan retenidas. De esta forma se produce un menor depósito orofaríngeo y se aumenta el depósito pulmonar. El uso de la cámara inhalatoria permite utilizar menor cantidad de fármaco, reduciendo los efectos secundarios, tanto sistémicos como locales y, por eso, se aconseja en caso de disfonía debida al uso de los inhaladores. Además, eliminan la dificultad de coordinar la inspiración con la pulsación del dispositivo.
Se utilizan en el tratamiento de las exacerbaciones de asma (excepto las de riesgo vital), ya que el efecto broncodilatador administrado con cámara de inhalación es equivalente al de un nebulizador y es una alternativa en pacientes con bajo flujo inspiratorio.
Al igual que con los diferentes inhaladores es importante adiestrar al paciente en el uso de la cámara inhalatoria y revisar la técnica periódicamente.
Tipos de cámaras
Existen cámaras de diferentes tamaños desde 140-800 ml. Son universales, permitiendo su conexión a los diferentes modelos de inhaladores de cartucho presurizado, son portátiles y se pueden utilizar con mascarillas faciales. 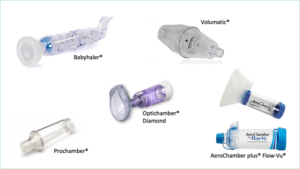
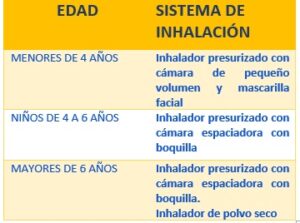
Recomendaciones de uso de dispositivos de inhalación según edad
Elaboración propia (Modificado de GEMA- Inhaladores,2018)
Limpieza y mantenimiento de las cámaras
- Son de uso personal
- Limpiar semanalmente, si se usa a diario, con agua templada y detergente suave o neutro, separando las piezas y por inmersión.
- Dejar secar las piezas al aire, sin frotar para no aumentar la carga electrostática que contribuye a que las partículas del aerosol se peguen en las paredes de la cámara.
- Hay que reemplazarlas cuando tengan fisuras.
Ventajas e inconvenientes
Errores en el uso de la cámara inhalatoria
-No agitar el inhalador de cartucho presurizado
-No adaptar bien el inhalador a la cámara.
-No adaptar bien la cámara al rostro o no usar la cámara adecuada a la edad del paciente.
-No realizar un adecuado mantenimiento y limpieza cámara
-No enjuagar la boca
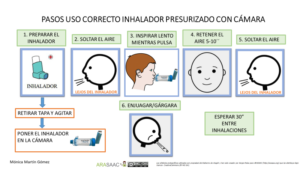
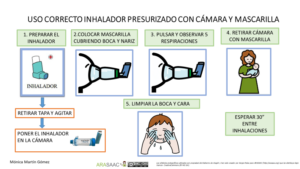
Técnica de uso de la cámara inhalatoria
1- Destapar el inhalador y agitarlo
2- Mantener el inhalador en vertical con la boquilla en la parte inferior.
3-Vaciar los pulmones lentamente, hasta donde sea cómodo
4- Colocar la boquilla, entre los labios y los dientes, evitando que la lengua obstruya la salida de la boquilla. Comenzar a inhalar lentamente, a través de la boca y al mismo tiempo presionar el dispositivo para activar una dosis. (también se puede presionar primero y a continuación inhalar lenta y profundamente)
5-Mantener una inhalación lenta y profunda, a través de la boca, hasta que los pulmones estén llenos de aire.
6-Aguantar la respiración entre 5 y 10 segundos y soplar lentamente (En caso de agudización se puede inhalar y exhalar en cinco ocasiones sin retirar la cámara de la boca y también en menores de 5 años)
7-Cerrar el dispositivo de inhalación
8- Hacer gárgaras y enjuagar la boca al terminar
Imagen 1.- Técnica de uso de cámara de inhalación con presurizado (adultos y niños > 5 años)
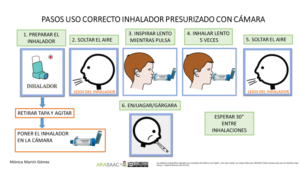
Imagen 2.- Técnica de uso de cámara de inhalación con presurizados niños < 5años
Imagen 3.- Técnica de uso de cámara de inhalación con presurizado en lactantes
En el caso de los lactantes y menores de 5 años que no sepan realizar apnea, se usa una cámara de inhalación con mascarilla del tamaño adecuado para que se adapte a la cara del niño/a.
1.-Se prepara el inhalador previamente: se agita, se retira la tapa y se conecta a la cámara.
2.-Se pulsa solo 1 vez mientras se mantiene la mascarilla en la cara del niño/a cubriendo boca y nariz.
3.-Debe respirar al menos 5 veces (observaremos la válvula de la cámara).
4.-Esperar 30 segundos para nueva inhalación si precisa.
5.- Limpiar la cara y boca del niño/a.
BIBLIOGRAFÍA
- Romero de Ávila G, Gonzálvez Rey J, Mascarós Balaguer E. AGAMFEC. Las 4 reglas de la terapia inhalada [Internet]. Disponible en: https://www.agamfec.com/wp/wp-content/uploads/2015/05/Las4reglasdelaterapiainhalada.pdf
- Plaza V Giner J, Bustamente V, Viejo A, Flor X, Maiz M, et al. GEMA inhaladores. Terapia inhalada: fundamentos, dispositivos y aplicaciones prácticas [internet]. Luzan 5, editor. Madrid; 2018.Disponible en: www.gemasma.com
- Giner J, Plaza V, López-Viña A, Rodrigo G, Neffen H, Casan, P. Consenso SEPAR-ALAT sobre terapia inhalada [internet]. Arch Bronconeumol. 49. 2-14; 2013. Disponible en: http://www.archbronconeumol.org/ el 09/07/2013.
- Gema 5.4. Guía española para el manejo del asma [Internet]. Madrid: Ed. Luzán5; 2024. Disponible en: http://.www.gemasma.com.
- Gema educadores. Manual del educador en asma [Internet]. Madrid: Ed. Luzán5; 2010. Disponible en: http://.www.gemasma.com.
Castilla y León
Castilla y León
Centros con actividad asistencial pública en Alergología
Ávila
Complejo Asistencial de Ávila
Hospital Nuestra Señora de Sonsoles
- http://www.saludcastillayleon.es/CAAvila
- Avda. Juan Carlos I, s/n. 05071 Ávila
- 920358000
Burgos
Complejo Asistencial de Burgos
Hospital Universitario de Burgos
- http://www.saludcastillayleon.es/CABurgos
- Avda. Islas Baleares, 96. 09006 Burgos
- 947281800
León
Complejo Asistencial de León
Hospital Universitario de Burgos
- http://www.saludcastillayleon.es/CHLeon
- Avda. de la Nava, s/n. 24071 León
- 987237400
Hospital El Bierzo
- http://www.saludcastillayleon.es/HBierzoPonferrada
- C/ Médicos sin Fronteras, 7. 24411 Ponferrada
- 987455200
Palencia
Complejo Asistencial de Palencia
Hospital Río Carrión
- http://www.saludcastillayleon.es/CAPalencia
- C/ Donantes de Sangre, 5. 34005 Palencia
- 979167000
Salamanca
Complejo Asistencial de Salamanca
Hospital Clínico Universitario de Salamanca
- http://www.saludcastillayleon.es/CASalamanca
- Paseo de San Vicente, 58-182. 37007 Salamanca
- 923291634
Segovia
Complejo Asistencial de Segovia
Hospital General de Segovia
- http://www.saludcastillayleon.es/CASegovia
- Miguel Servet, s/n. 40002 Segovia
- 921419149
Soria
Complejo Asistencial de Soria
Hospital Santa Bárbara
- http://www.saludcastillayleon.es/CASoria/
- Paseo de Santa Bárbara, s/n. 42005 Soria
- 975234300
Valladolid
Hospital Universitario Río Hortega
- http://www.saludcastillayleon.es/HRHortega
- C/ Dulzaina, 2. 47012 Valladolid
- 983420400
Zamora
Complejo Asistencial de Zamora
Hospital Virgen de la Concha
- http://www.saludcastillayleon.es/CAZamora
- Avda. de Requejo, 35. 49022 Zamora
- 980548200
Vacuna COVID-19 y población de riesgo
Cuando una enfermedad infectocontagiosa presenta una amplia capacidad de diseminarse, el aumento de la morbi-mortalidad puede llegar a ser considerable. Los efectos adversos relacionados con la administración de una vacuna en desarrollo durante dicho período pueden ser aceptados por un balance riesgo-beneficio (efecto secundario vs efecto protector) para alcanzar el control de la enfermedad y su diseminación. Una vez que el uso de la vacuna lleva al descenso dramático de la enfermedad, los efectos adversos parecen presentarse de forma más frecuente, disminuyendo la aceptación de la misma por parte de la población.
Pandemia y enfermedad
El coronavirus es un patógeno importante que afecta tanto a los humanos como a los animales. A finales del año 2019 se identificó una nueva cepa de coronavirus como causa de brotes de Neumonía en Wuhan (China), con una rápida diseminación, resultando en una epidemia a lo largo de todo el país. En febrero de 2020 la Organización Mundial de la Salud (OMS) asignó a la enfermedad el término de infección por la COVID-19, caracterizado por el desarrollo de un síndrome respiratorio agudo grave por coronavirus 2 (SARS-CoV-2) con alta tasa de morbimortalidad. Como ha ocurrido con otras pandemias en la historia de la humanidad se comenzó a desarrollar una vacuna para erradicar dicha enfermedad.
Las vacunas utilizadas durante la fase de emergencia (la pandemia COVID-19) fueron sometidas de manera rigurosa a los mismos pasos preclínicos y clínicos estandarizados que requiere todo ensayo clínico.
El punto clave en la creación de la vacuna contra el SARS-CoV-2 fue la proteína de superficie denominada Spike, dicho antígeno mayoritario se encuentra en la superficie del virus y es la que se une al receptor de la enzima de angiotensina tipo 2 (ECA-2) localizado en la superficie celular del huésped, favoreciendo la infección y replicación del mismo. Los anticuerpos generados durante las fases de la respuesta inmune, van dirigidos contra dicha proteína evitando así la unión de la proteína spike a la célula huésped (ECA-2) y la fusión de las partículas víricas a la membrana celular, favoreciendo de esta manera la neutralización del virus.
En la actualidad se dispone de dos tipos de vacunas: 2 vacunas de ARNm (Ácido Ribonucleico mensajero), la vacuna de COVID-19 Moderna y PFizer-BioNTech y por otro lado, la vacuna de proteína recombinante monovalente ( Novavax COVID-19).
Según las recomendaciones de la CDC (Centro de Control y Prevención de Enfermedades) y la OMS (Noviembre 2023), establecen vacunar a todos los individuos a partir de los seis meses de edad con las vacunas disponibles del período actual 2023-2024 (nuevas variantes del virus). En particular, individuos mayores de 65 años, inmunocomprometidos y con diferentes comorbilidades asociadas, debido a que dicha población presenta mayor riesgo de desarrollar enfermedad grave al contraer la COVID-19.
El uso de las vacunas actuales se ha asociado a una reducción sustancial de desarrollar enfermedad grave, hospitalizaciones y muerte por dicha causa, incluso en el contexto de otras variantes que evaden parcialmente la respuesta inmune del huésped. Sin embargo, no todos los individuos presentan el mismo riesgo de presentar la enfermedad de forma grave.
Las personas con inmunodepresión moderada o grave tienen un mayor riesgo de padecer la COVID-19 (grave), independientemente de la edad, aunque el riesgo aumenta aún más con la edad. En la categoría de las personas con inmunodepresión moderada o grave se incluye a las personas con patología oncológica activa o trasplante de órgano, así como las personas con inmunodeficiencias que reciben tratamiento inmunosupresor. También se incluye a las personas con infección por el VIH con un recuento de linfocitos CD4+ inferior a 200 células/µl, con indicios de infección oportunista y que no reciben tratamiento contra el VIH o con una carga viral detectable.
Entre el grupo de riesgo alto, también cabe mencionar, pacientes con tratamiento inmunosupresor en curso para tumores sólidos o neoplasias hematológicas (leucemia, linfoma o mieloma), o que lo hayan recibido en los 12 meses siguientes a la finalización de dicho tratamiento. También individuos receptores de trasplantes, es decir, personas que hayan recibido un trasplante de víscera u órgano sólido y que estén tomando un tratamiento inmunosupresor; personas que hayan recibido un trasplante de células madre (si no han pasado dos años desde el trasplante o si están tomando fármacos inmunosupresores). Inmunodeficiencias como por ejemplo, inmunodeficiencia primaria grave y diálisis crónica también se incluye en este grupo de riesgo.
La hoja de ruta de la OMS sobre el uso de las vacunas contra el SARS-CoV-2 en el contexto de la variante ómicron y de la elevada inmunidad de la población incluida en la lista OMS de uso en emergencias, apuntan a que la eficacia real y la inmunogenicidad de las vacunas son menores en las personas inmunodeprimidas que en las inmunocompetentes, sin embargo, los nuevos datos probatorios indican que administrar una dosis adicional como parte de una pauta de primovacunación ampliada, refuerza la respuesta inmunitaria de algunas personas inmunodeprimidas. Las pruebas científicas publicadas, indican que en el caso de las personas inmunodeprimidas es necesario ampliar la pauta de primovacunación, por ejemplo, administrándoles más dosis que a las personas inmunocompetentes. El momento más adecuado para administrar la dosis adicional varía en función del entorno epidemiológico y del alcance y el momento del tratamiento inmunosupresor, y debe analizarse con el médico tratante.
Las adultas y adolescentes embarazadas conforman un grupo de prioridad alta, debido a los posibles efectos adversos de la COVID-19 para la madre, el feto y el bebé. Aunque el riesgo de enfermedad grave en la época de la variante ómicron es menor que en la época anterior, las mujeres embarazadas que han contraído la COVID-19 siguen teniendo un mayor riesgo de morbilidad materna grave o de desenlace adverso del embarazo, como el parto prematuro. También pueden presentar un mayor riesgo de mortalidad materna.
La cobertura de vacunación en los trabajadores de la salud ha aumentado considerablemente en todo el mundo. Se debe dar prioridad a los trabajadores de la salud, en particular a los que se encuentran en primera línea, que tienen contacto directo con los pacientes y a los empleados de los centros de atención de salud.
Al igual que en la población general, la tasa de letalidad por la COVID-19 entre los trabajadores de la salud aumenta con la edad. Todos los trabajadores de la salud que son adultos mayores o tienen comorbilidades o enfermedades que ocasionan inmunodepresión de moderada a grave deben permanecer en la categoría de prioridad alta para vacunarse.
Como ocurre con todos los productos farmacológicos, medicamentos, tratamientos de inmunoterapia, fármacos biológicos y vacunas, existe el riesgo de presentar reacciones adversas o reacciones de hipersensibilidad. En relación con la vacuna contra el SARS-CoV-2, una contraindicación absoluta de administrar la misma, sería haber presentado una reacción alérgica grave (anafilaxia) o presentar alergia con algún componente de la misma de forma previa.
Dado que las vacunas disponibles actualmente confieren una reducción escasa y de corta duración de los síntomas de la enfermedad y tienen poco efecto en disminuir la transmisión en dicha población, se deben adoptar otras medidas de control de infecciones para disminuir la transmisión y proteger a los pacientes vulnerables, como el uso de la mascarilla y el lavado de manos, entre otras medidas de protección. Así como asegurar que los familiares y contactos estrechos de dichos pacientes, estén vacunados para la enfermedad.
Beneficios de la vacunación
Protección contra el desarrollo de la enfermedad grave y muerte:
Se ha demostrado de forma amplia en los estudios observacionales basado en poblaciones, una reducción de las tasas de hospitalización y muerte en paciente vacunados en comparación con los no vacunados, así como una reducción del desarrollo de enfermedad grave (COVID-19). Además, una dosis de refuerzo genera el llamado efecto “booster”, protegiendo aún más el individuo y manteniendo la respuesta inmune a lo largo del tiempo.
En el estudio de Link-Gelles R. (Updates on COVID-19 Vaccine Effectiveness during Omicron), se observó un riesgo de muerte mayor a causa de la COVID-19, de 7.3 a 16.3 veces más en pacientes no vacunados en comparación con los sujetos vacunados, con variaciones dependiendo de la cepa de SARS CoV-2 involucrada. En un estudio en Estados Unidos (Lin DY, Gu Y, Xu Y, et al. Association of Primary and Booster Vaccination and Prior Infection With SARS-CoV-2. Infection and Severe COVID-19 Outcomes, JAMA 2022), el riesgo de enfermedad grave en pacientes vacunados y muerte por la COVID-19 fue de 1.5 y 0.3 respectivamente. De igual forma se ha visto baja prevalencia de eventos cardiovasculares (infarto agudo de miocardio, ictus, etc) en pacientes vacunados con infección aguda por la COVID-19.
En conclusión, las vacunas contra el SARS CoV-2 son esenciales en la prevención y transmisión de la enfermedad, sobre todo en la población de riesgo anteriormente nombrada. Mantener la respuesta inmune a lo largo del tiempo mediante los planes de vacunación, favorece una mejor evolución clínica de la enfermedad, haciéndola más corta, menos sintomática y con menos posibilidad de diseminar el virus.
BIBLIOGRAFÍA
- World Health Organization. Draft landscape of COVID-19 candidate vaccines. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines (Noviembre 2023).
- Link-Gelles R. Updates on COVID-19 Vaccine Effectiveness during Omicron. ACIP meeting,September-2022.https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2022-09-01/04-COVID-Link-Gelles-508.pdf (Accessed on September 02, 2022).
- Lin DY, Gu Y, Xu Y, et al. Association of Primary and Booster Vaccination and Prior Infection With SARS-CoV-2 Infection and Severe COVID-19 Outcomes. JAMA 2022; 328:1415.
- Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020; 579:270.
- Krammer F. SARS-CoV-2 vaccines in development. Nature 2020; 586:516.
- Edwards KM, Dupont WD, Westrich MK, et al. A randomized controlled trial of cold-adapted and inactivated vaccines for the prevention of influenza A disease. J Infect Dis 1994; 169:68.
- Ohmit SE, Victor JC, Rotthoff JR, et al. Prevention of antigenically drifted influenza by inactivated and live attenuated vaccines. N Engl J Med 2006; 355:2513.
- Graepel KW, Kochhar S, Clayton EW, Edwards KE. Balancing Expediency and Scientific Rigor in Severe Acute Respiratory Syndrome Coronavirus 2 Vaccine Development. J Infect Dis 2020; 222:180.
- Graham BS. Rapid COVID-19 vaccine development. Science 2020; 368:945.
- Halstead SB, Katzelnick L. COVID-19 Vaccines: Should We Fear ADE? J Infect Dis 2020; 222:1946.
- Brighton Collaboration. Accelerated Assessment of the Risk of Disease Enhancement with COVID-19 Vaccines, March 2020. https://brightoncollaboration.us/brighton-collaboration-cepi-covid-19-web-conference/ (Accessed on October 20, 2020).
- SPIKEVAX (COVID-19 Vaccine, mRNA) Suspension for injection, for intramuscular use; 2023-2024 Formula. US Food and Drug Administration (FDA) approved product information. Revised September 11, 2023. https://www.fda.gov/media/155675/download?attachment (Accessed on September 11, 2023).
- FACT SHEET FOR HEALTHCARE PROVIDERS ADMINISTERING VACCINE: EMERGENCY USE AUTHORIZATION OF MODERNA COVID-19 VACCINE (2023-2024 FORMULA), FOR INDIVIDUALS 6 MONTHS THROUGH 11 YEARS OF AGE https://www.fda.gov/media/167208/download?attachment (Accessed on September 11, 2023).
- COMIRNATY (COVID-19 Vaccine, mRNA) suspension for injection, for intramuscular use; 2023-2024 Formula. US Food and Drug Administration (FDA) approved product information. Revised September 11, 2023. https://www.fda.gov/media/151707/download?attachment (Accessed on September 11, 2023).
- FACT SHEET FOR HEALTHCARE PROVIDERS ADMINISTERING VACCINE: EMERGENCY USE AUTHORIZATION OF PFIZER-BIONTECH COVID-19 VACCINE (2023-2024 FORMULA), FOR 6 MONTHS THROUGH 11 YEARS OF AGE https://www.fda.gov/media/167211/download?attachment (Accessed on September 11, 2023).
- Recommendation for the 2023-2024 Formula of COVID-19 vaccines in the US. https://www.fda.gov/media/169591/download?attachment (Accessed on September 11, 2023).
- Emergency Use Authorization (EUA) of the Novavax COVID-19 vaccine, adjuvanted (2023-2024 Formula), for individuals 12 years of age and older https://www.fda.gov/media/159897/download?attachment (Accessed on October 04, 2023).
- US Food and Drug Administration. Emergency use authorization (EUA) of the Janssen COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19). https://www.fda.gov/media/146304/download (Accessed on March 27, 2023).
- Middleton’s ALLERGY Principles and Practice. Volume 2. Eighth edition. Chapter 85. page 1384-1385.
DESMITIFICANDO EL ASMA – ASMA: mitos y verdades
Échale un vistazo al documento que elaboró nuestro Comité conjuntamente con el Comité de Comunicación para el Día del Asma 2021
El documento nos da conceptos y explicaciones fáciles y comprensibles para aquellas preguntas frecuentes y ciertos mitos que las personas con asma suelen tener.
El documento consta de 11 mitos. ¡Descúbrelos todos, no te quedes con la duda!
 Cargando...
Cargando...
Anafilaxia a carne de cocodrilo: reactividad cruzada por parvalbuminas
La carne de cocodrilo se consume fundamentalmente en el sur de Estados Unidos y en Australia, en España se considera una carne exótica pero con frecuencia la podemos encontrar en restaurantes y mercados. La carne de cocodrilo tiene una buena proporción proteína/grasa, motivo por el que es una fuente muy saludable de alimento. La prevalencia de alergia a este alimento es desconocida, sin embargo en el último año se han publicado dos artículos de alergia a este reptil en dos niños que nunca lo habían consumido previamente.
Severe anaphylaxis due to crocodile-meat allergy exhibiting wide cross-reactivity with fish allergens. Haroun-Díaz E, Blanca-López N, et al. J Allergy Clin Immunol Pract. 2017 Sep 8. pii: S2213-2198(17)30540-8. doi: 10.1016/j.jaip.2017.07.015 Anaphylactic Reactions to Novel Foods: Case Report of a Child With Severe Crocodile Meat Allergy. Ballardini N, Nopp A ,et al. Pediatrics. 2017;139(4): e2016140.
En el primero de los artículos se trataba de un niño de 9 años, con antecedentes de dermatitis atópica y alergia a pescado blanco diagnosticado a los 19 meses de edad. A los pocos minutos de la ingesta de un trozo de hamburguesa de carne de cocodrilo comienza a presentar prurito oral intenso, eritema perioral, habones generalizados y disnea. Acudieron a urgencias donde se le trata con adrenalina, antihistamínico y corticoide con resolución completa del cuadro en 6 horas. En el segundo artículo se trataba de un niño de 13 años, con antecedentes personales de alergia a aves de corral (pollo y pavo) diagnosticado a los 5 años de edad. De manera inmediata a la ingesta de un trozo de carne de cocodrilo el niño presenta prurito oral y faríngeo, habones en cara, conjuntivitis, angioedema palpebral y dificultad respiratoria con opresión torácica. En el domicilio se le administra adrenalina intramuscular y b2-agonistas inhalados acudiendo a urgencias donde no se evidencia broncoespasmo pero si disnea intensa, con resolución del cuadro en 4 horas sin reaparición de la sintomatología. El estudio alergológico realizado confirmó en ambos casos la alergia a la carne de cocodrilo. En el primer caso, el niño es diagnosticado mediante prueba cutánea: prick positivo con extracto de carne cruda (10x7mm) y con extracto de carne cocinada (6x6mm). Se realizó prick-prick con alimento fresco con resultado positivo con carne cruda (12×12 mm) y con carne cocinada (6×6 mm) y una IgE específica a parvalbúmina de pescado positiva (rGad C1: 24.6 KU/L).
En el segundo caso, el niño es diagnosticado mediante determinación de IgE específica a carne de cocodrilo (6 KUA/L) y mediante test de activación de basófilos. En ámbos pacientes se descartó alergia a otros componentes de la carne de cocodrilo mediante administración controlada (mezcla de ajo, cebolla, arroz, patata y especias) en el primer caso, y mediante estudio de DNA y de proteínas de pollo o pavo en el segundo caso. Para tratar de demostrar la proteína causante de la reacción alérgica en el primer artículo se realiza un IgE Immunoblotting con el suero del paciente obteniéndose una banda de entre 10-14 KDa en el extracto realizado con carne cruda de cocodrilo. Mediante SDS-.PAGE se determina que se trata de una banda de 11 KDa que tras ser analizada mediante proteómica se detectan en esa banda péptidos que contienen la misma secuencia que otros péptidos de otras parvalbúminas (rana, aves, peces y caimán). Al realizar un IgE immunoblotting con el suero del paciente y extractos de merluza y bacalao se obtiene también una banda de entre 10-14 KDa. Este mismo perfil de inmunoglobulina se detecta en este extracto con antisuero de conejo frente a la parvalbúmina de sardina, revelando que es la parvalbúmina el origen de la banda descrita. Se realiza un SDS-PAGE inmunoblotting inhibición utilizando carne cruda de cocodrilo en la fase sólida, observándose una inhibición completa cuando se incuba con extracto de carne cruda de cocodrilo, con extracto de carne cocinada de cocodrilo, así como con extractos de merluza y bacalao.
En el segundo artículo se realiza un IgE immunoblotting con el suero del paciente y extracto de carne cruda de cocodrilo obteniéndose una banda de entre 18-50 KDa; un IgE immunoblotting con carne cocinada de cocodrilo obteniéndose una única banda de 14 KDa y un IgE immunoblotting con carne de pollo obteniéndose 3 bandas: 14 KDa, 19-22 KDa y de 30 KDa. La preincubación con el extracto de cocodrilo no inhibió completamente la unión de la IgE a los alérgenos del pollo, y si se inhibió completamente cuando se preincubó con extracto de pollo. Finalmente, dado que la carne de pollo se consume preferiblemente cocinada se realizó un immunoblotting con un extracto de carne de pollo cocinado observándose que la IgE del suero reconocía una única banda de 14 KDa. Se confirmó que la banda de 14 KDa era una parvalbúmina al emplear un anticuerpo antiparvalbúmina. La secuencia de aminoácidos reveló un 94% de homología entre la parvalbúmina de cocodrilo y la de pollo. En el primer artículo descrito se demuestra la reactividad cruzada entre parvalbúmina de pescados y de carne de cocodrilo, mientras que en el segundo artículo se demuestra la reactividad cruzada entre carne de pollo y la parvalbúmina de la carne de cocodrilo. El primer paciente tolera bien la ingesta de carne de aves y el segundo niño toleraba la ingesta de pescados. Las parvalbúminas son proteínas ácidas de bajo peso molecular ligadoras de calcio, presentes en animales vertebrados. Resisten tanto la digestión enzimática como la exposición al calor, por lo que producen reacciones incluso con el alimento cocinado.
Las parvalbúminas son las responsables de la reactividad cruzada entre especies de pescado, siendo mayor en las especies taxonómicamente más cercanas (como la merluza y el bacalao que pertenecen al orden Gadiformes o entre el lenguado, gallo, rodaballo del orden Pleuronectiformes). Se ha descrito reactividad cruzada entre parvalbúminas de pescado y de rana y entre pescado y carne de pollo.
Nunca antes se había descrito la reactividad cruzada con carne de cocodrilo. En el primer niño que había presentado reacciones alérgicas con varios pescados, la presencia de IgE específica a parvalbúmina y la inhibición completa sugiere que la parvalbumina de pescado es el alérgeno responsable de la sensibilización primaria. En el segundo caso los autores concluyen que no es posible determinar si la sensibilización primaria fue por la carne de pollo o por la de pavo, pero que debido a que la alfa-parvalbúmina es idéntica en ambas carnes deben ser especies muy cercanas filogenéticamente.
La importancia de estos hallazgos son de especial interés dado que en ámbos casos los niños presentaron una reacción anafiláctica la primera ocasión que probaban la carne de cocodrilo. El hecho de que ocurrió con pequeña cantidad de carne de cocodrilo pone de relevancia su alto potencial alergénico, no descrito previamente.
La accesibilidad a este tipo de carnes exóticas tanto en restaurantes como en mercados, asociado a la posibilidad de viajes al extranjero donde este tipo de carnes son con frecuencia consumidas, hace que debamos aconsejar a nuestros pacientes alérgicos a pescados y/o carne de aves de corral evitar la toma de carne de cocodrilo (y por ende de otros reptiles) hasta que se confirme su tolerancia en los Servicios de Alergia por un alergólogo.
Autor: Francisco Javier Ruano Perez. Medico Adjunto Servicio de Alergia Hospital Universitario Infanta Leonor
Artículos de interés
Antolín-Amerigo D, Ruiz-León B, Boni E, Alfaya-Arias T, Alvarez-Mon M, Barbarroja-Escudero J, Gonzalez de Olano D, Moreno-Aguilar C, Rodriguez-Rodriguez M, Sánchez-González MJ, Sánchez-Morillas L, Vega-Castro A. Component-resolved diagnosis in hymenoptera allergy. Allergol Immunopathol 2017 Jul 21.
https://www.ncbi.nlm.nih.gov/pubmed/28739022
Alfaya-Arias T, Soriano Gomis V, Soto Mera T, Vega Castro A, Vega Gutierrez JM, Alonso LLamazares A, Antolin Amérigo D, Carballada González FJ, Domínguez Noche C, Gutierrez Fernández D, Marques Amat L, Martínez Aecediano A, Martínez San Ireneo M, Moreno Ancillo A, Puente Crespo Y, Ruiz León B, Sánchez Morillas L. Key Issues in Hymenoptera Venom Allergy: an update. J Investig Allergol Clin Immunol 2017;27(1):19-31.
https://www.ncbi.nlm.nih.gov/pubmed/28211342
Gutiérrez Fernández D, Moreno-Ancillo A, Fernández Meléndez S, et al. Insect Venom Immunotherapy: Analysis of the Safety and Tolerance of 3 Buildup Protocols Frequently Used in Spain. J Investig Allergol Clin Immunol. 2016;26(6):366-373.
https://www.ncbi.nlm.nih.gov/pubmed/27996943
Ruiz B, Serrano P, Moreno C. IgE-Api m 4 Is Useful for Identifying a Particular Phenotype of Bee Venom Allergy. J Investig Allergol Clin Immunol. 2016;26(6):355-361.
https://www.ncbi.nlm.nih.gov/pubmed/27996941
Armisén M, Guspi R, Alfaya T, et al. Cross-Sectional Validation of a Quality of Life Questionnaire in Spanish for Patients Allergic to Hymenoptera Venom. J Investig Allergol Clin Immunol. 2015;25(3):176-82.
https://www.ncbi.nlm.nih.gov/pubmed/26182683
Alfaya T, Vega A, Domínguez-Noche C, Ruiz B, Marqués L, Sánchez-Morillas L. Longitudinal Validation of the Spanish Version of the Health-Related Quality of Life Questionnaire for Hymenoptera Venom Allergy (HRQLHA). J Investig Allergol Clin Immunol. 2015;25(6):426-30.
https://www.ncbi.nlm.nih.gov/pubmed/26817139
Ruiz B, Serrano P, Verdú M, Moreno C. Sensitization to Api m 1, Api m 2, and Api m 4: association with safety of bee venom immunotherapy. Ann Allergy Asthma Immunol. 2015 Feb 27;114(4):350–2.
http://www.ncbi.nlm.nih.gov/pubmed/25736542
Armisén M, Guspi R, Alfaya T, Cruz S, Fernández S, Domínguez-Noche C, Alonso A, Gaspar D, Marqués L, Vega A. Cross-Sectional Validation of a Quality of Life Questionnaire in Spanish for Patients Allergic to Hymenoptera Venom. J Investig Allergol Clin Immunol. 2015 Jan;25(3):176–82.
http://www.ncbi.nlm.nih.gov/pubmed/26182683
Köhler J, Blank S, Müller S, Bantleon F, Frick M, Huss-Marp J, et al. Component resolution reveals additional major allergens in patients with honeybee venom allergy. J Allergy Clin Immunol. 2014 May;133:1383–9.
http://www.ncbi.nlm.nih.gov/pubmed/24440283
Golden DB. Advances in diagnosis and management of insect sting allergy. Ann Allergy Asthma Immunol. 2013;111:84-89.
http://www.ncbi.nlm.nih.gov/pubmed/23886224
Rueff F, Przybilla B, Bilo MB, et al. Predictors of side effects during the buildup phase of venom immunotherapy for Hymenoptera venom allergy: the importance of baseline serum tryptase. J Allergy Clin Immunol. 2010;126(1):105-11 e5.
http://www.ncbi.nlm.nih.gov/pubmed/20542320
Ruëff F, Przybilla B, Biló MB, et al. Predictors of severe systemic anaphylactic reactions in patients with Hymenoptera venom allergy: importance of baseline serum tryptase-a study of the European Academy of Allergology and Clinical Immunology Interest Group on Insect Venom Hypersensitivity. J Allergy Clin Immunol. 2009;124(5):1047-54.
http://www.ncbi.nlm.nih.gov/pubmed/19895993
Marques L, Vega A, Munoz E, Moreno-Ancillo A. Epidemiologic observations on Hymenoptera allergy in Spain: the Alergologica-2005 study. J Investig Allergol Clin Immunol. 2009;19 Suppl 2:51-55.
http://www.ncbi.nlm.nih.gov/pubmed/19530419
Bilo BM, Rueff F, Mosbech H, Bonifazi F, Oude-Elberink JN. Diagnosis of Hymenoptera venom allergy. Allergy. 2005;60(11):1339-1349.
http://www.ncbi.nlm.nih.gov/pubmed/16197464
Bonifazi F, Jutel M, Biló BM, Birnbaum J, Muller U. Prevention and treatment of hymenoptera venom allergy: guidelines for clinical practice. Allergy. 2005;60:1459-70.
http://www.ncbi.nlm.nih.gov/pubmed/16266376
Monsalve RI, Vega A, Marques L, et al. Component-resolved diagnosis of vespid venom-allergic individuals: phospholipases and antigen 5s are necessary to identify Vespula or Polistes sensitization. Allergy. 67(4):528-536.
Los inesperados riesgos del control del asma en niños.
El asma es una condición médica crónica muy común en niños y es especialmente susceptible a los cambios provocados por el COVID-19. Actualmente se dispone de poca información sobre el impacto que la pandemia COVID-19 puede tener en el control y manejo de los niños y jóvenes con asma bronquial.
El siguiente artículo “Oreskovic N, Bernard T, Aryee E, Kuhlthau K, Perrin J. The Unexpected Risks of COVID-19 on Asthma Control in Children. J Allergy Clin Immunol Pract.2020;8(8):2489-2491” revisa las influencias que han podido ser importantes o afectar en el control del asma en niños durante la pandemia de COVID-19 debido a los cambios sociales que estamos viviendo. Estos suponen cambios en el entorno, en la práctica clínica médica diaria y su gestión, y en el uso de medicación de esta enfermedad, cambios que tendrán repercusión a largo plazo en los resultados de control del asma. Además, desde nuestro Comité de Alergia Infantil se realizó una encuesta entre los especialistas para conocer cómo ha afectado la pandemia al manejo del asma pediátrico en España, que ha sido publicada en Sanchez-Garcia S, Ruiz-Hornillos J, Escudero C. Pediatric Asthma Management during the COVID-19 pandemic: Results of a national survey. Ped All Immunol Pulm. 2020 Dec; 33(4):199-203. https://doi.org/10.1089/ped.2020.1250
Los pacientes con asma tienen especial vulnerabilidad a los cambios provocados en el contexto de la pandemia COVID-19, con muchas vías y factores de riesgo compartidos, incluyendo la calidad del aire, el ambiente interior, la actividad física, el control del peso, la gestión de la medicación y la prestación de atención sanitaria.
El lugar donde los niños pasan mayor cantidad de tiempo, que ahora es en los interiores, los hábitos diarios (patrón de asistencia a clases), de viaje o transportes, y la actividad física que realizan, afectan al asma.
Además, ha habido cambios en la disponibilidad, la prestación y la utilización de la atención sanitaria que tienen importantes implicaciones para el asma y otras enfermedades crónicas que requieren atención médica continuada. Se han limitado las visitas a la consulta para el control del asma, tanto en atención primaria como especializada (Neumología y Alergología) y se han limitado las visitas a urgencias. Todo ello ha favorecido el formato de visita telefónica o videoconferencia. Estos cambios han ofreciendo nuevas oportunidades gracias a la denominada “telesalud”, que deberán ser valoradas y aprovechadas.
En cuanto a las visitas a Urgencias, se observó una importante disminución en la atención relacionada con el asma y el comienzo de la pandemia, que atiende seguramente el temor de las familias al contagio y/o las recomendaciones sanitarias del momento. Todo esto condujo además, a que la realización de las pruebas tempranas para un mejor control de la enfermedad, como las pruebas de función pulmonar, se viera afectada.
La COVID-19 también ha influido probablemente en la adherencia de los pacientes a los medicamentos controladores del asma. Los padres de los niños con asma pueden tener un mayor control y ser más vigilantes para que los niños tomen su medicación con regularidad y que una mayor adherencia a la medicación mejore el control del asma o, por el contrario, que otros dejen su medicación ante el temor de los posibles efectos de los corticoides, tanto orales como inhalados, en la infección por coronavirus.
Todos estos factores han podido influir de diferente manera en función del lugar en el que residiese el niño, de la situación socioeconómica de la familia, de las limitaciones para realizar actividad física al aire libre a causa de las restricciones particulares de cada zona, etc. En este sentido, los niños de familias de entornos urbanos con menores ingresos tienen un acceso más limitado a espacios seguros para la actividad física, tienen domicilios en los que la exposición a alérgenos/contaminantes de interior (hongos, roedores, cucarachas y el humo del tabaco, entre otros) es mayor, y pueden convivir además con adultos con menor posibilidad de teletrabajar y más expuestos a la infección por coronavirus.
Estos cambios en el entorno, en la práctica médica y en la gestión del tratamiento, tendrán probablemente un gran impacto en el asma infantil que tendremos que vigilar para evaluar su impacto final a medio y largo plazo.
Margarita Tomás Pérez. Médico Adjunto Alergología Hospital General Universitario La Paz. Madrid. Comité de Alergia Infantil SEAIC.
Comunidad Valenciana
Comunidad valenciana
Centros con actividad asistencial pública en Alergología
Alicante
Hospital de Alcoy "Virgen del los Lirios"
- http://www.a14.san.gva.es
- Polígono Caramanxell, s/n. 03804 Alcoy
- 965537400
Hospital de Orihuela "Vega Baja"
- http://www.dep21.san.gva.es
- Ctra. Orihuela-Almoradí, s/n (Ptda.S.Bart) 03314 Orihuela
- 965877500
Hospital de Villajoyosa "Marina Baixa"
- Sitio web no disponible
- Avda. Alcalde En Jaume Botella Mayor, 7. 03570 Villajoyosa
- 966859800
Hospital de Denia "Marina Salud"
- http://www.marinasalud.es
- Partida Beniadlá, s/n. 03700 Denia
- 966429000
Hospital del Vinalopó
- http://www.vinaloposalud.com
- Tónico Sansano Mora, 14. 03293 Elche
- 966 67 98 00
Hospital General de Elda "Virgen de la Salud"
- http://www.elda.san.gva.es
- Ctra. Elda-Sax. Ptda La Torreta. 03600 Elda
- 966989000
Hospital General Universitario de Alicante
- http://www.dep19.san.gva.es
- C/ Pintor Baeza, 12. 03010 Alicante
- 965933000
Hospital General Universitario de Elche
- http://www.dep20.san.gva.es
- C/ Camino de la Almazara, 11. 03203 Elche
- 966616900
Hospital de Torrevieja
- http://www.torrevieja-salud.com
- Ctra. CV-95 Torrevieja-S.Miguel de Salinas.Ptda Ceñuela. 03186 Torrevieja
- 965721313
Castellón
Hospital de La Plana
- http://www.laplana.san.gva.es
- Ctra. Villarreal-Borriana, km 0,5. 12540 Villarreal
- 964357600
Hospital Universitario General de Castellón
- http://www.castello.san.gva.es/
- Avda. Benicasim, s/n. 12004 Castellón de la Plana
- 964726500
Valencia
Consorcio Hospital General Universitario de Valencia
- http://chguv.san.gva.es
- Avda. tres Cruces, s/n. 46014 Valencia
- 961972000
Hospital Arnau de Vilanova – Valencia
- Sitio web no disponible
- C/ San Clemente, 12. 46015 Valencia
- 963868501
Hospital Clínico Universitario de Valencia
- Sitio web no disponible
- Avda. Blasco Ibáñez, 17. 46010 Valencia
- 963862600
Hospital La Ribera de Alzira
- http://www.hospital-ribera.com
- Ctra. Corbera, km. 1. 46600 Alcira
- 962458100
Hospital Lluís Alcanyís
- http://www.xativaontinyent.san.gva.es
- Crta. Xátiva-Silla, km 2. 46800 Xátiva
- 962289500
Hospital Universitario Doctor Peset
- Sitio web no disponible
- Avda. Gaspar Aguilar, 90. 46117 Valencia
- 961622300
Hospital Universitari i Politècnic La Fe
- http://www.hospital-lafe.com/
- http://www.alergialafe.org/
- Avda. Fernando Abril Martorell, 106. 46026 Valencia
- 961244083
Factores de riesgo para el desarrollo de asma en la edad escolar
Durante los últimos años, el estudio de los factores de riesgo que pueden influir en el desarrollo del asma ha sido un tema candente en esta enfermedad. No obstante, si hacemos una revisión exhaustiva de la literatura, los trabajos publicados hasta el momento sobre este tema en población pediátrica de nuestra área geográfica, son escasos. Es por este motivo, que desde la Unidad de Alergología Pediátrica del Hospital Universitario Vall d’Hebron, decidimos diseñar un estudio caso-control para determinar aquellos factores que podían influir en el desarrollo y la gravedad del asma. El trabajo ha sido recientemente publicado en la revista “Pediatria Catalana” (revista de libre acceso). A continuación expondré brevemente el contenido del artículo:
Los avances médicos durante las últimas décadas han permitido mejorar la clasificación etiopatogénica y el manejo clínico del asma. Pero a pesar de esto, su incidencia ha seguido en aumento, sobre todo en los países industrializados y en vías de desarrollo, convirtiéndose en un desafío médico mundial. Es obvio que un incremento de prevalencia en poblaciones genéticamente estables ha de ser consecuencia de cambios medioambientales. Por todo ello es necesario conocer aquellos factores que puedan influir en la patogenia de la enfermedad y desarrollar estrategias preventivas. De este modo, el objetivo del estudio presentado fue valorar la influencia de factores de riesgo conocidos del asma y su gravedad en una población pediátrica del área mediterránea, mediante un estudio caso-control.
Se incluyeron 107 pacientes asmáticos de edad media 9 años y predominio masculino [62,6% (n=67)] y 32 controles sanos de edad media 10 años y predominio también masculino [59,3% (n=19)]. El rango de edad fue entre 4 y 14 años en ambos grupos. Respecto a los resultados, destacar que no se encontraron asociaciones estadísticamente significativas entre el género, la edad o la gravedad del asma; pero sí que se objetivó que las edades de entre cinco y seis años fueron las que mostraron un mayor porcentaje de asma persistente.
La comparación de los factores de riesgo de desarrollo de asma con el grupo control mostró como única diferencia estadísticamente significativa el antecedente de sibilantes recurrentes los primeros 3 años de vida (p<0,001). También se objetivó una asociación estadísticamente significativa entre el asma persistente moderada o grave y los antecedentes de sibilantes recurrentes los primeros 3 años de vida (p<0,001), antecedentes de bronquiolitis por Virus Respiratorio Sincitial (VRS) (p<0,05) y antecedentes de criterios del Índice Predictivo de Asma (API) positivos (p<0,001). Estos resultados están en conjunción con otros trabajos publicados recientemente en los que relacionan las bronquiolitis y los sibilantes recurrentes el primer año de vida con estilos de vida modificables, como tener hermanos en edad escolar e ir a la guardería, del mismo modo que la guía Global Initiative for Asthma (GINA) sugiere que un niño con episodios de sibilantes recurrentes, de mayor duración e inducidos por el ejercicio, tienen una mayor probabilidad de tener asma. No obstante, estos datos contrastarían con algunos estudios publicados previamente que habían identificado las infecciones de repetición no específicas en la primera infancia como factor protector del asma.
Otro dato importante a considerar en este estudio es el peor control de la enfermedad en población asmática de 5-7 años, hecho que podría estar relacionado con una mayor repercusión de las infecciones víricas a esta edad. Del mismo modo, la sensibilización a ácaros del polvo y a epitelios se asoció también a un mal control de la enfermedad y la sensibilización a esporas de hongos se asoció a una forma más grave de asma (p<0,05). En conclusión, se debe prestar una especial atención a los niños con asma en edad escolar y antecedentes de bronquiolitis por VRS, sibilantes de repetición los tres primeros años de vida y a aquellos con sensibilización a esporas de hongos, ya que pueden presentar una forma más grave de asma que precise un seguimiento más estrecho y tratamiento más intenso.
Encontrarán el resumen del artículo en tres idiomas (catalán, español e inglés). El artículo original está íntegramente escrito en lengua catalana. Por este motivo y dada la relevancia de los datos que contiene para todos los profesionales especialistas que se dedican al campo de la alergia y el asma pediátricas y, como autora de correspondencia del mismo, he creído oportuno, hacer una traducción del artículo a lengua española para que pueda llegar a un mayor número de profesionales de la salud. Deseo pues que puedan sacar el máximo partido posible a la lectura de este artículo, desarrollado en población escolar del área del mediterránea, y, por tanto, extrapolable a buena parte de nuestro territorio.
Dra. Teresa Garriga Baraut, MD, PhD
Miembro del Comité de Alergia Infantil (CAI) de la Sociedad Española de Alergología e Inmunología Clínica (SEAIC). Facultativa Especialista Adjunta | Servicio de Pediatría/Sección de Alergia Pediátrica, Pneumología Pediátrica y Fibrosis quística/ Unidad de Alergología Pediátrica. Hospital Universitari Vall d’Hebron. Investigadora del grupo de investigación «Crecimiento y Desarrollo» VHIR Vall d’Hebron.
¿Ha influido la Pandemia por Enfermedad de COVID-19 en el sueño de los pacientes pediátricos y adolescentes con asma alérgica?
Sin duda 2020 y 2021 han sido años sin precedentes debido a un hecho inesperado que descolocó por completo la vida de millones de personas: la rápida propagación del coronavirus SARS-CoV-2 por todos los continentes ocasionó la primera gran pandemia del siglo XXI, la cual tuvo un gran impactó social, económico y emocional de manera global en todo el mundo. La enfermedad por coronavirus 2019 (COVID-19), aparte de ocasionar muchos síntomas orgánicos graves como la neumonía bilateral con distrés respiratorio agudo, ha sido también la responsable de muchos síntomas neurológicos y cambios importantes en el sueño. A lo largo de estos intensos dos años, el estrés originado por la incertidumbre constante, el aislamiento social y, en definitiva, los cambios en la rutina diaria, se han acompañado de diversas alteraciones del sueño conocidas como “coronasomnia».
La Pandemia por Enfermedad de COVID-19 ha afectado a toda la población de manera global, con un impacto claramente negativo en la mayoría de los casos. Además, sabemos que hoy en día, la combinación Pandemia por Enfermedad de COVID-19 y asma es un problema vital al que nos enfrentamos tanto los profesionales de la salud como los pacientes y familiares de pacientes con asma alérgica. No obstante, el impacto que la Pandemia por Enfermedad de COVID-19 ha ocasionado en el descanso de los pacientes pediátricos y adolescentes con asma de nuestra área geográfica aún no ha sido estudiado. De aquí que hayamos estimado interesante presentar los datos del estudio realizado en la Unidad de Alergia Pediátrica del Hospital Universitario Vall d’Hebron, cuyo objetivo fue investigar cómo la Pandemia por Enfermedad de COVID-19 influyó en el sueño de pacientes pediátricos y adolescentes con asma alérgica residentes en el área mediterránea. Para lograr este objetivo se realizó un estudio piloto prospectivo que incluyó a pacientes pediátricos y adolescentes con asma alérgica persistente de entre 6 y 18 años.
Todos los participantes del estudio respondieron el Cuestionario BEARS y la Escala de Bruni. El cuestionario de BEARS1-4 es un cuestionario útil para el cribaje de trastornos del sueño en la infancia. Está dividido en cinco áreas principales del sueño, facilitando el cribado de los trastornos del sueño, en población pediátrica y adolescentes de entre 2 y 18 años. Cada área tiene una pregunta para cada grupo de edad. Una respuesta positiva en cualquiera de los aspectos obliga a una investigación más profunda. Las cinco áreas de estudio se detallan a continuación:
B= Problemas para acostarse (“bedtime problems”)
E= Excesiva somnolencia diurna (“excessive daytme sleepiness”)
A= Despertares durante la noche (“awakenings during the night”)
R= Regularidad y duración del sueño (“regularity and duration of sleep”)
S= Ronquidos (“snoring”)
Respecto a la Escala de Bruni5,6 de trastornos del sueño para población pediátrica y adolescente, decir que consta de 26 ítems valorados según una escala tipo Likert. Está diseñada para detectar trastornos del sueño divididos en seis categorías: problemas para iniciar o mantener el sueño, problemas respiratorios, desórdenes del despertar, alteraciones de la transición sueño-vigilia, excesiva somnolencia diurna e hiperhidrosis nocturna. En total, el paciente responde a 26 preguntas y proporciona una respuesta que puntúa del 0 al 4 según la clínica presente. El punto de corte a partir del cual se considera que el paciente puede presentar algún trastorno global del sueño es de 39. A continuación se define cada puntuación:
0=Nunca
1=Ocasionalmente (una o dos veces al mes o menos)
2=Algunas veces (una o dos a la semana)
3=A menudo (de tres a cinco veces a la semana)
4=Siempre (diariamente)
En total se incluyeron 77 pacientes con una edad media de 12 años. La mayoría eran pacientes del sexo femenino (62%, n=48) y veintisiete (35%) habían sido diagnosticados de Enfermedad de COVID-19. Con respecto al Cuestionario de BEARS, el 70% (n=54) de los pacientes tuvo como mínimo una respuesta positiva. Además, casi la mitad de los pacientes tenían problemas a la hora de acostarse [42% (n=32)], seguido de somnolencia diurna excesiva [34% (n=26)]. En cuanto a la Escala de Bruni, 52 de los 77 pacientes incluidos (67%) presentaban una puntuación superior a 39 puntos, hecho que indicaba trastornos del sueño entre la población de estudio. Los trastornos más prevalentes encontrados tras la evaluación utilizando la Escala de Bruni fueron los trastornos respiratorios del sueño [26 de los 77 pacientes estudiados (34%)], seguido de los trastornos de inicio y mantenimiento del sueño (30%, n = 23) y de la somnolencia diurna excesiva (24%, n=18). No se encontraron diferencias estadísticamente significativas entre los pacientes COVID-19 positivos y negativos ni en el cuestionario de BEARS ni en la escala de Bruni.
En conclusión, en este trabajo se encuentra una elevada prevalencia de trastornos del sueño en pacientes asmáticos pediátricos y adolescentes durante la pandemia debida a la Enfermedad de COVID-19. El trastorno más prevalente en esta población de estudio, evaluado mediante la Escala de Bruni, fue el trastorno respiratorio del sueño. Por tanto, es importante proporcionar a los pacientes un control óptimo de las enfermedades respiratorias para mejorar la calidad de su sueño.
La importancia del presente estudio radica en que es el primero que proporciona datos sobre la posible afectación del sueño debida al impacto de la pandemia por COVID-19 en población pediátrica y adolescente con asma alérgica en el área mediterránea. Debido a este hecho, es difícil poder comparar nuestros datos con los realizados por otros autores ya que, si bien sí que hay varios trabajos que evalúan los posibles trastornos del sueño asociados a la pandemia por COVID-19 en población de esta edad, la mayoría de ellos incluyen población sana o con trastornos neuroconductuales del sueño previos, pero sin especificar la posible concomitancia con otras patologías respiratorias asociadas, como el asma alérgica. No obstante, sí que es interesante comentar algunos trabajos que evalúan los posibles trastornos del sueño en población pediátrica y adolescentes, aunque sean poblaciones sin asma.
Ya antes de la pandemia debida a la Enfermedad de COVID-19, habían sido varios los estudios publicados que alertaban que el sueño insuficiente, la mala calidad del sueño, el insomnio, la apnea del sueño y las alteraciones de los horarios de sueño-vigilia eran manifestaciones típicas de morbilidad física y emocional en las pandemias. De este modo, no es de extrañar que los primeros estudios sobre trastornos del sueño asociados a la pandemia por Enfermedad de COVID-19 se publicaran en China, epicentro de esta enfermedad. En los inicios de la pandemia Huang y Zhao7 recopilaron información de una encuesta de 7236 voluntarios e informaron que el 18% de los individuos encuestados presentaban una mala calidad del sueño. Posteriormente, los trastornos del sueño en pacientes con COVID-19 también pasaron a estudiarse en otros países, encontrando una prevalencia mayor de trastornos del sueño que antes de la pandemia en la población general en la mayoría de los estudios. En Italia, en una encuesta realizada a 2291 italianos, el 57,1% de los individuos informó de una mala calidad del sueño relacionada con la ansiedad que les ocasionaba la Enfermedad por COVID-19. Los síntomas más prevalentes fueron pesadillas, astenia y apneas del sueño. Parece que la somnolencia y el trastorno del sueño en la fase REM podrían estar más relacionados con la Enfermedad de COVID-19 en sí misma, mientras que el insomnio estaría más relacionado con el aislamiento social, la ansiedad y otros factores psicosociales.
Uno de los trabajos más relevantes publicados hasta ahora en población pediátrica y adolescente es el de Sharma M. y sus colaboradores8, cuyo objetivo fue realizar una revisión sistemática y un metanálisis para estudiar la prevalencia y el patrón de trastornos del sueño en población pediátrica y adolescente durante la pandemia por COVID-19. Para ello, los autores realizaron una exhaustiva búsqueda bibliográfica en MEDLINE, EMBASE y Web of Science en busca de estudios originales que describieran anomalías del sueño en pacientes de esta edad, con o sin trastornos neuroconductuales preexistentes, durante la pandemia por COVID-19. Los autores analizaron un total de 371 artículos pero finalmente, únicamente incluyeron 16 estudios. De estos, cinco se realizaron en niños/niñas de edad preescolar, dos en pacientes con trastornos neuroconductuales preexistentes y el resto (nueve) en población pediátrica y adolescentes sanos en edad escolar. En esta revisión los autores hallan que la prevalencia combinada de cualquier alteración del sueño en los niños durante la pandemia fue del 54% (IC del 95%: 50-57%). Estos datos, aún siendo elevados, ya que indican que más de la mitad de la población de estudio presentaba algún tipo de trastorno del sueño, serían inferiores a los encontrados en nuestra serie en la que el 70% (n=54) de los pacientes presentaba al menos un ítem positivo en evaluar el Cuestionario BEARS y el 67% (n=52) de los pacientes presentaban puntuaciones superiores a 39 puntos en la Escala de Bruni. Curiosamente, en esta revisión de Sharma, la prevalencia de estos trastornos en los niños de edad preescolar, cuyo grupo no fue evaluado en nuestra población de estudio, fue menor que en los tiempos prepandémicos (RR = 0,87; IC del 95%: 0,58-1,30), aunque estos resultados no fueron estadísticamente significativos. Este dato concuerda con el trabajo publicado por Liu Z. y su equipo9, donde los niños en edad preescolar se comportaron de manera diferente en el contexto del sueño durante la pandemia en comparación con los niños escolares y los adolescentes. Liu Z. y su equipo encuentran que, de manera totalmente inesperada, los niños en edad preescolar confinados parecían tener menos trastornos generales del sueño en comparación con la muestra del 2018 (prepandemia).
En otra revisión reciente publicada por Panda PK. y su equipo10, encontraron que el 34,5% de los pacientes pediátricos y adolescentes estudiados sufrían ansiedad, el 41,7% depresión, el 42,3% irritabilidad y el 30,8% falta de atención debido a la pandemia por la Enfermedad de COVID-19. Además, el 79,4% de los pacientes se vio afectado negativamente por la pandemia y el confinamiento. El 22,5% de la población estudiada tenía un miedo significativo a la Enfermedad de COVID-19, el 35,2% de los pacientes pediátricos y adolescentes tenían aburrimiento y el 21,3% trastornos del sueño. Además, el 52,3% de los cuidadores/padres/madres/representantes legales desarrollaron ansiedad y el 27,4% depresión mientras estaban aislados con sus hijos/hijas. En esta revisión vemos que la prevalencia de trastornos del sueño también fue algo menor que la encontrada en nuestra población de estudio pero, en cualquier caso fue significativa.
Otro dato interesante que cabe considerar es que antes de la pandemia, diferentes estudios publicaban una prevalencia de trastornos del sueño en población pediátrica y adolescente diferente a la actual. De este modo, los datos publicados según grupos de edad oscilaban entre un rango del 25% al 50% en pacientes preescolares, del 6% al 37% en escolares y de entorno el 40% en adolescentes11-14. No obstante, esta prevalencia durante la pandemia se ha visto claramente incrementada15-19 y los datos publicados hasta el momento concuerdan, en la mayoría de los trabajos, con los encontrados en nuestra población de estudio, aunque no sean del todo comparables con nuestra serie ya que la mayoría de trabajos no especifican la inclusión de pacientes con asma.
Sea como sea, lo cierto es que la pandemia por COVID-19 ha dejado las economías devastadas y la gente asustada por sí misma y por sus seres queridos. Con esta situación sin precedentes, es injustificable no dar la debida importancia al sueño, ya que un sueño saludable es sin duda el mejor rejuvenecimiento, y no en vano está asociado a numerosos beneficios, como el bienestar físico y el correcto funcionamiento de nuestro sistema inmunológico. Además, es el principal determinante de la salud mental y emocional, ya que es conocido que un sueño correcto alivia la ansiedad, el estrés y la depresión y puede tener consecuencias diversas en el desarrollo20. Por contra, los trastornos del sueño inducen neuroinflamación, que promueve la alteración de la barrera hematoencefálica y la entrada de antígenos y factores inflamatorios en el cerebro21-26. De este modo, los trastornos del sueño relacionados con la Enfermedad de COVID-19 podrían contribuir a la apertura de la barrera hematoncefálica, actuando así como una puerta para la entrada del virus SARS-CoV-2 en el cerebro y producirse entonces una mayor inflamación en el sistema nervioso central. La deprivación/restricción del sueño, su fragmentación o la apnea del sueño inducen una inflamación sistémica de bajo grado caracterizada por la liberación de varias moléculas, como las citocinas como la interleucina 6, quimiocinas y proteínas de fase aguda, y todos ellos pueden promover cambios en componentes celulares de la barrera hematoncefálica, particularmente en las células endoteliales del cerebro27-30.
En definitiva, se deberían realizar estudios futuros que incluyan el análisis de los patrones del sueño mediante la realización de electroencefalogramas, la evaluación de marcadores de inflamación así como de la función inmunitaria, en relación con los parámetros del sueño. Estos procedimientos podrían ser revolucionarios para un mejor conocimiento de la “coronasomnia”, es decir, para el control de los trastornos del sueño asociados a la pandemia debida a la Enfermedad de COVID-199
Se puede consultar el documento completo en el siguiente enlace: Aquí : Trabajo_Final_Máster_Teresa_Garriga_Baraut.pdf
Teresa Garriga Baraut. Facultativa Especialista Adjunta, Unidad de Alergia Pediátrica. Hospital Universitario Vall d’Hebron. Comité de Alergia Infantil SEAIC.
Referencias Bibliográficas:
- Bastida-Pozuelo MF, Sánchez-Ortuño MM. Preliminary analysis of the concurrent validity of the Spanish translation of the BEARS sleep screening tool for children. J Psychiatr Ment Health Nurs. 2016 Oct;23(8):513-520.
- Owens JA, Dalzell V. Use of the ‘BEARS’ sleep screening tool in a pediatric residents’ continuity clinic: a pilot study. Sleep Med. 2005 Jan;6(1):63-9.
- Pin-Arboledas G. Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP). Anexo: cuestionarios y herramientas. Pediatría Integral. 2010; XIV (9):749-758.
- Ramírez-Vélez R, Huertas-Zamora L, Correa-Bautista JE, Cárdenas- Calderón EG. Confiabilidad y validez del cuestionario de trastornos de sueño BEARS en niños y adolescentes escolares de Bogotá, D.C., Colombia: Estudio FUPRECOL. Retos, número 34, 2018 (2o semestre).
- Bruni O, Ottaviano S, Guidetti V, Romoli M, Innocenzi M, Cortesi F et al. The Sleep Disturbance Scale for Children (SDSC). Construction and validation of an instrument to evaluate sleep disturbances in childhood and adolescence. J Sleep Res. 1996 Dec;5(4):251-61.
- Escala de Alteraciones del Sueño en la Infancia (avpap.org) [www.avpap.org/gtsueno/Bruni.pdf].
- Huang Y, Zhao N. Generalized anxiety disorder, depressive symptoms and sleep quality during COVID-19 outbreak in China: A web-based cross- sectional survey. Psychiatry Res. 2020; 288: 112954.
- Sharma M, Aggarwal S, Madaan P, Saini L, Bhutani M. Impact of COVID- 19 pandemic on sleep in children and adolescents: a systematic review and meta-analysis. Sleep Med. 2021;84:259-267.
- Liu Z, Tang H, Jin Q, Wang G, Yang Z, Chen H et al. J. Sleep of preschoolers during the coronavirus disease 2019 (COVID-19) outbreak. J. Sleep Res. 2021; 30(1):e13142.
- Panda PK, Gupta J, Chowdhury SR, Meena AK, Madaan P, Sharawat IK et al. Psychological and behavioral impact of lockdown and quarantine measures for COVID-19 pandemic on children, adolescents and caregivers: a systematic review and meta-analysis. J Trop Pediatr. 2021;67(1):fmaa122.
- Blader JC, Koplewicz HS, Abikoff H, Foley C. Sleep problems of elementary school children. A community survey. Arch Pediatr Adolesc Med. 1997;151(5): 473e80.
- Owens JA, Spirito A, McGuinn M, Nobile C. Sleep habits and sleep disturbance in elementary school-aged children. J Dev Behav Pediatr. 2000; 21(1): 27e36.
- Pagel JF, Forister N, Kwiatkowki C. Adolescent sleep disturbance and school performance: the confounding variable of socioeconomics. J Clin Sleep Med. 2007; 15;3(1):19e23.
- Vignau J, Bailly D, Duhamel A, Vervaecke P, Beuscart R, Collinet C. Epidemiologic study of sleep quality and troubles in French secondary school adolescents. J Adolesc Health. 1997; 21(5):343e50.
- Altena E, Baglioni C, Espie CA, Ellis J, Gavriloff D, Holzinger B et al. Dealing with sleep problems during home confinement due to the COVID- 19 outbreak: Practical recommendations from a task force of the European CBT-I Academy. J. Sleep Res. 2020;29:e13052.
- Wang J, Gong Y, Chen Z, Wu J, Feng J, Yan S et al. Sleep disturbances among Chinese residents during the Coronavirus Disease 2019 outbreak and associated factors. Sleep Med. 2020; 74:199-203.
- Gruber R, Gauthier-Gagne G, Voutou D, Somerville G, Saha S, Boursier J. Pre-pandemic sleep behavior and adolescents’ stress during Covid-19: a prospective longitudinal study. Child Adolesc Psychiatry Ment Health. 2021; 30:15(1):43.
- Zreik G, Asraf K, Haimov I, Tikotzky L. Maternal perceptions of sleep problems among children and mothers during the coronavirus disease 2019 (COVID-19) pandemic in Israel. J. Sleep Res. 2021; 30(1):e13201.
- Cerasuolo M, Malloggi S, Conte F, Albinni B, De Rosa O, Rescott ML et al. The Effects of the COVID19-Related Lockdown Are Modulated by Age: An Italian Study in Toddlers and Pre-Schoolers. Brain Sci. 2021; 9:11(8):1051.
- Spruyt K. A review of developmental consequences of poor sleepness in childhood. Sleep Med. 2019; Aug;60:3e12.
- Markuu P. Sleep research in 2020: COVID-19-related sleep disorders. Lancet Neurol. 2021; 20:15–1.
- Mazza, C.; Ricci, E.; Biondi, S.; Colasanti, M.; Ferracuti, S.; Napoli, C.; Roma, P. A nationwide survey of psychological distress among Italian people during the covid-19 pandemic: Immediate psychological responses and associated factors. Int. J. Environ. Res. Public Health. 2020; 17: 3165.
- Varatharaj A, Thomas N, Ellul MA, Davies NWS, Pollak TA, Tenorio EL et al. Neurological and neuropsychiatric complications of COVID-19 in 153 patients: A UK-wide surveillance study. Lancet Psychiatry 2020; 7:875– 882.
- Sharifian-Dorche M, Huot P, Osherov M, Wen D, Saveriano A, Giacomini P et al. Neurological complications of coronavirus infection; a comparative review and lessons learned during the COVID-19 pandemic. J. Neurol. Sci. 2020; 417:117085.
- Cellini N, Canale N, Mioni G, Costa S. Changes in sleep pattern, sense of time and digital media use during COVID-19 lockdown in Italy. J. Sleep Res. 2020; 29: e13074.
- Zhang C, Yang L, Liu S, Ma S, Wang Y, Cai Z et al. Survey of insomnia and related social psychological factors among medical staff involved in the 2019 novel Coronavirus disease outbreak. Front. Psychiatry. 2020; 11:306.
- Hurtado-Alvarado G, Becerril-Villanueva E, Contis-Montes OA, Domínguez-Salazar E, Salinas-Jazmín N, N, Pérez-Tapia SM et al. The yin/yang of inflammatory status: Blood-brain barrier regulation during sleep. Brain Behav. Immun. 2018; 69, 154–166.
- Cuddapah VA, Zhang SL, Sehgal A. Regulation of the blood-brain barrier by circadian rhythms and sleep. Trends Neurosci. 2019; 42: 500–510.
- Medina-Flores F, Hurtado-Alvarado G, Contis-Montes de Oca A, López- Cervantes SP, Konigsberg M, Deli MA et al. Sleep loss disrupts pericyte- brain endothelial cell interactions impairing blood-brain barrier function. Brain Behav. Immun. 2020; 89: 118–132.
- Benedict C, Cedernaes J, Giedraitis V, Nilsson EK, Hogenkamp PS, Vågesjö E et al. Acute sleep deprivation increases serum levels of neuron- specific enolase (NSE) and S100 calcium binding protein B (S-100B) inhealthy young men. Sleep. 2014; 37: 195–198.
Angioedema hereditario: no toda hinchazón es alergia
El angioedema hereditario (AEH) es una enfermedad rara que produce episodios recurrentes de hinchazón (edema) de algunas partes del cuerpo – piel o mucosas (gastrointestinal y de vía aérea superior). A diferencia del edema alérgico, es de instauración lenta, duro (sin fóvea), cursa sin urticaria (ronchas), sin picor y habitualmente la hinchazón dura más de 24-48 horas.
Es una enfermedad genética y en la mayoría de los casos se debe a una mutación en el cromosoma 11 de transmisión autosómica dominante (la posibilidad de transmisión de la enfermedad es de un 50%). Esta mutación conduce a un déficit enzimático – cuantitativo (AEH tipo I) o funcional ( AEH tipo II) del factor C1 inhibidor del sistema del complemento. Como consecuencia se produce hinchazón en diversas localizaciones a través de un mediador bioquímico denominado bradicinina. Existen algunos desencadenantes conocidos, como la manipulación de la cavidad oral o de la vía respiratoria superior, algunos fármacos (anticonceptivos orales que contengan estrógenos, antihipertensivos del grupo de los inhibidores de la enzima convertidora de la angiotensina), las infecciones y los traumatismos. En muchas ocasiones no se reconoce un precipitante concreto.
El AEH suele debutar en edad infantil y y se agrava a partir de la pubertad. Los ataques pueden afectar a cualquier órgano y pueden ser letales si afectan a la vía aérea superior. Sin embargo, el diagnóstico suele ser tardío debido a la inespecificidad de los síntomas:
- Edema en manos, brazos, piernas, labios, párpados, lengua, garganta o genitales
- Obstrucción de la vía aérea superior. Existe riesgo vital.
- Episodios recurrentes de dolor abdominal sin causa aparente. Puede llegar a ser grave, simular causa quirúrgica, ocasionar deshidratación y/o shock hipovolémico.
La frecuencia y la intensidad de los ataques son muy variables. Varían tanto en un mismo paciente, como en los familiares afectados por la misma mutación genética.
El diagnóstico se realiza a través de un análisis de sangre, donde se objetiva una disminución del C4 del complemento y del C1 inhibidor (actividad y/o cantidad). El estudio genético establece el diagnostico definitivo.
Tratamiento
Los ataques causados por esta enfermedad no responden al tratamiento antialérgico habitual -corticosteroides, antihistamínicos, adrenalina-. Se han de tratar con medicación específica, por lo que es fundamental establecer la sospecha en la crisis aguda. Los objetivos del tratamiento se basan en 3 principios:
- Tratar las crisis que aparezcan (tratamiento de las crisis)
El inhibidor específico de C1 es el tratamiento de primera elección para los ataques agudos, en los países en los que está disponible. Se recomienda su uso via intravenosa para el tratamiento de las crisis en niños. La dosis recomendada es de 20 U/kg. El icatibant (un antagonista del receptor B2 de bradicinina, subcutáneo) es una alternativa válida aprobada para su uso en niños mayores de 2 años.
- Prevención en situaciones de riesgo especial (prevención o profilaxis a corto plazo)
Se recomienda realizar profilaxis a corto plazo con inhibidor C1 purificado intravenoso ante procedimientos quirúrgicos o manipulaciones dentales/ en la cavidad oral (aplicable de 6 horas a 1 hora antes).
- Evitar o disminuir la aparición de crisis a lo largo del tiempo (prevención o profilaxis a largo plazo).
La necesidad de profilaxis a largo plazo deberá ser individualizada para cada paciente.
Dra. Krasimira Baynova. UGC Alergología, CSUR Angioedema hereditario. Hospital Universitario Virgen del Rocío, Sevilla. Comité de Alergia Infantil de SEAIC
Enlaces de interés:
- Asociación Española de Angioedema Familiar: https://angioedema-aedaf.haei.org/
- US Hereditary Angioedema Association – HAEA (Estados Unidos): https://es.haea.org/
Bibiliografía
- Frank MM, Zuraw B, Banerji A, Bernstein JA, Craig T, Busse P, et al. Management of children with hereditary angioedema due to C1 inhibitor deficiency. 2016;138:e20160575.
- Farkas and HAWK International consensus on the diagnosis and management of pediatric patients with hereditary angioedema with C1 inhibitor deficiency. Allergy.2017 Feb; 72(2): 300–313. PMID: 27503784.
- https://angioedema-aedaf.haei.org/wp-content/uploads/2019/03/GUIA- PACIENTE-NEW-V4.pdf
Estudio VAC-ASMA: percepción de la vacunación en pacientes con asma grave
El proyecto VAC-ASMA, busca conocer la actitud de los profesionales ante la vacunación en pacientes con asma grave desde las consultas de Alergología y Neumología de España.
Dirigido a especialistas que realicen labor asistencial en asma grave en hospitales españoles y cuenten con más de tres años de experiencia.
Participa: https://vacasma.gruposaned.com/
Código de acceso: ASMA
![]() Estudio VAC-ASMA (984 descargas )
Estudio VAC-ASMA (984 descargas )
Captador de la semana: Córdoba
Hoy toca presentar el captador de Córdoba, pertenece a la red de captadores de pólenes de la SEAIC.
La Dra Cristina De Castro Gómez, alergóloga en el Hospital San Juan De Dios, así como actual secretaria del comité de Aerobiología, nos aporta los datos en www.pólenes.com desde 2019.
Angiodema hereditario
Seguimiento del angioedema hereditario
Requisitos
- Diagnóstico previo de angioedema hereditario confirmado por un especialista.
- Disposición de teléfono, sistema de videoconsulta y de envío de imágenes. Disposición de Internet. El paciente ha de entender el sistema de funcionamiento de la aplicación empleada.
- No sufrir ninguna discapacidad que impida usar ninguno de estos sistemas.
- El paciente menor de 16 años debe estar acompañado por un progenitor o persona responsable.
- Consentimiento verbal o escrito del paciente o tutor legal, que debe reflejarse en la historia clínica. Actualmente la normativa no exige el consentimiento por escrito.
- Aceptar unas condiciones de legales y de privacidad de datos acorde a la normativa vigente.
Fase de preparación
- Fecha y hora de la visita.
- Si precisa: cuestionarios de evaluación de calidad de vida para angioedema, con instrucciones para su cumplimentación y para disponer, en el momento de la consulta, de ellos ya cumplimentados.
- Valoración de pruebas complementarias, si estas han sido solicitadas en la visita anterior.
Esta fase puede estar dirigida a una visita de revisión ya programada o a una visita solicitada por el propio paciente para resolver dudas o abordar una reagudización de la enfermedad o preparar futuros momentos que supongan un aumento de riesgo, como intervenciones o viajes.
Consulta telemática
Se realiza mediante llamada telefónica o plataforma para videoconsultas. Se aconseja realizar consultas síncronas aunque la disposición de consultas asíncronas puede ayudar a mejorar la accesibilidad del sistema y su usabilidad para el paciente. Durante el desarrollo de la consulta se abordarán los siguientes aspectos:
Introducción
Presentación y recordatorio del motivo de la consulta de seguimiento.
Evaluación del estado actual
- Preguntar por la frecuencia de brotes, áreas afectadas y gravedad de las crisis desde la última consulta.
- Investigar si ha habido algún desencadenante identificable o pródromos en las crisis.
- Preguntar por la duración y respuesta al tratamiento de rescate de los episodios. Preguntar cuántos episodios precisaron tratamiento en algún centro médico y cuántos se resuelven en domicilio.
- Los episodios ¿han tenido repercusión en actividades diarias o laborales?
- Indagar sobre el uso correcto del medicamento de rescate: ¿qué intervalo temporal existió entre el inicio de los síntomas y la administración del medicamento de rescate?
Valoración de pruebas complementarias en caso de haberse solicitado previamente
Comentar los resultados de analíticas y pruebas de imagen, si estas se habían solicitado en anterior consulta.
Revisión de medicación de mantenimiento a largo plazo
- Confirmar la adhesión al tratamiento prescrito. ¿Ha olvidado alguna dosis del tratamiento de control a largo plazo?
- Preguntar por posibles efectos secundarios del mencionado medicamento, o por nuevas afecciones aunque a priori no tengan una relación causal aparente con el medicamento pautado. (Ante la supuesta aparición de efecto adverso por el medicamento empleado, comunicar a farmacovigilancia).
- Discutir cualquier cambio en la dosis o la necesidad de ajustes en la medicación.
Educación y asesoramiento
- Ofrecer consejos sobre medidas de autocuidado, identificación de desencadenantes y estrategias para evitarlos.
- Aclarar cualquier duda o preocupación del paciente sobre su condición y tratamiento.
Plan de manejo consensuado
- Establecer un plan de acción para manejar futuros ataques, incluida la instrucción en el uso del medicamento de rescate.
- Recordar las señales de alarma que requieren atención médica inmediata.
- Confirmar la disponibilidad de medicamentos y recursos en caso de nuevo episodio. Actualizar receta electrónica.
Seguimiento y programación de citas
- Programar la próxima consulta de seguimiento o cualquier prueba complementaria necesaria.
- Confirmar la disponibilidad de apoyo continuo de atención médica entre consultas, según disponibilidad de cada área (teléfono de contacto, consulta WhatsApp, consulta médico de primaria, etc)
Despedida
Fijar fecha de próxima cita y agendar.
Agradecer al paciente por su tiempo y colaboración.
Documentación adecuada de la consulta en la historia clínica electrónica del paciente.
Consultas asíncronas: Aunque se aconseja realizar consultas síncronas, la disposición de consultas asíncronas puede ayudar a mejorar la accesibilidad del sistema y su usabilidad para el paciente. En caso de optar por esta modalidad debe disponerse siempre de un correo electrónico seguro con dirección de correo electrónico corporativa. A través de esta vía pueden enviarse al paciente:
- Cuestionarios de calidad de vida para angioedema.
- Informes clínicos actualizados.
- Planes de tratamiento nuevos, copia de receta electrónica o receta de farmacia hospitalaria.
- Aplicaciones recomendadas.
- Copias de pruebas de imagen o de laboratorio si lo solicita el paciente.
Aplicaciones y páginas web
de apoyo a la consulta telemática en angioedema hereditario.
Recursos adicionales para pacientes
- Guía del paciente angioedema hereditario:
- Asociación española de angioedema familiar
- https://angioedema-aedaf.haei.org
¿Y entonces qué hacemos con el perro?
Actualmente, más de la mitad de los hogares europeos conviven con al menos una mascota; durante la pandemia SARS CoV2 se observó un incremento del censo de animales domésticos en los países desarrollados, siendo los perros, junto a los gatos, los animales que más conviven dentro del hogar.
 En el caso de los perros, su función de cuidador o ayudante en el trabajo diario ha cambiado a la de ser un miembro más de la familia, con el que se establecen vínculos emocionales y de dependencia; no en vano las mascotas son reconocidas en España con un estatuto jurídico desde enero de 2022 como “seres vivos dotados de sensibilidad”, garantizándoles el derecho a cuidados y bienestar (1).
En el caso de los perros, su función de cuidador o ayudante en el trabajo diario ha cambiado a la de ser un miembro más de la familia, con el que se establecen vínculos emocionales y de dependencia; no en vano las mascotas son reconocidas en España con un estatuto jurídico desde enero de 2022 como “seres vivos dotados de sensibilidad”, garantizándoles el derecho a cuidados y bienestar (1).
Según Alergológica 2015, los epitelios ocupan el tercer lugar en orden de frecuencia como causa de rinoconjuntivitis alérgica, siendo el perro (9,9%), tras el gato (12,5%), el agente etiológico más común en la población española estudiada. Se describe además, que el porcentaje de alérgicos a ácaros y/o pólenes es superior en los pacientes que conviven con animales con respecto a los pacientes que no tienen un animal en su domicilio. En la población pediátrica de ese estudio, un 36,2% de los niños convivían con animales domésticos, el 24,3% de ellos con perros, y mostraron un aumento en la prevalencia de la rinitis alérgica por epitelios con respecto a los estudios previos – Alergológica 2005 – por lo que es probable que la exposición sea un factor precipitante de este incremento (2).
Los síntomas habituales de la alergia a animales suelen ser los que afectan a las vías respiratorias; sin embargo, los animales pueden producir síntomas cutáneos asociados tras contacto directo con el animal por alérgenos de su epitelio, caspa, glándulas linguales y parótida (saliva), y próstata (orina). Los alérgenos del perro son muy ubicuos, pudiendo estar presentes no solo en el domicilio donde habitan, sino en lugares muy diversos tales como áreas comunes, oficinas, autobuses, metro, aviones etc., debido, probablemente, a su transporte por personas que conviven con ellos a través de su ropa y accesorios.
Los alérgenos del perro más estudiados son (3,4):
- Lipocalinas: Can f 1 (alérgeno mayoritario y especifico de sensibilización primaria), Can f 2, Can f 4 y Can f 6. Son proteínas estables con una gran reactividad cruzada entre ellas, cuya función es el transporte de ligandos lipofílicos como: hormonas, vitaminas, ácidos grasos y feromonas, permitiendo su unión a receptores de superficie celular.
- Albúmina (Can f 3): proteínas con gran homología entre diferentes especies animales, por lo cual tienen una alta reactividad cruzada entre ellas; se ha descrito que la sensibilización inicial a Can f3 puede estar relacionada en la progresión a polisensibilización a otros animales.
- Calicreína prostática (Can f 5): es considerado un alérgeno mayoritario, siendo una arginina-esterasa relacionada con la producción prostática, exclusiva de perros machos. Posee reactividad cruzada con el antígeno seminal prostático humano (PSA) con el que comparte una homología mayor al 50%, y se ha relacionado con alergia a líquido seminal humano pudiendo tener a su vez un papel importante en los casos de infertilidad.
- Proteína secretora epididimal (Can f 7): relacionada con proteínas NCP2 (Niemman Pick tipo 2),se ha implicado en el reconocimiento de lípidos de patógenos y transporte intracelular de colesterol. Su función exacta en los perros sigue sin estar clara.
- Cistatinas (Can f 8): actúa como inhibidor de cistein-proteasas.
La frecuencia de sensibilización a los alérgenos mayoritarios (Can f1 – Can f5) varía según las diferentes regiones geográficas y, aunque puede haber diferencias entre razas, todos los perros producen proteínas alergénicas. Los perros hipoalergénicos, o que se publicitan como tales, suelen considerarse así porque mudan menos pelo o son criados para producir menor cantidad de Can f 1; sin embargo, no eliminan la posibilidad de exposición a saliva y otros alérgenos menores no relacionados con los epitelios, por lo cual la disponibilidad de que una raza de perro sea realmente hipoalergénica es cuestionable (5).
Es muy frecuente la sensibilización simultánea con otros animales (principalmente el gato). En efecto, un 75% de los pacientes sensibilizados a una mascota tiene hasta 14 veces más de probabilidad de sensibilizarse a otra, lo que puede deberse a la homología y/o similitud estructural, como sucede con las albúminas y lipocalinas del perro y el gato, motivo de la reactividad cruzada entre ambos animales y otros como los roedores, los equinos, incluso con las aves. (5)
 El diagnóstico molecular en la alergia a animales ha permitido un conocimiento individualizado del perfil de sensibilización, lo que ha traído múltiples beneficios como mejorar la presunción diagnóstica, distinguiendo la reactividad cruzada de la co-sensibilización, permitir el reconocimiento de biomarcadores de riesgo en cuanto a gravedad de los síntomas y optimizar la indicación de inmunoterapia, posibilitando también reconocer componentes asociados a reacciones adversas durante la misma, e incluso llegar a predecir su efectividad. (6)
El diagnóstico molecular en la alergia a animales ha permitido un conocimiento individualizado del perfil de sensibilización, lo que ha traído múltiples beneficios como mejorar la presunción diagnóstica, distinguiendo la reactividad cruzada de la co-sensibilización, permitir el reconocimiento de biomarcadores de riesgo en cuanto a gravedad de los síntomas y optimizar la indicación de inmunoterapia, posibilitando también reconocer componentes asociados a reacciones adversas durante la misma, e incluso llegar a predecir su efectividad. (6)
Uriarte y cols., (6) demostraron que la sensibilización a 2 o más alérgenos de perro se asociaba a asma grave, y la sensibilización a Can f 1 y Can f 5 a rinitis persistente. Estos datos son similares a los reportados por Dávila y cols., (7), quienes también observaron que los pacientes con asma o rinitis aisladas causada por epitelios son escasos, y que al mismo tiempo un tercio de ellos tenían no solo urticaria de contacto, sino también un alto porcentaje de co-sensibilización a pólenes y ácaros.
 Sin embargo, en la actualidad hay datos que sugieren que la exposición temprana (durante el primer año de vida) a perros y/o a gatos, puede asociarse a una disminución del riesgo de asma alérgica, mientras que si la exposición se da tras ese periodo puede incrementar el riesgo a desarrollarla; estas observaciones parecen solo estar relacionadas con perro y gatos, y no se ha visto con otros animales como los roedores, cuya exposición temprana parece que puede incluso incrementar el riesgo a asma no alérgica. (5,8). Tampoco hay suficiente evidencia para predecir si la sensibilización a perros está asociada a alergia clínica; no obstante, la sensibilización a Can f1 asociada al Feld1 de gatos sí se ha asociado a un mayor riesgo de alergia posterior a ambos.
Sin embargo, en la actualidad hay datos que sugieren que la exposición temprana (durante el primer año de vida) a perros y/o a gatos, puede asociarse a una disminución del riesgo de asma alérgica, mientras que si la exposición se da tras ese periodo puede incrementar el riesgo a desarrollarla; estas observaciones parecen solo estar relacionadas con perro y gatos, y no se ha visto con otros animales como los roedores, cuya exposición temprana parece que puede incluso incrementar el riesgo a asma no alérgica. (5,8). Tampoco hay suficiente evidencia para predecir si la sensibilización a perros está asociada a alergia clínica; no obstante, la sensibilización a Can f1 asociada al Feld1 de gatos sí se ha asociado a un mayor riesgo de alergia posterior a ambos.
En cuanto a la dermatitis atópica no es posible establecer conclusiones. Algunos estudios hablan de un incremento en la gravedad de la dermatitis, no solo asociados a la exposición al perro, sino también tras el estrés psicológico que puede ocasionar el deshacerse de la mascota. Al igual que con la rinitis y el asma, también se ha descrito que la exposición a perros desde el nacimiento podría disminuir hasta en un 25% el riesgo de padecer dermatitis atópica, asociándolo a que, al ser miembro de la familia, los perros pueden compartir microbiota intestinal con sus convivientes, lo que podría alterar desde temprana edad la microbiota intestinal de los niños, sirviendo de medida protectora para el desarrollo de eczemas; sin embargo los datos actuales en cuanto a la implicación en la dermatitis en los niños expuestos son bastante contradictorios. (5,9)
Algunos estudios demuestran una disminución de los niveles de IgE específica frente a perro tras su retirada del domicilio, pero sin cambios significativos con respecto a la intensidad de los síntomas tras nuevos contactos también se ha descrito que algunos pacientes pueden presentan una menor respuesta clínica tras la exposición continua a los alérgenos del perro. Por otra parte, sigue sin estar claro si la sensibilización a perros es un factor de riesgo para sensibilización a otro neumoalérgenos, aunque en un estudio Park et al (10) describen un mayor riesgo de alergia a ácaros en paciente adultos que tienen o han tenido un perro en la infancia, sobre todo para el género de Dermatophagoides.
 El manejo de los pacientes con alergia a epitelios incluye la posibilidad de retirar la fuente alergénica (perro) del hogar, siendo ésta la medida que ha mostrado más beneficio, pero para su efectividad, al igual que la administración de lociones tópicas en el pelaje del perro, debe realizarse de manera combinada con la evitación del alérgeno y de manera sostenida en el tiempo; esto es difícil debido a la ubicuidad de los alérgenos del animal y no aseguran un beneficio clínico en la progresión de la enfermedad. Además, no debemos menospreciar el impacto emocional de retirar el animal del domicilio, lo que puede hacer en la mayoría de los casos inviable esta medida. Asimismo, aunque con evidencia poco consistente, se ha descrito que en pacientes monosensibilizados a Can f 5 la esterilización de perros machos puede aportar algún beneficio. (5,11)
El manejo de los pacientes con alergia a epitelios incluye la posibilidad de retirar la fuente alergénica (perro) del hogar, siendo ésta la medida que ha mostrado más beneficio, pero para su efectividad, al igual que la administración de lociones tópicas en el pelaje del perro, debe realizarse de manera combinada con la evitación del alérgeno y de manera sostenida en el tiempo; esto es difícil debido a la ubicuidad de los alérgenos del animal y no aseguran un beneficio clínico en la progresión de la enfermedad. Además, no debemos menospreciar el impacto emocional de retirar el animal del domicilio, lo que puede hacer en la mayoría de los casos inviable esta medida. Asimismo, aunque con evidencia poco consistente, se ha descrito que en pacientes monosensibilizados a Can f 5 la esterilización de perros machos puede aportar algún beneficio. (5,11)
Otra herramienta en el tratamiento es la inmunoterapia alérgeno específica (principalmente por vía subcutánea) que, en estudios limitados en pacientes con rinitis y asma, ha demostrado en pacientes con alergia a perro: mejoría de los síntomas y puntuación en los cuestionarios de la calidad de vida, reducción del tamaño de las pruebas cutáneas y aumento de los valores de FEV1 e IgG4 específicas, además de la disminución del uso de medicación de rescate. Sin embargo, es de resaltar que la eficacia clínica está limitada a la calidad de los extractos, a la variabilidad y complejidad del perfil alergénico de muchos pacientes y al gran porcentaje de co-sensibilización a otros alérgenos como pólenes, ácaros e incluso otros animales, constituyendo dichos factores una desventaja en el manejo actual de esta patología. (5,12)
Hilda Rianec Hernández Suárez. Hospital Universitario de Gran Canaria Dr. Negrín. Comité de Alergia Infantil
Bibliografía
- Jefatura del Estado. Ley 17/2021, de 15 de diciembre, de modificación del Código Civil, la Ley Hipotecaria y la Ley de Enjuiciamiento Civil, sobre el régimen jurídico de los animales [Internet]. Sec. 1, Ley 17/2021 dic 16, 2021 p. 154134-43. Disponible en: https://www.boe.es/eli/es/l/2021/12/15/17
- SEAIC. Alergologica 2015 [Internet]. Draft Grupo de Comunicación Healthcare; Disponible en: https://www.seaic.org/inicio/en-portada/alergologica-2015.html
- Alergias a gatos y perros [Internet]. Alliance Allergy. Disponible en: https://allianceallergy.com/diagnosticos-resueltos-por-componentes-para-la-enfermedad-alergica/alergias-a-gatos-y-perros/?lang=es
- Chan SK, Leung DYM. Dog and Cat Allergies: Current State of Diagnostic Approaches and Challenges. Allergy Asthma Immunol Res. marzo de 2018;10(2):97-105.
- Dávila I, Domínguez-Ortega J, Navarro-Pulido A, Alonso A, Antolín-Amerigo D, González-Mancebo E, et al. Consensus document on dog and cat allergy. Allergy. 2018;73(6):1206-22.
- Uriarte SA, Sastre J. Clinical relevance of molecular diagnosis in pet allergy. Allergy. 2016;71(7):1066-8.
- Dávila I, Isidoro-García, María. Perfiles clínicos y de sensibilización molecular en la alergia al epitelio de perro. 2017;11.
- Al-Tamprouri C, Malin B, Bill H, Lennart B, Anna S. Cat and dog ownership during/after the first year of life and risk for sensitization and reported allergy symptoms at age 13. Immun Inflamm Dis. 2019;7(4):250-7.
- Song SJ, Lauber C, Costello EK, Lozupone CA, Humphrey G, Berg-Lyons D, et al. Cohabiting family members share microbiota with one another and with their dogs. Weigel D, editor. eLife. 16 de abril de 2013;2:e00458.
- Park Y-B, Mo E-K, Lee J-Y, Kim J-H, Kim C-H, Hyun I-G, et al. Association Between Pet Ownership and the Sensitization to Pet Allergens in Adults With Various Allergic Diseases. Allergy Asthma Immunol Res. septiembre de 2013;5(5):295-300.
- Uriarte S, Sastre J. Subcutaneous Immunotherapy With High-Dose Cat and Dog Extracts: A Real-life Study. J Investig Allergol Clin Immunol. 18 de junio de 2020;30(3):169-74.
- Uriarte S, Grönlund H, Wintersand A, Bronge J, Sastre J. Clinical and immunologic changes due to subcutaneous immunotherapy with cat and dog extracts using an ultrarush up-dosing phase: a real-life study. J Investig Allergol Clin Immunol. Disponible en: http://www.jiaci.org/ahead-of-print/clinical-and-immunologic-changes-due-to-subcutaneous-immunotherapy-with-cat-and-dog-extracts-using-an-ultrarush-up-dosing-phase–a-real-life–study
Aviso Legal
0. RECOMENDACIÓN PREVIA:
Por favor, lea todos los apartados del presente aviso legal y nuestra política de privacidad antes de utilizar este website. Las siguientes condiciones son vinculantes para cualquier usuario del mismo. Documento revisado el 28/06/2021.
En cumplimiento con el deber de información dispuesto en la Ley 34/2002 de Servicios de la Sociedad de la Información y el Comercio Electrónico (LSSI-CE) de 11 de julio, se facilitan a continuación los siguientes datos de información general de este sitio web.
La razón de este texto es explicarle de manera detallada las funcionalidades de esta web y aportarle toda la información relacionada con el responsable y la finalidad de los contenidos incluidos en ella.
1. INTRODUCCIÓN; DATOS IDENTIFICATIVOS y USUARIOS:
El presente aviso legal y política de privacidad regula el uso del servicio del PORTAL de Internet www.seaic.org informándole en cumplimiento de la Ley 34/2002, de 11 de julio lo siguiente:
- Titular: SOCIEDAD ESPAÑOLA DE ALERGOLOGIA E INMUNOLOGIA CLINICA (SEAIC). CIF/NIF: G-58318395
- Domicilio social: Calle Agustín de Foxá 25, 28036 Madrid
- Inscrita en el Registro en el Registro Nacional de Asociaciones, Sección 1, Número Nacional 3446.
- Correo electrónico: seaic@seaic.org Teléfono: 915 348 826
- Actividad social: Sociedad profesional y científica, sin ánimo de lucro, que desarrolla sus actividades en todo el territorio del Estado español y está constituida por profesionales que trabajan en el estudio de las enfermedades de mecanismo inmunológico, particularmente por hipersensibilidad.
- Finalidad de la página web: Dar a conocer sus actividades, contactar, suscripciones y realizar alta de asociados.
El presente documento tiene por objeto establecer los términos y condiciones generales de uso del PORTAL. Los términos y condiciones generales son de obligada aceptación y cumplimiento por parte de todos las personas, profesionales y empresas (en adelante el USUARIO), que deseen hacer uso de los mismos (actuales o nuevos servicios que SEAIC preste en el futuro a través del PORTAL).
2. OBLIGACIONES DE LOS USUARIOS, USO DEL SITIO WEB, SUS SERVICIOS Y CONTENIDOS;
El usuario se compromete a utilizar el portal, el contenido y servicios, sin contravenir la legislación vigente, los usos generalmente aceptados y el orden público. Queda prohibido, el uso del Web con fines ilícitos o lesivos contra SEAIC o un tercero, que, de cualquier forma, puedan causar perjuicio o impedir el normal uso del PORTAL.
SEAIC garantiza que los contenidos y servicios que ofrece el portal respetan el principio de dignidad de la persona, de protección de la juventud y la infancia, de no-discriminación por motivos de raza, sexo, religión, opinión, nacionalidad, discapacidad o cualquier otro aspecto personal y social. SEAIC se reserva el derecho de retirar todos aquellos comentarios y aportaciones que vulneren la ley o no respeten los principios señalados.
SEAIC es titular o se encuentra debidamente autorizada para su difusión por sus legítimos titulares, de los derechos de propiedad intelectual e industrial sobre las marcas, imágenes, textos, diseños, animaciones, o cualquier otro contenido o elementos de este portal. Cualquier acto de reproducción, distribución, comunicación pública, puesta a disposición, o transformación, así como cualquier otra forma de explotación de todo o parte de dichos contenidos o elementos, realizado bajo cualquier forma o mediante cualquier medio, requerirá el consentimiento previo y por escrito de SEAIC.
Las presentes Condiciones Generales de Uso del PORTAL no confieren al USUARIO ningún otro derecho de uso, alteración, explotación, reproducción, distribución o comunicación pública del Portal y/o de sus Contenidos distintos de los aquí expresamente previstos. Los contenidos (información, archivos de sonido y/o imagen, fotografías, diseños, etc.) recogidos en el portal, son propiedad de SEAIC o se encuentra debidamente autorizada para su difusión por sus legítimos titulares. SEAIC se compromete a no realizar publicidad engañosa y por tanto, queda prohibido:
- El uso para todo tipo de fines comerciales o publicitarios, distintos de los estrictamente permitidos.
- Su reproducción, publicación, distribución o modificación, total o parcial a menos que se cuente con la autorización previa y por escrito de sus legítimos titulares o resulte legalmente permitido.
- Cualquier vulneración de los derechos de SEAIC o de sus legítimos titulares sobre los mismos.
3. PROPIEDAD INTELECTUAL E INDUSTRIAL;
En todo caso, el USUARIO reconoce y acepta que todos los derechos de propiedad industrial e intelectual sobre los Contenidos y/o cualesquiera otros elementos insertados en el portal pertenecen a SEAIC o se encuentra debidamente autorizada para su difusión en el presente PORTAL. En el caso de que un usuario o un tercero consideren que se ha producido una violación de sus legítimos derechos de propiedad intelectual por la introducción de un determinado contenido en el Web, deberá notificar dicha circunstancia a SEAIC indicado:
- Datos personales del interesado titular de los derechos presuntamente infringidos, o indicar la representación con la que actúa en caso de que la reclamación la presente un tercero distinto del interesado.
- Señalar los contenidos protegidos por los derechos de propiedad intelectual y su ubicación en el Web, la acreditación de los derechos de propiedad intelectual señalados y declaración expresa en la que el interesado se responsabiliza de la veracidad de las informaciones facilitadas en la notificación.
4. ENLACES
El PORTAL proporciona enlaces a otros sitios web propios y contenidos que son propiedad de terceros. El único objeto de los enlaces es proporcionar al usuario la posibilidad de acceder a dichos enlaces. SEAIC no se responsabiliza en ningún caso de los resultados que puedan derivarse al usuario por acceso a dichos enlaces.
El usuario que se proponga establecer cualquier dispositivo técnico de enlace desde su sitio web al portal www.seaic.org deberá obtener la autorización previa y escrita de SEAIC. El establecimiento del enlace no implica en ningún caso la existencia de relaciones entre el PORTAL y el propietario del sitio en el que se establezca el enlace, ni la aceptación o aprobación por parte de www.seaic.org de sus contenidos o servicios.
5. MODIFICACIÓN UNILATERAL Y DURACIÓN;
SEAIC se reserva el derecho de modificar, en cualquier momento y sin necesidad de previo aviso, la presentación y configuración del PORTAL web www.seaic.org como el presente aviso legal.
6. EXCLUSIÓN DE GARANTÍAS Y RESPONSABILIDAD;
SEAIC no otorga ninguna garantía ni se hace responsable, en ningún caso, de los daños y perjuicios de cualquier naturaleza que pudieran acarrear a causa de:
- La falta disponibilidad, mantenimiento y efectivo funcionamiento del Web y/o de sus servicios o contenidos.
- La existencia de virus, programas maliciosos o lesivos en los contenidos.
- El uso ilícito, negligente, fraudulento, contrario a las presentes Condiciones Generales, a la buena fe, a los usos generalmente aceptados o al orden público, del sitio Web, sus servicios o contenidos, por parte de los usuarios.
7. TRATAMIENTO DE DATOS PERSONALES
SEAIC, tal y como recoge en su “POLITICA DE PRIVACIDAD” que puede consultar en nuestra web, ha adoptado los niveles de seguridad adecuados a los datos que trata y gestiona, incorporando todos los medios y medidas técnicas a su alcance para garantizar su confidencialidad, evitar su mal uso, pérdida, alteración, acceso no autorizado y robo.
8. LEGISLACIÓN APLICABLE Y JURISDICCIÓN;
Las presentes Condiciones Generales se regirán por la legislación española, sometidas a los juzgados y tribunales de la ciudad de Madrid (España) ante cualquier controversia derivada del acceso al PORTAL.
9. CONTACTO
En caso de que cualquier Usuario tuviese alguna duda acerca de este aviso legal o cualquier comentario sobre la web puede dirigirse a seaic@seaic.org
Grupos de trabajo del Comité de Asma SEAIC
Los grupos de trabajo del Comité de Asma de la SEAIC abordan áreas clave de la enfermedad con el objetivo de avanzar en el conocimiento, mejorar la atención clínica y promover la formación e investigación en asma desde un enfoque multidisciplinar y colaborativo:
- Grupo de relación con Atención Primaria – Coordinadores Ibon Eguiluz y Manuel Pajarón
- Grupo de Asma Grave – Coordinadores Julio Delgado y Javier Domínguez
- Grupo de Comunicación: redes sociales, web y medios de comunicación – Coordinadoras Lorena Soto y Paula Galván
- Grupo de relación con Pacientes y Enfermería – Coordinadora Virginia Bellido
- Grupo de Asma Infantil – Coordinadoras Remedios Cárdenas y Alicia Habernau
- Grupo de Procedimientos en Asma – Coordinadora Mª del Mar Fenández Nieto
- Grupo de Inmunoterapia en Asma – Coordinadora Lorena Soto
- Grupo de relación con el Comité de Rinoconjuntivitis (especial interés en RSCcPN) – Coordinador Ismael García
- Grupo de Investigación y relación con PII de SEPAR – Coordinadores Juan Carlos Miralles e Ismael García
- Grupo Comisión Acreditación UAG – Coordinadora Alícia Habernau
- Grupo de Tos Crónica – Coordinadores Manuel Rial y Paula Galván
Captador de la semana: Ciudad Real
Desde el Hospital General Universitario de Ciudad Real, los doctores Alberto Palacios, Aranzazu Martin, Alba Extremera y Carmen García, nos proporcionan los datos a pólenes.com.
A continuación os dejamos un interesante video que han realizado donde podéis observar su captador y la recogida de muestras.
Video: ¿cómo se cuentan los pólenes?
Muchas personas sufrimos enfermedades respiratorias alérgicas causadas por pólenes, y durante los meses de primavera buscamos información sobre cómo de alto está ese día el polen que nos preocupa, de cara a protegernos, tomar medicación o planificar un viaje, pero, ¿cómo se realizan esos contajes?
El comité de Aerobiología cuenta con una red de colectores repartidos por todo el país, con el objetivo de potenciar el estudio de los pólenes y hongos ambientales. Se trata de captadores volumétricos que succionan el aire ambiente, impactando las partículas sobre una superficie que posteriormente se recoge, se prepara sobre un portaobjetos, y finalmente se realiza un contaje de manera manual utilizando un microscopio óptico.
Aquí un video publicado por Canal Sur el 26 de abril de 2023 en el que Manuel Alcántara, vocal de la Sociedad Española de Alergología e Inmunología Clínica, explica y muestra el proceso.
Dra. Alicia López Guerrero, Hospital Universitario de Jaén, Jaén. Comité Aerobiología Clínica.