Noticias Alergología
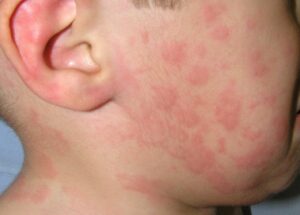
Dermatitis Alérgica de Contacto en niños: Una realidad cada vez más frecuente
Situación actual y epidemiología
Durante mucho tiempo se pensó que la dermatitis alérgica de contacto (DAC) era una enfermedad exclusiva del adulto. Sin embargo, estudios recientes revelan una prevalencia similar a la de adultos, con casos descritos incluso en lactantes (1). Se estima que hasta un 16–20% de la población pediátrica está sensibilizada a algún alérgeno, aunque muchos casos no se diagnostican porque los síntomas se confunden con otras afecciones más comunes, como la dermatitis atópica (DA) (1,2). De hecho, menos del 10% de las pruebas epicutáneas se realizan en niños, lo que contribuye a este infradiagnóstico (1).
Dermatitis atópica y dermatitis alérgica: ¿cómo se relacionan?
La DAC y la DA pueden coexistir y a menudo se solapan, ya que ambas provocan inflamación y picor. Más de un tercio de los niños con DAC tienen también DA (1), y en muchos casos, los productos utilizados para tratar la piel atópica contienen ingredientes sensibilizantes que agravan los síntomas (1). Esta superposición puede dificultar el diagnóstico y retrasar el tratamiento adecuado.
En niños con DA, debe sospecharse una DAC cuando la dermatitis es recalcitrante al tratamiento convencional, presenta una distribución atípica (como afectación localizada de párpados, labios, manos, pies o zona del pañal), o empeora con el uso de productos destinados al cuidado de la piel atópica, los cuales pueden contener alérgenos como fragancias, lanolina o conservantes. También debe considerarse la DAC si las lesiones se localizan en áreas en contacto con cosméticos, cremas, ropa, joyas, materiales escolares o deportivos. En estos casos, la realización de pruebas epicutáneas permite identificar alérgenos relevantes y guiar el tratamiento (1,3).
¿Cómo se diagnostica?
El diagnóstico de la DAC en niños se basa en la historia clínica detallada y en la realización de pruebas epicutáneas, que son el método de referencia para identificar alérgenos causantes. Estas pruebas consisten en aplicar parches con alérgenos sobre la espalda del niño, retirarlos a las 48 horas, y realizar segunda lectura a las 72-96 horas. También se puede complementar con pruebas como el ROAT (Repeat Open Application Test), una prueba sencilla, no invasiva, que se utiliza para evaluar si un producto concreto (como una crema, cosmético o medicamento tópico) está causando una DAC. Es especialmente útil en niños o cuando no es posible realizar pruebas epicutáneas estándar (3,4).
En 2015, la EAACI (European Academy of Allergy and Clinical Immunology) propuso una batería reducida de alérgenos como herramienta práctica y segura para facilitar el diagnóstico en población pediátrica (5). Con el tiempo, la experiencia clínica y nuevas evidencias han puesto de manifiesto la necesidad de considerar también alérgenos emergentes, cada vez más presentes en productos infantiles como la metilisotiazolinona aislada, hidroperóxidos de limoneno y linalol, benzofenonas, 3-dimetilaminopropilamina (DMAPA), isobornil acrilato y clorhexidina. Además, se recomienda adaptar las pruebas a la exposición individual de cada paciente y complementarlas con productos propios y alérgenos actuales, con el objetivo de optimizar la precisión diagnóstica en niños (6-8).
¿Cuáles son los alérgenos más frecuentes?
En los niños, los alérgenos más comunes que pueden causar DAC incluyen (8-13):
- Metales: como el níquel, cloruro de cobalto y dicromato potásico, presentes en objetos de uso cotidiano como bisutería, gafas, relojes, calzado, ropa, juguetes, videoconsolas, teléfonos móviles, tablets, aparatos de ortodoncia, botas, sandalias o material deportivo.
- Conservantes: destacan la metilisotiazolinona (MI) y la metilcloroisotiazolinona (MCI), que se encuentran en productos como el slime, pinturas, productos de limpieza y equipamiento deportivo. Otro conservante importante es el formaldehído, que puede estar presente en algunas toallitas infantiles.
- Fragancias: como las mezclas de fragancias I y II, el bálsamo del Perú, y los hidroperóxidos de linalol y limoneno, que se utilizan en cosméticos, medicamentos tópicos y productos de limpieza.
- Emolientes: como la lanolina y el propilenglicol, habituales en cosméticos, bálsamos labiales y medicamentos de aplicación tópica.
- Tensoactivos: derivados del aceite de coco como la cocamidopropil betaína (CAPB) y su principal fracción alergénica, la 3-dimetilaminopropilamina (DMAPA), presentes en champús, acondicionadores y detergentes.
- Parafenilendiamina (PPDA): sustancia empleada en tatuajes de henna y tintes capilares.
- Colofonia: una resina procedente de la savia del pino, utilizada en adhesivos, apósitos, tintas, cosméticos, productos farmacéuticos y material escolar.
- Antibióticos tópicos: como la neomicina y la bacitracina, ampliamente utilizados en cremas y pomadas.
Además de los alérgenos clásicos, en los últimos años se han identificado alérgenos emergentes en la población pediátrica. Entre ellos destacan la benzisotiazolinona, presente en ropa, calzado y detergentes (5); la acetofenona azina, un derivado de la goma EVA presente en espinilleras y calzado infantil (6); el isobornil acrilato (IBOA), utilizado en dispositivos médicos como las bombas de insulina (4); la benzofenona-4, presente en algunos protectores solares; y la clorhexidina, cuyo uso cada vez más frecuente en antisépticos se ha relacionado con un aumento de casos de sensibilización (8–13).
Estrategias de prevención
Una de las estrategias más prometedoras es el enfoque PEAS (Pre-Emptive Avoidance Strategy), que propone evitar desde el inicio los alérgenos más comunes en productos infantiles. Esta medida preventiva puede aplicarse incluso sin diagnóstico previo, especialmente en niños con piel sensible o antecedentes de dermatitis, para prevenir sensibilizaciones en la población pediátrica (14).
Manejo y tratamiento
El tratamiento principal es la evitación del alérgeno, una vez identificado mediante pruebas epicutáneas. Para controlar los brotes, se utilizan corticoides tópicos suaves, inmunomoduladores y emolientes para restaurar la barrera cutánea. En casos más graves, puede ser necesaria la fototerapia o tratamiento sistémico (3,4). El seguimiento debe incluir educación continua a las familias, revisión de productos y apoyo emocional, ya que un manejo adecuado mejora significativamente la calidad de vida del niño y su entorno (1,14).
Autora: Dra. Ana Láinez Nuez. Servicio de alergología, Hospital IMED Valencia. Comité de Alergia Infantil SEAIC
Bibliografía
- Neale H, Garza-Mayers AC, Tam I, Yu J. Pediatric allergic contact dermatitis. Part I. Clinical features and common contact allergens in children. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.002
- Ortiz Salvador JM, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017. doi:10.1016/j.ad.2016.12.018
- Neale H, et al. Pediatric allergic contact dermatitis. Part II. J Am Acad Dermatol. 2020. doi:10.1016/j.jaad.2020.11.001
- Young K, et al. Pediatric allergic contact dermatitis registry patch testing results from 2016–2022. J Am Acad Dermatol. 2023. doi:10.1016/j.jaad.2023.01.016
- de Waard-van der Spek FB, Darsow U, Mortz CG, et al. EAACI position paper for practical patch testing in allergic contact dermatitis in children. Pediatr Allergy Immunol. 2015;26(7):598–606. doi:10.1111/pai.12463
- Ortiz Salvador JM, Esteve Martínez A, Subiabre Ferrer D, et al. Dermatitis alérgica de contacto pediátrica. Actas Dermosifiliogr. 2017;108(6):571–578. doi:10.1016/j.ad.2016.12.018
- Felmingham C, Davenport R, Bala H. Allergic contact dermatitis in children and proposal for an Australian Paediatric Baseline Series. Australas J Dermatol. 2019;60(4):308–313. doi:10.1111/ajd.13169
- Yu J, Atwater AR, Brod B, et al. Pediatric Baseline Patch Test Series: Initial Findings of the Pediatric Contact Dermatitis Workgroup. Dermatitis. 2018;29(4):206–212. doi:10.1097/DER.0000000000000353
- Lidén C, White I. Increasing non-cosmetic exposure and sensitization to isothiazolinones. Contact Dermatitis. 2024. doi:10.1111/cod.14433
- Manière I, et al. Sensitization properties of acetophenone azine: a new skin sensitizer identified in textiles. Contact Dermatitis. 2023. doi:10.1111/cod.14284
- Magdaleno-Tapial J, et al. Allergic contact dermatitis to chlorhexidine in pediatric patients. Pediatr Dermatol. 2019. doi:10.1111/pde.13808
- Heurung AR, Raju SI, Warshaw EM. Dermatitis. 2014;25(1):3–10. doi:10.1097/DER.0000000000000025
- Moral L, et al. Allergic contact dermatitis to chlorhexidine in children. Allergol Immunopathol (Madr). 2024;52(6):33–39. doi:10.15586/aei.v52i6.1171
- Hill H, et al. Pre-emptive avoidance strategy (PEAS). Expert Rev Clin Immunol. 2016. doi:10.1586/1744666X.2016.1142373
¿Puede ser preventiva la inmunoterapia con alergenos inhalantes en niños?
Las enfermedades alérgicas suponen una carga de salud que afecta a todos los grupos de edad y que pueden manifestarse temprano en la vida como dermatitis atópica, alergia alimentaria, rinitis/conjuntivitis alérgica y asma alérgica.
En una revisión bibliográfica recientemente publicada por Dwived y col.1 revisan las estrategias de prevención que se pueden implementar en cada etapa de la vida:
- Primaria: se dirige a niños, preferiblemente recién nacidos, que están en alto riesgo de desarrollar enfermedades alérgicas pero que aún no están sensibilizados. El objetivo en esta etapa es prevenir el desarrollo de sensibilizaciones y el consiguiente inicio de una enfermedad alérgica.
- Secundaria: involucra a niños sensibilizados antes de la aparición de síntomas. Este enfoque se centra en la prevención de nuevas sensibilizaciones y el inicio de nuevas enfermedades alérgicas.
- Terciaria: se dirige a niños con enfermedades alérgicas existentes. Los objetivos en esta etapa son prevenir la progresión de la enfermedad alérgica existente a otra y prevenir nuevas sensibilizaciones.
Dado que el sistema inmunológico es más plástico en la primera infancia, esta etapa se considera ideal para llevar a cabo medidas para prevenir enfermedades alérgicas. En este sentido, se han investigado los efectos preventivos de la inmunoterapia con alérgenos (AIT). La evidencia para aplicar la inmunoterapia preventiva con alérgenos (pAIT) está creciendo rápidamente, aunque aún enfrenta desafíos debido a factores relacionados con la edad y que los datos son limitados.
Esta revisión presenta un resumen actualizado de la evidencia disponible sobre aspectos preventivos de AIT con alérgenos respiratorios en nuevas sensibilizaciones, inicio y progresión de enfermedades alérgicas, así como otros efectos inmunomoduladores, centrándose particularmente en niños.
Los autores realizaron una búsqueda en PubMed, Embase y el Registro Central de Ensayos Controlados de Cochrane (CCRCT) para estudios pediátricos sobre AIT con alérgenos inhalantes. Se evaluaron 33 publicaciones de 27 cohortes. En estos informes, participaron 2952 niños y 1491 fueron tratados activamente.
Según los datos obtenidos, la prevención primaria con pAIT parece segura, aunque con resultados inciertos. En uno de los ensayos se observó una efecto preventivo para nuevas sensibilizaciones transitorio y no alérgeno-específico al final del tratamiento (pero no durante ni tras el tratamiento). La reducción en la proporción de asma solo se evidenció después de una prolongación en uno de los estudios. Por tanto, este enfoque plantea algunos retos que aclarar, incluyendo la identificación de sujetos y la optimización de la dosis y duración efectivas.
La prevención secundaria sí demostró ser viable y segura según esta revisión. En un ensayo clínico doble ciego controlado con placebo se evaluó la prevención secundaria en niños asintomáticos y sensibilizados a ácaros o polen de gramíneas. Tras dos años de tratamiento con inmunoterapia sublingual, en este estudio no se observó una prevención en nuevas sensibilizaciones y tampoco mostró datos en relación al inicio de la enfermedad alérgica. Sin embargo, se describieron efectos pro-tolerogénicos como el desarrollo de IgG específica en el grupo activo y la inducción de citoquinas reguladores: Il10 y TGF-b. Por tanto, los niños en edad preescolar sensibilizados pero asintomáticos podrían ser objeto de intervención a este nivel de prevención.
La prevención terciaria fue estudiada en 28 publicaciones. Cambios en la tasa de sensibilización fueron reportados en 13 grupos al final del tratamiento. 6 de ellos observaron protección frente a nuevas sensibilizaciones en los grupos activos. En 9 publicaciones se evidenció un efecto tras el tratamiento en desarrollo de nuevas sensibilizaciones. 4 de ellos reportaron efectos favorables, mientras que en uno se observó un incremento en nuevas sensibilizaciones en el grupo activo. En 3 de 5 cohortes hubo un efecto de la pAIT sobre la progresión de la rinoconjuntivitis alérgica. La persistencia a largo plazo de este efecto se observó en 2 cohortes. 5 estudios que analizaban parámetros inmunomoduladores reportaron efectos favorables al final y tras el tratamiento (incremento en los niveles de IgG e IgG4 específicas, citoquinas reguladoras o niveles bajos de eosinófilos). Por tanto, a nivel de prevención terciaria, los resultados sobre la eficacia de la pAIT en nuevas sensibilizaciones o la progresión de la enfermedad alérgica se describen de manera inconsistente. Los autores concluyen que evaluar la eficacia de este enfoque es complejo y requiere más ensayos, particularmente enfocados en aspectos preventivos.
Los posibles mecanismos subyacentes a la inducción de tolerancia en AIT se han observado en niveles de prevención terciaria y secundaria, pero no en el nivel primario. Para la prevención primaria, algunos autores sugirieron que la inducción de tolerancia específica de alérgeno podría requerir un paso obligatorio que implicara la activación transitoria de la inmunidad primaria. En los otros niveles de prevención (secundaria y terciaria), los posibles mecanismos tolerogénicos incluyen la regulación positiva de IgG1 e IgG 4, principalmente, pero también IgA1 e IgA2. Estos anticuerpos pueden poseer capacidad neutralizante y podrían competir con IgE por el alérgeno. También pueden prevenir la activación de mastocitos y basófilos e inducir células B, que secretan estos anticuerpos bloqueadores y son responsables de la inmunotolerancia a largo plazo. Otras respuestas celulares implican la reducción del reclutamiento de eosinófilos, la supresión de células Th2 y la inducción de poblaciones de células reguladoras (de células linfoides innatas, células dendríticas, células T y B) y respuestas de citoquinas reguladoras (IL10 y TGF β), restableciendo el equilibrio Th1-Th2.
Según los autores, los efectos diferenciales de pAIT en cada etapa del desarrollo de niños y adolescentes deben ser evaluados para identificar la ventana de oportunidad para la prevención. Enfatizan en un inicio temprano de pAIT, ya que tener como objetivo el sistema inmunológico infantil puede ofrecer beneficios preventivos más efectivos y duraderos. Tener una sensibilización, especialmente polisensibilizaciones, a la edad escolar ya eleva el riesgo de asma en la edad adulta. Por lo tanto, los niños entre 5 meses y la edad preescolar, con un riesgo alto de desarrollar alergias debido a antecedentes familiares positivos, teniendo un menor grado de sensibilización y sin síntomas alérgicos o con síntomas leves, parecerían óptimos para pAIT.
El pAIT de ácaros es el más comúnmente estudiado. A diferencia de las mezclas heterogéneas de alérgenos, la aplicación de monoterapia de ácaros para la prevención primaria mostró un efecto protector sobre el desarrollo de nuevas sensibilizaciones.
Se ha establecido que la administración de AIT debe durar 2–3 años para lograr una inmunotolerancia duradera. Se están explorando regímenes de tratamiento más cortos, aunque el valor definitivo de los mismos aún no se ha aclarado, particularmente para enfoques de prevención primaria y secundaria.
Los autores de la revisión concluyen explicando que la eficacia global de pAIT sigue sin aclararse en niños debido a la naturaleza multifactorial de los resultados. La prevención secundaria parece factible y puede inducir inmunotolerancia. La prevención terciaria usando pAIT de pólenes de gramíneas y/o árboles parece ser capaz de prevenir la progresión de rinoconjuntivitis a asma, aunque los beneficios de pAIT basada en otras fuentes de alérgenos no son concluyentes. Es necesario definir la dosis óptima de alérgenos, adyuvantes y vías de administración.
La infancia representa una ventana de oportunidad para iniciar medidas profilácticas, pero se necesitan ensayos pediátricos adicionales bien diseñados para comprender los efectos preventivos de la AIT sobre las nuevas sensibilizaciones, el inicio y la progresión de enfermedades alérgicas junto con los beneficios inmunomoduladores.
Mercedes Ramírez Hernández. Complejo Hospitalario Universitario de Cartagena.Comité de Alergia Infantil SEAIC.
Bibliografía:
1,. Varsha Dwived, Sonja Kopanja, Klara Schmidthaler, Justyna Sieber, Christina Bannert, Zsolt Szépfalusi. Preventive allergen immunotherapy with inhalant allergens in Children. Allergy. 2024;79:2065–2087. DOI: 10.1111/all.16115
Importancia de la correcta identificación del niño con anafilaxia en Urgencias pediátricas
La mayoría de las guías nacionales e internacionales de anafilaxia recomiendan a nuestros pacientes acudir a urgencias después de un episodio de anafilaxia, independientemente de que se hayan tratado o no.
La puerta de entrada de todos ellos en Urgencias es el triaje. Allí, el personal, habitualmente de enfermería, decidirá en pocos minutos, cuándo, quién y donde serán atendidos. En esto consiste la priorización o triaje.
Todos sabemos que la anafilaxia es una reacción de hipersensibilidad potencialmente mortal y que por ello requiere el máximo nivel de prioridad. Sin embargo, los pocos datos disponibles muestran que estos pacientes no se identifican correctamente, reciben una prioridad menor que la merecen y reciben tratamiento tarde, con riesgo de empeorar su pronóstico.
Hasta la fecha, los datos disponibles acerca de la priorización del paciente con anafilaxia se han limitado a hospitales seleccionados y a sistemas de triaje específicos.
Desde el Comité de Alergia Infantil de Seaic, nuestro objetivo ha sido conocer y describir la priorización que reciben los niños con anafilaxia en España. Este es el primer estudio que revisa la priorización de la anafilaxia pediátrica más allá de un solo centro, superando las barreras de los múltiples sistemas de triaje existentes en España. Los participantes en el estudio trabajan en 36 hospitales de 12 comunidades autónomas distintas. Su conocimiento acerca de que anafilaxia es una emergencia que merece atención médica inmediata es correcto. Sin embargo, su aplicación práctica no lo es al analizar la prioridad que recibirían casos reales. Asi, los niños con anafilaxia probablemente son identificados de forma incorrecta en los servicios de urgencias pediátricas en España, lo que puede empeorar su pronóstico.
La anafilaxia debería identificarse en triaje para garantizar un tratamiento precoz y adecuado.
Los alergólogos podemos ayudar a mejorar el triaje del niño con anafilaxia por nuestro conocimiento acerca de sus peculiaridades, variedades en la presentación clínica, ausencia de datos patognomónicos, y porque aportamos un punto de vista que complementa la visión del especialista en Urgencias.
“Anaphylaxis must be suspected in triage. Triage advice regarding anaphylaxis identification should be included in anaphylaxis guidelines”
J Investig Allergol Clin Immunol 2025; Vol. 35(4)(enlace a la versión del artículo) doi10.18176_jiaci.1064.pdf
Esozia Arroabarren Aleman. Servicio de Alergología del Hospital Universitario de Navarra. Comité de Alergia Infantil de la Sociedad Española de Alergia e Inmunología Clínica
Alergia a las carnes
El valor nutricional de la carne se debe a que está formada por proteínas de alto valor biológico como fuente de aminoácidos esenciales, vitamina B y hierro, muy aprovechables por nuestro organismo.
La alergia a las carnes es una alergia alimentaria poco frecuente en los países desarrollados, a pesar de su elevado consumo. En la infancia, suele asociarse con dermatitis atópica y tiende a desaparecer en los primeros años de vida. No obstante, la alergia a la carne también puede aparecer “de novo” en la edad adulta.
En la actualidad, se desconoce la incidencia general y la prevalencia de la alergia a las carnes en la población general. Entre los pacientes con alergia alimentaria, se ha informado de alergia a la carne en el 3-15% de casos pediátricos y en el 3% de casos adultos.
Su baja prevalencia puede atribuirse, en parte, al hecho de que la mayoría de las carnes se consumen cocidas, y cocinarlas, normalmente aunque no siempre, reduce su alergenicidad.
Las reacciones pueden ser muy variables, desde un cuadro leve de picor en la boca y garganta o algunos habones aislados, pasando por angioedema (inflamación) de labios, párpados… hasta urticaria más extensa, rinoconjuntivitis, asma, síntomas digestivos, y/o cuadros muy graves de anafilaxia.
El tipo de carne que causa la alergia, presenta variabilidad geográfica, en relación con los diferentes hábitos de consumo. En nuestro medio, la alergia a las carnes de mamíferos es más frecuente que la alergia a las aves de corral. De acuerdo con esto, se ha descrito alergia a carne de canguro en Australia y a carne foca y ballena en Alaska.
La alergia a carne de vaca es la más comúnmente reportada, con una prevalencia que oscila entre el 1,5 y el 6,5% entre los niños con dermatitis atópica o con alergia alimentaria. Sin embargo, la alergia a carne de ternera, puede llegar al 20% en niños con alergia a leche de vaca. También se han informado casos de alergia a carne de cerdo, cordero, conejo, pollo y pavo, pudiendo ser alérgico a la carne de una especie o de varias.
- Alergia a carne de vacuno: frecuentemente debida a una proteína (albúmina sérica bovina), que se inactiva con el calor, pudiendo producir reacciones si la carne está cruda o poco cocinada, tolerándose perfectamente cuando la carne está bien cocinada. Se ha demostrado que la homogeneización y liofilización (empleadas en la producción de alimentos para bebés) disminuyen el contenido de albúminas e inmunoglobulinas en la carne, al igual que la digestión con pepsina. Algunos niños con alergia a proteínas de leche de vaca pueden presentar también reacciones con ternera e incluso con otras carnes, pero esto solo ocurre en un pequeño número de casos, generalmente cuando el alérgeno responsable de su alergia es la albúmina sérica bovina.
- Alergia a carne de cerdo: se pueden producir sensibilizaciones primarias a la albúmina sérica y a las inmunoglobulinas por vía inhalada o cutánea, que en primer lugar ocasionan alergia respiratoria y, de forma secundaria, y por reactividad cruzada, reacciones alérgicas tras la ingestión de carne de cerdo poco cocinada. El denominado “síndrome gato-cerdo” es la asociación de alergia respiratoria a gato y alergia alimentaria a la carne de cerdo. Característicamente, estos pacientes pueden no tener síntomas de rinitis al contacto con gatos, ya que la mayoría de los pacientes con síntomas alérgicos a la caspa de gato están sensibilizados a un alérgeno diferente. Se ha descrito también una asociación entre la alergia respiratoria a gato y la carne de cordero o de caballo, y una alergia respiratoria a hámster y alergia a carne de caballo.
- Alergia a carne de cordero: es la más infrecuente aunque, en ocasiones, se asocia a alergia a carne de ternera y cerdo.
- Alergia a carne de pollo: aunque la alergia a huevo es muy frecuente en la infancia, casi todos los niños alérgicos a huevo toleran la carne de pollo. Por otro lado, se han descrito adultos alérgicos a la carne de ave, con tolerancia de huevo y sin alergia a plumas o caspa de ave, cuyos alérgenos responsables, no han sido identificados. Por otra parte existe un síndrome poco frecuente, el “síndrome pescado-pollo”, donde las personas presentan síntomas alérgicos tanto con carne de pollo como pescado y en el que los alérgenos principalmente responsables son las parvalbúminas.
- Síndrome ave-huevo: debido al contacto frecuente con pájaros en el domicilio o en criaderos, hay un grupo minoritario de alérgicos que se sensibilizan por vía inhalada a proteínas de las plumas y/o excrementos de las aves y posteriormente desarrollan alergia al huevo y a la carne de pollo u otras aves (loros, periquitos, canarios, palomas, aves de corral, etc.). Afecta a personas adultas que presentan síntomas con la yema de huevo cruda o poco cocinada, a diferencia de lo que ocurre con la forma de alergia más habitual al huevo que se produce en la infancia y es por sensibilización a proteínas de la clara.
- Síndrome Alfa-gal: en general, las reacciones alérgicas a las carnes suelen ser reacciones de hipersensibilidad inmediata, que ocurren en la primera hora tras la ingesta. En este síndrome, las reacciones tras ingerir carnes de mamíferos (ternera, cerdo, cordero) tienen lugar más tarde de lo habitual, entre 3, 6 y hasta 8 horas después de haberlas ingerido, debido a la unión del alérgeno alfa-gal a los lípidos, que se absorben más lentamente y mediante mecanismos diferentes en comparación con las proteínas. Pueden producirse desde urticarias más o menos extensas hasta cuadros graves de anafilaxia. Estas personas reaccionan a un carbohidrato presente en las carnes de mamíferos no primates llamado galactosa alfa 1-3 galactosa (alfa-gal), al que se han sensibilizado. La sensibilización se ha producido en algún momento, tras la picadura de garrapatas que llevan alfa-gal en su saliva y la inoculan con la picadura. Además de reaccionar a los alimentos, los pacientes sensibilizados a alfa-gal también pueden tener reacciones al anticuerpo monoclonal cetuximab, gelatinas, coloides intravenosos, heparina, válvulas cardiacas de origen bovino o porcino y otros agentes hemostáticos derivados de productos animales.
En la alergia a las carnes, a diferencia de lo que sucede con otros alimentos, se han identificado alérgenos tanto de proteínas como de carbohidratos. Las albúminas séricas y las inmunoglobulinas parecen ser las principales proteínas alergénicas en la carne de ternera y otras carnes de mamíferos (cerdo, cordero, conejo), con una gran homología entre sí, lo que explicaría la alta reactividad cruzada entre carnes de mamíferos. Estas proteínas también podemos encontrarlas en aves como el pollo, aunque con una menor homología con las de los mamíferos, lo que explicaría que los individuos tiendan a reaccionar a carnes de mamíferos o aves pero rara vez a ambas.
El diagnóstico general de alergia a las carnes se realizará en base a la historia clínica y mediante la realización de pruebas cutáneas (prick-test) con extractos de las distintas carnes y la medición en sangre de los niveles de anticuerpos IgE específicos para cada uno de ellos. En ocasiones es necesaria la realización de una prueba cutánea con el alimento en freso (prick-prick) y si hay dudas, también puede ser necesario realizar un test de exposición oral controlada, siempre bajo supervisión del especialista.
En las reacciones con preparados cárnicos, como embutidos o salchichas, habrá que descartar una alergia a algún alimento o compuesto añadido o en el proceso de elaboración, como las proteínas de la leche, el huevo o los hongos.
Ante un diagnóstico confirmado, hoy por hoy, el tratamiento es evitar la ingesta de la carne responsable y los productos elaborados con ella (embutidos, salchichas, gelatinas,…). No obstante, conocer los alérgenos responsables, puede permitir una dieta más flexible, de manera que hay pacientes, cuya alergia depende de las albúminas séricas, que toleran la carne bien cocinada, y otros, presentan síntomas o no dependiendo del grado de cocinado y otro grupo no la tolera de ninguna forma. En algunos casos, se deberán eliminar de la dieta varios tipos de carnes, en cuyo caso, podría ser necesario aportar a la dieta suplementos de hierro y vitamina B.
Dra. Angélica Feliú Vila. Hospital Universitario del Tajo, Madrid. Comité de Alergia Infantil. SEAIC
Bibliografía
- Scott P Commins, MD, PhD. Allergy to meats. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed),Up To Date, Anna M Feldweg, MD. (Accessed on april of 2024).
- Scott H Sicherer, MD, FAAAAI. Food allergens: Clinical aspects of cross-reactivity. In: UpToDate, Robert A Wood, MD (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april of 2024).
- Julie Wang, MD. Component testing for animal-derived food allergies. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april 2024).
- García Figueroa, B.E, Mateo Borrega, M.B, 2021. Alergia a las carnes. Zubeldia, J.M, Baeza, M.L, Chivato, T, Jáuregui, I, Senent, C.J. Libro de las enfermedades alérgicas (287-292).
Anafilaxia en niños y adolescentes
La anafilaxia, como extremo más grave del espectro de las reacciones alérgicas, de afectación sistémica, aguda y potencialmente mortal, representa una patología de especial interés en pediatría.
En Europa, la anafilaxia es un problema común que afecta aproximadamente a 1 de cada 300 habitantes en algún momento de su vida. Según datos de la red europea de reacciones alérgicas graves, el 27% de los casos de anafilaxia se produce en menores de 18 años. Además, se ha descrito un incremento de su incidencia, especialmente en niños y preescolares.
Causas/desencadenantes
La causa más común de anafilaxia en niños son los alimentos (75%), seguida a distancia por los medicamentos (11%). Estudios epidemiológicos de la SEAIC* señalan a la alergia alimentaria como tercer motivo de consulta a los servicios de Alergología en edad pediátrica, con una tendencia al alza. La anafilaxia representa el 7,5% de los casos diagnosticados, siendo la leche de vaca, el huevo, los frutos secos y las frutas, los alimentos implicados más frecuentemente.
Los desencadenantes alimentarios varían según la edad y el área geográfica. En los dos primeros años de vida, la leche de vaca y el huevo son los desencadenantes más habituales; posteriormente, los frutos secos en edad preescolar, siendo el cacahuete el más común en todas las edades. En ciertos países europeos, particularmente en el área mediterránea, el melocotón tiene especial relevancia.
La anafilaxia inducida por ejercicio y dependiente de alimentos también debe ser considerada en los niños. Es un tipo especial de alergia mediada por IgE en la que el ejercicio o el consumo de un alimento causante no inducen síntomas por sí solos, pero el ejercicio tras la ingestión del alimento desencadena anafilaxia.
Por último, los padres con frecuencia expresan su preocupación sobre el riesgo de anafilaxia por vacunas; sin embargo, son una causa excepcional en niños.
Factores de riesgo y casos fatales
Las muertes por anafilaxia son raras. En aquellas relacionadas con alimentos, el 73% son debidas a frutos secos o cacahuete, siendo la leche de vaca responsable del 21% de las muertes en <16 años. El riesgo de muerte por anafilaxia aumenta dos veces entre adolescentes en comparación con los niños de 0-2 años. En general, los factores de riesgo identificados para la anafilaxia fatal por alimentos en niños incluyen asma coexistente, edad >10 años, alergia al cacahuete o frutos secos y la falta o la administración tardía de adrenalina.
Un tercio de los casos de anafilaxia ocurren en casa, el 25% en restaurantes y un 15% en la escuela.
Diagnóstico de anafilaxia
La anafilaxia es un diagnóstico predominantemente clínico, con afectación de varios sistemas y de inicio rápido tras la exposición al desencadenante. En los niños muy pequeños, el diagnóstico puede presentar algunos desafíos por la dificultad para describir ciertos síntomas como el prurito o la opresión faríngea; y ciertos signos, como la irritabilidad y los cambios de comportamiento, pueden ser difíciles de interpretar. La anafilaxia en los lactantes suele afectar a la piel (98%), al sistema respiratorio (59%), al aparato digestivo (56%) y, con menos frecuencia, al sistema cardiovascular. Cuando se produce hipotensión, en niños <10 años se define como una tensión arterial sistólica inferior a <70mmHg + (2 x edad en años) o un descenso >30% respecto a un registro basal.
Los síntomas respiratorios aparecen con frecuencia en los niños, especialmente en aquellos que padecen asma. Por otro lado, la anafilaxia puede suceder sin afectación de la piel, de tal forma que los signos cutáneos están ausentes en 10-20% de las anafilaxias. Este hecho afecta de manera crítica a su diagnóstico y tratamiento precoces.
Manejo
Para el autocuidado temprano de los pacientes con anafilaxia es fundamental educar a los padres, cuidadores y a los niños sobre el riesgo de anafilaxia, el control de las enfermedades concomitantes y sus desencadenantes y el autotratamiento de cualquier recurrencia. Durante la infancia, el cuidado/responsabilidad en la aplicación de medidas de evitación, reconocimiento de reacciones y tratamiento de las mismas recae inicialmente en padres y cuidadores. A medida que el niño crece se le enseña a evitar los desencadenantes, reconocer los síntomas y tratar futuras reacciones. Se ha estimado por encuestas que los niños de 9-11 años podrían reconocer síntomas y utilizar correctamente un AIA*.
A los pacientes se les deben recetar uno o más AIA*. Se recomienda que lleven siempre consigo un plan de acción de emergencia escrito y personalizado que ilustre cómo reconocer los síntomas e instruya sobre cómo inyectar rápidamente la adrenalina. Esta debe ser administrada por vía intramuscular en la parte anterolateral media del muslo manteniendo el AIA durante aproximadamente 3-10 segundos. La administración de adrenalina es el tratamiento de primera línea y no existen contraindicaciones absolutas para su administración. La dosis debe repetirse cada 5-15 minutos si los síntomas persisten y tras su administración se debe solicitar asistencia médica. Estas medidas preparan a los padres y a los niños para afrontar una reacción y evitar que se agrave.
Durante una anafilaxia es crucial evaluar periódicamente las vías respiratorias, la respiración, la circulación, el estado mental y la piel, posicionar al paciente según sus características y simultáneamente llamar a los servicios de emergencia. La mayoría de los niños deben colocarse tumbados boca arriba, a menos que haya dificultad respiratoria, en cuyo caso una posición sentada optimiza el esfuerzo respiratorio; si está inconsciente, el niño puede colocarse en posición de recuperación. Al mismo tiempo, y si es posible, se debe eliminar la exposición al desencadenante (p. ej., suspender la administración de medicamentos/agentes terapéuticos).
El tratamiento de la anafilaxia continúa con el traslado a un entorno de atención sanitaria, idealmente en ambulancia. En niños con anafilaxia y síntomas de broncoespasmo, se pueden administrar agonistas beta-2 de acción corta inhalados (p. ej., salbutamol); sin embargo, en presencia de síntomas persistentes no son alternativa a la administración repetida de adrenalina intramuscular. En caso de obstrucción de las vías respiratorias superiores debe considerarse nebulizar adrenalina. Los medicamentos de segunda línea incluyen agonistas beta2-adrenérgicos, glucocorticoides y antihistamínicos. Es necesario observar a los niños durante varias horas, siendo especialmente importante en reacciones graves y en aquellas que requieren varias dosis de adrenalina.
Conclusiones
La anafilaxia es una patología de especial relevancia en edad pediátrica, siendo los alimentos su causa más común. En los niños, los síntomas respiratorios y la ausencia de afectación cutánea son características que deben ser consideradas en su presentación. El asma, la adolescencia, la alergia al cacahuete o los frutos secos y la falta o la administración tardía de adrenalina son factores asociados a mayor gravedad. La educación periódica de niños y familias, sobre cómo identificar los episodios, responder adecuadamente y emplear el AIA son vitales y deben ser revisados regularmente.
Dr. Carmelo Escudero Díez. Servicio de Alergología Hospital Infantil Universitario Niño Jesús (Madrid). Comité de Alergia Infantil.
*SEAIC: Sociedad Española de Alergología e Inmunología Clínica.
*AIA: Auto-inyector de adrenalina.
Referencias recomendadas
- Turner PJ, Campbell DE, Motosue MS, Campbell RL. Global Trends in Anaphylaxis Epidemiology and Clinical Implications. J Allergy Clin Immunol Pract. 2020;8:1169-76.
- Wang Y, Allen KJ, Suaini NHA, McWilliam V, Peters RL, Koplin JJ. The global incidence and prevalence of anaphylaxis in children in the general population: A systematic review. Allergy. 2019;74:1063-80.
- Ojeda P, Ibáñez MD, Olaguibel JM, Sastre J, Chivato T. Alergológica 2015: A National Survey on Allergic Diseases in the Spanish Pediatric Population. J Investig Allergol Clin Immunol 2018;28(5):321-329. doi: 10.18176/jiaci.0308.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
- MS Shaker, DV Wallace, DBK Golden, J Oppenheimer, JA Bernstein, RL Campbell, et al. Anaphylaxis—a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020;145:1082–1123.
- Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020 Jun;8(6):1854-1864. doi: 10.1016/j.jaip.2020.02.010.
MI HIJO ES ALÉRGICO AL MARISCCO ¿PUEDE COMER PESCADO?
INTRODUCCIÓN
La alergia a marisco es una de las alergias alimentarias más frecuentes. Es más frecuente en adultos que en niños y en éstos últimos suele debutar en la infancia tardía o adolescencia. Su prevalencia varía entre países, siendo del 1.3% en Europa en niños entre 2 y 17 años1.
CLASIFICACION TAXONÓMICA
Marisco se define como animal marino invertebrado, por ello es importante conocer su clasificación taxonómica. El marisco se divide en dos reinos: moluscos y artrópodos2-4.
- Los moluscos se dividen a su vez en los subfilos:
- Gastrópoda (abalón, caracol, lapa)
- Bivalvos (almeja, mejillón, vieira, ostra)
- Cefalópodos (pulpo, sepia, calamar)
- Los artrópodos se clasifican en los subfilos:
- Crustáceos (gamba, langosta, bogavante, nécora, cigala, langostino, buey de mar, centollo, santiaguiño)
- Queliceratos (ácaros, arañas)
- Hexópodos (cucaracha)
Los crustáceos producen reacciones alérgicas más frecuentemente que los moluscos y dentro de ellos, la gamba es el crustáceo que con más frecuencia produce reacciones alérgicas2.
REACCIONES ADVERSAS
En cuanto a las reacciones adversas al marisco, hemos de diferenciar las reacciones adversas inmunológicas de las no inmunológicas:
- REACCIONES ADVERSAS INMUNOLÓGICAS:
IgE mediadas: ocurren en las 2 horas siguientes a la ingesta del alimento. Pueden producir desde picor oral (60-95%), ronchas, inflamación facial; síntomas gastrointestinales como náuseas, vómitos, dolor abdominal (20%); síntomas respiratorios como congestión nasal, tos, dificultad para respirar o dificultad para tragar o anafilaxia (21-33%)1,2. La reacción alérgica no sólo ocurre tras la ingesta, sino que también puede desencadenarse con la inhalación de los vapores de cocción. También es importante saber que el ejercicio físico es un cofactor muy frecuente en la anafilaxia por marisco en niños1,2.
La sensibilización puede producirse bien a través de la ingesta o bien a través de la piel (sobre todo en pacientes con dermatitis atópica)2,3.
No IgE-mediadas: El Síndrome de enterocolitis por proteínas de la dieta (FPIES en inglés) por marisco en niños es poco frecuente (0,8% de los casos de FPIES) 5. Los síntomas consisten en vómitos proyectivos, repetidos, entre 1 y 4 horas de la ingesta del alimento, que pueden ir asociados a letargia, hipotensión, palidez y/o diarrea. Los síntomas se repiten cada vez que el niño toma el alimento y se resuelve una vez se retira el alimento implicado de la dieta5-6.
- REACCIONES ADVERSAS NO INMUNOLÓGICAS:
Estos animales invertebrados pueden ingerir toxinas (algas tóxicas), contaminantes o parásitos. Dependiendo de la cantidad de toxina ingerida, los síntomas y duración de la clínica varía. Los síndromes más frecuentes son los síntomas gastrointestinales (náuseas, vómitos, dolor abdominal, diarrea), intoxicación paralítica (hormigueo o adormecimiento de lengua, cuello y dedos, debilidad, dificultad respiratoria), neurotoxicidad (síntomas gastrointestinales y neurológicos, como parálisis y coma), ciguatera (síntomas neurológicos y cardiovasculares) e intoxicación amnésica (síntomas gastrointestinas seguidos de síntomas neurológicos)1.
ALERGENOS DEL MARISCO
Un alérgeno es una sustancia antigénica que induce una reacción alérgica en un organismo. Los alérgenos más importantes del marisco son1,2:
- Tropomiosina: es el principal alergeno de la alergia a gamba, ostra, caracol y calamar. También está en insectos, ácaros, insectos comestibles y anisakis simplex. Es resistente a la temperatura y a la digestión, por lo que no se degrada al cocinarlo ni con el jugo gástrico. El 90-100% de los pacientes alérgicos a un tipo de crustáceo también lo será a otros crustáceos y el 65% también tendrá alergia a moluscos. Hay estudios que demuestran que pacientes con alergia a marisco pueden tener alergia a los ácaros del polvo.
- Arginina-kinasa: también resiste altas temperaturas y es muy volátil, por lo que el vapor producido durante la cocción del marisco puede producir síntomas respiratorios. La arginina-kinasa se encuentra fundamentalmente en el camarón, cangrejo, pulpo y ácaros.
- Otros alérgenos menos relevantes son: cadena ligera de la miosina, proteína de unión al calcio sarcoplásmico, troponina C, etc.
Reactividad cruzada
- Crustáceos-moluscos: El 45% de los alérgicos a crustáceos también tienen alergia a moluscos, sin embargo, la mayoría (70-80%) de las personas alérgicas a moluscos también lo son a crustáceos1,2.
- Ácaros- crustáceos: pacientes alérgicos a ácaros pueden desarrollar alergia a marisco por reactividad cruzada. En ocasiones los síntomas tras ingesta de marisco se limitan al área orofaríngea (picor de boca, de garganta…) debido a la reactividad cruzada entre a tropomiosina de ácaros y marisco; a esto se le llama Síndrome de Alergia Oral ácaros-marisco 1-2
TRATAMIENTO
Los pacientes alérgicos a algún tipo de marisco deben evitar el consumo de todo tipo de marisco hasta que sea estudiado en Alergología1.
ENTONCES, ¿MI HIJO PUEDE COMER PESCADO?
El principal responsable de la alergia al pescado es la parvalbúmina. Es un alérgeno distinto al alérgeno principal del marisco (tropomiosina). Como diría una sabia compañera: “en lo único en que se parece el marisco y el pescado es que ambos viven en el mar”. Por tanto, los pacientes alérgicos a marisco sí pueden comer pescado1.
Dra. Paloma Jaqueti Moreno. Hospital La Mancha Centro, Alcázar de San Juan, Ciudad Real. Comité de Alergia Infantil SEAIC.
BIBLIOGRAFÍA
- IgE-Mediated Shellfish Allergy in Children. Mattia Giovanini, Burcin Beken, Betul Buyuktiryaki, Simona Barni, Giulia Liccioli, Lucrezia Sarti, Lorenzo Lodi, Matteo Pontone, Irene Bartha, Francesca Mori, Cansin Sackesen, George du Toit, Andreas L Lopata, Antonella Muraro. 2023 Jun 11;15(12):2714. doi:10.3390/nu15122714.
- IgE Mediated Shellfish Allergy in Children-A Review. Ariana Giannetti, Andrea Pession, Irene Bettini, Giampaolo Ricci, Giuliana Gianni, Carlo Caffarelli. 2023 Jul 12;15(14):3112. doi: 10.3390/nu1514311
- Food allergy and hypersensitivity reactions in children and adults-A review. Sandra G Tedner, Anna Asarnoj, Helena Thulin, Marit Westman, Jon R Konradsen, Caroline Nilsson. J Intern Med. 2022 Mar;291(3):283-302. doi: 10.1111/joim.13422. Epub 2021 Dec 22
- C. Diéguez Pastor, F. Martín Muñoz, M. Reche Frutos, P.C. Vlaicu. Peculiaridades clínicas de la alergia a los alimentos de origen animal. En: Dávila, I. Jáuregui, I. Olaguibel, J. Zubeldía, J. SEAIC (Sociedad Española de Alergología e Inmunología Clínica). Tratado de Alergología tomo III. 2ª edición. Madrid: Ergon. 2016. Página 1023-1048.
- Infante S, Argiz L, Cabrera-Freitag P, Fernández-de-Alba I, Moya B, Escudero C (2022) Spanish Survey of Food Protein-Induced Enterocolitis Syndrome. J Investig Allergol Clin Immunol 2023; Vol 33(2): 134-136. doi: 10.18176/jiaci.0828
- Infante, S., Marco-Martín, G., Sánchez-Domínguez, M., Rodríguez-Fernández, A., Fuentes-Aparicio, V., Alvarez-Perea, A., … Zapatero, L. (2017). Food protein-induced enterocolitis syndrome by fish: Not necessarily a restricted diet. Allergy, 73(3), 728–732. doi:10.1111/all.13336
Mi niño tiene urticaria. ¿La urticaria es igual a alergia?
La urticaria es una enfermedad de la piel muy común. Consiste en la aparición de ronchas/habones y/o hinchazón/angioedema, que habitualmente se acompañan de picor. Si dura menos de 6 semanas se clasifica como urticaria aguda y si dura más de 6 semanas como urticaria crónica. Las ronchas aparecen y desaparecen con rapidez, cambian de localización y duran menos de 24 horas y puedes reaparecer en los días siguientes. La hinchazón puede afectar a la cara, las manos, los pies, los genitales y suele ser pruriginoso.
La mayoría de las urticarias en la edad infantil son agudas y no tienen relación con la alergia. La infección parece ser la causa predisponente más frecuente (más del 40%) de urticaria en lactantes y niños en comparación con los adultos. Suelen ser infecciones víricas leves y el niño mantiene buen estado general a pesar de que la urticaria afecte a gran parte de la superficie corporal. Los síntomas de la infección viral pueden estar presentes o no.
¿La urticaria es igual a alergia? En pocas ocasiones la urticaria que dura varios días o semanas es producida por una alergia alimentaria; medicamentosa o por una picadura de insecto. En estos casos, es habitual que la urticaria aparezca antes de que pasen dos horas tras la ingesta del alimento/medicamento o haya antecedente de picadura de insecto en los minutos previos (muy inusual en niños). En ocasiones, pueden asociarse síntomas respiratorios, digestivos, mareos, el niño podría estar mucho más nervioso y afectado. En estos casos, podría tratarse de una reacción alérgica generalizada (anafilaxia) y se debe instaurar tratamiento con adrenalina y solicitar asistencia sanitaria de inmediato.
La urticaria crónica es mucho menos frecuente en niños y en la práctica, la mayoría de los pacientes no tienen una causa identificable. Se clasifica como urticaria crónica espontánea. En un pequeño porcentaje la urticaria crónica en niños se asocia a presencia de anticuerpos autoinmunes. Los medicamentos antiinflamatorios no esteroideos (ibuprofeno, metamizol, paracetamol, etc.) se han identificado como principales factores agravantes de la urticaria crónica espontánea en niños.
En conclusión, la urticaria aguda (<6 semanas de duración) es más frecuente en niños que la urticaria crónica (>6 semanas de duración) y suele ser un proceso benigno, transitorio, y que no se asocia a patología grave subyacente en la la gran mayoría de los casos.
Autora:
Krasimira Baynova, MD. Comité de Alergia Infantil SEAIC. CSUR Angioedema. UGC Alergología. Hospital Universitario Virgen del Rocío. Sevilla.
Bibliografía
1) Meeyong Shin et al. Prevalence and Causes of Childhood Urticaria Allergy Asthma Immunol Res. 2017 May; 9(3): 189–190.
2) Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et all. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018 Jul;73(7):1393-1414. doi: 10.1111/all.13397. PMID: 29336054.
3) Brüske I, Standl M, Weidinger S, et al. Epidemiology of urticaria in infants and young children in Germany–results from German LISAplus and GINIplus Birth Cohort Studies. Pediatr Allergy Immunol 2014;25:36 –42.
4) Cornillier, H., Giraudeau, B., Munck, S., Hacard, F., Jonville-Bera, A.-P., d’ Acremont, G., … Maruani, A. (2018). Chronic spontaneous urticaria in children – a systematic review on interventions and comorbidities. Pediatric Allergy and Immunology, 29(3), 303–310.
Enlace de interés práctico:
https://enfamilia.aeped.es/temas-salud/decalogo-urticaria-infantil
Actualización en Anafilaxia (guía GALAXIA)
Recientemente, se ha presentado en el Congreso de la Sociedad Española de Alergología e Inmunología Clínica, la tercera actualización de la Guía Galaxia, un documento de posicionamiento sobre el diagnóstico y el tratamiento de la anafilaxia, en esta edición se presentan novedades relevantes como la perspectiva del paciente y la implicación de la sociedad para la creación de ambientes seguros.
La anafilaxia es la presentación clínica aguda más grave de una reacción alérgica y puede comprometer la vida del paciente, es una emergencia médica que requiere de una actuación inmediata, con el reconocimiento de la clínica y un tratamiento precoz, y de un manejo a medio y, largo plazo que incluya medidas de educación y prevención, en algunos casos se puede conseguir la curación, como la anafilaxia por veneno de himenópteros, o en algunas alergias alimentarias
Todo paciente que ha sufrido una anafilaxia debe ser derivado a un especialista de Alergología para realizar un estudio completo, confirmar el desencadenante sospechoso, prevenir nuevos episodios, evaluando la posibilidad del paciente de volver a desarrollarlos y recibir información, y un tratamiento adecuado.
El paciente diagnosticado de anafilaxia debe ser valorado por el especialista
por lo menos una vez al año, y en esa consulta se le debe explicar y dar por escrito:
- Normas estrictas de evitación de los alérgenos (sustancias que provoca la reacción alérgica) implicados o sospechosos que incluyan los alergenos específicos y su reactividad cruzada con otros productos, esta información debe ser revisada en cada visita
- Educación para el reconocimiento precoz de los síntomas típicos de la anafilaxia incluyendo un plan de actuación que indique al paciente que tratamiento administrar dependiendo de la clínica que presente en el momento de la reacción, y que le permita una actuación lo más rápida posible, para evitar un desenlace fatal
- Educación y entrenamiento sobre el uso de autoinyectores de adrenalina. En los siguientes casos es necesario llevar dos dispositivos: si hay coexistencia de asma inestable o moderada-grave persistente y alergia a alimentos, si hay coexistencia de enfermedad mastocitaria y/o triptasa basal elevada, falta de acceso rápido a asistencia sanitaria por barreas geográficas o idiomáticas, requerimiento previo de más de una dosis antes de llegar a un hospital, reacción previa casi mortal, dosis del autoinyector inferior a la calculada por peso del paciente. Se deben administrar de forma precoz.
Existe un uso deficiente de los autoinyectores, por escasa información, miedo o aversión al tratamiento intramuscular, dificultades económicas o afectación en la calidad de vida por la dificultad de llevarlo consigo. Los padres, tutores y docentes deben estar entrenados en su uso en el caso de los niños. El alergólogo debe informar de que la adrenalina tiene una vida útil corta, por lo que se debe revisar la fecha de caducidad y la reposición de los dispositivos caducados
- Recibir información sobre las enfermedades o tratamientos (comorbilidades) que pueden provocar una sintomatología más grave, o disminuir la atención del paciente ante los síntomas. El asma mal controlada, las enfermedades cardiovasculares, algunos fármacos como los betabloqueantes, los IECA (inhibidores del enzima convertidor de la angiotensina), ansiolíticos, pueden aumentar el riesgo de desarrollar una anafilaxia fatal
- Medidas de prevención: Tratamientos que pueden curar o mitigar la sensibilización a alérgenos específicos, como la inmunoterapia oral con alimentos en casos seleccionados, desensibilización a fármacos, o inmunoterapia con venenos de himenópteros. Llevar una pulsera o tarjeta de identificación médica en la cartera, recomendar llevar teléfono móvil si el paciente está solo
También es labor de los especialistas, pacientes, y asociaciones de pacientes impulsar medidas de salud pública, como exigir la mejora del etiquetado de los alimentos, exigir planes de acción en colegios, restaurantes ( información disponible y accesible para los ingredientes del alimento no envasado) y centros de ocio ( recomendar espacios alergoprotegidos que dispongan de lo necesario para asistir a una persona que sufra un episodio de anafilaxia ) e intentar conseguir que en edificios públicos, centros de ocio , y comerciales se disponga de autoinyectores de adrenalina, como ahora se dispone de desfibriladores.
Se aconseja al lector visualizar los siguientes videos sobre
Auto inyectores de adrenalina:
Anapen: https://youtu.be/8I-r_ftcUMc
Jext:: https://youtu.be/QDXRhZBNjFw
Altellus: https://www.epinefrina.es/es-es/epinefrinaguide?userstate=public#
Emerade: https://youtu.be/NzyNoUeiu9o
Dra. M.ª Isabel Alvarado Izquierdo. Alergóloga del Complejo Hospitalario Universitario de Cáceres. Miembro del Comité de Alergia Infantil de la SEAIC
CÓMO ENFRENTARSE A UNA EPIDEMIA DE BRONQUIOLITIS Y EL ASMA INFANTIL.
Hemos superado una pandemia en los últimos años de un virus respiratorio que nos ha traído de cabeza y cuando estábamos “descuidados” nos encontramos con que nuestros niños ahora están “en peligro”. ¿Es así?, ¿nos debemos preocupar los padres/madres? ¿Y si nuestros hijos tienen asma?, ¿hay algo que podamos hacer?
Tenemos las UCI pediátricas y los servicios de urgencia saturados con casos de esta enfermedad respiratoria. Se ha estimado que hasta un 40% más que en años anteriores a la pandemia. Entonces: ¿Qué debemos saber?, ¿podemos prevenir esta infección? ¿Si nuestro hijo/a tiene asma, debemos tener especial precaución?
Esto era algo que podíamos prever, pues hemos pasado 2 años en los que los niños han estado con medidas de aislamiento estrictas que han ido desapareciendo, tales como mascarillas y la distancia social, han estado menos expuestos a virus y ahora, se enfrentan de nuevo a los virus típicos de estas fechas: la bronquiolitis, que aunque es una enfermedad epidémica y por tanto, todos los años hay muchos casos, este año parece que se están detectando con mayor frecuencia; la gripe, que se trata de otra enfermedad epidémica y se puede solapar con la anterior y además la Covid-19. Y los 3, pueden solaparse y darse en la misma época.
La bronquiolitis es una enfermedad de la vía respiratoria inferior que suele darse en menores de 2 años y que es causada fundamentalmente por el virus respiratorio sincitial (VRS) aunque también pueden influir otros virus respiratorios. Las pequeñas vías respiratorias bajas llamadas bronquios y bronquiolos se inflaman debido a esta infección, se llenan de moco y esto causa dificultad respiratoria. Suele ocurrir en los meses de invierno pero también puede tener un pico en los meses de primavera. Llamamos “bronquiolitis” al primer episodio y el resto ya serían episodios de “bronquitis”.
Lo primero que debemos saber es que no debemos alarmarnos a priori. Nos preocuparían sobre todo los niño/as más pequeñitos, fundamentalmente entre 2 y 6 meses o aquellos con algún factor de riesgo (inmunodeprimidos, prematuros, enfermedades cardiológicas, asma no controlada…) pero debemos ser conscientes, que aunque no existe un tratamiento específico, podemos tomar ciertas medidas para “prevenir” o tratar de la forma más adecuada. Generalmente en niños mayores y adultos, el cuadro suele pasarse como un simple cuadro catarral leve con mucosidad.
Ya que no existe un tratamiento específico, pues sobre todo en lactantes muy pequeños, los broncodilatadores no son eficaces, y no se trata con antibióticos, puede ser que estos niños precisen de oxigenoterapia y tengan que acudir a urgencias y que ingresar en el hospital. De ahí el “colapso” de urgencias y la atención hospitalaria. La buena noticia es que recientemente la Comisión Europea acaba de aprobar un anticuerpo monoclonal, llamado nirsevimab, que ha demostrado eficacia y seguridad en la prevención de enfermedad e ingreso por VRS para toda la población de recién nacidos y lactantes sanos o con enfermedades previas, aunque todavía no es de uso generalizado y habrá que esperar, por el momento, en la mayoría de casos.
Debemos estar atentos a las señales de alarma: decaimiento, falta de apetito, adormecimiento, fiebre de varios días que no cede (aunque no siempre tiene que haber fiebre) que puede significar una sobreinfección bacteriana, respiración superficial con taquipnea y tiraje subcostal (respiración rápida, podemos ver como las costillas suben y el abdomen sube y baja) y ante éstas, acudir a nuestro pediatra o médico especialista, y establecer las medidas de confort más adecuadas (tenerlos nutridos e hidratados, antitérmicos en caso de fiebre, etc).
Para prevenir estas infecciones podemos realizar lavado frecuente de manos, evitar el contacto con personas que presenten síntomas de catarro (no visitar o coger a niños de riesgo o bebés muy pequeños si tenemos un leve catarro aunque sea con síntomas leves) o evitar espacios con humo de tabaco, entre otras.
El 50% de los niños que tienen un episodio de bronquiolitis tiene más probabilidades de sufrir nuevos episodios de bronquitis y tener bronquitis de repetición, aunque normalmente conforme van creciendo y sobre todo a partir de los 3 años estos cuadros se reducen y dejan de ocurrir. Esto no quiere decir que todos vayan a ser asmáticos con el tiempo, pero evidentemente, habrá que vigilar y seguir su curso para ver evolución, pues un pequeño porcentaje de estos niños podrán desarrollar un asma infantil en el futuro.
En el caso de niños con episodios de broncoespasmos de repetición y/o asma debemos tener la precaución de mantener su tratamiento de base en el caso de que lo tengan, bien con inhaladores u otros fármacos, seguir las instrucciones en cuanto al tratamiento del pediatra o especialista (alergólogo, neumólogo) que les trate y establecer las medidas anteriormente descritas.
En definitiva, mucho ánimo a esos padres y madres que se enfrentan a esta época de virus; recomendando información veraz y actualizada y trabajo en equipo, padres/madres y personal sanitario.
Margarita Tomás Pérez. Médico adjunto de Alergología. Hospital Universitario La Paz. Comité de Alergia Infantil. SEAIC
1-. Susana Rodríguez M. Bronchiolitis in the year of COVID-19. Arch Argent Pediatr.2020;118(3):222-223.
2-. Gómez C, Alarcón G, Cifuentes L. Beta-2 agonists for the treatment of bronchiolitis. Beta-2 agonistas para el tratamiento de bronquiolitis. Medwave. 2020;20(8):e7945. Published 2020 Sep 3. doi:10.5867/medwave.2020.08.7947.
3-. Hammitt LL, Dagan R, Yuan Y, Baca Cots M, Bosheva M, Madhi SA, et al;MELODY Study Group. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022;386(9):837-846.
4-. Garcia-Garcia ML, Calvo Rey C, Rabes T. Pediatric Asthma and viral infection. Arch Bronconeumol. 2016; 52(5): 269–273.
Más allá de la piel
La dermatitis atópica es una condición dermatológica cuya cronicidad afecta la calidad de vida de pacientes pediátricos y de sus cuidadores.
A menudo nuestros esfuerzos terapéuticos se centran en tratar lo más visible, olvidándonos o subestimando las heridas y cicatrices más profundas e invisibles.
El artículo “Skin Disease in Children: Effects on Quality of Life, Stigmatization, Bullying, and Suicide Risk in Pediatric Acne, Atopic Dermatitis, and Psoriasis Patients” se centra en investigar las consecuencias emocionales que pueden desencadenaralgunas patologías dermatológicas crónicas, entre ellas la dermatitis atópica.
El peso emocional de la dermatitis atópica es más extenso que el prurito que puede manifestar. La carga emocional producida por la percepción negativa de la propia imagen corporal dificulta las relaciones sociales con otros coetáneos o incluso con los familiares más cercanos.
Los padres u otros familiares manifiestan a menudo sensación de frustración, agotamiento, culpabilidad e impotencia que inconscientemente puede repercutir en la relación con el menor y alterar las dinámicas familiares.
Se ha observado que pacientes los pediátricos con dermatitis atópica sufren alteraciones del comportamiento (mayor dependencia, aflicción, trastornos del sueño) similares a las que pueden padecer los pacientes pediátricos con otras enfermedades crónicas de mayor afectación sistémica.
El prurito les limita no sólo en sus casas, sino también fuera, en las actividades de ocio y extraescolares. Les exponen a actos de bulling que a veces conllevan a estados de ansiedad e incluso depresión que, en ocasiones, por suerte raras, pueden conducir a ideas autolíticas e intento de suicidio.
Para frenar esa deriva es necesario implantar herramientas para aquellas figuras que a todos los niveles son referencia en la vida del menor:
- A los padres, cuidadores principales, hay que educarles sobre los diferentes aspectos de la enfermedad y ofrecerles herramientas saludables para saber resolver conflictos y asegurar una armonía familiar.
- A los educadores hay que instruirles para que sean capaces de desarrollar un ambiente escolar que ofrezca apoyo al menor. Programas escolares dirigidos a entrenar al profesorado a reconocer precozmente actos de bulling y favorecer la inclusión y relación entre compañeros.
- A los médicos para que seamos capaces de tratar el paciente de manera global y no sólo las lesiones físicas de la enfermedad. Para que no nos limitemos en la apariencia del cuadro cutáneo, sino investigando también componentes emocionales, derivar a otros especialistas si fuera necesario, o poniendo en contacto al paciente y la familia con otros pacientes que sufran o haya sufrido de la misma condición. Además de intentar una decisión compartida médico-paciente de la mejor línea terapéutica que tenga en cuenta las prioridades del paciente, y así fortalecer la relación médico-paciente.
Concluyendo, la dermatitis atópica es una patología con gran impacto en todos los niveles de la vida del paciente, tanto físico como psicológicos. Se necesita de una visión multidisciplinar que incluya a todas las figuras capaces de mejorar la calidad de vida del paciente y limitar las afecciones de la dermatitis atópica, que va “mas allá de la piel”.
Nicola Giangrande, Hospital público da Mariña, Burela, Lugo. Comité de Alergia Infantil. SEAIC.
Actualización de la “Hipótesis de la exposición dual al alérgeno”
La prevalencia de la alergia alimentaria ha aumentado dramáticamente en las últimas dos décadas a nivel mundial, lo que indica que los factores ambientales pueden estar impulsando la progresión de la enfermedad.
Actualmente sabemos que factores como el estilo de vida, los hábitos dietéticos y las interacciones materno-neonatales juegan un papel fundamental en el desencadenamiento de la alergia alimentaria, incluida la composición cualitativa y cuantitativa de la microbiota. Estos factores parecen tener una mayor influencia en las primeras etapas de la vida, observación que ha llevado a la generación de diversas hipótesis para explicar la epidemia de alergia alimentaria en la que nos vemos actualmente inmersos y que incluye la “hipótesis de la exposición dual al alérgeno”.
Clásicamente, se creía que la alergia alimentaria se originaba en el intestino, a través de un fallo en los mecanismos de tolerancia oral. Sin embargo, la observación de que la mayoría de los alérgicos a cacahuete reaccionaban durante la primera exposición oral, llevó a los investigadores a plantear que la sensibilización podría producirse por vías distintas a la vía oral.
La ruta de sensibilización cutánea a alérgenos alimentarios se ha establecido con fuerza en la última década y, actualmente, se está proponiendo la vía respiratoria como otra interesante y potencial ruta de sensibilización a los alérgenos alimentarios.
La “hipótesis de la exposición dual al alérgeno” (a través de la piel y el intestino) se basa en la observación de que los bebés con eczema tienen un alto riesgo de desarrollar alergia alimentaria mediada por IgE. Esta hipótesis establece que el contacto con alérgenos a través de la piel eccematosa puede causar sensibilización alérgica, mientras que es más probable que la exposición a través del tracto gastrointestinal induzca tolerancia inmunológica.
Esta hipótesis evolucionó al profundizar en el conocimiento de la alergia al cacahuete. De esta manera, se determinó que la exposición oral a los alérgenos del cacahuete conduce a tolerancia oral, mientras que la exposición a través de la piel, en ausencia de exposición oral previa, conduce a alergia.
Un ensayo clínico histórico, LEAP (N Engl J Med 2015), demostró claramente que la administración oral temprana y regular de proteínas de cacahuete, en bebés sensibilizados de alto riesgo y no sensibilizados, redujo drásticamente la incidencia de alergia a cacahuete en niños de 5 años, en comparación con bebés que evitaron la ingestión de cacahuete.
Estos hallazgos respaldan la “hipótesis de la exposición dual al alérgeno” y enfatizan la importancia de la exposición oral temprana al cacahuete antes de que pueda ocurrir la sensibilización a través de rutas alternativas.
Años más tarde, los mismos autores (JACI 2018) concluyen, en un nuevo estudio, que el consumo temprano de cacahuete en lactantes con alto riesgo de alergia al cacahuete es alérgeno específico y no previene el desarrollo de otras enfermedades alérgicas ni la sensibilización a otros alérgenos alimentarios o aeroalérgenos, y que el consumo de cacahuete no acelera la resolución del eczema o la alergia al huevo.
Kulis y cols (JACI 2021) proponen una actualización de la “hipótesis de la exposición dual”, con la vía respiratoria como otra potencial ruta de sensibilización a los alérgenos alimentarios. Así, las células dendríticas tanto de la vía respiratoria como de la piel atópica, migran a los ganglios linfáticos regionales donde presentan el alérgeno alimentario a las células T (CD4+) vírgenes que, en un ambiente rico en citocinas innatas, se diferenciarán a TH2 con la producción de citocinas específicas que activarán a los linfocitos B para producir IgE específica de antígeno, mientras que, por el contrario, cuando la exposición inicial se produce por vía oral, las células dendríticas presentan el antígeno alimentario a los linfocitos T (CD4+) vírgenes en los ganglios linfáticos mesentéricos, en un ambiente tolerogénico característico del tracto gastrointestinal, que hará que se diferencien en linfocitos T reguladores, favoreciendo así la tolerancia alimentaria.
En los países en los que la alergia a cacahuete es muy prevalente, y donde el consumo es frecuente, parece que existe una fuente ambiental de cacahuete en el polvo doméstico, así como también en comedores y aulas escolares, donde los niños pasan la mayor parte del tiempo, pudiendo ser inhaladas. Las proteínas de cacahuete dentro del polvo parecen estar estructuralmente intactas y se ha demostrado que contienen epítopos de unión a IgE. Estos autores han demostrado, mediante estudios realizados en ratones y en células humanas, que la vía aérea es una vía factible de sensibilización a alérgenos alimentarios.
No obstante, en la actualidad se desconoce si la sensibilización ocurre exclusivamente a través de una ruta o una combinación de rutas, aunque los autores propugnan que esto difiere entre individuos. Además, no está claro si la exposición por ruta no oral al cacahuete ambiental puede promover la tolerancia en algunas personas. De hecho, los estudios en animales han demostrado que, tanto en la vía respiratoria como en la cutánea, la exposición a antígenos en condiciones no inflamatorias puede inducir tolerancia, y la inmunoterapia epicutánea se está investigando como tratamiento para la alergia al cacahuete.
Los autores defienden que los estudios futuros deben centrarse en el papel de la exposición de las vías respiratorias y la sensibilización a otros alimentos, ya que también se han detectado otras proteínas alimentarias como proteínas de leche y huevo en el polvo doméstico.
Además, no debemos olvidar que, otros factores ambientales como los contaminantes del aire, pueden desempeñar un papel en la sensibilización de las vías respiratorias, dado que las tasas urbanas de alergia alimentaria son más altas que las tasas en las zonas rurales.
Por lo tanto, los autores demuestran, mediante estudios realizados en ratones y en células humanas, que la vía respiratoria puede tener un papel en la “hipótesis de la exposición dual al alérgeno”, al igual que la ruta cutánea. Por último, alientan al desarrollo de nuevas investigaciones, ya que quedan muchas preguntas por resolver, y defienden que la modulación de los componentes ambientales (microbioma, proteoma, metaboloma del entorno doméstico), incluida la eliminación del cacahuete del medio ambiente antes de la exposición oral, podría conducir a la prevención de la alergia alimentaria.
Angélica Feliú Vila. Hospital del Tajo, Aranjuez, Madrid. Comité de Alergia Infantil SEAIC
BIBLIOGRAFÍA
1.- Heine RG. Food Allergy Prevention and Treatment by Targeted Nutrition. Ann Nutr Metab. 2018;72 Suppl 3:33-45. doi: 10.1159/000487380. Epub 2018 Apr 9. PMID: 29631274.
2.- Renz H, Allen KJ, Sicherer SH, Sampson HA, Lack G, Beyer K, Oettgen HC. Food allergy. Nat Rev Dis Primers. 2018;4:17098. doi: 10.1038/nrdp.2017.98. PMID: 29300005.
3.- Wang S, Wei Y, Liu L, Li Z. Association Between Breastmilk Microbiota and Food Allergy in Infants. Front Cell Infect Microbiol. 2022;11:770913. doi: 10.3389/fcimb.2021.770913. PMID: 35096637; PMCID: PMC8790183.
4.- Du Toit G, Roberts G, Sayre PH, Bahnson HT, Radulovic S, Santos AF, Brough HA, Phippard D, Basting M, Feeney M, Turcanu V, Sever ML, Gomez Lorenzo M, Plaut M, Lack G; LEAP Study Team. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med. 2015;372(9):803-13. doi: 10.1056/NEJMoa1414850. Epub 2015 Feb 23. Erratum in: N Engl J Med. 2016 Jul 28;375(4):398. PMID: 25705822; PMCID: PMC4416404.
5.- Du Toit G, Sayre PH, Roberts G, Lawson K, Sever ML, Bahnson HT, Fisher HR, Feeney M, Radulovic S, Basting M, Plaut M, Lack G; Immune Tolerance Network Learning Early About Peanut Allergy study team. Allergen specificity of early peanut consumption and effect on development of allergic disease in the Learning Early About Peanut Allergy study cohort. J Allergy Clin Immunol. 2018;141(4):1343-53. doi: 10.1016/j.jaci.2017.09.034. Epub 2017 Oct 31. PMID: 29097103; PMCID: PMC5889963.
6.- Michael D. Kulis, Johanna M. Smeekens, Robert M. Immormino, Timothy P. Moran. The airway as a route of sensitization to peanut: An update to the dual allergen exposure hypothesis. Journal of Allergy and Clinical Immunology. 2021. 148(3);689-693.
7.- McGowan EC, Bloomberg GR, Gergen PJ, Visness CM, Jaffee KF, Sandel M, O’Connor G, Kattan M, Gern J, Wood RA. Influence of early-life exposures on food sensitization and food allergy in an inner-city birth cohort. J Allergy Clin Immunol. 2015;135(1):171-8. doi: 10.1016/j.jaci.2014.06.033. Epub 2014 Aug 13. PMID: 25129677; PMCID: PMC4440482.
ESOFAGITIS EOSINOFÍLICA EN PACIENTES PEDIÁTRICOS
La esofagitis eosinofílica (EoE) se considera una enfermedad crónica emergente; en la actualidad, ha pasado a ser una de las condiciones más comunes en la valoración y diagnóstico de problemas alimentarios en niños así como en la evaluación de disfagia y/o impactación en la edad adulta.
Se ha estudiado más extensamente en países occidentales, pero, aunque existen datos de prevalencia, se precisan estudios más amplios para consensuar datos epidemiológicos reales. Una revisión sistemática reciente mostró que la prevalencia poblacional de esofagitis eosinofílica en niños es 19,1 casos por 100.000 niños/año (1), con gran variabilidad de los datos según la localización geográfica y, probablemente, de otros factores como el diseño del estudio, los criterios diagnósticos utilizados, etc.
Fisiopatogénicamente se caracteriza por una inflamación Th2 en la que intervienen mecanismos mixtos mediados y/o no mediados por IgE dando lugar a una inflamación eosinofílica en el epitelio esofágico que origina una disfunción del mismo, dando lugar a los síntomas clínicos característicos.
En la población pediátrica los síntomas más prevalentes son los vómitos, dolor abdominal, disfagia, odinofagia e impactación del bolo alimenticio. Estas características clínicas difieren también según la edad del niño, siendo en niños más pequeños (2-8 años) más frecuente: el fallo de medro, rechazo del alimento, dolor abdominal, vómitos, trastornos del sueño, etc. En niños mayores y adolescentes los síntomas se asemejan más a los adultos, presentando disfagia, impactación, odinofagia, regurgitación, etc.
La prueba de oro para el diagnóstico es la toma de biopsias tanto de esófago proximal como distal (aumentando así el rendimiento del estudio) mediante una endoscopia digestiva. Esta técnica precisa de la sedación del paciente, lo que supone un “inconveniente” sobre todo en población pediátrica. Por ello se están estudiando otras técnicas menos invasivas como:
– Prueba del hilo esofágico (EST: esophageal string test), técnica basada en cápsulas que capturan las proteínas asociadas a los eosinófilos de la luz esofágica.
–Citoesponja: tecnología basada también en cápsulas, diseñada originalmente para la evaluación de la mucosa esofágica en el esófago de Barrett.
– Endoscopia transnasal sin sedación.
Estas técnicas y algunas otras en estudio también, podrían tener un papel importante en el control regular de la esofagitis, pero es muy poco probable que reemplacen la confirmación de un diagnóstico dudoso y/o actos terapéuticos realizables durante una endoscopia convencional como una dilatación.
Las opciones terapéuticas, ambas consideradas de primera línea son: tratamiento dietético y farmacológico:
– Terapias dietéticas: la fórmula de aminoácidos se describe como una terapia eficaz en niños con EoE, lo que indica la implicación de antígenos dietéticos en su patogenia. Se han descrito diversos enfoques dietéticos: dieta elemental, dieta dirigida según sensibilización alergénica, dietas empíricas, etc. La dieta de eliminación es una opción no farmacológica de primera línea para el manejo de la EoE; sin embargo, el orden y el número de antígenos específicos a evitar, así como su posterior reintroducción sigue siendo un área activa de investigación.
– Corticoides tópicos: este tipo de fármaco actúa a diversos niveles en esta patología: vías/genes inducidos por IL-13, reducción de la eosinofilia esofágica e infiltración mastocitaria, regulación a la baja de los genes de los mastocitos, reducción de células T y citocinas proinflamatorias como el factor de necrosis tumoral (TNF), etc. Los metanálisis realizados utilizando fluticasona o budesonida demuestran la superioridad de los corticoides frente a placebo para la eosinofilia esofágica, los hallazgos endoscópicos y los síntomas tanto en pacientes adultos como pediátricos. No están exentos de efectos adversos como puede ser la candidiasis, insuficiencia suprarrenal, etc. Los estudios abogan por una terapia que debe ser mantenida a largo plazo por la alta tasa de recaídas tras su retirada. Sigue en estudio la dosis y duración óptima de cada terapia.
– Tratamiento con inhibidores de la bomba de protones (IBP): la tasa de respuesta varía ampliamente desde un 30 a un 70%.Están en estudio las posibles diferencias fisiopatológicas entre la EoE sensible y/o resistente a los IBP. Algunos ejemplos incluyen:
– Técnicas de biología molecular demuestran que la expresión del transcrito para el canal de potasio Kir2.1 (gen KCNJ2) es menor en los pacientes que responden a los IBP. Si se valida, esto podría proporcionar una detección potencial para terapias personalizadas.
– Los pacientes con rinitis alérgica y metabolizadores rápidos CYP2C19 tienen un mayor riesgo de pérdida del control de la EoE a pesar de la terapia continua con IBP.
– Dilatación esofágica: destinada a aliviar complicaciones como la estenosis; técnica destinada a modificar cambios estructurales sin alivio histológico.
– Terapias emergentes:
* Nuevas formulaciones de esteroides: budesonida viscosa, budesonida en comprimidos bucodispersables, etc.
* Tratamientos biológicos: ANTICUERPOS MONOCLONALES
Anti-L5: benralizumab, mepolizumab, reslizumab. Se están realizando estudios para valorar la mejoría tanto clínica como histológica de estos tratamientos, por la involucración de la IL-5 en la infiltración y supervivencia del eosinófilo, sin resultados científicamente concluyentes aún.
Anti-IL13: la IL-13 es un mediador claramente implicado en la patogénesis de la EoE, mediante la activación y quimiotaxis de los eosinófilos a través del aumento de los niveles de eotaxina-3 y periostina. El anticuerpo QAX576 parece reducir los síntomas pero no se ha demostrado efecto significativo en la actividad clínica de la enfermedad; mientras que RPC4046 consigue una reducción significativa de la eosinofilia esofágica y la actividad de la enfermedad endoscópica así como en la reducción de síntomas.
Anti-IL4 y Anti-IL-13: Dupilumab (aprobado por la FDA en > 12 años). Se están llevando a cabo ensayos que parecen demostrar mejoría sintomática, endoscópica e histológica significativa.
Anti-IgE (omalizumab) y Anti-TNF (infliximab). No existe ningún ensayo clínico con evidencia científica que apoye su uso en la EoE.
*Otras dianas moleculares en estudio: Integrina α4β7, Siglec 8, TSLP, TGFβ, canales de calcio, IL- 9, 15 y 33, receptor de eotaxina anti CCR3.
Dra. Guacimara Hernández Santana, Hospital Universitario Nuestra Señora de la Candelaria en Santa Cruz de Tenerife. Comité de Alergia Infantil SEAIC
BIBLIOGRAFÍA:
- Arias A, Perez-Martinez I, Tenias JM, Lucendo AJ. Systematic review with meta-analysis: the incidence and prevalence of eosinophilicesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2016; 43(1): 3-15.
- Alfredo J Lucendo (2019): Pharmacological treatments for eosinophilic esophagitis: current options and emerging therapies, Expert Review of Clinical Immunology, DOI:10.1080/1744666X.2019.1705784
- Nirmala P. Gonsalves, Seema S. Aceves. Diagnosis and Treatment of Eosinophilic Esophagitis. J Allergy Clin Immunol. 2020 January ; 145(1): 1–7.
- Thomas Greuter, Ikuo Hirano, Evan S. Dellon. Emerging therapies for eosinophilic esophagitis. J Allergy Clin Immunol. 2020 January ; 145(1): 38–45.
- Arianna De Matteis et al. Eosinophilic Esophagitis in Children: Clinical Findings and Diagnostic Approach.Current Pediatric Reviews, 2020, 16, 206-214.
¡Tengo alergia al sol!
¡Cuántas veces escuchamos esta frase en esta época del año en la que nuestra exposición solar ha sido máxima! Son muchos los pacientes que ante reacciones cutáneas coincidiendo con la exposición solar se refieren a ellas como “alergia al sol”. Aunque es un término científicamente incorrecto, se refiere a aquellas fotodermatosis (reacciones anormales o adversas de la piel a la luz ultravioleta o la radiación visible) en las que subyace un mecanismo inmunológico.
Entre ellas, la erupción polimorfa lumínica es la entidad más frecuente, afectando al 10-20% de la población occidental. Aparece sobre todo en mujeres jóvenes y es más típico en las primeras exposiciones solares del año (primavera), mejorando a medida que la estación soleada avanza (tras exposiciones repetidas al sol y la progresiva melanización de la piel).
Se caracteriza por brotes repetidos de lesiones cutáneas pruriginosas con localización predominante en aquellas zonas de mayor exposición solar: cara, cuello, zona alta del tórax, caras laterales de antebrazos y cara anterior de las piernas.
Las lesiones pueden ser de distinto tipo (de ahí el término polimorfismo): pápulas, pápulo-vesículas, eccema, placas, erosiones o costras; aunque, en un paciente individual, las lesiones son normalmente monomórficas y simétricas, apareciendo habitualmente a las pocas horas de exposición al sol.
Las reacciones agudas requerirán el tratamiento sintomático acorde con la gravedad del cuadro. Los antihistamínicos ayudarán a controlar el prurito; aunque, en ocasiones, puede ser necesario el uso de corticoides sistémicos. Sin embargo, lo más importante es prevenir la aparición de la erupción mediante fotoprotección adecuada (ropa, protección solar UVA y UVB). Si con ello no se consigue evitar la aparición de los brotes, se puede llevar a cabo una terapia de “desensibilización mediante fototerapia” con radiación UVB de banda estrecha (UVB-BE) para conseguir el endurecimiento (hardening) de la piel. Se basa en ir acostumbrando poco a poco a nuestra piel a la exposición al sol (fototolerancia), mediante la aplicación de cursos cortos de UVB-BE desde principios de la primavera y durante varias semanas, hasta alcanzar niveles que permitan al paciente tolerar exposiciones solares diarias de 15-20min de duración. Además, en adultos jóvenes, que viajan de vacaciones a zonas soleadas, se ha comprobado que la realización de ciclos cortos (6-7 días) de corticoides sistémicos (prednisona 0,6-0,8 mg/kg/día) es útil en la prevención de aparición de brotes.
Entre las fotodermatosis que afectan con más frecuencia a población infantil, se encuentra la erupción primaveral juvenil, considerada una variedad localizada de la erupción polimorfa lumínica, de origen desconocido y que afecta más frecuentemente a varones entre 5 y 12 años. Cursa con pápulas eritematosas pruriginosas que aparecen típicamente durante la primavera en el hélix de las orejas que no está cubierto por pelo. Pueden evolucionar a vesículas y costras sin dejar lesiones residuales o solo mínimas cicatrices.
También el hidroa vacciniforme, aunque es una afección rara, se suele dar en niños menores de 10 años, mejorando hacia la edad adulta. Algunos autores consideran que se trata de una variante cicatricial de la erupción polimorfa lúminica. Consiste en brotes recurrentes de lesiones vesiculosas, de contenido viscoso, seroso o hemorrágico, que evolucionan a costras y escaras negruzcas que se desprenden, dejando lesiones cicatriciales varioliformes, deprimidas e hipopigmentadas. Suelen darse cada verano en las partes descubiertas del cuerpo tras la exposición a la luz solar. Su localización más frecuente es en orejas, nariz, dedos, mejillas, dorso de manos o antebrazos y, a veces, puede afectar también a ojos y cuero cabelludo, con efectos adversos importantes sobre la calidad de vida de los niños. Se desconoce la patogenia, aunque se ha asociado a infecciones por virus de Epstein-Barr, y puede evolucionar a linfoma.
Otras fotodermatosis menos frecuentes en niños son el prurigo actínico, la dermatitis actínica crónica o la urticaria solar.
Todas ellas se engloban dentro de este grupo de fotodermatosis inmunológicamente mediadas conocido coloquial- y erróneamente bajo el único nombre de “alergia solar”. Sin embargo la patogenia y clínica de cada una de ellas es diferente y por tanto su tratamiento. Por ello es importante acudir al especialista quien establecerá un diagnóstico preciso y con ello el tratamiento más adecuado.
Dra. Paula Cabrera Freitag, Hospital Universitario Gregorio Marañón de Madrid. Comité de Alergia Infantil SEIAC
Bibiliografía:
- Barceló JM, Rosillo MR, Muñoz C. Fotodermatosis. En IJ Dávila, I Jáuregui, JM Olaguibel y JM Zubeldia, eds. Tratado de Alergología. 2ª ed. Madrid: Ergon, 2016, 889-912.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses. Part 1: pathophysiology and technical aspects of photobiologic studies. Actas Dermosifiliogr. 2014 Mar;105(2):112-21.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses, part II: photobiologic testing. Actas Dermosifiliogr. 2014 Apr;105(3):233-42.
- Gruber-Wackernagel A, Byrne SN, Wolf P. Polymorphous light eruption: clinic aspects and pathogenesis. Dermatol Clin. 2014 Jul;32(3):315-34
EL CONSUMO DE CARNES “EXÓTICAS” PUEDE SER PELIGROSO EN PACIENTES CON ALERGIA A PESCADO
Los múltiples beneficios del pescado han generado un ascenso en su consumo en los últimos años. Este incremento se ha acompañado a su vez de un aumento de la prevalencia de alergia a este alimento, estimándose que afecta al 3% de la población, aunque con diferencias geográficas relacionadas con los hábitos de consumo. La alergia aparece en la primera infancia en la mayoría de estos casos y puede persistir hasta la edad adulta.
Los pescados se dividen en dos grandes grupos: cartilaginosos y óseos. Dentro de este último grupo existen más de 32.400 especies. Las identificadas hasta el momento se clasifican en los órdenes: clupeiforme, cypriniforme, gadiforme, perciforme, salmoniforme, siluriforme y pleuronectiforme.
El principal alérgeno del pescado es la parvalbúmina que contiene dos isoformas: β-parvalbúmina (mayores concentraciones en pescados óseos) y α-parvalbúmina (mayores concentraciones en pescados cartilaginosos). También se han caracterizado otros alérgenos como las enolasas, aldolasas, colágeno, tropomiosina y vitelogenina, aunque con menor relevancia alergénica en la mayoría de los casos.
Basados en la prevalencia de sensibilización a β-parvalbúmina (IgE específica detectable en el 95% de los pacientes alérgicos a pescado), la recomendación habitual es la evitación del consumo de todas las especies, lo que desencadena importantes restricciones dietéticas. Afortunadamente, la capacidad de un pescado de generar una reacción alérgica es específica de su especie y del individuo afectado. Es así como se han descrito casos de mono sensibilización a especies de pescados, ej. Pacientes que reaccionan tras consumo de bacalao pero toleran atún y/o salmón. Pacientes alérgicos a más de una especie, toleraran en muchos casos túnidos en conserva.
Considerando todas las variantes de la alergia a pescado y la dificultad en predecir estas múltiples posibilidades diagnósticas, el estudio alergológico dirigido por el especialista es fundamental. Este estudio contará con pruebas cutáneas y serológicas que servirán para guiar a las pruebas de provocación oral. Las pruebas de provocación oral tendrán la finalidad de confirmar tolerancia a otras especies dependiendo de las preferencias de consumo individuales.
La comparación de secuencias de aminoácidos de la β-parvalbúmina de más de 4.000 vertebrados sugiere que existe un alto porcentaje de reactividad cruzada entre pescado, cocodrilo, serpientes, lagartos y sapos. Así mismo, se ha descrito reactividad cruzada entre el pescado y la carne de pollo en pacientes no sensibilizados a huevo (síndrome pescado-pollo), en estos se ha detectado sensibilización a alérgenos “menores”: enolasas y aldolasas además de parvalbumina.
La reactividad cruzada entre cocodrilo y pescado es de 60% y es secundaria principalmente a α-parvalbúmina. En 2022, Ruethers et al, publicaron una casuística de pacientes alérgicos a pescados con reacciones graves a cocodrilo en los que se detectaban ambas isoformas de la parvalbúmina (α y β). Concluyen que esta proteína se encuentra en la carne de cocodrilo a suficiente concentración como para provocar reacciones, en ocasiones graves, en aquellos pacientes previamente sensibilizados a pescado. Con el incremento de los viajes y la globalización, cada vez más individuos consumen carnes antes consideradas “exóticas”. En este sentido, los pacientes con alergia a pescados deben proceder con precaución a la hora de consumir estas carnes y en los casos de síntomas graves tras consumo de pescado, consultar al alergólogo previamente.
Andreina Marques-Mejias
Hospital Universitario La Paz, Madrid. Comité de Alergia Infantil SEAIC
Department of Women and Children’s Health – Paediatric Allergy, School of Life Course Sciences, Faculty of Life Sciences and Medicine, King’s College London. Children’s Allergy Service, Evelina London, Guy’s and St Thomas’ Hospital, London, UK.
Referencias
- Buyuktiryaki B, Masini M, Mori F, Barni S, Liccioli G, Sarti L, Lodi L, Giovannini M, du Toit G, Lopata AL, Marques-Mejias MA. IgE-Mediated Fish Allergy in Children. Medicina (Kaunas). 2021 Jan 18;57(1):76.
- Kuehn A, Swoboda I, Arumugam K, Hilger C, Hentges F. Fish allergens at a glance: variable allergenicity of parvalbumins, the major fish allergens. Front Immunol. 2014;5:179.)
- Mourad AA, Bahna SL. Fish-allergic patients may be able to eat fish. Expert Rev Clin Immunol. 2015;11:419-430.
- Sicherer, Scott H., and Hugh A. Sampson. “Food allergy.” Journal of allergy and clinical immunology 125.2 (2010): S116-S125.
- Lopata, A.L.; O’Hehir, R.E.; Lehrer, S.B. Shellfish allergy. Clin. Exp. Allergy 2010, 40, 850–858.
- Kuehn A, Swoboda I, Arumugam K, Hilger C, Hentges F. Fish allergens at a glance: variable allergenicity of parvalbumins, the major fish allergens. Front Immunol. 2014;5:179)
- Hilger C, Thill L, Grigioni F, et al. IgE antibodies of fish allergic patients cross-react with frog parvalbumin. Allergy. 2004;59:653-660
- Hamada Y, Nagashima Y, Shiomi K. Reactivity of serum immunoglobulin E to bullfrog Rana catesbeiana parvalbumins in fish-allergic patients. Fish Sci. 2004;70:1137-1143.
- Kuehn A, Codreanu-Morel F, Lehners-Weber C, Doyen V, Gomez-André SA, Bienvenu F, Fischer J, Ballardini N, van Hage M, Perotin JM, Silcret-Grieu S, Chabane H, Hentges F, Ollert M, Hilger C, Morisset M. Cross-reactivity to fish and chicken meat – a new clinical syndrome. Allergy. 2016 Dec;71(12):1772-1781.
- Ruethers T, Nugraha R, Taki AC, et al. The first reptilian allergen and major allergen for fish-allergic patients: Crocodile β-parvalbumin. Pediatr Allergy Immunol. 2022;33:e13781.
- Severe anaphylaxis due to crocodile-meat allergy exhibiting wide cross-reactivity with fish allergens. Haroun-Díaz E, Blanca-López N, et al. J Allergy Clin Immunol Pract.2017 Sep 8. pii: S2213-2198(17)30540-8. doi: 10.1016/j.jaip.2017.07.015
- Anaphylactic Reactions to Novel Foods: Case Report of a Child With Severe Crocodile Meat Allergy. Ballardini N, Nopp A,et al. 2017;139(4): e2016140.
Mapa de inmunoterapia con alimentos en Europa
La relevancia tanto en términos de prevalencia, como en impacto socioeconómico de la alergia a alimentos está creciendo no solo en España, sino en todo el mundo, afectando a millones de pacientes. Hasta hace apenas dos décadas, la única solución para este problema era la identificación del agente causal, su evitación y la aplicación del tratamiento adecuado en caso de producirse un contacto accidental.
Sin embargo, en las últimas décadas, la comunidad científica ha puesto mucho esfuerzo en el desarrollo de terapias activas para tratar a los pacientes con alergia alimentaria, siendo la más relevante la inmunoterapia con alimentos. Estos esfuerzos han sido liderados mediante proyectos de investigación y ensayos clínicos que, a medida que iban publicándose, se aplicaban en la práctica clínica diaria de algunos centros europeos.
Actualmente la inmunoterapia con alimentos, especialmente la inmunoterapia por ruta oral, se ha consolidado como un tratamiento eficaz y ya se incluye en las guías de la EAACI como tratamiento indicado en pacientes con alergia persistente a leche, huevo o cacahuete en centros con experiencia. Este paso adelante se ha visto reforzado por la reciente comercialización en Estados Unidos del primer producto para tratar la alergia a cacahuete con inmunoterapia oral. Sin embargo, el tratamiento, aunque eficaz, sigue siendo objeto de debate debido a su controvertido perfil de seguridad y su implementación en la práctica clínica diaria aún plantea ciertos dilemas.
En este contexto, desde el Board of Pediatrics de la EAACI se puso en marcha un grupo de trabajo con el objetivo de saber el nivel de implementación del tratamiento en Europa, y poder hacer una valoración del grado de experiencia que atesora el continente ante la probable alta expansión que sufrirá la aplicación del tratamiento fuera del ensayo clínico en los próximos años.
La metodología consistió en identificar a través de abstracts a congresos europeos y nacionales de los últimos 5 años, centros en los que se practicase la inmunoterapia, además de identificar autores en la literatura. Adicionalmente, se enviaron 3 rondas de emails desde la secretaría de la EAACI a todos los miembros, para intentar identificar más centros con experiencia. Los voluntarios participaron rellenando una encuesta extensa sobre la práctica general de la inmunoterapia, y más específica sobre la práctica de la inmunoterapia con leche, huevo y cacahuete.
Un total de 102 centros en 18 países en toda Europa participaron en el proyecto. El primer dato llamativo es la gran disparidad en la distribución por todo el territorio, siendo España el país con un mayor número de centros (n=39), seguido de Francia (n=16) e Italia (n=7), y con una escasísima representación en países con una gran población como por ejemplo Alemania, con un solo centro. Se indagó sobre la experiencia en el tratamiento de alergia a alimentos menos estudiados habitualmente, y se encontró un interesante patrón geográfico marcado por los hábitos de consumo. En el sur de Europa, se trataba con frecuencia la alergia a melocotón, en el centro de Europa la alergia a la avellana, y en el norte la alergia a pescados. La experiencia acumulada estimada de pacientes tratados para todos los alimentos identificados es 24,875 pacientes, lo que se puede considerar una cifra muy baja, teniendo en cuenta la prevalencia global de la alergia a alimentos.
El perfil de un centro “medio” europeo que realiza inmunoterapia con alimentos es un servicio que trabaja en la sanidad pública (80,4% de los centros identificados), que lleva 9 años realizando el tratamiento y ha tratado aproximadamente a 100 pacientes en total, por ruta oral eminentemente. El tratamiento se aplica de rutina en la práctica clínica habitual en el 80,4% de los centros, principalmente en hospitales terciarios (77,5%). El número de médicos medio por centro es de 3 alergólogos/pediatras y 2 enfermeras con todo el equipo médico necesario para atender eventuales reacciones. El 98% de los centros realizan pruebas de exposición oral previa al inicio de la inmunoterapia, y evaluaciones alternativas relevantes de la eficacia, como son el estudio de la calidad de vida o la tolerancia mantenida (sustained unresponsiveness) solo se realizan en el 20,6% y 54,9% de los centros, respectivamente. Las alergias alimentarias más frecuentemente tratadas en los centros son alergia a leche y huevo (91,2% y 78,4%, respectivamente), mientras que la implementación de la inmunoterapia con cacahuete no llega a la mitad de los centros (46,1%).
En conclusión, más allá de la disparidad de procedimientos, entornos y experiencia de los centros identificados, y teniendo en cuenta que no todos los centros europeos han participado en el proyecto, debemos reflexionar sobre si los recursos sanitarios están preparados para asumir la alta demanda de tratamiento prevista en los próximos años.
Por último, querría agradecer profundamente a todos los centros españoles que colaboraron en este estudio y que dedicaron tiempo a completar la encuesta. Muchas gracias a todos vosotros.
Pablo Rodríguez del Río, Facultativo especialista de área en Alergia Hospital Niño Jesús, Madrid, España. Comité de Alergia Infantil
REFERENCIAS RELEVANTES:
.- Hossny E, Ebisawa M, El-Gamal Y, et al. Challenges of managing food allergy in the developing world. World Allergy Organ J. 2019;12(11):100089.
.- Pajno GB, Fernández-Rivas M, Arasi S, et al. EAACI Guidelines on allergen immunotherapy: IgE-mediated food allergy. Allergy.2018;73(4):799-815
.- Chu KD, Wood RA, French S et al. Oral immunotherapy for peanut allergy (PACE): a systematic review and meta-analysis of efficacy and safety. Lancet. 2019 Jun 1;393(10187): 2222-2232
.- Rodríguez del Río P, Álvarez-Perea A, Blumchen K, et al. Food immunotherapy practice: Nation differences across Europe, The FIND project. Allergy. 2021; 00:1–13. https://doi.org/10.1111/all.15016
Estudio de alergia a betalactámicos en niños
La sospecha de alergia a betalactámicos es un motivo frecuente de consulta en niños, descartándose en la mayoría de los casos tras el estudio alergológico. Seguir el mismo algoritmo diagnóstico que en el adulto consume tiempo y pruebas que son molestas para el niño. En los últimos años diferentes grupos han investigado el valor de las pruebas cutáneas y serológicas, recomendándose en algunos casos la prueba de exposición oral directa.
El grupo de trabajo de la EAACI ha publicado una revisión valorando el diagnóstico de alergia a betalactámicos en niños. Diferencia las formas clínicas en función del mecanismo inmunológico y la cronología de la reacción:
- Reacciones cutáneas benignas de aparición inmediata mediadas por IgE.
Las más frecuentes son leves con urticaria y/o angioedema, causadas en muchos casos por la infección subyacente. Diferenciarlas es difícil a pesar de la historia clínica, siendo necesario el estudio alergológico mediante pruebas cutáneas, seguidas de una prueba de exposición. Algunos autores proponen realizar la exposición oral sin pruebas cutáneas previas en las reacciones leves. A pesar de los estudios publicados, la evidencia para realizar prueba de exposición directa en niños con reacción inmediata es limitada.
- Reacciones sistémicas de aparición inmediata mediadas por IgE.
Los fármacos son una posible causa de anafilaxia en niños, pero el riesgo de reacción mortal es extremadamente bajo. El diagnóstico precisa un estudio alergológico completo, que incluya pruebas in vitro (IgE específica, prueba de activación de basófilos) y pruebas cutáneas. Cuando estas pruebas son positivas, el riesgo de reacción con la prueba de exposición es alto. En los casos graves esta prueba solo se realizará si no hay alternativa terapéutica segura, comenzando por dosis muy bajas, estando contraindicada si durante la reacción índice se produjo un shock anafiláctico.
- Reacciones no inmediatas leves, urticaria no inmediata/exantema maculopapular.
Las pruebas cutáneas en estos casos tienen muy baja sensibilidad y no están bien estandarizadas, pero el valor predictivo positivo es alto. Por otro lado, para las pruebas in vitro (prueba de transformación de linfocitos) se dispone de una evidencia limitada. Dada su baja sensibilidad, algunos autores realizan una prueba exposición oral directa, confirmando la seguridad del procedimiento. No hay acuerdo en el protocolo a seguir, administrándose generalmente la dosis fraccionada seguida de uno o varios días de administración domiciliaria. Haciendo referencia a un estudio que sugiere que los niños con reacción no inmediata leve podrían superar su alergia, podría indicarse la realización de una prueba de exposición tras al menos un año de la prueba de exposición positiva.
- Enfermedad del suero-like.
Se observa generalmente en niños menores de 5 años, especialmente con cefaclor. El diagnóstico es fundamentalmente clínico. En estos pacientes se debe evaluar la tolerancia a otros betalactámicos que, generalmente, son bien tolerados.
- Reacciones graves no inmediatas.
Incluyen el síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, reacción a fármaco con eosinofilia y síntomas sistémicos, y la pustulosis exantemática aguda generalizada. El diagnóstico es fundamentalmente clínico, junto a pruebas histológicas y analíticas. Se pueden realizar pruebas epicutáneas tras 6 meses de la reacción a pesar de tener una sensibilidad baja. Si estas son negativas, se pueden realizar pruebas intradérmicas, estando contraindicadas si durante la reacción índice hubo riesgo vital. En general, la prueba de exposición se realiza para excluir el diagnóstico de alergia en los casos de baja sospecha.
El grupo de trabajo concluye que hay una amplia variabilidad clínica en las reacciones a betalactámicos en niños, siendo la más común la reacción cutánea leve no inmediata con exantema maculopapular o urticaria tardía. En estos casos se recomienda el diagnóstico mediante la prueba de exposición, existiendo suficiente evidencia para realizarla sin pruebas cutáneas previas. Para poder definir una reacción como leve o de bajo riesgo hay que tener en cuenta la fiabilidad de los datos obtenidos de la historia clínica, la edad del niño, el tiempo transcurrido hasta realizar el estudio y las comorbilidades que pueda presentar el paciente. No hay un protocolo óptimo para la realización de la prueba de exposición ni consenso en su duración, por lo que es imperativo establecer un protocolo unificado.
Con respecto a las reacciones inmediatas leves, es necesario realizar más estudios para poder confirmar la seguridad de realizar la exposición sin pruebas cutáneas previas.
Finalmente, en relación con la posibilidad de que los niños con reacción no inmediata leve puedan superar su alergia, el consenso se recomienda la realización de estudios multicéntricos que incluyan un gran número de niños para investigar la historia natural de la alergia a betalactámicos.
Dos trabajos realizados en nuestro país repiten el estudio con prueba de exposición en niños tras el diagnóstico de alergia a betalactámico con reacción no inmediata leve. En ellos, el 50% y el 80% de los pacientes toleran el betalactámico en la segunda prueba de exposición controlada, realizada al menos 6-12 meses tras una primera prueba de exposición positiva. Todos los pacientes incluidos son menores de 8 años, predominando preescolares en los que en muchos casos un cuadro viral subyacente podría ser la causa de la reacción. Ante estos resultados y dado que los betalactámicos son de primera elección en la mayoría de los procesos infecciosos de origen bacteriano en el niño, se podría proponer repetir la prueba de exposición controlada tras un año de evitación, al menos en los niños de menor edad, siempre que la reacción inicial al betalactámico sea no inmediata y leve.
Candelaria Muñoz Román. Alergología Pediátrica, UGC Pediatría, H. Materno Infantil, Hospital Regional Universitario de Málaga. Comité de Alergia Infantil SEAIC.
Bibliografía
- Blanca-López N, Atanaskovic-Markovid M, Gomes ER, Kidon M, Kuyucu S, Mori F, et al. An EAACI Task Force report on allergy to beta-lactams in children: Clinical entitisand diagnostico procedures. Pediatr Allergy Immunol. 2021; 32: 1426-1436.
- Tonson la Tour A, Michelet M, Eigenmann P, Caubet JC. Natural history of benign nonimmeediate allergy to beta-lactams in children: a prospective study in retreated patiens after a positive and a negative provocation test. J Allergy Clin Immunol Pract. 2018; 6: 1321-1326.
- Berroa F, Callero A, Fuentes-Aparicio V, Infante S, Alonso-Lebrero E, Zapatero L. Rechallenge in Pediatric Patients Diagnosed with delayed hypersensitivity to penicillins. J Investig Allergol Clin Immunol. 2013; 23: 369-370.
- Sánchez de Toro MA, Muñoz Román C, Corzo Higueras JL. Negativización de estudio alérgológico en pacientes en edad pediátrica diagnosticados de reacción alérgica no inmediata frente a amoxicilina. Allergol et Immunopathol Proceedings. 2017; 166. ISSN 2014-9859. 41º Congreso SEICAP.
- Ibáñez MD, Rodríguez del Río P, Lasa EM, Joral A, Ruiz-Hornillos J, Muñoz, C, et al. Prospective assessment of diagnostic tests for pediatric penicillin allergy: From clinical history to challenge tests. Ann Allergy Asthma Immunol. 2018;121(2):235-244.
Anafilaxia en el lactante.
En los últimos meses se han publicado varios artículos acerca de la anafilaxia en el lactante.
Cárdenas Morales y Hernández Trujillo (1) nos dan una visión global a través de una revisión. Carlisle y Lieberman (2) se centran en el manejo del episodio y Frith y colaboradores actualizan las guías de la Australasian Society of Clinical Immunology and Allergy (ASCIA) (3).
La incidencia de la anafilaxia está aumentando particularmente en los lactantes y preescolares, aunque los datos son limitados y las cifras varían según los diferentes autores.
Las peculiaridades del lactante incluyen diferencias en la presentación clínica, las comorbilidades asociadas, dificultades en el diagnóstico y en el tratamiento, siendo por todo ello aún menor la frecuencia de utilización de adrenalina que en otras edades.
Como factores de riesgo en lactantes hay que considerar comorbilidades como el asma, la bronquiolitis y la laringotraqueobronquitis. Entre los posibles cofactores se incluyen la fiebre, infecciones respiratorias y el estrés. No parece haber acuerdo (1,2) en el papel del eccema atópico como comorbilidad de interés en anafilaxia.
Los síntomas más frecuentes en lactantes suelen ser cutáneos, seguidos de los respiratorios y digestivos. Los síntomas cardiovasculares parecen ser menos frecuentes o peor detectados. Además, la sintomatología puede pasar de tener valor diagnóstico a ser inespecífica según el contexto clínico, o pasar desapercibida por ser específica del lactante (Tabla 1) (2). También debemos tener en cuenta que el diagnóstico diferencial es amplio, con entidades propias de esta edad (Tabla 2)(1).
La alergia alimentaria es el principal desencadenante, destacando la leche y el huevo como los principales implicados. Sin embargo, hay que tener en cuenta los hábitos de consumo local. En nuestro medio las frutas y pescados son también causa frecuente de anafilaxia (1).
En cuanto al diagnóstico en el lactante, se han identificado varias dificultades
- La imposibilidad a esta edad de comunicar síntomas verbalmente
- Las diferencias entre las distintas definiciones de anafilaxia. Aunque los criterios de Sampson et al está muy extendidos y se consideran aplicables también en este grupo de edad, algunas sociedades como la ASCIA no incluyen la sintomatología digestiva como criterio de anafilaxia
- La determinación de triptasa suele tener limitaciones en el caso de la anafilaxia inducida por alimentos y no se han determinado puntos de cortes específicos a esta edad.
El tratamiento se basa en el reconocimiento de síntomas, y en la administración precoz de adrenalina. Como medidas adicionales, la guía ASCIA recomienda específicamente evitar que los lactantes estén en brazos sobre el hombro de sus cuidadores y recomienda que se mantengan horizontales sobre los brazos del cuidador (3). Aunque pueden ser necesarias medidas adicionales como la fluidoterapia, apenas se mencionan otros fármacos, como los antihistamínicos y corticoides (2), acerca de los que sí se discutía en revisiones previas (4,5).
La infrautilización de adrenalina se ha atribuido a un peor reconocimiento de los síntomas, pero también a una menor prescripción de dispositivos de adrenalina. Una de las razones se debe a que en lactantes hay discordancia entre el peso y la dosis de los autoinyectores disponibles (0.15 y 0.3 mg). Tanto la guía de anafilaxia pediátrica de EAACI de 2007(6) como la australiana proponen la prescripción de dispositivos de 0.15mg lactantes-niños a partir de los 7.5 kg de peso (3). En 2017 la Food and Drug Administration autorizó la comercialización de dispositivos de 0.1mg en Estados Unidos, por lo que las recomendaciones en este punto varían según la guía consultada (1,2,4).
Finalmente, desconocemos aun el efecto de las recomendaciones actuales de introducción precoz de la alimentación complementaria en la incidencia y prevalencia futuras de anafilaxia en lactantes.
| Órgano Diana | Síntoma Típico propio de otras edades | Síntoma poco frecuente…o propio de lactante |
| Piel | Habones, rash, picor, angioedema | Roce ocular, picor ocular, rascado de las orejas, sacar la lengua, lamido repetido de labios o de las manos |
| Digestivos | Vómitos, diarrea, dolor abdominal | Escupir, arquear la espalda, llevarse las rodillas al pecho, hipo |
| Respiratorios | Tos, sibilancias taquipnea | Llanto, afonía, meterse los dedos en la orejas, tirarse de las orejas |
| Cardiovascular | Hipotensión, desmayo, sincope | Piel moteada |
| Neurológico | Irritabilidad, llanto inconsolable, letargo |
Tabla 1. Síntomas de anafilaxia en lactantes. De A Carlisle y J. Lieberman
| Signo/Síntoma Guía | Diagnóstico alternativo |
| Angioedema | Angioedema Hereditario
Celulitis |
| Diarrea | Gastroenteritis |
| Habones/Rash | Dermatitis de contacto
Eritema multiforme Mastocitosis Síndrome de piel escaldada estafilocócica Síndrome de shock tóxico |
| Hipotensión | Shock séptico |
| Neurológico | Intoxicación por fármacos o alcohol
Encefalitis Hemorragia intracraneal Meningitis Traumatismo no accidental (maltrato) Convulsión |
| Dificultad respiratoria | Asma
Espasmo del Sollozo Bronquiolitis Crup Aspiracion de cuerpo extraño Membrana laríngea Traqueolaringomalacia Anillo vascular |
| Vómitos | Enterocolitis inducida por proteínas alimentarias (FPIES)
Intoxicación alimentaria Gastroenteritis Reflujo gasotroesofágico |
| Otros | BRUE (episodios breves resueltos inexplicado: brief resolved unexplained) **
Síndrome de Munchausen Síndrome de muerte súbita del lactante |
Tabla 2. Diagnóstico diferencial de anafilaxia en lactantes **Denominación actual del Episodio Aparentemente Letal
Esozia Arroabarren Aleman. Servicio de Alergología. Complejo Hospitalario de Navarra. Comité de Alergia Infantil SEAIC
Bibliografía
- Cardenas-Morales M, Hernandez-Trujillo V. Infant Anaphylaxis: A Diagnostic Challenge. Curr Allergy Asthma Rep. 2021 Feb 23;21(2):12. doi: 10.1007/s11882-021-00990-4.
- Carlisle A, Lieberman J. Clinical Management of Infant Anaphylaxis. J Asthma Allergy. 2021 Jul 8;14:821-827. doi: 10.2147/JAA.S286692.
- Frith K, Smith J, Joshi P, Ford LS, Vale S. Updated anaphylaxis guidelines: management in infants and children. Aust Prescr. 2021 Jun;44(3):91-95. doi: 10.18773/austprescr.2021.016.
- Greenhawt M, Gupta RS, Meadows JA, Pistiner M, Spergel JM, Camargo CA, Jr, et al. Guiding principles for the recognition, diagnosis, and management of infants with anaphylaxis: an expert panel consensus. J Allergy Clin Immunol Pract 2019;7:1148-1156.e5. 10.1016/j.jaip.2018.10.052 –
- Simons FE, Sampson HA. Anaphylaxis: Unique aspects of clinical diagnosis and management in infants (birth to age 2 years). J Allergy Clin Immunol. 2015 May;135(5):1125-31. doi: 10.1016/j.jaci.2014.09.014.
- Muraro A, Roberts G, Clark A, Eigenmann PA, Halken S, Lack G, Moneret-Vautrin A, Niggemann B, Rancé F; EAACI Task Force on Anaphylaxis in Children. The management of anaphylaxis in childhood: position paper of the European academy of allergology and clinical immunology. Allergy. 2007 Aug;62(8):857-71. doi: 10.1111/j.1398-9995.2007.01421.x.
BABY LED WEANING. VISION DEL ALERGÓLOGO
En los últimos 15 años una nueva forma de alimentación del bebé, Baby led weaning (BLW), ha ido creciendo en popularidad. Se inició en Reino Unido y Nueva Zelanda y después se ha ido extendiendo por el resto de los países de Europa, así que en la actualidad no es raro que atendamos a pacientes cuyos padres están siguiendo este método de alimentación.
BLW se define como el proceso de iniciar la alimentación complementaria del niño con alimentos del tamaño y textura adecuados para comer por sí mismo, comenzando aproximadamente a los 6 meses de edad. Se define también como “auto-weaning” lo cual significa ofrecer los alimentos individuales troceados o triturados que toma habitualmente la familia. El bebé decide qué, cuánto, y en qué tiempo come, siendo así un compañero activo en el proceso de su alimentación en lugar de un recipiente pasivo al que hay que llenar de alimentos.
En general, es más fácil para los cuidadores, ahorra dinero y tiempo, ya que los bebés pueden comer la comida familiar con algunos ajustes menores (como reservar una porción para el bebé antes de agregarle sal), reduciendo la necesidad de comprar o preparar comida específica para ellos.
Sin embargo, este procedimiento causa preocupación a los pediatras por el riesgo de una ingesta deficitaria en vitaminas y minerales, como el hierro, u otros nutrientes, así como por el riesgo de atragantamiento.
La Sociedad Europea de Gastroenterología pediátrica, Hepatología y Nutrición (ESPGHAN) en 2021 ha declarado que no hay suficiente evidencia para concluir acerca de la conveniencia de este procedimiento. Una revisión no sistemática de 2016 había llegado a conclusiones similares. En el año 2018, una revisión sistemática analizó la evidencia publicada hasta entonces, para valorar si este método es seguro y recomendable, así como la necesidad de futuras investigaciones. Esta revisión concluyó que, para evitar riesgos en el bebé, los padres que deseen seguir este método necesitan una cuidadosa y profunda educación nutricional, particularmente sobre cómo preparar los alimentos para que resulten seguros, saludables y nutritivos. Esta revisión sistemática concluye que existe insuficiente evidencia para determinar si es adecuada la ingesta de nutrientes y energía. De hecho, persiste la preocupación de estudios previos observacionales en los que se determina que los padres que siguen BLW estiman que sus hijos toman más lácteos y menos alimentos sólidos comparados con los que siguen el método tradicional. Sin embargo, estudios más recientes sugieren que un método de BLW modificado, que incluya recomendaciones sobre la introducción de alimentos ricos en hierro y evitando aquellos con riesgo de atragantamiento, pueden tener efectos preventivos de estos riesgos y posibles deficiencias. En cualquier caso, se necesitan investigaciones con estudios más grandes y randomizados.
Sin embargo, en estas revisiones no se contempla la influencia que puede tener el seguimiento de este método en la incidencia de alergia a alimentos; particularmente en los niños con riesgo alto de atopia, es decir, aquellos con antecedentes personales o familiares de primer grado (padres o hermanos) con dermatitis atópica, alergia alimentaria o alergia respiratoria en forma de rinoconjuntivitis y/o asma.
En estos niños habría que considerar de forma especial por una parte, el momento y la forma de introducción de los alimentos y por otra, la exposición epicutánea temprana a dichos alimentos.
Se han publicado múltiples estudios controlados, randomizados, prospectivos, que muestran evidencia de que la introducción temprana de cacahuete y huevo cocinado disminuye la incidencia de alergia a estos alimentos en niños de alto riesgo de presentarla, aunque la cantidad y la forma precisa de introducción requiere más investigación. Varios estudios de prevención de alergia a otros alimentos han mostrado evidencia de seguridad, pero no de eficacia. El estudio EAT (Enquiring About Tolerance) randomizó a lactantes de la población general para una intervención en la cual se introducía leche, huevo, cacahuete, sésamo, pescado y trigo desde los 3 meses de edad, pero tuvo una moderada adherencia y el análisis estadístico no mostró significación estadística para la prevención de alergia alimentaria. No obstante, no hubo un riesgo aumentado de alergia a ninguno de estos alimentos comparado con el grupo de introducción estándar. Otro estudio (“HealthNuts study”) demostró que la introducción del anacardo antes del año de edad se asocia a la ausencia de alergia a este alimento a los 6 años. Hasta la actualidad no hay estudios de seguridad y eficacia de la introducción temprana de otros frutos secos, soja o mariscos. Varios estudios han indicado que los niños con dieta más diversa de forma temprana tienen una incidencia inferior de alergia a alimentos.
Recientemente la Sociedad europea de Alergia e Inmunología Clínica (EAACI) ha publicado una guía de prevención de desarrollo de alergia a alimentos en lactantes y preescolares basada en una revisión sistemática de la evidencia actual y en la opinión de expertos. En ella se recomienda lactancia materna exclusiva los 6 primeros meses de vida, aunque la introducción de alimentos sólidos entre los 4 a 6 meses es también recomendada. Como novedad respecto a la guía anterior de 2014, sugieren evitar suplementos de fórmula de leche de vaca en la primera semana de vida, la introducción temprana de huevo bien cocinado (evitando huevo crudo o pasteurizado sin cocinar) y la introducción de cacahuete en una forma apropiada para el lactante, aunque no está claro el beneficio de la introducción de cacahuete en países sin alta prevalencia de alergia a este alimento. Tampoco está claro el beneficio en la introducción temprana de otros frutos secos y otros alérgenos alimentarios.
La mayoría de otras guías sugieren también no retrasar la introducción en la dieta de los alimentos alergénicos. Aunque el orden de introducción depende de las guías de cada país, es común en todas ellas, al igual que en la guía de la EAACI, la recomendación de introducir precozmente el huevo y cacahuete basados en la evidencia actual. Otros alimentos evaluados, como la leche, trigo, sésamo y pescados en los que se ha descartado riesgo de alergia con su introducción precoz, podrían ser la siguiente prioridad. Habría que analizar la influencia en la introducción precoz en niños de alto riesgo de aquellos otros aún sin evidencia actual, como los frutos secos, soja y mariscos.
Esta introducción temprana podría verse favorecida por el método BLW siempre que se hiciese en la forma, cantidad y frecuencia adecuada. Una vez que la introducción de un alimento se ha iniciado, es muy importante que se mantenga de forma regular en la dieta. No hay que olvidar, por otra parte, que el objetivo de la alimentación complementaria temprana con alimentos alergénicos es ofrecerlos sin exceder las necesidades calóricas en este periodo de alimentación y sin desplazar a otros alimentos ricos en nutrientes como frutas, verduras, carnes y cereales.
En conclusión, aunque existe interés creciente en la introducción temprana de los alimentos alergénicos, las decisiones con respecto a la eficacia preventiva, seguridad, momento de introducción, dosis y formas de estos alimentos alergénicos son difíciles dado que aún no disponemos de la evidencia científica suficiente para todos ellos y suponen un reto para pediatras, alergólogos y familias.
Por otra parte, este método en el que el lactante se autoalimenta, podría aumentar la exposición epicutánea temprana a los alimentos a través del traspaso de las manos al cuerpo del bebé. Actualmente hay una creciente evidencia de la exposición epicutánea temprana, particularmente en aquellos pacientes con barrera cutánea alterada, favorece la sensibilización y la exposición oral favorece la tolerancia.
En modelos animales se ha demostrado que la exposición epicutánea sensibiliza a los animales de manera más efectiva que la oral e intraperitoneal y que la alteración de la barrera cutánea juega un papel importante en el desarrollo de alergia alimentaria y puede contribuir a la gravedad de las reacciones.
La sensibilización a través de la piel puede ser explicada por la exposición de los alimentos a través del ambiente (polvo, superficies…) o a la transferencia de los alérgenos a través del contacto mano-cuerpo. En este sentido, un estudio demostró que la aplicación de cremas que contenían cacahuete era un factor de riesgo independiente para el desarrollo de alergia a este alimento y varios estudios han encontrado relación entre la exposición a cacahuete en el ambiente del bebé (ropa de cama, zona de juegos) y la alergia al mismo, llegándose a cuantificar el aumento del riesgo de sensibilización a cacahuete por cada unidad de su concentración en el ambiente.
Otros estudios en humanos muestran que la alteración de la barrera cutánea en la dermatitis atópica, debida a la mutación del gen de la filagrina, puede favorecer la penetración de los antígenos y la inflamación tipo2. Actualmente hay una evidencia creciente de la importancia de la inflamación de la barrera cutánea en el desarrollo de sensibilización y alergia a alimentos, de ahí el interés reciente de la restauración de esta barrera cutánea en la prevención de la alergia alimentaria.
De todas estas consideraciones deducimos que el seguimiento del método BLW debería ser, en los pacientes de alto riesgo de alergia alimentaria, consensuado y supervisado por pediatras y/o alergólogos.
Atendiendo a los datos de los que hasta ahora tenemos evidencia deberían seguirse las siguientes recomendaciones:
- Introducir de manera prioritaria el huevo cocinado que es el alimento sólido con mayor incidencia de alergia en niños en nuestro medio.
- Posteriormente se introducirían otros alimentos alergénicos: pescado, legumbres, etc.
- Respecto a los frutos secos distintos de cacahuete o mariscos, no existen suficientes datos para recomendar su introducción temprana, aunque hipotéticamente podría ser también preventiva si se introducen en forma y cantidad segura.
- Los alimentos se deben introducir de manera progresiva y no deberían introducirse más de uno cada día. Una vez introducidos es importante que se mantengan de forma regular en la dieta.
- Por otra parte, habría que evitar que el método BLW conlleve una mayor exposición epicutánea por el contacto de los alimentos con la piel, lo que favorecería la sensibilización. No debemos olvidar el control de la dermatitis atópica en estos niños para evitar la alteración en la barrera cutánea de la piel inflamada.
Dra. Soledad Terrados, Hospital Ramón y Cajal. Comité de Alergia Infantil SEAIC
BIBLIOGRAFIA
-Enza D’Auria1* , Marcello Bergamini et all Baby-led weaning: what a systematic review of the literature adds on. Italian Journal of Pediatrics (2018) 44:49
-Susanne Halken, Antonella Muraro, Debra de Silva et all. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update) Pediatr Allergy Immunol. 2021;32:843–858
-Brian Schroer, MDa, Marion Groetch, MS et all Practical Challenges and Considerations for Early Introduction of Potential Food Allergens for Prevention of Food Allergy .J Allergy Clin Immunol Pract 2021;9:44-56
-H.A. Brough, K.C. Nadeau et all Epicutaneous sensitization in the development of food allergy: what is the evidence and how can this be prevented? Allergy. 2020 September ; 75(9): 2185–2205.
Angioedema hereditario: no toda hinchazón es alergia
El angioedema hereditario (AEH) es una enfermedad rara que produce episodios recurrentes de hinchazón (edema) de algunas partes del cuerpo – piel o mucosas (gastrointestinal y de vía aérea superior). A diferencia del edema alérgico, es de instauración lenta, duro (sin fóvea), cursa sin urticaria (ronchas), sin picor y habitualmente la hinchazón dura más de 24-48 horas.
Es una enfermedad genética y en la mayoría de los casos se debe a una mutación en el cromosoma 11 de transmisión autosómica dominante (la posibilidad de transmisión de la enfermedad es de un 50%). Esta mutación conduce a un déficit enzimático – cuantitativo (AEH tipo I) o funcional ( AEH tipo II) del factor C1 inhibidor del sistema del complemento. Como consecuencia se produce hinchazón en diversas localizaciones a través de un mediador bioquímico denominado bradicinina. Existen algunos desencadenantes conocidos, como la manipulación de la cavidad oral o de la vía respiratoria superior, algunos fármacos (anticonceptivos orales que contengan estrógenos, antihipertensivos del grupo de los inhibidores de la enzima convertidora de la angiotensina), las infecciones y los traumatismos. En muchas ocasiones no se reconoce un precipitante concreto.
El AEH suele debutar en edad infantil y y se agrava a partir de la pubertad. Los ataques pueden afectar a cualquier órgano y pueden ser letales si afectan a la vía aérea superior. Sin embargo, el diagnóstico suele ser tardío debido a la inespecificidad de los síntomas:
- Edema en manos, brazos, piernas, labios, párpados, lengua, garganta o genitales
- Obstrucción de la vía aérea superior. Existe riesgo vital.
- Episodios recurrentes de dolor abdominal sin causa aparente. Puede llegar a ser grave, simular causa quirúrgica, ocasionar deshidratación y/o shock hipovolémico.
La frecuencia y la intensidad de los ataques son muy variables. Varían tanto en un mismo paciente, como en los familiares afectados por la misma mutación genética.
El diagnóstico se realiza a través de un análisis de sangre, donde se objetiva una disminución del C4 del complemento y del C1 inhibidor (actividad y/o cantidad). El estudio genético establece el diagnostico definitivo.
Tratamiento
Los ataques causados por esta enfermedad no responden al tratamiento antialérgico habitual -corticosteroides, antihistamínicos, adrenalina-. Se han de tratar con medicación específica, por lo que es fundamental establecer la sospecha en la crisis aguda. Los objetivos del tratamiento se basan en 3 principios:
- Tratar las crisis que aparezcan (tratamiento de las crisis)
El inhibidor específico de C1 es el tratamiento de primera elección para los ataques agudos, en los países en los que está disponible. Se recomienda su uso via intravenosa para el tratamiento de las crisis en niños. La dosis recomendada es de 20 U/kg. El icatibant (un antagonista del receptor B2 de bradicinina, subcutáneo) es una alternativa válida aprobada para su uso en niños mayores de 2 años.
- Prevención en situaciones de riesgo especial (prevención o profilaxis a corto plazo)
Se recomienda realizar profilaxis a corto plazo con inhibidor C1 purificado intravenoso ante procedimientos quirúrgicos o manipulaciones dentales/ en la cavidad oral (aplicable de 6 horas a 1 hora antes).
- Evitar o disminuir la aparición de crisis a lo largo del tiempo (prevención o profilaxis a largo plazo).
La necesidad de profilaxis a largo plazo deberá ser individualizada para cada paciente.
Dra. Krasimira Baynova. UGC Alergología, CSUR Angioedema hereditario. Hospital Universitario Virgen del Rocío, Sevilla. Comité de Alergia Infantil de SEAIC
Enlaces de interés:
- Asociación Española de Angioedema Familiar: https://angioedema-aedaf.haei.org/
- US Hereditary Angioedema Association – HAEA (Estados Unidos): https://es.haea.org/
Bibiliografía
- Frank MM, Zuraw B, Banerji A, Bernstein JA, Craig T, Busse P, et al. Management of children with hereditary angioedema due to C1 inhibitor deficiency. 2016;138:e20160575.
- Farkas and HAWK International consensus on the diagnosis and management of pediatric patients with hereditary angioedema with C1 inhibitor deficiency. Allergy.2017 Feb; 72(2): 300–313. PMID: 27503784.
- https://angioedema-aedaf.haei.org/wp-content/uploads/2019/03/GUIA- PACIENTE-NEW-V4.pdf
Caminando hacia la Medicina Personalizada
Cuando un médico necesita prescribir un fármaco debe asumir de entrada dos grandes problemas: muchos fármacos sólo son efectivos en una parte de los pacientes, y algunos de ellos producen efectos indeseados, a veces peligrosos, en algunos pacientes. En la actualidad sabemos que gran parte de las diferencias interindividuales tanto en efecto como en toxicidad son genéticas. La farmacogenética y la farmacogenómica (FG) estudian las interacciones entre los fármacos y los genes. En la era post genoma humano y sabiendo que los genotipos personales difieren en millones de bases (polimorfismos genéticos), la aplicación de la genética para explicar las diferencias interindividuales en la respuesta clínica a un fármaco parece ofrecer una gran promesa. Los genes más estudiados son los implicados en el metabolismo (farmacocinética) y en la acción de los fármacos (farmacodinámica).
En el metabolismo de una gran cantidad de fármacos intervienen enzimas del citocromo p450 (CYP) y la existencia de numerosos polimorfismos en los CYP condiciona la diferente respuesta en cada persona frente estos fármacos. En función de cómo sea este metabolismo, se han descrito diferentes fenotipos: lento, intermedio, rápido y ultrarrápido. En general se puede resumir que el efecto de un fármaco es mayor en los metabolizadores lentos y mucho menor en los metabolizadores rápidos. Con dosis estándares, el fármaco puede no tener efecto en los metabolizadores ultrarápidos, y los metabolizadores lentos pueden tener efectos de sobredosis.
Las reacciones adversas a medicamentos siguen siendo una de las principales causas de morbi-mortalidad, por lo que en la actualidad gran parte de los esfuerzos de la investigación biomédica se centran en optimizar la eficacia de los fármacos y minimizar sus efectos adversos.
En los últimos años se ha producido un aumento significativo en las recomendaciones de dosificación guiadas por FG, no sólo para nuevos medicamentos, sino también para otros más antiguos; sin embargo, la mayor parte de esta información se concentra en los fármacos que son utilizados para tratar a los adultos. La elección de la dosis adecuada de un fármaco puede ser un desafío en el caso de poblaciones pediátricas, donde el conocimiento de los efectos de la maduración (ontogenia) sobre la eficacia de los medicamentos y la práctica basada en la evidencia en este área son limitados.
La dieta, la edad, el estilo de vida, el estado de salud y el medio ambiente influyen en la respuesta de una persona a los medicamentos. Pero si conociésemos además datos acerca de su constitución genética, aumentaríamos la probabilidad de obtener resultados positivos y reduciríamos el riesgo de que se produjesen reacciones adversas graves. Los avances en FG permitirán seleccionar el medicamento y la dosis apropiada para cada paciente, con el objetivo de adaptar el tratamiento según la genética del individuo, lo que se conoce como Medicina Personalizada.
Para saber más: Pediatric pharmacogenomics: challenges and opportunities: on behalf of the Sanford Children’s Genomic Medicine Consortium. Gregornik D, Salyakina D, Brown M, Roiko S, Ramos K. Pharmacogenomics J. 2021 Feb;21(1):8-19.
María Rueda García. Alergóloga, MD, PhD. Servicio de Alergología, Hospital Quironsalud, Barcelona. Miembro del Comité de Alergia Infantil de la SEAIC, grupo de interés en Alergia a Medicamentos.