resultados de la búsqueda: asma/wp-content/uploads/logos/Sitio web no disponible/profesionales/aviso-importante/Hospital Universitario Fundación Jiménez Díaz/inicio/cme-jiaci
Banco de Imágenes en Alergología
El próximo 14 de septiembre concluye el plazo de participación en el proyecto BIA (Banco de Imágenes en Alergología), iniciativa que, bajo el formato de concurso, tiene como objetivo crear una colección de imágenes seleccionadas por su calidad e interés demostrativo aportadas por los alergólogos.
Valoramos tu opinión
Arranca el proyecto «Valoramos tu opinión», con el fin de que las opiniones, sugerencias y peticiones de los socios nos permitan responder a sus necesidades. Si no dispone de su código solicítelo a mariajesus.hernandez@seaic.org.
Acceda al sitio desde aquí.
¿Qué es la Esofagitis Eosinofílica?
¿Qué es la esofagitis eosinofílica (EoE)?
– Es una enfermedad inflamatoria del esófago de carácter crónico, mediada por mecanismos inmunológicos, que se caracteriza por la presencia de infiltración de eosinófilos en mucosa esofágica. Se puede observar eosinofilia en sangre periférica entre aproximadamente el 10 y el 50% de los casos.
– En la actualidad, es la segunda causa de esofagitis crónica tras la enfermedad por reflujo gastroesofágico (ERGE) y la principal causa de disfagia e impactación de alimentos en niños y adultos jóvenes
– Fue descrita en los años 90, actualmente con un aumento dramático en la prevalencia hasta afectar al menos a un habitante por cada 2.000 en Europa y Norteamérica.
– Es más frecuente en varones y puede manifestarse a cualquier edad
– En la mayoría de los casos, la inflamación esofágica está desencadenada por alimentos, aunque es posible que también influyan factores ambientales. Los alimentos más frecuentes implicados son: leche de vaca, gluten y huevo.
– Puede ser causada por mecanismos de sensibilización alimentaria mediados por inmunoglobulina E (IgE), no mediados por IgE o mixtos.
– Un problema importante es la falta de correlación entre la intensidad de los síntomas y la inflamación del tejido ya que actualmente el único método diagnóstico y de seguimiento es la gastroscopia con toma de biopsias.
¿Cuándo se debe sospechar una esofagitis eosinofílica?
• Ingiere muchos líquidos con las comidas para lubricar los alimentos
• Modifica la comida (cortarla en pequeños trozos)
• Tiempos de comida prolongados
• Evita alimentos de textura dura (pan, carnes)
• Mastica excesivamente
• Rechaza pastillas/comprimidos
• Dolor en el pecho
¿Cuáles son los síntomas?
– Depende de la edad:
• Preescolares: fallo de medro, rechazo del alimento, dolor abdominal, vómitos, trastornos del sueño, etc.
• Escolares, adolescentes y adultos: disfagia, impactación, odinofagia, regurgitación.
¿Cómo se diagnostica?
– Gastroscopia con toma de biopsias de esófago proximal y distal
El diagnóstico etiológico o causal se realiza:
– Pruebas cutáneas con batería extensa de alérgenos.
– Determinación de IgE específicas
– Dieta de evitación y valoración de la respuesta de la mucosa esofágica
¿Cuál es el tratamiento?
– Dieta de eliminación
– Inhibidores de la bomba de protones (IBP)
– Corticoides deglutidos
– En casos de estenosis o estrechamiento importante del esófago: Dilatación esofágica
– Terapias en trámites de aprobación en Europa: anti IL4 y IL13 (Dupilumab)
IMPORTANTE: La EoE no es una enfermedad mortal pero su carácter crónico y agresivo afectan la calidad de vida de los que la padecen y de sus familias. Recuerda consultar con tu alergólogo/a, si presentas síntomas descritos.
Bibliografía:
1. Attwood SE, Smyrk TC, Demeester TR, Jones JB. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci. 1993 Jan;38(1):109-16. doi: 10.1007/BF01296781. PMID: 8420741.
2. Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. Idiopathische, eosinophile Osophagitis: eine häufig verkannte Krankheit mit typischer Klinik und diskretem endoskopischem Bild [Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings]. Schweiz Med Wochenschr. 1994 Aug 20;124(33):1419-29. German. PMID: 7939509.
3. Spergel JM, Beausoleil JL, Mascarenhas M, Liacouras CA. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol. 2002 Feb;109(2):363-8. doi: 10.1067/mai.2002.121458. PMID: 11842310.
4. Sampson HA. Update on food allergy. J Allergy Clin Immunol. 2004 May;113(5):805-19; quiz 820. doi: 10.1016/j.jaci.2004.03.014. PMID: 15131561. 5. Arias Á, Pérez-Martínez I, Tenías JM, Lucendo AJ. Systematic review with meta analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016 Jan;43(1):3-15. doi: 10.1111/apt.13441. Epub 2015 Oct 28. PMID: 26510832. 6. Lucendo AJ, Arias-González L, Molina-Infante J, Arias Á. Systematic review: health-related quality of life in children and adults with eosinophilic oesophagitis-instruments for measurement and determinant factors. Aliment Pharmacol Ther. 2017 Aug;46(4):401-409. doi: 10.1111/apt.14194. Epub 2017 Jun 22. PMID: 28639700.
7. Molina infante J, Corti R, Doweck J, Lucendo AJ. Actualización terapéutica en esofagitis eosinofílica. Acta Gastroenterol Latinoam 2018; 48(3): 242-252 8. Molina-Infante J, Gonzalez-Cordero PL, Ferreira-Nossa HC, Mata-Romero P, Lucendo AJ, Arias A. Rising incidence and prevalence of adult eosinophilic esophagitis in midwestern Spain (2007-2016). United European Gastroenterol J. 2018 Feb;6(1):29-37. doi: 10.1177/2050640617705913. Epub 2017 Apr 21. PMID: 29435311; PMCID: PMC5802667.
9. Arias Á, Lucendo AJ. Incidence and prevalence of eosinophilic oesophagitis increase continiously in adults and children in Central Spain: A 12-year population-based study. Dig Liver Dis. 2019 Jan;51(1):55-62. doi:
10.1016/j.dld.2018.07.016. Epub 2018 Jul 31. PMID: 30115573.
10. Gupta M, Grinman M. Diagnosis and management of eosinophilic esophagitis. CMAJ. 2024 Feb 4;196(4):E121-E128. doi: 10.1503/cmaj.230378. PMID: 38316452; PMCID: PMC10843442.
11. Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, Amil Dias J, Bove M, González-Cervera J, Larsson H, Miehlke S, Papadopoulou
A, Rodríguez-Sánchez J, Ravelli A, Ronkainen J, Santander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017 Apr;5(3):335-358. doi: 10.1177/2050640616689525. Epub 2017 Jan 23. PMID: 28507746; PMCID: PMC5415218.
12. Joan Domenech Witek, Vicente Jover Cerda, Zahira Maria Franzon Laz, et al.. (2020-04-14). «Study and Follow-Up of Patients with Allergic Eosinophilic Esophagitis Phenotype.» *Volume 3*, 1, 7-17
13. Gómez Torrijos E, González-Mendiola R, Alvarado M, Ávila R, Prieto-Garcia A, Valbuena T, Borja J, Infante S, López MP, Marchan E, Prieto P, Moro M, Rosado A, Saiz V, Somoza ML, Uriel O, Vásquez A, Mur P, Poza-Guedes P, Bartra J. Eosinophilic Esophagitis: Review and Update. Front Med (Laussanne). 2018 Oct 9;5:247. doi: 10.3389/fmed.2018.00247. PMID: 30364207; PMCID: PMC6192373.
14. Domenech Witek J, González Mendiola R, Jover Cerdá V, Pereira González J, Carballas Vásquez C, Villas Martínez F, Rodríguez Pacheco R. Description of allergic phenotype in patients with eosinophilic oesophagitis: management protocol proposal. Sci Rep. 2023 Feb 8;13(1):2226. doi: 10.1038/s41598-023- 29602-z. PMID: 36755125; PMCID: PMC9906574
Los Aditivos Alimentarios: El mal de todo paciente, el olvido de todo alergólogo.
Los aditivos alimentarios son sustancias que habitualmente no se consumen como producto alimentario. No obstante, tienen un papel fundamental a la hora de mantener la calidad y las características de los alimentos que exigen los consumidores y hacen que estos alimentos sigan siendo seguros, nutritivos y deseables. De este modo, los aditivos no son alimentos en sí, sinó sustancias que se añaden a los alimentos para mejorar su conservación, color, sabor o consistencia.
A este grupo de sustancias se les ha atribuído con bastante frecuencia la capacidad de producir reacciones adversas, e incluso alérgicas. No obstante, en la actualidad se desconoce la prevalencia exacta de reacciones adversas frente aditivos, si bien sabemos y se ha demostrado que los aditivos alimentarios muy raramente provocan auténticas reacciones inmunológicamente mediadas (hecho poco creíble entre la población general).
A continuación se describen los grupos de aditivos existentes en el mercado actual, sus características fundamentales y algunas de las principales reacciones adversas descritas hasta el momento debido a estas sustancias:
Antioxidantes y conservantes: Son aditivos que mantienen la frescura e impiden su deterioro. Contribuyen a qué los alimentos se puedan conservar durante más tiempo protegiéndolos contra el daño ocasionado por la oxidación o los microrganismos. Los antioxidantes evitan la oxidación de las grasas de los alimentos e impiden que se decoloren y se vuelvan rancios. Los conservantes limitan, retrasan o previenen la proliferación de los microorganismos.
Antioxidantes: Ácido ascórbico E300, Ascorbato De Sodio E301, Ascorbato De Calcio E302, Ascorbato De Potáseo E303, palmitato ascorbil E304, estearato ascorbil E305, Extractos Naturales Ricos En Tocoferol E306, Alfa Tocoferol E307, gamma tocoferol E308, delta tocoferol E309, Galato De Propil E310, Galato De Octil E311, Galato De Dodecil E312, Ácido Eritórbico E315, Eritorbato Sódico E316, Butilhidroquinona (Bhq) E319, Butilhidroxianisol (Bha) E320, Butilhidroxitolueno (Bht) E321, lactato de sodio E325, lactato de potáseo E326, lactato de calcio E327, etileno diamino tetra acetato E385, ácido etilendiaminotetracético E386, extracto de romero E392, Tocoferoles (E306-307-308-309), Ácido ascórbico (E300), BHA (butilhidroxianisol o E320) y BHT (butilhidroxitoluol o E321). La incidencia de broncoespasmo debido a estos aditivos es realmente muy baja. Se han descrito casos de urticaria de contacto, urticaria crónica y dermatitis atópica debido a estos antioxidantes.
Los conservantes físicos son muy efectivos, pero, en muchos casos, tienen una duración muy corta y un elevado coste. Los conservantes físicos serían el frío (refrigeración o congelación), la liofilización y el envasado al vacío. Existen también los conservantes químicos que según su origen pueden dividirse en:
- Minerales
- Cloruros: cloruro sódico o sal común, es el primer conservante químico utilizado y un eficaz agente antimicrobiano.
- El dióxido de azufre y los sulfitos (E220 hasta 228): Anhídrico sulforoso y sulfitos con concentraciones superiores a 10 mg/l expresados como SO2: Los sulfitos y bisulfitos son sustancias derivadas del azufre y se utilizan como antioxidantes o conservantes. La normativa europea obliga a etiquetar cualquier alimento que contenga sulfitos a concentraciones superiores a 10 mg/kg o 10 mg/l, y estos productos han de ser declarados con el término sulfito o dióxido de azufre (E-220, E-221, E-222, E-223, E-224, E-225, E-226, E-227 i E-228). Los sulfitos pueden ser responsables de reagudizaciones asmáticas en pacientes con asma. Los principales alimentos que contiene sulfitos son: el vino (que contiene sulfitos producidos durante la fermentación) y otras bebidas alcohólicas o no alcohólicas envasadas (zumos, mosto, sidra), alimentos envasados, alimentos pre-cocinados, conservas, alimentos ultracongelados y vinagre. A parte de síntomas respiratorios bronquiales, los sulfitos también pueden ocasionar molestias nasales (rinitis), digestivas y/o cutáneas (urticaria, angioedema y dermatitis de contacto).
- Nitratos y nitritos (sales potásicas y sódicas) (desde E249 a 252). Se utilizan como conservantes en el procesado de carnes como el jamón y otros embutidos con la finalidad de garantizar la seguridad de los productes e inhibir el crecimiento de la bacteria botulínica. Los nitritos y los nitratos se encuentran en productos cárnicos curados, derivados del pescado y los quesos. La formación de nitrosamina se considera cancerígena. Pueden ser responsables de agravar la clínica de dermatitis atópica en algunos pacientes. También se han descrito casos de reacciones alérgicas graves (anafilaxia) debido a estos conservantes.
- Orgánicos:
- Ácidos grasos saturados y sus derivados: Ácido acético y acetatos, ácido fórmico y formiatos, ácido propiónico y propionatos.
- Ácido sórbico y sorbatos. Tienen actividad frente Clostridium botulinum. Se han descrito casos de urticaria de contacto perioral debida a estos conservantes.
- Ácido benzoico y benzoatos. Los benzoatos se encuentran de manera natural en las cerezas y la canela. Son unos de los aditivos más relacionados con reacciones alérgicas. Pueden ser responsables de agravar la clínica de dermatitis atópica en algunos pacientes. También se han descrito casos de urticaria, urticaria de contacto, angioedema, rinitis y asma debido a estos conservantes si bien la incidencia es muy baja. Los benzoatos también se han asociado a otras reacciones como por ejemplo el dolor de cabeza, la migraña, la dificultad de concentración, la hiperactividad y las artralgias, si bien la incidencia es también muy baja.
- Antioxidantes fenólicos.
- Antibióticos. Se utilizan poco por el riesgo de producir efectos indeseables así como por la posibilidad de producir cepas microbianas resistentes. La nisina es el más utilizado ya que inhibe el crecimiento de
Aditivos que aumentan o potencian las cualidades sensoriales.
- Modificadores del sabor y la textura:
- Emulsionantes y estabilitzantes: se utilizan para mantener la consistencia de la textura y evitar que los ingredientes se disgreguen. La lecitina (E322), los monoglicéridos y los diglicéridos, entre otros pertenecen a este grupo. Entre los estabilizantes destaca la metilcelulosa (E461), habiéndose descrito sobre todo reacciones adversas gastrointestinales debidas a este estabilizante (predominantemente dolor, distensión abdominal y en algunos casos incluso obstrucción intestinal). De entre los emulsionantes, destaca el triestearato de sorbitán (E492), el cual puede incrementar la absorción de sustancias solubles en grasas.
- Espesantes: ayudan a incrementar la viscosidad de los alimentos. Habitualmente se utilizan como espesantes sustancias naturales como la gelatina (E441: se han descrito reacciones alérgicas graves –anafilaxia- debidas a la gelatina) o la pectina [E440a: grandes cantidades pueden producir síntomas gastrointestinales (sobre todo dolor y distensión abdominal)]. Otros espesantes son el ácido algínico (E400), el alginato de sodio (E401), el alginato de potáseo (E402), el alginato de amonio (E403), el alginato de calcio (E404) o el agar-agar (E406). A pequeñas cantidades no se les conocen efectos adversos atribuíbles. No obstante, grandes cantidades pueden inhibir la absorción de algunos nutrientes y ocasionar patología gastrointestial. Las gomas naturales también se utilizan como espesantes. Pertenecen a la familia de las legumbres la goma arábiga (E414), la goma de algarroba (E410), la goma guar (E412), la goma de tara (E417) y la goma de tragacanto (E413). La goma guar (E412) es una goma natural proviniente de la semilla de la planta Cyamopsis tetragonoloba (familia Fabaceae). Este aditivo se encuentra casi siempre en forma de polvo, pero, cuando se combina con otros ingredientes también puede verse en forma líquida o de gel. Debido a qué es una fibra soluble en agua, la goma guar puede tener un efecto laxante en aquellas personas que la consuman. Muy frecuentemente también es la responsable de ocasionar patología gastrointestinal (diarrea, dolor abdominal, distensión abdominal), habiéndose incluso descrito casos de obstrucción intestinal debido a su consumo. Al igual que la goma de algarroba puede incrementar los niveles de colesterol. La goma de tragacanto (E413) se obtiene de diversas especies de Astragalus. Se han descrito reacciones alérgicas por contacto (dermatitis de contacto y/o urticaria).
- Edulcorantes: proporcionan un sabor dulce a los alimentos y se utilizan en productos bajos en calorías. Son edulcorantes intensos el acesulfam K (E950), el aspártamo (E951) y la sacarina (E954). También son edulcorantes la taumatina (E957), que es una proteína edulcorante natural que se extrae de la planta Thaumatococcus danielli (es 2.500 veces más dulce que el azúcar), el sorbitol (E420), la isomaltosa (E953), el maltitol (E965i), el ciclamato E 952, la sucralosa E955, la glicirricina E958, la neohesperidina (Nhdc) E959, la estevia (extracto de stevia) E960, el jarabe de maltitol E965ii, el lactitol E966, el xilitol E967, el eritritol E968, el advantamo E969, el sorbitol (E420), el manitol (E421) y el glicerol (E422). Principalmente pueden producir trastornos gástricos (náuseas, vómitos y diarreas).
- Potenciadores del sabor: El más conocido es el glutamato monosódico (se identifica con los códigos GMS o E621). Se utiliza sobre todo en productos salados, alimentos de sobre y en una gran variedad de platos orientales. Es la sal sódica del ácido glutámico. Originariamente se extraía de las algas y del trigo. Se utiliza sobre todo para la preparación de alimentos de sobre y en las cocinas orientales. Las manifestaciones clínicas más características de las reacciones adversas por glutamato se engloban dentro del «síndrome del restaurante chino» que se describe como la aparición de dolor de cabeza, sensación de ardor en la piel (sobre todo en escote y cara) que posteriormente afecta al resto del cuerpo y se acompaña de náuseas, palpitaciones y en ocasiones incluso pérdida de conocimiento. El cuadro se inicia a los pocos minutos de la ingesta de una alta cantidad de glutamato y cede en 2-3 horas. Actualmente está todavía en controversia el papel del glutamato monosódico como desencadenante de crisis de asma o de patología cutánea (urticaria y/o angioedema). Parece que sí que podría estar relacionado con la clínica de rinitis.
- Acidulantes: Un acidulante es un aditivo alimentario que incrementa la acidez de un alimento o le da un sabor ácido. Entre los diversos acidulantes que se utilizan están los ácidos orgánicos y los ácidos inorgánicos.
- Otros: antiaglomerantes, antiespumantes, gases de envasado, midones, disolventes, entre otros.
- Colorantes: Los colorantes se utilizan en los alimentos para añadir o restaurar el color con el objetivo de mejorar su aspecto visual. Pueden inducir reacciones de urticaria, angioedema (hinchazón), asma, rinitis, eczemas cutáneos, dermatitis de contacto e incluso anafilaxia. Parece que también pueden inducir reacciones pseudoalergicas o anafilactoides. Los colorantes también se han involucrado en otras reacciones afortunadamente bastante infrecuentes tales como dolor de cabeza, migraña, hiperactividad, dificultad de concentración y atención así como artralgias. Desde el punto de vista de su origen, los colorantes alimentarios se pueden clasificar en colorantes naturales [extracto de pimiento (paprika)], minerales y de síntesis. Dentro de los colorantes de síntesis encontramos dos grupos principales:
- Azoicos: Los colorantes azoicos son los que más frecuentemente se han implicado en reacciones adversas. Tartrazina: La tartrazina puede provocar clínica de urticaria en algunos pacientes aunque la prevalencia en la actualidad se sabe que es realmente muy baja. Tampoco queda claro su posible papel como desencadenante de crisis de asma. Sí parece que podría ser responsable de agravar la clínica de dermatitis atópica en algunos pacientes. Amarillo naranja: Se han descrito casos de urticaria, angioedema, eczemas y clínica gastrointestinal debidas a este colorante. Rojo de cochinilla: Es un colorante de síntesis muy utilizado en la industria, sobre todo para la conservación del color de los frutos rojos y de las conservas de marisco. Se han descrito casos de anafilaxia debido a este colorante en los que se ha podido demostrar un mecanismo alérgico mediado por anticuerpos IgE. Rojo carmín o ácido carmínico: Se obtiene a partir de la maceración de las hembras del insecto conocido popularmente como cochinilla (Dactylopius coccus). Es un colorante de color rojo intenso y no debe confundirse con el mismo colorante de origen sintético llamado rojo de cochinilla. Se ha implicado en casos de reacciones adversas y en muchos casos se ha podido demostrar un mecanismo alérgico mediado por anticuerpos IgE. Se han descrito reacciones de urticaria, asma, rinitis e incluso anafilaxia debidas a este colorante. Amarillo tartrazina: Este colorante se ha involucrado en reacciones alérgicas cruzadas con los derivados pirazolónicos (grupo de medicamentos antiinflamatorios donde pertenece el metamizol) así como con múltiples reacciones alérgicas.
- No azoicos: eritrosina, amarillo quinoleína e indigosina. Eritrosina: Es un polvo de color marrón que disuelto proporciona una tonalidad roja y puede presentar reactividad cruzada con la eosina. Según el lugar donde se añadan pueden ser de dos tipos:
- Los que se añaden directamente al alimento y se pueden consumir con ellos. En la Unión Europea se identifican con la letra E seguida de un número de 3 cifras.
- Los que se utilizan para dar un determinado color en el exterior de algunos alimentos y que no se suelen consumir. En la Unión Europea se identifican con la letra C, seguida de un número.
Aditivos que pueden contener trigo:
Almidones modificados: 1400, 1401a, 1402, 1403, 1404, 1405, 1410, 1412, 1414, 1420, 1.422, 1440, 1442, 1450, 1451. Los almidones abundan en los alimentos amiláceos (cereales y patata). El almidón más utilizado es el que se obtiene del maíz.
Polidextrosa E-1200.
E-306 Vitamina E. Son extractos de origen natural ricos en tocoferoles. Pueden ser de trigo, de arroz, de maíz o de soja.
Aditivos que contienen proteína de leche de vaca:
H-4511 caseinato cálcico
H-4512 caseinato sódico
H-4513 caseinato potásico
Aditivos que pueden contener proteína de leche de vaca:
E-101 Riboflavina o lactoflavina: Se utiliza como colorante. Actualmente casi siempre es de origen sintético.
E-270 Ácido láctico, E-325 Lactato sódico, E-326 Lactato potásico, E-327 Lactato cálcico: Tanto el ácido láctico como los lactatos se producen comercialmente a partir de la fermentación bacteriana del almidón y melazas, sin embargo, es posible que el cultivo para iniciar la producción de ácido láctico pueda contener leche.
E-966 Lactitol: Es un azúcar-alcohol sintético producido a partir de la lactosa que es un azúcar que contiene la leche de vaca. Aunque es bastante improbable que este aditivo contenga proteína de leche de vaca, el hecho de provenir de la lactosa hace que no se pueda descartar alguna posible contaminación.
E-472b Ésteres lácticos de los mono y diglicéridos de ácidos grasos, E-481 Estearoil-2-lactilat sódico, E-482 Estearoil-2-lactilat cálcico: Generalmente se producen a partir de grasas vegetales. Sin embargo, también pueden provenir de grasas animales por lo que en caso de provenir de grasas animales bovinos podrían contener proteína de leche de vaca.
Aditivos que contienen huevo:
E-161B Luteína, E-1105 Lisozima
Aditivos que pueden contener huevo:
E-101 Riboflavina: Se utiliza como colorante. Actualmente casi siempre es de origen sintético.
E-322 Lecitina: Actualmente casi siempre se obtiene de la soja, pero, en caso de duda se debe consultar al fabricante.
Aditivos que pueden contener pescado:
Potenciadores del sabor (E-626, E-627, E-628, E-629, E-630, E-631, E-632, E-633, E-634, E-635): Se obtienen a partir de levaduras o de extractos de carne o de peces.
Dra. Teresa Garriga Baraut
Bienvenidos
Primera comunicación a los miembros de comité de asma
LEER POR FAVOR COMO SE REALIZAN LAS COLABORACIONES Y COMUNICADOS
Enlace de presentación: Presentacion1 (1143 descargas )
Premio Dr Ricardo Palacios Mejor Tesis en Alergología
PREMIO NACIONAL «Dr. Ricardo Palacios» a la MEJOR TESIS en ALERGOLOGÍA convocado por la Fundación SEAIC y Diater Laboratorio, año 2024.
Plazo de inscripción: hasta el 30 de septiembre de 2024.
ABIERTO PARA SOCIOS PRE-NUMERARIOS Y NUMERARIOS.
Nos complace anunciar la convocatoria del Premio Nacional «Dr. Ricardo Palacios» a la mejor tesis doctoral en Alergología, organizado por la Fundación de la Sociedad Española de Alergología e Inmunología Clínica (FSEAIC) y el Laboratorio DIATER, que tiene como objetivo fomentar la excelencia en la investigación en Alergología, reconociendo anualmente la tesis doctoral más destacada en este campo, ya sea realizada dentro o fuera de España.
Premio: diploma acreditativo y 5,000 € (importe en bruto sujeto a retenciones fiscales vigentes).
Requisitos: médicos especialistas o residentes en Alergología, miembros de la SEAIC (únicamente), con tesis defendida y calificada entre el 1 de septiembre de 2023 y el 30 de julio de 2024.
La convocatoria está abierta a todos los médicos especialistas y residentes en Alergología miembros de la SEAIC, te invitamos a que le des difusión.
Descarga toda la información y la convocatoria a continuación:
Premio mejor TFG en Alergología
PREMIO NACIONAL al MEJOR TFG en ALERGOLOGÍA convocado por la Fundación SEAIC y Diater Laboratorio, año 2024.
Plazo de inscripción: hasta el 30 de septiembre de 2024.
Nos complace anunciar la convocatoria del Premio Nacional al Mejor TFG en Alergología, organizado por la Fundación de la Sociedad Española de Alergología e Inmunología Clínica (FSEAIC) y el Laboratorio DIATER. Este premio tiene como objetivo fomentar la excelencia en la investigación en Alergología, reconociendo anualmente el mejor Trabajo de Fin de Grado (TFG) en este campo, presentado, defendido y aprobado en cualquier universidad española durante el curso académico 2023-2024.
Premio: diploma acreditativo y 1,500€ (importe en bruto sujeto a retenciones fiscales vigentes). Se podrá conceder un accésit de 300€ brutos y diploma.
Requisitos: estudiantes matriculados en cualquier universidad española, con TFG defendido y aprobado en el curso académico 2023-2024 (septiembre 2023 a julio 2024), que aborde cuestiones relacionadas con la Alergología.
Descarga toda la información y la convocatoria a continuación:
![]() Bases Premio mejor TFG en Alergología 2024 (1485 descargas )
Bases Premio mejor TFG en Alergología 2024 (1485 descargas )
Los abejorros, culpables del aumento de alérgicos
Fuente: SALUD REVISTA.ES | Granada
La preocupación de los alergólogos radica en la gravedad que pueden alcanzar los posibles síntomas tras su picadura
La utilización de abejorros o Bombus en los invernaderos para la polinización de hortalizas , debido a que trabajan más rápido y a que pueden acarrear cargas más pesadas que otros polinizadores, ha provocado en los últimos años un aumento en el número de pacientes alérgicos a las picaduras de estos insectos himenópteros. «Los trabajadores de los invernaderos son muy susceptibles de hacerse alérgicos a las picaduras de estos insectos: al estar más expuestos el número de picaduras aumenta y en consecuencia también han aumentado las reacciones alérgica», explica la doctora Sergia Cruz, alergóloga del Hospital Torrecárdenas en Almería. Pero la preocupación de los alergólogos no radica en la prevalencia de este tipo de alergia, sino en la gravedad que pueden alcanzar los posibles síntomas. «Las reacciones alérgicas que pueden producir al picar son similares a las causadas por otros himenópteros comunes. Pueden provocar desde reacciones locales extensas que cursan con enrojecimiento, picor e hinchazón intenso en la zona afectada, hasta reacciones generalizadas que pueden llegar a ser realmente graves», alerta la alergóloga. Diagnóstico y tratamiento Por ello, los especialistas recomiendan no minimizar los síntomas que se puedan sentir con una primera picadura y acudir siempre al alergólogo. El objetivo es realizar un diagnóstico para establecer un tratamiento mediante inmunoterapia (vacunación) y dotar al paciente de un tratamiento de emergencia, como inyecciones de adrenalina, por si vuelve a ser picado por uno de estos insectos. Otras picaduras Existen insectos no himenópteros (ni abejorros, avispas, hormigas u abejas, por ejemplo) cuyas picaduras también pueden producir reacciones generalizadas por la picadura de estos son poco frecuentes, siendo los insectos implicados mosquitos, chinches, pulgas, moscas y la oruga procesionaria. En casos menos habituales, se han observado reacciones graves por cucaracha y tetraníquidos (ácaros y arañas rojas). Por la importancia de sus picaduras, y a pesar de pertenecer al orden Hymenoptera, las hormigas rojas se incluyen en este apartado. «Cuando hablamos de los riesgos de las picaduras pensamos solo en trabajos al aire libre, pero olvidamos que con la globalización recibimos a través del transporte múltiples mercancías de países lejanos que llegan a nuestros almacenes», afirma el doctor Darío Antolín, miembro del Comité Científico del Simposio Internacional de Alergia a Himenópteros y alergólogo del Hospital Universitario Príncipe de Asturias en Madrid. Test de repicadura La mayoría de los apicultores reciben picaduras de himenópteros a diario y no presentan diagnóstico de alergia a su veneno. Algunos estudios realizados en esta población sugieren que al estar sometidos al estímulo desarrollan cierta inmunidad. «La exposición mantenida y persistente al estímulo alergénico podría inducir un estatus de tolerancia inmunológica que afectaría a la respuesta inmunológica general de estas personas, explica el doctor Francisco Carballada, del Hospital Lucus Augusti, en Lugo. Esta es la base del test de repicadura que se practica a los pacientes que reciben tratamiento con inmunoterapia en los hospitales o que están en seguimiento. El test consiste en que la abeja pique al paciente, mediante una exposición controlada, para corroborar la efectividad de la vacuna. En la mayoría de los casos se confirma la inmunotolerancia, lo que mejora la adhesión al tratamiento por parte de los propios afectados. «En realidad, las vacunas para himenópteros están fabricadas con veneno puro de distintos tipos de avispas y abejas. Lo que se busca es que sea el propio sistema inmunológico del paciente el que se haga tolerante al veneno», concluye Carballada.
Aragón
Aragón
Centros con actividad asistencial pública en Alergología
Teruel
Hospital Obispo Polanco
- http://www.opolanco.es
- Avda. Ruiz Jarabo, s/n. 44002 Teruel
- 978621150
Zaragoza
Hospital Clínico Universitario Lozano Blesa
- http://www.hcuz.es
- Avda San Juan Bosco, 15. 50009 Zaragoza
- 976765700
Hospital Royo Villanova
- Avda San Juan Bosco, 15. 50009 Zaragoza
- 976765700
Asturias
Asturias
Centros con actividad asistencial pública en Alergología
Hospital de la Cruz Roja Española de Gijón
- http://www.hospitalcrgijon.com
- C/ Uría, 37. 33202 Gijón
- 985195000
Hospital Monte Naranco
- Avda. Dres. Fernández-Vega, 107. 33012 Oviedo
- 985106900
Hospital Universitario Central de Asturias
- http://www.hca.es
- C/ Celestino Villamil, s/n. 33006 Oviedo
- 985108000
Monografía de alergia cutánea
Ya está disponible para los socios registrados la monografía de la Fundación SEAIC sobre alergia cutánea. Acceda desde la Biblioteca Virtual.
V Congreso Nacional sobre Esofagitis Eosinofílica
El 18 de octubre de 2025 se celebrará en Sevilla el V Congreso Nacional sobre Esofagitis Eosinofílica (EoE), organizado por:
- European Consortium for Eosinophilic Diseases of the Gastrointestinal Tract (EUREOS)
- Asociación Española de Esofagitis Eosinofílica (AEDESEO)
- Hospital Universitario Virgen Macarena de Sevilla
- Asociación de Investigación Biomédica La Mancha Centro
Información útil:
- Modalidad: presencial y online en directo.
- Inscripción: gratuita para profesionales de la salud → Formulario de inscripción
- Acreditación: solicitada ante la Comisión de Formación Continuada del Sistema Nacional de Salud.
- Facilidades: el Congreso cuenta con la autorización de Farmaindustria para que los profesionales presenciales puedan gestionar con sus compañías farmacéuticas la cobertura de desplazamiento y alojamiento.
- Más información: web del Congreso
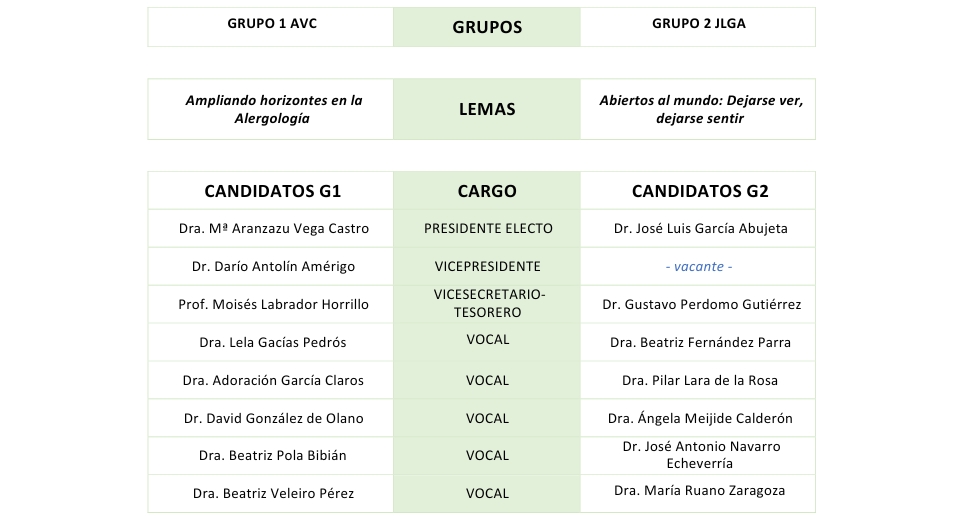
Campaña electoral 2024
Las elecciones SEAIC comienzan el 1 de octubre de 2024.
La Junta Directiva ha decidido extender la campaña electoral hasta finales de septiembre para que los socios tengan más tiempo para informarse e involucrarse en las distintas propuestas.
Aquí encontrarás información sobre el proceso de votación, los grupos electorales y aquello que los candidatos consideren relevante compartir sobre la campaña (la SEAIC facilita la difusión de mensajes electorales de los candidatos de ambas candidaturas).
PROCESO DE VOTACIÓN
Las votaciones online comenzarán el 1 de octubre. Recuerden que, aquellos que no voten online, podrán hacerlo en persona durante el simposio SEAIC en Bilbao.
La votación es de carácter voluntario y está abierta a todos los socios de la SEAIC.
⚠️ Se podrá elegir a toda la candidatura completa o bien seleccionar personas concretas de dicha candidatura.⚠️
Importante: solo se podrá optar por una modalidad de votación (online o presencial). Es decir, no se puede votar en algunas categorías online y en otras de forma presencial. Aquellos que voten online no podrán votar en persona en Bilbao.
- ONLINE: desde la web de la SEAIC - accediendo con el usuario y clave de socio. Permanecerá abierta durante 66 días.
Apertura: martes 1 de octubre a las 9:00 am
Cierre: 6 de noviembre a las 15:30 horas - PRESENCIAL: se podrá votar en el stand de la SEAIC en el marco del Simposio Internacional de la SEAIC en Bilbao (con DNI). Permanecerá abierta durante 2 días.
Apertura: jueves 7 de noviembre a las 9 a.m
Cierre: viernes 8 de noviembre a las 14:00 horas
Atención del niño alérgico en Urgencias: El Papel del Triaje
Cuando diagnosticamos a un paciente de anafilaxia, le indicamos una serie de medidas de actuación en caso de que presente un nuevo episodio que incluyen la autoadministración de adrenalina y la necesidad de acudir a un centro médico para ser evaluado y tratado. Es más, asumimos que ese paciente será atendido correcta y rápidamente en Urgencias.
Somos poco conscientes del papel que han cobrado los sistemas de Triaje en la mayoría de los servicios de urgencias para hacer frente a la creciente presión asistencial. En los últimos 25 años se han implantado progresivamente múltiples sistemas de triaje hospitalario1, en base a los que se decide cuándo (tiempo de espera), quién (según la organización propia del centro) y dónde (Consulta o Sala de Exploración, Sala de Reanimación…) se atiende a los pacientes. La sala de triaje es donde debe identificarse al paciente con anafilaxia.
Nuestro hospital utiliza el Canadian Paediatric E.D. TRIAGE and Acuity Scale (PaedCTAS)2, con 5 posibles niveles de prioridad (I: Reanimación, de atención inmediata; II: Emergencia, con un tiempo de espera de atención inferior a 15 minutos; III: Urgencia, con un tiempo de espera de unos 30 minutos; IV: Semi urgencia, con tiempo de espera de 1 hora y finalmente, la No Urgencia, con una espera de hasta 2 horas). Estos tiempos recomendados para atender a los pacientes se cumplen en mejor o en peor medida según la afluencia. Según este sistema de triaje una anafilaxia es una patología de prioridad I.
Nos planteamos evaluar la calidad del triaje del niño alérgico a raíz del comentario de un paciente en la Consulta. Nuestro paciente, con anafilaxia previa por alergia a alimentos, siguió todos los pasos indicados en consulta y en su informe clínico, incluidos el uso de su autoinyector y traslado a Urgencias de nuestro hospital. Una vez allí, y tras el triaje, se le envió a la Sala de Espera y fue dado de alta en menos de 2 horas.
Al evaluar triaje en urgencias de pediatría de otros niños atendidos por alergia encontramos que más de la mitad de los niños con diagnóstico de anafilaxia habían recibido una prioridad III (categoría: urgente; prioridad intermedia; tiempo de espera estimado: 30 minutos). En la práctica, una prioridad intermedia supone esperar en la Sala de Espera el mismo tiempo que niños con enfermedades tan frecuentes como la fiebre, gastroenteritis y bronquiolitis. En periodos epidémicos esto se traduce en retrasos de horas por el gran aumento de la demanda asistencial. Además, este retraso podría condicionar peor respuesta a la adrenalina (por su administración más tardía), y aumentar el riesgo de mortalidad. En nuestro centro Sólo un caso de cada 3 fue identificado correctamente como prioridad I-II3.
El siguiente paso fue proponer medidas de mejora de 2 tipos:
- Formación del personal de enfermería que realiza labores de Triaje: Se destacaron la importancia del tiempo de evolución y la duración de síntomas, la importancia de la anamnesis obtenida de los padres sobre la apariencia del paciente al llegar a Urgencias….
- Modificaciones en el propio Sistema de Triaje (no fue posible la implementación de modificaciones en el Soporte informático, por lo que se introdujo material de apoyo (chuleta) al personal encargado del triaje): Se destacó la importancia de la afectación multisistémica, la prescripción y/o el uso de dispositivos de adrenalina autoinyectable y la duración de síntomas.
Al reevaluar el funcionamiento de nuestra urgencia 12 meses después de estas medidas, encontramos que el número de niños correctamente triados había pasado del 36.2 % al 72.2 % y lo que es más importante, que el tiempo de espera medio se había reducido de 8 min a 1 min. También se observaron modificaciones en la ubicación de los pacientes, que, en lugar de ser enviados a la sala de espera, quedaron en observación4.
Nuestros resultados no son extrapolables a otros hospitales dado que en nuestro país se utilizan varios sistemas de triaje distintos, incluyendo, entre otros, el Sistema Canadiense de Triaje Pediátrico, Sistema Estructurado de Triaje-Modelo Andorrano de Triaje, Sistema Manchester de Triaje5. Cada uno de estos sistemas consta de procesos propios en su aplicación e idiosincrasia a la hora de gestionar la prioridad de los pacientes y de las patologías. Además, precisan de formación específica para su aplicación.
Como alergólogos:
- Debemos ser conscientes de que el triaje del servicio de urgencias es clave para que el paciente diagnosticado de anafilaxia reciba el tratamiento adecuado en el momento preciso.
- Deberíamos conocer el sistema de triaje que se utiliza en nuestros hospitales y saber si tiene (o no) problemas en la identificación de los pacientes con anafilaxia.
- Debemos colaborar con el personal de urgencias para, desde nuestro conocimiento de las peculiaridades de la anafilaxia, proponer medidas de mejora que faciliten la identificación precoz y por tanto, la atención correcta de los pacientes.
Dra. Esozia Arroabarren Alemán, Servicio de Alergia, Complejo Hospitalario de Navarra, Pamplona. Comité de Alergia Infantil SEAIC
Bibliografía
- Mínguez Navarro MC, Guerrero Márquez G, Ignacio Cerro MC, editores. Manual de Clasificación y Triage del paciente Pediátrico en Urgencias. Primera Edición. Majadahonda (Madrid): Ergon; 2015.
- Warren DW, Jarvis A, LeBlanc L, Gravel J; CTAS National Working Group; Canadian Association of Emergency Physicians; National Emergency Nurses Affiliation; Association des Médecins d’Urgence du Québec; Canadian Paediatric Society; Society of Rural Physicians of Canada. Revisions to the Canadian Triage and Acuity Scale paediatric guidelines (PaedCTAS). CJEM. 2008; 10(3):224-43.
- Arroabarren E, Alvarez-Garcia J, Anda M, de Prada M, Ponce MC, Palacios M. Quality of the Triage of Children With anaphylaxis at the Emergency Department. Pediatr Emerg Care. 2018 May 15. doi: 10.1097/PEC.0000000000001442
- Arroabarren E, Alvarez-García J, Anda M, de Prada M, Ponce C, Alvarez-Puebla MJ. Impact of specific training in anaphylaxis of the Triage nursing staff in a Tertiary Hospital’s Paediatric Emergency Department. J Investig Allergol Clin Immunol. 2018 May 2:0. doi: 10.18176/jiaci.0271.
- https://www.aetsa.org/download/publicaciones/antiguas/AETSA_2011-4_Triage_def.pdf (ultimo acceso: junio 2019)
LAS INMUNODEFICIENCIAS ASOCIADAS A AGENTES BIOLÓGICOS INMUNOMODULADORES COMO FENOCOPIAS DE LAS INMUNODEFICIENCIAS PRIMARIAS
http://www.thehistoryblog.com/archives/14881
En nuestro sistema sanitario, las consultas de Inmunología atienden principalmente pacientes con una respuesta inmunitaria deficiente. Las inmunodeficiencias primarias (IDP) asociadas a errores innatos de la inmunidad son una causa importante de estas consultas, pero no la única. En la práctica clínica, en la mayoría de los casos, habrá que buscar una causa secundaria de la misma.
Las inmunodeficiencias primarias se incluyen bajo el concepto más global de errores innatos de la inmunidad (EII), que representa un grupo de más de 485 enfermedades definidas genéticamente (1). La inmunodeficiencia secundaria (IDS) podría definirse como una alteración transitoria o persistente de la función de las células o tejidos del sistema inmunitario, causada por factores extrínsecos al mismo (2). Estos grupos de factores incluyen agentes ambientales, malnutrición, trastornos metabólicos, uso de medicamentos inmunosupresores e inmunomoduladores, infecciones crónicas, neoplasias malignas, traumatismos graves o simplemente el envejecimiento. El enfoque inicial recomendado para la valoración de una IDS sigue las mismas directrices que en el caso de las IDP. Los hallazgos de la historia clínica, en particular los patrones de infecciones, y los hallazgos en la exploración física son esenciales para guiar la evaluación del sistema inmunitario.
Dentro de las causas de IDS, la generalización del uso de agentes biológicos inmunomoduladores para tratar enfermedades autoinmunes, inflamatorias o neoplasias hematológicas en las últimas dos décadas, se ha acompañado de un mayor riesgo de infecciones e inmunodeficiencias secundarias (3); el abordaje de este importante tema en una entrada a un blog es complicado como revisión sistemática, así que optaré por una exposición narrativa.
Examinar qué enfermedades infecciosas acompañan a una determinada inmunodeficiencia primaria ha permitido obtener información valiosa sobre los componentes del sistema inmunológico que son claves en la respuesta frente a microrganismos particulares. Gracias a ello sabemos que los defectos en moléculas críticas en la ontogenia, activación y proliferación de los linfocitos T, como las mutaciones en el gen IL2RG del cromosoma X humano, que codifica la cadena gamma común (γc) del receptor de interleucina-2 (IL-2R), o una inactivación mutación en la quinasa Jak3, que se asocia físicamente con γc, causan una depleción profunda en la función del sistema inmune, que de forma sindrómica se denomina Inmunodeficiencia combinada severa. Los defectos en el desarrollo de las células B, como la mutación en el gen que codifica una proteína tirosina quinasa llamada BTK (tirosina quinasa de Bruton), que transduce la señal a través del receptor de células pre-B, provocan deficiencias en la producción de anticuerpos que causan una incapacidad para eliminar bacterias extracelulares y algunos virus cuya eliminación eficaz requiere anticuerpos específicos.
Es instructivo considerar los defectos inmunológicos en el contexto de los principales tipos de inmunidad afectada, ya que estos pueden conducir a distintos patrones de infección y enfermedad clínica.
Las terapias biológicas no causan La inmunosupresión global característica de la terapias inmunosupresoras clásicas como los glucocorticoides, azatioprina, metotrexato o ciclosporina (4). Del mismo modo a cómo actúan las mutaciones específicas en cada IDP, las terapias biológicos se dirigen selectivamente a células y vías del sistema inmunitario para lograr efectos terapéuticos específicos, pudiéndose comportar en ciertos casos como fenocopias de la IDP original.
Por ejemplo, el OKT3 (muromonab-CD3) es un anticuerpo monoclonal IgG2 murino que se une a la cadena CD3-epsilon del complejo receptor de células T-CD3 y produce una linfopenia rápida y profunda de las células T (4). Como cabría esperar, la inmunosupresión asociada provoca una mayor susceptibilidad a las infecciones, en particular por virus herpes y bacterias. Igualmente, Alemtuzumab (anti-CD52) es un anticuerpo monoclonal humanizado utilizado para la terapia de inducción del trasplante de órganos sólidos, depletor de células T.
Basiliximab es un monoclonal contra la cadena alfa del receptor de la interleucina (IL)-2 (CD25). La activación de las células T conduce normalmente a una regulación al alza del receptor de IL-2 de alta afinidad que implica la expresión de la cadena alfa del receptor de IL-2 (CD25) que se asocia con las cadenas beta y gamma del receptor de IL-2. Basiliximab inhibe la generación de células T citotóxicas antígeno-específicas.
Las células T necesitan dos señales para activarse. La primera implica la unión directa del receptor de antígeno de la célula T (TcR) con el complejo formado por el péptido antigénico y determinadas moléculas de superficie (moléculas HLA), presentado por las células presentadoras de antígeno (APC). La segunda señal implica vías coestimuladoras específicas. El CD28 de las células T se une a sus ligandos, el CD80 (B7-1) y el CD86 (B7-2), en las APC. La presencia de ambas señales proporciona una señal de activación a las células T. Por el contrario, la molécula CTLA-4 en las células T compite por la unión a las mismas moléculas CD80/CD86, y esta interacción provoca la supresión de la activación. Abatacept y Belatacept son proteínas de fusión del dominio extracelular de CTLA-4 humano unido a una porción Fc modificada de IgG1 humana (CTLA-4-Ig), que interfieren la activación de las células T interrumpiendo la coestimulación CD28. Abatacept no obstante tiene un perfil de seguridad bien establecido en diferentes ensayos y metanálisis. Belatacept por su parte, con mayor capacidad de unión a CD80/CD86, no debe administrarse a pacientes con serología de VEB negativa candidatos a trasplante de un donante con serología VEB positiva, por el mayor riesgo de desarrollar trastornos linfoproliferativos asociados a VEB (4).
Las Janus quinasas (JAK) son una familia de tirosina quinasas no receptoras, cruciales en el desencadenamiento de las señales generadas por el receptor de diversas citoquinas y transducidas aguas abajo a través de las proteínas STAT (transductoras de señales y activadoras de la transcripción). Las STAT fosforiladas se disocian de sus subunidades receptoras y se translocan al núcleo celular para regular la transcripción génica. La familia JAK se compone de cuatro miembros: JAK1, JAK2, JAK3 y tirosina quinasa 2 (Tyk2). Tofacitinib, inhibidor JAK aprobado para la artritis reumatoide que actúa principalmente sobre JAK1 y JAK3, se ha asociado con un mayor riesgo de infección por herpes zoster (4).
Con respecto a las células B, Ibrutinib es una pequeña molécula inhibidora de la tirosina quinasa de Bruton (BTK). El ibrutinib se une a la actividad de la BTK y la inhibe de forma irreversible, impidiendo así tanto la activación de las células B como la señalización mediada por éstas. La BTK es necesaria para la señalización del receptor de células B, desempeña un papel clave en la maduración de las células B. Se han descrito casos de neutropenia e hipogammaglobulinemia. Igualmente, Idelalisib interrumpe la señalización del receptor de células B, de forma similar a ibrutinib, aunque a través de la inhibición de la isoforma delta de la fosfatidilinositol 3-cinasa. Idelalisib se asocia a un aumento de las infecciones oportunistas (4). Belimumab por su parte, es un anticuerpo monoclonal humano que se une al BlyS humano soluble e inhibe su actividad biológica. Está aprobado para el tratamiento de pacientes con LES. La celulitis y la neumonía son las infecciones graves más frecuentes (4).
Pero sin duda, la familia de biológicos con más impacto en la casuística de las consultas de inmunodeficiencias son los anti CD20 y en particular, rituximab. Este anticuerpo monoclonal quimérico (Ig)G1 CD20 específico actúa sobre las células B desde la fase pre-célula B hasta la fase pre-célula plasmática. Rituximab agota las células B de la sangre periférica, y su normalización posterior suele requerir de seis a nueve meses o más, con una variabilidad significativa entre pacientes. Con las células B deplecionadas, la capacidad del paciente para responder a las vacunas, en particular de polisacáridos, se ve afectada. Además, es frecuente cierto grado de hipogammaglobulinemia transitoria, que en algunos pacientes es persistente y significativa clínicamente, dando lugar a infecciones que requieren profilaxis antibiótica y/o terapia sustitutiva (4).
Así, hasta un largo etcétera de terapias biológicas que actúan selectivamente sobre la vía de diferentes citoquinas (interleuquina 6, interleuquina 1, factor de necrosis tumoral alfa, interleuquinas 4 y 13, interleuquina 17), integrinas (alfa-4 integrinas, CD11 alfa), o proteínas del complemento, entre otros, bloqueando con una precisión quirúrgica el normal funcionamiento del sistema inmune.
Disponemos de evidencias y de herramientas para tratar de disminuir el riesgo de IDS asociado al uso de medicamentos biológicos. Este riesgo se debe prevenir con profilaxis antibiótica adecuada, y se debe prever mediante una planificación del programa de vacunación adaptada al tipo de defecto en la respuesta inmune descrito para el fármaco.
Igualmente, las recomendaciones en cuanto a vacunación de pacientes en grupos de riesgo, tanto centrales como de las comunidades autónomas, deberían estar actualizadas acorde a la evidencia disponible e integrar la opinión de expertos con conocimiento en el funcionamiento del sistema inmune y en el mecanismo de acción de estos fármacos.
REFERENCIAS
- Tangye SG, Al-Herz W, Bousfiha A, Cunningham-Rundles C, Franco JL, Holland SM, Klein C, Morio T, Oksenhendler E, Picard C, Puel A, Puck J, Seppänen MRJ, Somech R, Su HC, Sullivan KE, Torgerson TR, Meyts I. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022 Oct;42(7):1473-1507. doi: 10.1007/s10875-022-01289-3. Epub 2022 Jun 24. PMID: 35748970; PMCID: PMC9244088.
- Tuano KS, Seth N, Chinen J. Secondary immunodeficiencies: An overview. Ann Allergy Asthma Immunol. 2021 Dec;127(6):617-626. doi: 10.1016/j.anai.2021.08.413. Epub 2021 Sep 3. PMID: 34481993.
- Cannon L, Pan A, Kovalick L, Sarkissian A, Wu EY. Secondary immunodeficiencies and infectious considerations of biologic immunomodulatory therapies. Ann Allergy Asthma Immunol. 2023 Jun;130(6):718-726. doi: 10.1016/j.anai.2023.02.010. Epub 2023 Feb 18. PMID: 36801438; PMCID: PMC10247415.
- https://www.uptodate.com/contents/secondary-immunodeficiency-induced-by-biologic-therapies (acceso abril/2024).
Influencia del Clima sobre la Alergia
Cruz Auñon J, Diaz Rubio M, Farrerons Co F. Influencia del Clima sobre la Alergia. 1ª edición. Sevilla: Graficas Tirvia; 1951.
XIX Allergy Review
El día 9 de mayo de 2020 tendrá lugar en Madrid la XIX edición de la reunión Allergy Review, convocada por la Fundación de la Sociedad Española de Alergología e Inmunología Clínica, con el apoyo de Mundipharma.
Micrófono Abierto en Investigación 2025
¡En mayo se abre el plazo para participar del III Micrófono Abierto en Investigación!
Del 15 de mayo al 30 de junio de 2025 estará abierta la convocatoria para participar en la 3ª edición del Micrófono Abierto en Investigación de la Fundación SEAIC, en el marco del 35º Congreso Nacional de la SEAIC que se celebrará en Granada.
Una oportunidad única para presentar tu proyecto de investigación en un formato breve, dinámico… ¡Y con un premio de 10.000 € al mejor proyecto!
¿Quién puede participar?
- Socios numerarios o adheridos de la SEAIC.
- Con proyectos sin financiación previa y de duración máxima de 2 años.
- Con preferencia para alergólogos jóvenes y predoctorales ≤ 40 años.
Cuando se abra el plazo, deberás presentar:
- Una memoria breve de tu proyecto (máximo de 3 páginas).
- Tu CV resumido (formato libre o CVA-ISCIII).
¿Cómo presentar tu solicitud?
- El enlace al formulario se publicará en la web de la SEAIC y en los canales habituales de comunicación, en los días previos a la apertura de la convocatoria.
Actualización Tratado de Alergología
Ya está disponible en nuestra web la 2ª edición del Tratado de Alergología de la SEAIC. Los capítulos se pueden consultar y descargar en PDF con las credenciales de socio.
Curso on-line artículos científicos
Se encuentra disponible el curso on-line «Como escribir y publicar un artículo de calidad: el proceso editorial». Su objetivo es que el facultativo cuente con las habilidades necesarias para afrontar la preparación de la publicación de su experiencia clínica o investigadora. El curso está acreditado con 3,9 créditos y cuenta con el aval de SEAIC.