resultados de la búsqueda: asma/wp-content/uploads/logos/Sitio web no disponible/Hospital Universitario Fundación Jiménez Díaz/profesionales/aviso-importante/inicio/cme-jiaci
Estudios experimentales sobre Inmunoterapia con péptidos de huevo, resultan esperanzadores en la inducción de tolerancia a huevo.
Daniel Lozano Ojalvo ha recibido hace unas semanas el Premio a la Investigación del Instituto de Estudio del Huevo. Ha sido premiado por sus trabajos en el tratamiento de la alergia a huevo realizados en el Consejo Superior de Investigaciones Científicas, en Madrid. En dicho organismo, realizó su Tesis Doctoral sobre “El uso de péptidos de huevo, para el tratamiento de la alergia persistente a huevo”.
Los estudios iniciales realizados por el Dr. Lozano en modelos animales, se basaron en la utilización de péptidos de huevo, con menor capacidad alergénica que el huevo completo, pero que mantienen su capacidad inmunogénica, y por tanto, la posibilidad de inducir tolerancia con la administración continuada de dichos péptidos.
Según explica el Dr. Daniel Lozano, al Diario Hoy: «Nosotros atacamos la alergia al huevo utilizando péptidos. Lo que hacemos es coger el huevo, partirlo en pequeñas porciones que hacen que no den alergia a aquellas personas que lo son, pero van a estimular su sistema inmunológico hacia la tolerancia. Se ha probado en ratones con éxito, y ahora nos acaban de conceder un proyecto de investigación, del Ministerio de Economía, para pasar a aplicarlo a pacientes con alergia a huevo. El tratamiento y manejo clínico de estos pacientes, será llevada a cabo por el Servicio de Alergia del Hospital Universitario Infanta Sofía de Madrid».
http://www.hoy.es/caceres/bueno-tomar-cinco-20180108000423-ntvo.html
El huevo es introducido en la dieta en España actualmente, alrededor de los 9-12 meses de edad. Es un alimento con un alto contenido proteico, nutricionalmente muy completo, y cuya aplicación en la cocina puede ser muy variada, dando lugar a innumerables recetas.
Una vez superada la campaña de desprestigio sufrida por el huevo, en las décadas de los años 70 y 80, actualmente, son muchos los estudio, que avalan su calidad como alimento, así como el beneficio a nivel cardiovascular, que genera la ingesta regular de huevo.
Se recomienda una ingesta en niños de la toma de huevo, al menos 3 veces por semana.
La alergia a huevo es la principal causa de alergia a alimentos en nuestro medio en la población menor de 5 años de edad. La incidencia a huevo en el primer año de edad se ha estimado en torno al 1-2% de la población infantil. La mayoría de las reacciones alérgicas a huevo son reacciones inmediatas mediadas por IgE, de gravedad variable, aunque también han sido descritas reacciones de mecanismo no IgE. La clínica cutánea es la más frecuente, seguida de la clínica digestiva.
El pronóstico de la alergia a huevo, es, en la mayoría de los casos, favorable. El 50% de los pacientes alcanzan la tolerancia completa entre los 3 y los 5 años de edad, persistiendo el estado alérgico a huevo, en alrededor de un 20% de los pacientes cuando llegan a la pubertad.
Para los pacientes con alergia persistente a huevo en la práctica clínica actualmente, se puede inducir desensibilización o tolerancia al huevo, mediante la administración gradual de cantidades crecientes del huevo. La tasa de éxito es alta, en torno al 70% para la mayoría de los protocolos clínicos. Sin embargo, la inmunoterapia oral con alergeno intacto tiene inconvenientes, principalmente la larga duración del tratamiento, y sobretodo, por la tasa relativamente alta de reacciones adversas durante el mismo, que pueden llegar a afectar al 70% de los pacientes, y en ocasiones ser graves, disminuyendo de forma severa la calidad de vida del paciente y de sus familiares.
En modelos animales se ha demostrado, que los ratones sensibilizados oralmente a proteínas de huevo que se tratan posteriormente con péptidos de huevo y no con la proteína intacta de huevo, están protegidos frente a las reacciones alérgicas a huevo, mientras dura esta inmunoterapia, pero recuperan la reactividad una vez interrumpido el tratamiento.
Las investigaciones del Dr. Lozano et al, ponen de manifiesto que la administración de ovoalbúmina hidrolizada en ratones sensibilizados a huevo durante tres semanas, disminuía significativamente los síntomas de anafilaxia ras la provocación oral e intra-peritoneal del alergeno y que la protección se mantenía 3 semanas después de la interrupción del tratamiento, coincidiendo con una disminución de los anticuerpos IgE específicos.
El efecto del hidrolizado se asociaba a una reducción en el porcentaje de los linfocitos Th2 y en la expresiómn de su factor de transcripción, GATA3, así como al aumento de las células T reguladoras (Treg) y a la sobreexpresión del factor de transcripción Foxp3, en los nódulos linfáticos mesentéricos y en el bazo de los ratones tratados, lo que señala a la inducción de células Treg como el principal mecanismo responsable de la aparición de tolerancia.
Por tanto el uso de péptidos puede ser una nueva herramienta para el tratamiento de las alergias alimentarias persistentes y graves.
Marta Reche Frutos.
Servicio de Alergología. Hospital Universitario Infanta Sofia.
San Sebastián de los Reyes. Madrid.
Captador de la semana: Cáceres

En el captador de la semana hoy os traemos al Dr. Sergio Porcel Carreño, alergólogo que realiza su labor asistencial en el Hospital Universitario de Cáceres, desde donde nos proporciona los datos para la red aerobiológica de la SEAIC.

Recordamos que podéis consultar los recuentos de pólenes en vuestra ciudad en www.polenes.com
Uso de Himenópteros en Alergia | USHIAL 2026
Fechas: 16 y 17 de abril de 2026
Ciudad: Córdoba
Lugar: Hospital Universitario Reina Sofía
Modalidad: Presencial
Organizan:
• Hospital Universitario Reina Sofía
• Universidad de Córdoba
Nuevo documento de consenso sobre la introducción precoz de los alimentos en niños de “riesgo alérgico”.
En los últimos años se han publicado algunos estudios que han hecho replantear determinados aspectos la práctica clínica habitual respecto al a alergia a los alimentos que parecían bien establecidos.
Las recomendaciones previas sobre la introducción de los alimentos en pacientes de “riesgo alérgico” eran hasta hace algunos años retrasar la introducción de los alimentos sólidos e incluso en algunas guías restricción materna de alimentos potencialmente alergénicos durante la lactancia. A pesar de estas medidas la prevalencia de alergia a alimentos ha ido en aumento en las últimas décadas.
Los resultados del estudio LEAP (The Learning Early About Peanut Allergy), y otras observaciones previas, han dado lugar a la modificación de las recomendaciones respecto a la introducción del cacahuete en las guías de las sociedades de alergia Americanas (AAAAI y AAP), Europea(EAACI), y Australiana(ASCIA). Recomendándose la introducción de forma precoz del cacahuete, en pacientes de alto riesgo de presentar alergia (pacientes con eccema severo y/o alergia al huevo), en contra de las recomendaciones previamente establecidas.
Recientemente la APAPARI Asia Pacific Association of Pediatric Allergy , Respirologi & Immunology ha publicado un documento de consenso a este respecto en el que analiza los resultados de los estudios publicados hasta el momento, las características de la población asiática y los puntos comunes y diferencias con las poblaciones del oeste.
Early introduction of allergenic foods for the prevention of food allergy from an Asian perspective-An Asia Pacific Association of Pediatric Allergy, Respirology & Immunology (APAPARI) consensus statement.
Tham EH, Shek LP, Van Bever HP, Vichyanond P, Ebisawa M, Wong GW, Lee BW; Asia Pacific Association of Pediatric Allergy, Respirology & Immunology (APAPARI). Pediatr Allergy Immunol. 2018 Feb;29(1):18-27
Destaca un estudio realizado en población asiática publicado en 2017 en el Lancet “Two-step egg introduction for prevention of egg allergy in high-risk infants with eczema (PETIT): a randomised, double-blind, placebo-controlled trial”.
En este trabajo, analiza los resultados de 121 pacientes con eccema, 60 pacientes en el grupo de intervención y 61 pacientes en el grupo placebo, en los que se realizó la introducción precoz de huevo cocinado mediante un protocolo de 2 pasos. Se inició con dosis equivalente a 0.2 gramos de huevo cocido, que se administraba de los 6-9 meses diariamente, seguido de administración de una dosis equivalente a 1.1 gramo de huevo cocido diariamente de los 9-12 meses en el grupo de intervención y dosis similares de placebo en el grupo de no intervención. Se realizó tratamiento intensivo de la DA en todos los pacientes a lo largo del estudio.
A los 12 meses se realiza provocación abierta con dosis equivalentes a 32 gr de huevo cocido presentado resultado positivo el 8% (5/60) de los pacientes en el grupo de intervención frente al 29.4% (23/61) en el grupo placebo. NNT 3.40(2.30-6.52). El estudio concluye que la introducción en dos pasos del huevo combinado con el tratamiento intensivo del eccema reduce la prevalencia de alergia al huevo en los niños de alto riesgo.
En los estudios revisados realizados con leche, trigo, soja, mariscos, cereales y nuez los resultados de los estudios no son consistentes.
El documento de consenso concluye que con la evidencia actual parece que la introducción precoz de cacahuete y huevo en pacientes de alto riesgo disminuye el riesgo de padecer la enfermedad alérgica pero que actualmente no existe evidencia respecto a si la introducción precoz de otros alimentos podría disminuir la frecuencia de alergia a estos.
Por otra parte existe acuerdo con las recomendaciones previas de otras guías sobre la población de bajo riesgo en la que no existe indicación de introducción precoz de los alimentos.
Autora: Mónica Rodríguez Álvarez. Comité de Alergia Infantil SEAIC.
Médico Adjunto Servicio de Alergia Hospital Universitario Fundación Alcorcón.
Cartera de servicios
- Excelencia de la práctica profesional
En este aspecto la SEAIC pretende:
– Definir estándares de práctica y de formación en la especialidad de la alergología basándose en el marco de la calidad, la seguridad y la eficiencia en el uso de recursos sanitarios.
– Establecer un plan de desarrollo profesional continuado y estructurado para los alergólogos de la Sociedad. - Congresos y Simposios
En la SEAIC somos conscientes de la importancia de promover la investigación y compartir el conocimiento de las enfermedades alérgicas entres los expertos de la alergología, por lo que de forma periódica organizamos encuentros profesionales.
- Alergología de precisión
Los avances en la tecnología biomédica están permitiendo tener un conocimiento más detallado de los alérgenos y de los mecanismos patógenos subyacentes de las enfermedades alérgicas. Así, es posible configurar el tratamiento que mejor se ajuste al perfil patogénico del paciente (endotipo) con el fin de obtener los mejores resultados de forma individual, dejando atrás en el tiempo, la medicina basada en el tratamiento de síntomas. - Revista JIACI
La Journal of Investigational Allergology and Clinical Immunology es un gran hito para la SEAIC. Esta revista propia que incluye las últimas investigaciones y novedades en el campo de la alergología pretende mantener actualizados a los profesionales de la especialidad. - Red de Aerobiología
Esta red de captadores pretende proporcionar el recuento de pólenes y esporas de hongos con distribución por todo el territorio nacional. - Generación de conocimiento
La SEAIC, en su compromiso con la generación de conocimiento, lleva a cabo diferentes iniciativas. El impulso de proyectos de investigación, la creación de guías de manejo de enfermedades alérgicas y la edición de monografías y libros de texto en el campo de la Alergología, son algunas de ellas.
Última edición: 29/04/2011
—————————————–
Día Mundial de la Esofagitis Eosinofílica
Mañana, 22 de mayo, se celebra el primer Día Mundial de la Esofagitis Eosinofílica.
Además de diversas acciones para dar visibilidad social a esta enfermedad de prevalencia creciente, la Asociación de Pacientes con Esofagitis Eosinofílica (ADESEO) ha organizado un interesante seminario web con ponentes de talla internacional:
Día 22 de mayo:
14:00 – 15:30 horas | Webinar «Día Mundial de la EoE!». Centrado en el ámbito médico, habrá tres ponencias especializadas a cargo de reconocidos expertos internacionales que compartirán los últimos avances en el diagnóstico y tratamiento de la enfermedad:
- Dr. Alfredo Lucendo (EUREOS)
- Dra. Carolina Gutiérrez (Hospital Universitario Puerta de Hierro)
- Dr. Javier Chahuan (Pontificia Universidad Católica de Chile)
Te puedes inscribir aquí
Más información sobre el Día Mundial en la página web de ADESEO
Alergológica 2005
Se ha publicado en la revista Journal of Investigational Allery and Clinical Immunology el Estudio sobre los factores epidemiológicos, clínicos y socioeconómicos de las enfermedades alérgicas en España.
Acceso online: www.jiaci.org
Revisión con enfoque al paciente de Esofagitis Eosinofílica
La esofagitis eosinofílica (EoE) es una enfermedad de tipo alérgico caracterizada por una inflamación crónica del esófago (el tubo muscular que transporta la comida desde la boca hasta el estómago) por eosinófilos. En condiciones
normales no hay eosinófilos en el esófago. Esta acumulación es consecuencia de una reacción frente a determinados alimentos, alérgenos ambientales (polen, polvo, hongos…) o en ocasiones también al reflujo gastroesofágico y puede
dañar el tejido esofágico, lo que origina dificultad para tragar la comida (disfagia) o hacer que los alimentos queden atascados (impactación).
Los eosinófilos son las células que participan habitualmente en enfermedades alérgicas como la rinitis, la conjuntivitis, la dermatitis atópica o el asma bronquial. Sin embargo, a diferencia de éstas, el mecanismo alérgico no es inmediato, si no retardado.
La EoE se conoce desde hace menos de tres décadas y desde entonces, el número de casos nuevos ha crecido exponencialmente, especialmente en Norteamérica y Europa. En la actualidad, se estima que la prevalencia (número
de personas afec- tas) media de la EoE es de 22 personas por cada 100.000 habitantes, con cifras de 46 y 55 casos por 100.000 habitantes recientemente descritas en España y EE.UU. En la actualidad, ya representa la segunda
causa de inflamación del esófago (tras la enfermedad por reflujo gastroesofágico) y es la primera causa de disfagia e impactación alimentaria en niños y adultos jóvenes.
Esta patología se puede presentar a cualquier edad y sexo, si bien suele ser más común en jóvenes caucásicos de sexo masculino. Los síntomas varían dependiendo de la edad a la que se manifieste. La gran mayoría de los pacientes
suelen padecer otras enfermedades alérgicas, como rinitis, asma bronquial o alergia a alimentos.
CAUSAS
Los alimentos que producen esta alergia son muy variados y en muchos pacientes no conocidos con certeza. Los más frecuentes son la leche de vaca, el trigo, el huevo, las legumbres, además de alérgenos aéreos, como pólenes, ácaros del polvo,etc. No está claro por qué los alimentos que se han consumido durante siglos ahora puedan causar estos síntomas, si bien todo apunta a que el aumento en la contaminación ambiental, las modificaciones genéticas
aplicadas a las plantas, la maduración artificial de los alimentos vegetales y otros factores, posiblemente sean los causantes del aumento en la frecuencia de ésta y del resto de enfermedades alérgicas en los países desarrollados.
SÍNTOMAS
En niños menores de 2 años, las manifestaciones clínicas más comunes son el rechazo del alimento y vómitos. Entre los 2 y los 8 años predominan los vómitos, regurgitación, ardores y dolor abdominal o torácico, además puede existir
de pérdida de peso o retraso en el crecimiento. A partir de los 10 años, todos los pacientes refieren como síntomas dominantes y de forma intermitente la disfagia para sólidos (dificultad para el paso de la comida) y la impactación
alimentaria (atascamiento de comida), debido a la presencia de inflamación y en algunos casos, de disminución en el calibre del esófago.
PREVENCIÓN
Puesto que esta enfermedad aún permanece en estudio, no se conocen medidas concretas que puedan prevenirla. Todos los pacientes que tienen alguna patología alérgica diagnosticada deberían estar atentos ante los síntomas de alerta y
consultar con un alergólogo y/o gastroenterólogo si comienzan a tener alguno de ellos.
DIAGNÓSTICO
Hoy en día sólo existe una manera de diagnosticar la enfermedad y es realizando una endoscopia digestiva alta con toma de biopsias por el gastroenterólogo. En las biopsias se confirmará la existencia de eosinófilos.
Después, el alergólogo le realizará un estudio y junto con el gastroenterólogo, se diseñará el tratamiento más adecuado.
TRATAMIENTO
Los objetivos principales del tratamiento son la curación de los síntomas, de la inflamación esofágica, así como la eliminación o reducción de las estrecheces (si las hubiera) en el esófago.
La curación de la inflamación esofágica se puede conseguir mediante tres tipos de tratamientos: protectores de estómago (por ejemplo, omeprazol), corticoides tópicos (fórmulas viscosas o líquidas que actúan al adherirse a la pared del esófago) o la eliminación de determinados alimentos de la dieta. La dieta que se incluya como parte del tratamiento se establecerá a partir de las características individuales de cada uno de los pacientes.
Además del tratamiento para la inflamación, en algunos casos se debe añadir dilatación (ensanchamiento) mediante endoscopia en el caso de la existencia de estrecheces en el esófago.
La EoE es una enfermedad crónica progresiva, por lo que la presencia de inflamación mantenida en el esófago sin tratamiento da lugar a una elevada probabilidad de estrecheces con el paso del tiempo. Por lo tanto, es tan
importante el diagnóstico y tratamiento precoz, como el seguimiento y tratamiento a largo plazo, que se deben de consensuar con el paciente, dado que es una enfermedad que incide negativamente en la calidad de vida del
paciente.
PRONÓSTICO
La EoE es una enfermedad de buen pronóstico, si bien al ser una enfermedad nueva, no existe un seguimiento de pacientes superior a los 15 años. Hasta la fecha no se ha descrito que predisponga a enfermedades malignas, tales como cáncer de esófago ni que evolucione hacia otros tipos enfermedades alérgicas más graves.
SUBCOMITÉ ESOFAGITIS EOSINOFILICA
Rosario González Mendiola. Facultativo Especialista en Alergología. Hospital
Central de la Cruz Roja, Madrid
Joan Doménech Witek. Facultativo Especialista en Alergología. Hospital de
Elda, Alicante
Administración de inmunoterapia subcutánea: mucho mas que una inyección subcutánea: La Enfermera de Alergología te lo explica.
Cuantas veces nos han preguntado “¿Eres la enfermera/o de alergia? ¿La que pone las vacunas no?”.
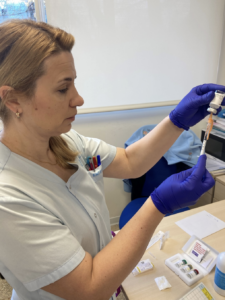 Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
Pues bien, es el momento de afirmar, que la administración de inmunoterapia (IT) subcutánea no solo consiste en el procedimiento de administración del alérgeno en dosis crecientes al paciente por vía subcutánea, sino que es un proceso donde se realiza previamente una valoración integral del paciente.
El paciente acude a nuestra consulta con la incertidumbre ante lo desconocido, a pesar de haber recibido información el día de la prescripción del tratamiento por el alergólogo/a, sobre el procedimiento y sus riesgos.
Es importante que nos presentemos, que conozca nuestro nombre, y le indiquemos que somos las enfermeras/os responsables de la administración del tratamiento. Es muy importante que el paciente se encuentre tranquilo.
Así mismo, procederemos a resolver aquellas dudas que pueda tener acerca de la inmunoterapia (IT) específica de alergia, además de informarle que este tratamiento consta de dos fases:
- Fase de Inicio: Donde se irá incrementando de forma periódica la dosis/concentración de la vacuna, comprobando la tolerancia a la misma. En esta fase deberemos preguntar siempre si han tolerado bien la dosis anterior y si han sufrido algún tipo de reacción en su domicilio (reacción tardía).
- Fase de Mantenimiento: Donde se habrá alcanzado la dosis terapéutica que se continuará administrando de forma periódica.
Respecto a la administración del tratamiento, como responsables de su administración, deberemos comprobar siempre: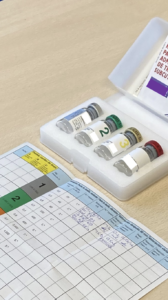
- Que la vacuna que nos entrega el paciente es la que ha prescrito su alergólogo.
- Que corresponde con el nombre del paciente, ya que están identificadas nominalmente.
- La fecha de caducidad.
- Que se ha conservado en nevera (entre 2 y 8 ºC teniendo especial cuidado que no se congele, pues se inactiva y pierde sus propiedades terapéuticas), y trasportada en bolsa térmica .
Procederemos a realizar la valoración de enfermería, recogiendo información sobre su estado de salud:
- Si se encuentra sin síntomas de infección activa (fiebre).
- Si no está presente un episodio agudo (crisis) de su enfermedad alérgica: asma mal controlada o rinoconjuntivitis alérgica.
- Si se encuentra en tratamiento con antibióticos. En cuyo caso se postpondrá la administración hasta su recuperación .
- Si ha recibido en los últimos 7-10 dias vacunas de virus atenuados (gripe, covid…). Como norma general es el intervalo de tiempo mínimo que se recomienda para la administración de la IT específica de alergia.
A continuación procederemos a la toma de constantes vitales (tensión arterial, frecuencia cardiaca, saturación de oxígeno y temperatura) y a la administración del tratamiento de IT específica de alergia siguiendo el protocolo establecido.
Los pacientes deben saber:
- Que tras la administración de su vacuna deben estar un tiempo mínimo de 30 minutos en nuestro servicio de alergia (o Centro de Salud), con el fin de comprobar que ha tolerado bien su IT, y que no han aparecido reacciones adversas inmediatas (por su seguridad).
- Que las reacciones adversas más frecuentes que pueden aparecer son: Enrojecimiento y picor (prurito) en la zona de administración.
- La presencia de síntomas como tos, falta de aire (disnea), aparición de eritemas (zonas enrojecidas en la piel), picor en palma de manos o síntomas exacerbados de su alergia deben ser comunicados inmediatamente para actuar de manera precoz.
- Que la IT especifica de alergia NO sustituye al tratamiento pautado por su alergólogo/a en referencia a antihistamínicos, colirios, inhaladores o nebulizadores nasales. Es un tratamiento conjunto.
- Que no deben practicar ejercicio físico intenso, coger peso, ir a saunas/piscinas cubiertas (ambientes húmedos y cargados) al menos en las 4 primeras horas de la administración de ITSC.
- Que deben informar de la aparición de reacciones tardías (en su domicilio): Aumento de eritema en zona de administración (recomendaremos que se realicen fotos), o cualquier otro síntoma que hayan podido experimentar.
- Que los beneficios de la IT específica de alergia se consiguen a medio/largo plazo y por ello, es necesario que los pacientes acudan a las revisiones programadas por sus alergólogos/as, para valorar la evolución con del tratamiento y si es oportuno continuar con el tratamiento o suspenderlo.
Día internacional de concienciación de la Enterocolitis Inducida por Proteínas de la Dieta (FPIES).
El pasado 4 de mayo se celebró el día de Star Wars (May the 4th) que coincidió con el día internacional de concienciación de la Enterocolitis Inducida por Proteínas de la Dieta (FPIES).
La FPIES es una alergia a alimentos no mediada por IgE, que típicamente comienza en la infancia, y que se caracteriza por vómitos repetidos, prolongados en el tiempo, que comienzan entre 1 y 4 horas tras la ingesta del alimento y que a menudo se acompañan de decaimiento, letargia o palidez y deposiciones diarreicas.
Los datos epidemiológicos referentes a esta enfermedad son escasos y variables, esto es debido a que, hasta finales de los años 70 no se había reconocido ni definido formalmente este síndrome y también a que no ha recibido una codificación adecuada hasta octubre de 2015 cuando se implementó el código K52.2 en la décima revisión de la Clasificación Internacional de las Enfermedades (CIE-10).
El diagnóstico de FPIES se basa fundamentalmente en la presencia de síntomas característicos que mejoran tras la retirada del alimento causal de la dieta. Estos criterios se han ido modificando según ha ido avanzando el conocimiento y reconocimiento de esta enfermedad. Actualmente están en vigor los propuestos por el Consenso Internacional para el Diagnóstico y Manejo de la Enterocolitis Inducida por Proteínas de la Dieta, elaborado por el grupo de trabajo de reacciones adversas a alimento de la Academia Americana de Alergia, Asma e Inmunología (AAAAI).
Actualmente se reconocen dos presentaciones clínicas:
- FPIES aguda.- Que se manifiesta por los síntomas típicos previamente mencionados.
- FPIES crónica.- Peor caracterizada que la FPIES aguda, descrita fundamentalmente en lactantes menores de 4 meses alimentados con fórmula adaptada de proteínas de leche de vaca o de soja. Las manifestaciones clínicas incluyen vómitos intermitentes, diarrea acuosa y fallo de medro. Los síntomas se producen a lo largo de varios días o semanas y no tienen una clara relación causal con el alimento.
Cualquier alimento es susceptible de producir FPIES, los alimentos más frecuentemente implicados son las proteínas de leche de vaca, y en nuestro medio el pescado. El alimento implicado varia en función de la localización geográfica y no resultan extrapolables las series anglosajonas o japonesas publicadas. En el área mediterránea no es tan frecuente la asociación de FPIES por leche de vaca y la FPIES por soja, por lo que la evitación de este último alimento es discutible y debe ser evaluarse de manera individual. En cuanto a los alimentos sólidos, el pescado es si duda el principal agente causal de FPIES en el área mediterránea. En estos casos se pueden evitar dietas restrictivas innecesarias testando pescados alternativos, minimizando los riesgos de déficits nutricionales en nuestros pacientes para mas información sobre este punto: Infante et al. Food protein-induced enterocolitis syndrome by fish: Not necessarily a restricted diet. Allergy. 2017;00:1-5.
Dado que las manifestaciones clínicas son exclusivamente gastrointestinales y la edad más frecuente de presentación es la infancia, el retraso diagnóstico o un diagnóstico erróneo suele ser habitual. La mayoría de los niños sufren mas de una reacción, en ocasiones grave y con necesidad de acudir a Urgencias, antes de que sean correctamente diagnosticados. Por ello es importante tener presente esta patología ante cuadros exclusivamente digestivos y con resolución en las siguientes 24 horas.
Para un mejor conocimiento de esta patología recomendamos la lectura de:
- International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma and Immunology. Nowak-Wegryzn et al. J Allergy Clin Immunol. 2017 Apr;139(4):1111-1126.e4. doi: 10.1016/j.jaci.2016.12.966
- Food Protein-Induced Enterocolitis Syndrome. Nowak-Wegryzn A et al. J Investig Allergol Clin Immunol 2017;27(1):1-18. Doi: 10.18176/jiaci.0135.
Ambos artículos, de acceso libre, resumen de manera práctica y didáctica el conocimiento actual de FPIES. “Aquello que no se conoce no se diagnostica”
Sonsoles Infante Herrero. Médico Adjunto. Unidad de Alergia Pediátrica. Hospital General Universitario Gregorio Marañón. Madrid.
Inmunoterapia sublingual para alergia a cacahuete a largo plazo: evidencia de desensibilización clínica e inmunológica
Se estima que la alergia a alimentos afecta a un 6-8% de los niños y hay evidencia de un incremento global en la prevalencia. Los alimentos que con mayor frecuencia causan reacciones anafilácticas en los niños mayores son los frutos secos. Hasta hace pocos años, el tratamiento se basaba en la evitación del alimento y el tratamiento de las reacciones alérgicas. La inmunoterapia con alimentos supone una alternativa de tratamiento en pacientes con alergia persistente, aunque no está aprobado como tratamiento en la práctica clínica habitual.
La inmunoterapia sublingual podría representar, a diferencia de la inmunoterapia oral o epicutánea, una alternativa viable por su vía de administración sencilla y el buen perfil de seguridad y eficacia observado en pequeños ensayos clínicos.
En esta publicación (Long-term sublingual immunotherapy for peanut allergy in children: Clinical and immunologic evidence of desensitization. J Allergy Clin Immunol 2019;144:1320-6.) se evalúa la eficacia y seguridad de la inmunoterapia sublingual con cacahuete a largo plazo en niños de 1 a 11 años que recibieron una dosis de mantenimiento de 2 mg/d de proteína de cacahuete durante 5 años. Los criterios de inclusión eran los siguientes: niños de 1 a 11 años, con anamnesis de reacción tras ingesta de cacahuete e IgE específica de 7 KU/L o mayor.
Treinta y siete de los cuarenta y ocho pacientes (77,1%) completaron el estudio y once (22,9%) abandonaron antes de finalizar.
Hubo reacción en 4,78% de las dosis. La mayoría de los síntomas se resolvieron espontáneamente y solo un 0,21% requirió tratamiento con antihistamínicos, no requiriendo el uso de adrenalina en ninguno de los casos. El prurito orolingual fue el síntoma más frecuente (3,6% de las dosis), y fue disminuyendo con las siguientes dosis. El edema labial se reportó en un 0,15% de las dosis y los síntomas gastrointestinales en 0,3% de las dosis.
El 67% de los sujetos toleraron al menos 750 mg de proteína de cacahuete, un 48% toleraron al menos 1750 mg y un 35% toleraron 2750 mg o más. Doce de los cuarenta y ocho sujetos (25%) tuvieron una prueba de provocación controlada negativa con 5000 mg de cacahuete. Tras un período de evitación de 2-4 semanas, diez de los doce sujetos tuvieron una prueba de provocación negativa, demostrando tolerancia permanente.
La media de la reactividad cutánea para los diez pacientes que demostraron tolerancia permanente fue de 11,5 mm al inicio del estudio, al finalizar el tratamiento dicha reactividad cutánea se redujo a 5,8 mm.
El nivel basal de IgE específica a cacahuete para los diez pacientes con una prueba de provocación oral negativa fue de media 28 KU/L y al finalizar el tratamiento la media de IgE específica fue de 7,8 KU/L.
Para los diez pacientes que alcanzan tolerancia permanente los niveles basales de IgG4 fueron de 0,4 mg/L y al finalizar el estudio se incrementan a 10,9 mg/L.
También se redujo de forma significativa el test de activación de basófilos al finalizar el estudio, comparativamente con el basal.
Entre los posibles sesgos del estudio destacar la falta de un grupo placebo control y la no realización de una prueba de exposición controlada al inicio del estudio.
En este estudio el tratamiento con inmunoterapia sublingual durante 5 años alcanzó desensibilización clínicamente significativa en la mayoría de los pacientes alérgicos a cacahuete compensado con una fácil administración y un favorable perfil de seguridad.
Dra. Sandra Blanco Bermejo
Hospital Universitario Infanta Elena
Comité de Alergia Infantil SEAIC
Son Espases incorpora tres nuevos profesionales para consolidar el primer servicio de alergología de Baleares
Son Espases incorpora tres nuevos profesionales para consolidar el primer servicio de alergología de Baleares.
La Junta directiva de la SEAIC se congratula con la contratación de tres Alergólogos en la sanidad pública balear en el hospital de Son Espases. De esta manera se crea el germen del primer servicio de alergología en la sanidad pública balear, demandado durante muchos años por las sucesivas juntas directivas de nuestra sociedad. La población alérgica de las islas Baleares se situará así en igualdad de condiciones en esta prestación sanitaria. con respecto al resto de las autonomías españolas.
Avispas gigantes en el Camp de Túria
Fuente: Rafel Montaner, Valencia para levante-emv.com
La presencia de avispas gigantes en una urbanización de l’Eliana ha desatado el pánico entre los vecinos de la zona. Con cinco centímetros de longitud, estos insectos son cuatro veces más grandes que las avispas comunes.
Varios vecinos de una urbanización de l’Eliana se han visto sobresaltados por la presencia en los jardines de sus viviendas de avispas gigantes que, con sus cinco centímetros de longitud, son cuatro veces más grandes que las avispas comunes. «Solo pensar que pudiera formarse un enjambre de estos avispones en el patio de casa… me aterroriza, sinceramente», relata una vecina que pudo capturar un ejemplar de estas avispas de gran tamaño.
La mujer, que nunca había visto nada igual, explica que encontró al avispón como aletargado, con las alas desplegadas, sobre las baldosas de una terraza. «Desde lejos me pareció un pajarillo pequeño, que quizás había atrapado mi gata de un nido. Pero cuando me di cuenta de que era una avispa enorme, menudo susto me llevé», añade. Su marido cogió el insecto con unas pinzas de barbacoa, lo metió en un tarro de cristal y lo trajo a Levante-EMV convencido de que se trataba de «un bicho raro».
Este diario ha puesto el espécimen capturado en l’Eliana a disposición de los investigadores de Fundación Entomológica Torres Sala, entidad que administra el Museu Valencià d’Història Natural, quienes han dictaminado que esta avispa es unahembra de la especie Megascolia maculata, el mayor himenóptero de Europa.
El entomólogo Sergio Montagud, experto de la Torres Sala que ha realizado la ficha de la Megascolia para el Banco de datos de Biodiversidad de la Comunitat Valenciana de la Conselleria de Medi Ambient explica que la Megascolia maculata «era muy frecuente en las zonas de agricultura tradicional de l’Horta y del Camp de Túria, pero su presencia ha ido descendiendo conforme se han abandonado los cultivos».
Montagud relata que, aunque casi son inofensivas -«sólo las hembras disponen de aguijón y es extraño que piquen sino se les molesta o se les intenta agarrar»-, cada vez que aparecen juntos varios ejemplares, «la gente se asusta ante el miedo de que vayan a formar un panal, temor que es del todo infundado porque se trata de avispas solitarias». Eso mismo fue lo que sucedió el año pasado en el antiguo Hospital Militar de Quart de Poblet, desde donde alertaron a la Fundación Torres Sala ante la presencia de muchas Megascolia.
El especialista en insectos señala que estas avispas son ectoparásitas, es decir, que viven en la superficie de otro organismo, como el piojo o el mosquito. Su objetivo preferido son las larvas de coleópteros como el escarabajo rinoceronte (Oryctes nasicornis) «que son buscadas activamente por las hembras para servir de sustrato a su descendencia».
La hembra de la Megascolia maculata, que se diferencia por tener la parte frontal de la cabeza de color naranja rojizo y ser de mayor tamaño, «paraliza mediante su aguijón a las larvas huéspedes, que inmediatamente cesan su desarrollo. Sobre ella depositan un huevo que dará lugar a una larva ya muy desarrollada que se alimentará, bajo el suelo, de la larva paralizada del coleóptero».
Los escarabajos rinoceronte alojan sus larvas en tocones de árboles talados, «principalmente naranjos, frutales y otros árboles de jardín a excepción de los pinos y demás resinosas». En el hospital lo que sucedió es que «habían cortadoárboles tiempo antes y tenían era una plaga de coleópteros».
Raras en las zonas urbanas
Comunicación
| Coordinación general, página web, boletín y medios: | Dr. Pedro Ojeda Fernández |
| Coordinación general, página web, RRSS y NNTT: | Ángela Meijide Calderón |
| Comunicación interna: | Dr. Darío Antolín Amérigo |
| NNTT-App | Dr. José Luis Cubero Saldaña Dra. Paloma Poza Guedes |
| NNTT-App-enlace Junta Directiva | Dr. Antonio Letrán Camacho |
| RRSS | Dra. Isabel Fernández de Alba Dra. Mónica Fernández Rodríguez Dra. Paula Galván Blasco |
| Página web | Dra. Alicia Gallardo Higueras Dr. Jesús Jurado Palomo |
| Boletín industria informa | Dra. Mercedes Ramírez Hernández |
Actualizado el día 10/03/2025
Labor social
La Fundación SEAIC desempeña una amplia labor social. Durante su trayectoria ha puesto en marcha actividades de carácter educativo, de divulgación, de ayuda y de promoción de conocimiento a la población. Y no solo eso, además ha sido medio de colaboración de recursos humanos y materiales en la investigación e intercambio de ideas y actividades científicas.
Por un lado, se ha llevado a cabo la distribución de ayudas económicas a campamentos de niños con asma y alergias alimentarias organizados por otras entidades. Además, se ha colaborado económicamente con proyectos educativos para pacientes o de concienciación social sobre enfermedades alérgicas. La Fundación de la SEAIC ha creado una red de Aerobiología para ofrecer datos de las tasas de pólenes atmosféricas, ha disposición de los pacientes.
DESAFÍO DIAGNÓSTICO DE LA ALERGIA A AINE EN NIÑOS
Según Alergológica 2015, un estudio epidemiológico de referencia sobre las enfermedades alérgicas en España la alergia a medicamentos fue el motivo de consulta en el 18,7% de los casos, y en particular en niños en el 9%. En los niños, las enfermedades exantemáticas son frecuentes y muchas veces no se puede discernir que la causa de las lesiones cutáneas sean los fármacos o la propia enfermedad. Siendo los antiinflamatorios no esteroideos (AINE) los segundos medicamentos que más frecuentemente causan reacciones alérgicas en niños. Un alto porcentaje de niños que han presentado alguna reacción donde hubiese implicado un AINE, los evitan sin ningún estudio.
Las reacciones asociadas a los AINE se dividen principalmente en dos tipos: agudas (reacción inmediata o reacción hasta varias horas después de la exposición) y retardadas (más de 24 horas después de la exposición). Las reacciones agudas a los AINE pueden ser selectivas (mecanismo inmunológico) o inducidas por múltiples AINE (reactividad cruzada, no inmunológicas), siendo estas últimas las más comunes en niños.
Hasta la fecha los estudios relacionados con reacciones alérgicas a los AINE en niños son limitados. Como variables predictoras encontramos una reacción sugestiva en los primeros 60 minutos y 2 o más reacciones con distintos AINE implicados. No queda claro si se podría involucrar a la genética como variable: algunos estudios apuntan el antecedente de padres alérgicos a AINE como un factor de riesgo.
En niños, entre los fármacos más frecuentemente implicados se encuentran el Ibuprofeno y derivados del ácido propiónico, junto al Paracetamol por ser los más utilizados. Las reacciones adversas a AINE en lactantes y preescolares son menos frecuentes, lo que se atribuye a su menor consumo.
Para no catalogar a los niños de alérgicos a fármacos que le serán imprescindibles en el futuro es importante realizar un estudio alergológico, en el que la prueba definitiva es la prueba de exposición controlada para determinar el tipo de alergia selectiva o reactividad múltiple, y en caso de confirmarse ésta última probar otros AINE alternativos. Las pruebas cutáneas solo son de utilidad en determinados casos de alergia selectiva.
Recientemente se ha publicado un trabajo interesante que insiste en la importancia de la valoración alergológica, sobre todo de cara a la evolución de la alergia ya que una proporción importante de niños con reacciones por reactividad múltiple tolera los AINE tras ser reevaluados a los 6 años (Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs). Dicha reevaluación es crucial considerando el gran número de niños que podrían estar evitando los AINE. Esto unido a que condiciones comórbidas como infecciones, fiebre o el uso concomitante de otros fármacos podrían causar los síntomas en estos pacientes nos hacen concluir que la historia detallada y las pruebas de provocación farmacológica son fundamentales para un diagnóstico definitivo de alergia a los AINE en niños.
Paula Méndez. Complexo Hospitalario Universitario de Santiago de Compostela. Comité de Alergia Infantil SEAIC
Biliografía:
- Erdem Topal 1, Mehmet Halil Celiksoy, Ferhat Catal, Yekbun Gamze Sayan, Recep Sancak The value of the clinical history for the diagnosis of immediate nonsteroidal anti-inflammatory drug hypersensitivity and safe alternative drugs in children.. Allergy Asthma Proc. Jan-Feb 2016;37(1):57-63. doi: 10.2500/aap.2016.37.3917.
- Yilmaz I. H. Ertoy Karagol A. Bakirtas E. Topal G. E. Celik M. S. Demirsoy I. Turktas Challenge‐proven nonsteroidal anti‐inflammatory drug hypersensitivity in children. Allergy. 2013 Dec;68(12):1555-61. doi: 10.1111/all.12266. Epub 2013 Oct 11.
- Hakan Guvenir 1, Emine Dibek Misirlioglu, Emine Vezir, Muge Toyran, Tayfur Ginis, Ersoy Civelek, Can N Kocabas Nonsteroidal anti-inflammatory drug hypersensitivity among children. Allergy Asthma Proc. Sep-Oct 2015;36(5):386-93. doi: 10.2500/aap.2015.36.3858.
- Sánchez-Borges M, Kidon M.Reactions to nonsteroidal anti-inflammatory drugs in children. J Allergy Clin Immunol Pract. 2018; 6(4):1236-7.
- Kidon M, Blanca-López N, Gomes E, Terreehorst I, et al.EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal antiinflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018; 29(5):469-80
- J Quiralte 1, R Avila-Castellano, S Cimbollek. A phenotype‐based classification of NSAIDs hypersensitivity: new patients, new challenges. Allergy 2014 Jun;69(6):814-5. doi: 10.1111/all.12377
- Inmaculada Doña, Natalia Pérez-Sánchez, Ibon Eguiluz-Gracia, Rosa Muñoz-Cano, Joan Bartra, María José Torres, José Antonio Cornejo-García. Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Allergy. 2020 Mar;75(3):561-575.
Histórico de congresos y simposios
En 1949, un año después de su fundación, la Sociedad celebró el primer congreso Nacional de Alergia en el Hospital Provincial de Madrid (actual Centro de Arte Reina Sofía). A partir de entonces se han celebrado congresos nacionales cada tres o cuatro años. A partir de 1978 la periodicidad pasa a ser bienal.
Actualmente de forma anual se celebran Congresos y Simposios (de forma consecutiva) para que todos los alergólogos puedan actualizarse en esta especialidad.
CONGRESOS
2021: 33º Congreso Nacional de la Sociedad Española de Alergología e Inmunología Clínica 2020 - Zaragoza.
2020: 32º Congreso Virtual de la Sociedad Española de Alergología e Inmunología Clínica 2020.
2018: XXXI Congreso Nacional de la SEAIC - Valencia
2016: XXX Congreso Nacional de la SEAIC - San Sebastián
2014: XXIX Congreso Nacional de la SEAIC - Salamanca
2012: XXVIII Congreso Nacional de la SEAIC - Pamplona
2010: XXVII Congreso Nacional de la SEAIC - Madrid
2008: XXVI Congreso Nacional de la SEAIC - Bilbao
2006: XXV Congreso Nacional de la SEAIC - Valencia
2004: XXIV Congreso Nacional de la SEAIC - Marbella
2002: XXIII Congreso Nacional de la SEAIC - Madrid
2000: XXII Congreso Nacional de la SEAIC - Pamplona
1998: XXI Congreso Nacional de la SEAIC - Barcelona
1996: XX Congreso Nacional de la SEAIC - Granada
1994: XIX Congreso Nacional de la SEAIC - Santa Cruz de Tenerife
1992: XVIII Congreso Nacional de la SEAIC - Sevilla
1990: XVII Congreso Nacional de la SEAIC - Valencia
1988: XVI Congreso Nacional de la SEAIC - Murcia
1986: XV Congreso Nacional de la SEAIC - Madrid
1984: XIV Congreso Nacional de la SEAIC - Santiago de Compostela
1982: XIII Congreso Nacional de la SEAIC - Sevilla
1980: XII Congreso Nacional de la SEAIC - Palma de Mallorca
1978: XI Congreso Nacional de la SEAIC - Las Palmas de Gran Canaria
1975: X Congreso Nacional de la SEAIC - Granada
1972: IX Congreso Nacional de la SEA - Zaragoza
1969: VIII Congreso Nacional de la SEA - Valencia
1966: VII Congreso Nacional de la SEA - Palma de Mallorca
1962: VI Congreso Nacional de la SEA - Oporto(Reunión conjunta con la Sociedad Portuguesa de Alergia)
1959: V Congreso Nacional de la SEA - Salamanca1956IV Congreso Nacional de la SEA - Barcelona
1954: III Congreso Nacional de la SEA - Santa Cruz de Tenerife
1951: II Congreso Nacional de la SEA - Sevilla
1949: I Congreso Nacional de la SEA - Madrid
SIMPOSIOS
2024: Simposio Internacional de "Enfermedades Alérgicas de Riesgo Vital", Bilbao.
2019: Simposio Internacional. "Avances y Perspectivas en Alergia Cutánea e Inmunología", Gran Canaria.
2017: Symposium Internacional de "Aerobiología, Contaminación y Cambio Climático", Murcia.
2015: Symposium Internacional de "Vía Respiratoria Única", Sevilla.
2013: Symposium Internacional de "Alergia a Himenópteros", Granada.
2011: Symposium Internacional de "Alergia Alimentaria" / «100 años de Inmunoterapia» Barcelona.
2009: Symposium Internacional de “Alergia a medicamentos”, Logroño.
2007: Symposium Internacional de “Alergia cutánea” Santander.
2005: Symposium Internacional de “Rinoconjuntivitis” Sevilla.
2003: Symposium Internacional “Aerobiología y Polinosis”, Zaragoza.
2001: Symposium Internacional de “Alergia a alimentos”, Bilbao.
1999: Symposium Internacional 50º Aniversario de la SEAIC, La Coruña.
1997: Symposium Internacional sobre “Reacciones adversas a fármacos con base inmunológica” Puerto de Santamaría (Cádiz)
1995: Symposium Internacional de “Asma bronquial” Barcelona.
1993: Symposium de “Inmunoterapia” Torremolinos (Málaga).
1991: Symposium de “Asma bronquial” Cáceres.
1989: Symposium de “Inmunoterapia” Madrid.
1989: Symposium de “Alergia a medicamentos” Palma de Mallorca.
1987 : Symposium de “Provocaciones bronquiales no inhalativas” Madrid.
1985: Symposium de “Alergia ocupacional”, Sevilla.
1983: Symposium de “Alergia a medicamentos”, Palma de Mallorca.
1977: Symposium de “Alergia a medicamentos”, Benidorm (Alicante).
1974: Symposium de “Mecanismos efectores de las reacciones alérgicas”, Madrid.
1974: Symposium de “Asma bronquial”, Palma de Mallorca.
1971: Symposium de “Alergia a medicamentos”, Benidorm (Alicante).
Nuevos horizontes en la alergia a alimentos: el rol de los biológicos
La prevalencia de alergia a alimentos ha ido en aumento en las últimas décadas tanto en España como a nivel global, hasta hace unos años no existía otra recomendación más que la de evitar el alimento al que el paciente es alérgico, lo cual en ocasiones lleva a una dieta muy restrictiva y un empeoramiento en la calidad de vida. Por lo tanto, existe la necesidad de ofrecer nuevos tratamientos más allá de las dietas de evitación.
Una alternativa de tratamiento en auge es la inmunoterapia oral (ITO), la cual consiste en administrar dosis crecientes del alimento al que el paciente es alérgico para aumentar su tolerancia. Esta es generalmente efectiva, pero tiene varias limitaciones como la larga duración del tratamiento durante el cual se pueden presentar reacciones graves y otros efectos adversos, ser específica para cada alimento, no estar estandarizada y no estar disponible en todos los centros ni para todos los alimentos.
Otra alternativa emergente en la alergia a alimentos es el uso de fármacos biológicos. Un fármaco biológico es un medicamento producido a partir de organismos vivos o componentes de estos, como células, tejidos, proteínas o anticuerpos. Estos medicamentos están diseñados para actuar sobre procesos biológicos específicos. Ejemplos comunes incluyen vacunas, hormonas y moduladores inmunitarios. En el campo de la alergología se dirigen contra moléculas concretas de la respuesta inmune de tipo alérgico, es por este motivo que los fármacos biológicos han revolucionado el manejo de enfermedades alérgicas e inflamatorias como el asma, urticaria y la dermatitis atópica, especialmente en casos severos que no responden a terapias convencionales y se muestran prometedores en el tratamiento de alergia alimentaria.
Una aplicación destacada es el uso del biológico Omalizumab, que bloquea la IgE, utilizado desde hace años en asma y urticaria y recientemente aprobado por la FDA para reducir las reacciones alérgicas a alimentos en pacientes con múltiples alergias alimentarias (febrero de 2024), basado en estudios como el OUTMATCH. Aunque no está aprobado específicamente para su uso en combinación con la ITO, múltiples ensayos clínicos han explorado esta combinación con resultados alentadores. Incluso consensos de expertos recomiendan el uso de Omalizumab como adyuvante de la ITO. Esta combinación permitiría aumentar las dosis del alimento en ITO de manera más rápida y segura.
Otro biológico en investigación en alergia alimentaria es el Dupilumab que bloquea ciertas moléculas que participan en la señalización de la respuesta alérgica (IL4 e IL13) y que cuenta ya con eficacia demostrada en múltiples patologías alérgicas como dermatitis atópica, asma grave, poliposis nasosinusal y este mes de noviembre ha sido aprobado por la EMA como el primer y único tratamiento biológico para la esofagitis eosinofílica en pacientes de >1 año de edad. En alergia alimentaria su uso sólo o en combinación con ITO aún está en etapas iniciales de investigación, pero los resultados preliminares son prometedores.
Actualmente están en investigación varios fármacos biológicos dirigidos frente a diferentes moléculas involucradas en la respuesta alérgica y su posible uso en alergia alimentaria, sin embargo, se encuentran todavía en etapas preliminares.
El desarrollo de terapias biológicas ofrece esperanza para muchos pacientes que hasta hace poco no tenían opciones viables pero hace falta más investigación para optimizar su aplicación y establecer guías clínicas claras.
María Carabel Lahera. Clínica Universidad de Navarra (Madrid).
Rosialzira Vera Berrios. Hospital Clínico San Carlos, IdISSC (Madrid).
Bibliografía:
Mutarelli A, Giavina-Bianchi B, Arasi S, Cafarotti A, Fiocchi A. Biologicals in IgE-mediated food allergy. Curr Opin Allergy Clin Immunol. 2023 Jun 1;23(3):205-209. doi: 10.1097/ACI.0000000000000900. Epub 2023 Mar 28. PMID: 37185824.
Sindher SB, Hillier C, Anderson B, Long A, Chinthrajah RS. Treatment of food allergy: Oral immunotherapy, biologics, and beyond. Ann Allergy Asthma Immunol. 2023 Jul;131(1):29-36. doi: 10.1016/j.anai.2023.04.023. Epub 2023 Apr 25. PMID: 37100276; PMCID: PMC10330596.
Sindher SB, Fiocchi A, Zuberbier T, Arasi S, Wood RA, Chinthrajah RS. The Role of Biologics in the Treatment of Food Allergy. J Allergy Clin Immunol Pract. 2024 Mar;12(3):562-568. doi: 10.1016/j.jaip.2023.11.032. Epub 2023 Nov 25. PMID: 38013157; PMCID: PMC11104487.
Wood RA, Chinthrajah RS, Rudman Spergel AK, Babineau DC, Sicherer SH, Kim EH, Shreffler WG, Jones SM, Leung DYM, Vickery BP, Bird JA, Spergel JM, Kulis M, Iqbal A, Kaufman D, Umetsu DT, Ligueros-Saylan M, Uddin A, Fogel RB, Lussier S, Mudd K, Poyser J, MacPhee M, Veri M, Davidson W, Hamrah S, Long A, Togias A; OUtMATCH study team. Protocol design and synopsis: Omalizumab as Monotherapy and as Adjunct Therapy to Multiallergen OIT in Children and Adults with Food Allergy (OUtMATCH). J Allergy Clin Immunol Glob. 2022 Jul 21;1(4):225-232. doi: 10.1016/j.jacig.2022.05.006. PMID: 37779534; PMCID: PMC10509974.
Zuberbier T, Muraro A, Nurmatov U, Arasi S, Stevanovic K, Anagnostou A, Bonaguro R, Chinthrajah S, Lack G, Fiocchi A, Le TM, Turner P, Lozano MA, Angier E, Barni S, Bégin P, Ballmer-Weber B, Cardona V, Bindslev-Jensen C, Cianferoni A, de Jong N, de Silva D, Deschildre A, Galvin AD, Ebisawa M, Fleischer DM, Gerdts J, Giovannini M, Gradman J, Halken S, Arshad SH, Khaleva E, Lau S, Loh R, Mäkelä MJ, Marchisotto MJ, Morandini L, Mortz CG, Nilsson C, Nowak-Wegrzyn A, Podestà M, Poulsen LK, Roberts G, Rodríguez Del Río P, Sampson HA, Sánchez A, Schnadt S, Smith PK, Szajewska H, Mitrevska NT, Toniolo A, Venter C, Warner A, Wong GWK, Wood R, Worm M. GA2LEN ANACARE consensus statement: Potential of omalizumab in food allergy management. Clin Transl Allergy. 2024 Nov;14(11):e70002. doi: 10.1002/clt2.70002. PMID: 39506193; PMCID: PMC11540805.
Invitación a participar: Alergodata
Estimado socio,
Nos gustaría invitarle a participar en el Proyecto ALERGODATA.
![]() Contenido disponible sólo para socios
Contenido disponible sólo para socios
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
ALFA TRIPTASEMIA HEREDITARIA (HaT), UNA ENTIDAD EMERGENTE EN ANAFILAXIA.
La alfa triptasemia hereditaria es un rasgo genético que ha supuesto un nuevo biomarcador a tener en cuenta, sobre todo entre los pacientes que tienen anafilaxia.
Sin embargo, su diagnóstico está limitado a algunos centros especializados y sus implicaciones clínicas continuan en exploración.
- TRIPTASA.
La actividad tripsina-like se describió por primera vez en mastocitos (MC) en 1960 empleando técnicas histoenzimáticas.(1) Posteriormente, en 1981, se demostró esta misma actividad en los MC humanos de tejido pulmonar,(2) se aisló la enzima con una pureza en torno al 90% y se denominó triptasa (EC 3.4.21.59). La triptasa es producida y almacenada principalmente por los MC, y en una mínima cantidad por los basófilos.(3)
Las protriptasas (α y β) son enzimáticamente inactivas y se liberan de forma constitutiva al plasma, constituyen lo que se determina como triptasa sérica basal (sBT). Tras un proceso de maduración, se producen las triptasas maduras (tetrámeros enzimáticamente activos que forman complejos con la heparina), que se acumulan en los gránulos de los MC. Los tetrámeros activos de β-triptasa y α/β triptasa, se liberan al medio extacelular tras la desgranulación secundaria a la activación mastocitaria, y su determinación resulta de gran utilidad en el diagnóstico de anafilaxia.(4)
Los tetrámeros de β-triptasa madura se comportan como serín proteasas, que actuando sobre el complemento, algunas citoquinas, el fibrinógeno, el cininógeno, prostromelisina y los receptores activados por proteasas (PAR), pueden inducir los siguientes efectos: la proliferación de fibroblastos y músculo liso, la degradación de la matriz extracelular, el reclutamiento de eosinófilos y neutrófilos, la estimulación de células nerviosas y epiteliales, la angiogénesis y la fibrinogenolisis.(5) Sin embargo, los tetrámeros de α-triptasa madura son inactivos.(5,6)
Los heterotetrámeros de α/β triptasa madura, también tienen actividad peptidolítica, siendo su diana los PAR2 presentes en células endoteliales e induciendo extravasación in vitro; y los EMR2 (like module–containing mucin-like hormone receptor-like 2) receptores (proteínas G mecanosensitivas) presentes en la superficie de los MC. La unión de los heterotetrámeros de triptasa madura a este receptor inducen la escisión de la subunidad α del EMR2, y desencadenan la desgranulación mastocitaria(5), mecanismo que se ha relacionado con la urticaria vibratoria.(7) El incremento del número de copias de α-triptasa aumenta la proporción de heterotetrámeros frente a los homotetrámeros llevando a una sobre activación de estos receptores.(8)
La técnica comercial actualmente disponible para la detección de triptasa (ThermoFisher Scientific) es un inmunoensayo que utiliza dos anticuerpos anti-triptasa (el B12 que se emplea para la captura y el G4 para el revelado) siendo el límite inferior de detección de la técnica de 0,5 ng/mL. Esta técnica cuantifica la triptasa total sin distinguir entre formas maduras o precursores, ni isoformas α y β en los fluidos biológicos. El punto de corte establecido para los valores séricos basales de triptasa (sBT) en sujetos sanos es de 11.4 ng/mL.(4)
- ALFA TRIPTASEMIA HEREDITARIA (HαT).
La triptasa en humanos se codifica por 4 genes parálogos TPSG1 (alelos γ), TPSB2 (alelos β2 y β3), TPSAB1 (alelos α y β1), y TPSD1 (alelos δ) localizados en el cromosoma 16p13.3. Presenta diferentes isoformas: α-triptasa, β-triptasa, δ-triptasa y γ-triptasa. El genotipo normal para α y β triptasa contiene 4 copias de los genes, incluyendo estas variaciones 0α:4β, 1α:3β y 2α:2β.(4,9)
También se han descrito variaciones en el número de copias que codifican la β-triptasa, sobre todo en algunos grupos raciales, pero estas variaciones no se asocian con elevaciones de la sBT en las familias. Mientras que, los valores elevados de sBT heredados con patrón dominante en una familia, se asocian con un alelo portador de un gen TPSAB1 que codifica α-triptasa, y se trata de HαT incluso aunque se detecten copias extra de β-triptasa. (4) (Figura 1).
La alfa triptasemia hereditaria (HaT) fue descrita en 2016.(10) Se caracteriza por presentar un número aumentado de copias del gen TPSAB1 que codifica la α-triptasa, tiene un patrón autosómico dominante, se ha descrito en el 4-7% de donantes sanos,(4,6) y asocia un leve predominio entre el género femenino.(11) Los pacientes con HαT suelen tener cifras basales de triptasa (sBT) >11.4 ng/mL; aunque existen casos con valores normales de triptasa (raramente <8 ng/mL). Se recomienda realizar el estudio de HaT en aquellos individuos con sBT >8 ng/mL;(12–14) este punto de corte ha demostrado una sensibilidad del 94% y una especificidad del 100% para detectar copias extra del gen TPSAB1.(12)
Se ha detectado una relación entre el número de copias extra del alelo α del gen TPSAB1 (hasta 4 copias extra) y los niveles de sBT, en familias con HαT+. Parece seguir un patrón por el cual las duplicaciones implican unos niveles de sBT de 15 ± 5 ng/mL, las triplicaciones de 24 ± 6 ng/mL, y las cuadruplicaciones de 37 ± 14 ng/mL.(4)
Además, los valores elevados de sBT se pueden encontrar en otras patologías como las mastocitosis sistémicas (MS), neoplasias mieloides e insuficiencia renal.(7) También se ha publicado en varios estudios, la relación entre los niveles elevados de sBT con la prevalencia y la gravedad de anafilaxia, sin embargo, estos datos deben interpretarse con cautela ya que en muchos de ellos no se ha valorado la presencia concomitante de MC clonales ni de HαT+.(4) En cambio, sí que resulta clara la relación entre HαT+ y las anafilaxias graves desencadenadas por veneno de himenóptero, otras alergias IgE mediadas, así como la asociación con MS.(4)
- GENOTIPADO DE HαT MEDIANTE PCR DIGITAL.
Las PCR (reacción en cadena de la polimerasa) digital, es una tecnología de última generación que se emplea para la cuantificación de ADN de forma reproducible y sensible, y se recomienda para analizar la variación del número de copias. Para llevar a cabo las mediciones, la muestra se divide en particiones, de forma que en cada una de ellas haya cero, una o varias moléculas diana presentes en cada reacción individual. Cada partición es analizada después de un ciclado de PCR en punto final para detectar la presencia (reacción positiva) o ausencia (reacción negativa) de una señal de fluorescencia. Finalmente, se calcula el número absoluto de moléculas presentes en la muestra, sin que los resultados dependan de una curva estándar, de este modo se reduce el error y se incrementa la precisión.(15) Existen en el mercado dos tipos de PCR digital: “Dropled digital PCR (ddPCR)” y “arraybased PCR”. La diferencia principal entre los dos modelos se debe a la estrategia diseñada para la división de la muestra: mediante la formación de gotas tipo emulsión, o mediante el uso de chips compuestos por micropocillos.(16)
Esta técnica detecta las secuencias α y β en los locus de TPSAB1 y TPSB2, a partir de DNA genómico (gDNA) se puede extraer tanto de sangre periférica como de MO.(6) Existe un KIT comercial para conseguir el DNA a partir de un “swab bucal”(17) y posteriormente proceder al estudio de las variaciones en el número de copias de TPSAB1; sin embargo, puede ocurrir que este método se encuentre limitado por problemas de daños y contaminación de las muestras.
- FENOTIPOS DE HαT.(18)
La expresión clínica de HαT puede ser muy variable, desde sujetos asintomáticos (descrito en el 4% de donantes sanos de población española(6), y 1/3 de los portadores) hasta cuadros de anafilaxia grave.(11)
En una reciente revisión, se ha descrito que los síntomas que con mayor frecuencia presentan los pacientes con HαT incluyen: 1) síntomas neuropsiquiátricos (depresión 59%, alteraciones del sueño 69% y alteraciones de memoria 59-68%); 2) síntomas gastrointestinales (colon irritable 30%-60%, nauseas 51%, y reflujo 49%-77%); 3) síntomas secundarios a la liberación de mediadores mastocitarios (flushing 47%, prurito 69%, urticaria 37%, y anafilaxia 14-28%); 4) hiperlaxitud articular 28%; 5) disfunción del sistema autónomo 34% (hipotensión ortostática, palpitaciones, taquicardia, presincope, síncope), y 6) síntomas constitucionales (dolor crónico, astenia 85%).(18,19)
Algunos de los síntomas descritos, aunque se encuentren con una elevada prevalencia, son difíciles de validar como secundarios a HαT+.(18)
Además, los síntomas de HαT+, en muchas ocasiones se pueden superponer con lo que se producen por activación mastocitaria. En este sentido, hay que tener en cuenta que los fenotipos hasta ahora asociados a HαT+ son muy heterogéneos, y que la mayoría de los casos descritos provienen de centros monográficos en patología mastocitaria y/o síndromes genéticos, por lo que es probable la existencia de sesgos en los datos obtenidos a partir de estas poblaciones.(4)
Sí que ha sido validado que los individuos con HαT+ tienen una mayor prevalencia de reacciones de hipersensibilidad inmediata sistémicas. (18)
4.1 HαT Y ANAFILAXIA
La elevación aguda de triptasa es un biomarcador de anafilaxia. El aumento de los valores de sBT triptasa en un 20 % + 2 ng/ml sobre el valor basal de cada individuo en el periodo comprendido entre 1-4 horas desde el inicio del cuadro agudo, es el criterio para confirmar activación mastocitaria y anafilaxia.(20) Esta fórmula tiene una elevada sensibilidad y es útil para identificar anafilaxia en los individuos con exposición parenteral al alérgeno.(21) Sin embargo, se encuentra limitada en algunas circunstancias como en la población pediátrica con alergia a alimentos, y pacientes con reacciones no IgE mediadas. Además, la variabilidad de los niveles de sBT en cada individuo a lo largo del tiempo no está bien estudiada.(22)
Por otra parte, diferentes estudios han identificado los niveles de sBT como un biomarcador asociado con el aumento en la prevalencia y la gravedad de la anafilaxia tras picaduras de insectos (sobre todo himenópteros),(4) y en alergia alimentaria infantil.(23)
HαT+ es el primer modificador genético hereditario descrito para la anafilaxia, que se asocia con un incremento en el riesgo para reacciones alérgicas graves al veneno de himenóptero con un riesgo relativo=2; así como un incremento del riesgo para la anafilaxia idiopática grave(12) y la anafilaxia grave desencadenada por alimentos en niños.(24)
Se ha estimado una prevalencia de HαT+ ≥8.5% en los pacientes con anafilaxia por veneno de himenóptero (HVA) en los que se ha descartado una patología mastocitaria clonal. Además, HαT+ no parece influir en la frecuencia de sensibilización al veneno de himenóptero, sólo influye en la gravedad de la reacción entre los individuos sensibilizados.(25)
También se ha descrito una mayor prevalencia de HαT+ en la anafilaxia idiopática (17%)(25) y en la anafilaxia desencadenada por alimentos en población infantil.(24)
4.2 HαT Y PATOLOGÍA MASTOCITARIA.
HαT+ está asociado a la presencia de patología mastocitaria clonal, encontrándose entre el 12-21% de los pacientes con síndrome de activación mastocitaria clonal (cSAM) y/o MS, sobre todo con formas no avanzadas de la enfermedad -MS indolentes (MSI) y MS quiescentes-.(11)
Un estudio realizado en población adulta española, ha descrito la prevalencia de HαT+ en el 29% de SAM no clonales (ncSAM) y el 18% de las mastocitosis. Entre los casos con mastocitosis, la detección de HαT+ es significativamente más frecuente (21% vs. 10%) entre los casos con la mutación D816V de KIT restringida a mastocitos vs. los casos con la mutación D816V de KIT multilineal. Además, entre los pacientes con mastocitosis, su cuadro clínico debutó con anafilaxia en el 76% vs. 65% (p = 0.18) de los HαT+ vs. HαT–.(6)
El mecanismo subyacente entre ambas entidades no es conocido, pero se ha planteado la hipótesis de que pudiera ser secundario al efecto de mitógeno del exceso de triptasa sobre el microambiente de la médula ósea (MO), promoviendo la selección de los clones aberrantes de MC.(11)
Los pacientes HαT+ con MS tienen una frecuencia de HVA del 30%, y una prevalencia de anafilaxia grave con síntomas cardiovasculares del 35.5%.(11) Así mismo, en población española se ha descrito que los pacientes con mastocitosis tienen una frecuencia de anafilaxia por alimentos del 15% en HαT+ vs. 5% en HαT– (p=0.013).(6)
Si se valora la patología mastocitaria global (clonal y no clonal), se ha descrito que la frecuencia de anafilaxia aumenta progresivamente desde los casos que no tienen alelos para α-triptasa (58%), los que tienen 1 alelo (65%), quienes tienen 2 alelos (72%) y aquellos que tienen ≥3 copias de este alelo (84%). En este estudio, también se describe, que si se analizan sólo los casos HαT+, la frecuencia de anafilaxia es mayor en los que tienen ≥3 copias vs. 2 copias de α-triptasa (82% vs. 61%; p=.017).(6)
- MANEJO DE HAT
Actualmente, para controlar los síntomas que habitualmente presentan los pacientes HAT+, se recomienda emplear el tratamiento antimediador que se suele emplear en la patología mastocitaria.(4) Se ha empleado con éxito el Omalizumab en casos plurisintomáticos complejos, consiguiendo la resolución de la urticaria y de la anafilaxia en el 94% de los pacientes.(13)
MTPS9579A, es un anticuerpo monoclonal humanizado IgG4 anti-triptasa, que inhibe selectivamente la actividad de la triptasa al disociar los tetrámeros activos en monómeros. Este anticuerpo anti-triptasa reduce la gravedad de la anafilaxia IgE mediada en un modelo murino humanizado.(26) Además, se ha desarrollado un modelo farmacocinético/farmacodinámico (PK/PD) para elegir la dosis de anticuerpo anti-triptasa MTPS9579A en pacientes con asma moderado-grave que permite predecir el nivel de exposición y de supresión de la triptasa en los tejidos diana.(27)
Otros estudios, describen anticuerpos monoclonales dirigidos a los receptores inhibidores de los mastocitos, como Siglec-8 (sialic acid-binding immunoglobulin-like lectin 8) [Lirentelimab/AK002], Siglec-6 [AK006], y CD200R [LY3454738].(28)
La eficacia y seguridad de Lirentelimab ha sido evaluado en ensayos clínicos con diferentes patologías en las que participan los mastocitos (incluyendo MSI, urticaria crónica espontanea, dermografismo sintomático, y conjuntivitis alérgica); en todos ellos los pacientes refieren mejoría se los síntomas.(28)
LY3454738 no demostró superioridad frente a placebo en un estudio fase II de urticaria crónica, por lo que esta línea de investigación se ha cerrado. Sin embargo, está pendiente de publicarse sus resultados en un estudio fase I en dermatitis atópica.(28)
AK006 inhibe la anafilaxia IgE mediada en modelos murinos.(28)
Todos estos anticuerpos, podrían abrir líneas de tratamiento de la anafilaxia y de los síntomas de HαT+ en el futuro.
FIGURAS.
Figura. Genotipos de triptasa codificados por TPSAB1 y TPSB2. (18)
BIBLIOGRAFÍA
- Glenner GG, Cohen LA. Histochemical demonstration of a species-specific trypsin-like enzyme in mast cells. Nature. 19 de marzo de 1960;185:846-7.
- Schwartz LB, Lewis RA, Seldin D, Austen KF. Acid hydrolases and tryptase from secretory granules of dispersed human lung mast cells. J Immunol Baltim Md 1950. abril de 1981;126(4):1290-4.
- Castells MC, Irani AM, Schwartz LB. Evaluation of human peripheral blood leukocytes for mast cell tryptase. J Immunol Baltim Md 1950. 1 de abril de 1987;138(7):2184-9.
- Wu R, Lyons JJ. Hereditary Alpha-Tryptasemia: a Commonly Inherited Modifier of Anaphylaxis. Curr Allergy Asthma Rep. 10 de mayo de 2021;21(5):33.
- Lyons JJ. Inherited and acquired determinants of serum tryptase levels in humans. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. octubre de 2021;127(4):420-6.
- González-de-Olano D, Navarro-Navarro P, Muñoz-González JI, Sánchez-Muñoz L, Henriques A, de-Andrés-Martín A, et al. Clinical impact of the TPSAB1 genotype in mast cell diseases: A REMA study in a cohort of 959 individuals. Allergy. 11 de octubre de 2023;
- Khoury P, Lyons JJ. Mast cell activation in the context of elevated basal serum tryptase: genetics and presentations. Curr Allergy Asthma Rep. 27 de noviembre de 2019;19(12):55.
- Zhang H, Zeng X, He S. Evaluation on potential contributions of protease activated receptors related mediators in allergic inflammation. Mediators Inflamm. 2014;2014:829068.
- Caughey GH. Tryptase genetics and anaphylaxis. J Allergy Clin Immunol. junio de 2006;117(6):1411-4.
- Lyons JJ, Yu X, Hughes JD, Le QT, Jamil A, Bai Y, et al. Elevated basal serum tryptase identifies a multisystem disorder associated with increased TPSAB1 copy number. Nat Genet. diciembre de 2016;48(12):1564-9.
- Kačar M, Rijavec M, Šelb J, Korošec P. Clonal mast cell disorders and hereditary α-tryptasemia as risk factors for anaphylaxis. Clin Exp Allergy. 2023;53(4):392-404.
- Robey RC, Wilcock A, Bonin H, Beaman G, Myers B, Grattan C, et al. Hereditary Alpha-Tryptasemia: UK Prevalence and Variability in Disease Expression. J Allergy Clin Immunol Pract. 2020;8(10):3549-56.
- Giannetti MP, Weller E, Bormans C, Novak P, Hamilton MJ, Castells M. Hereditary alpha-tryptasemia in 101 patients with mast cell activation-related symptomatology including anaphylaxis. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. junio de 2021;126(6):655-60.
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 27 de noviembre de 2020;21(23):9030.
- dPCR para principiantes [Internet]. Disponible en: https://www.qiagen.com/es-es/applications/digital-pcr/beginners
- Pérez-Barrios, C. PCR digital en la monitorización de la respuesta al tratamiento del paciente oncológico. En: Aplicaciones clínicas de lsa técnicas actuales de Biología Molecular. Cont. Lab. Clin.; 2018. p. 52-8.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, et al. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol. 2019;144(4):883-96.
- Lyons JJ. Hereditary Alpha Tryptasemia: Genotyping and Associated Clinical Features. Immunol Allergy Clin North Am. 2018;38(3):483-95.
- von Bubnoff D, Koch D, Stocker H, Ludwig RJ, Wortmann F, von Bubnoff N. The Clinical Features of Hereditary Alpha-Tryptasemia—Implications for Interdisciplinary Practice. Dtsch Arzteblatt Int. 22 de marzo de 2024;(Forthcoming):arztebl.m2023.0287.
- Valent P, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, Butterfield JH, et al. Why the 20% + 2 Tryptase Formula Is a Diagnostic Gold Standard for Severe Systemic Mast Cell Activation and Mast Cell Activation Syndrome. Int Arch Allergy Immunol. 2019;180(1):44-51.
- Baretto RL, Beck S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: A perioperative perspective. Allergy. diciembre de 2017;72(12):2031-4.
- Mateja A, Wang Q, Chovanec J, Kim J, Wilson KJ, Schwartz LB, et al. Defining baseline variability of serum tryptase levels improves accuracy in identifying anaphylaxis. J Allergy Clin Immunol. marzo de 2022;149(3):1010-1017.e10.
- Sahiner UM, Yavuz ST, Buyuktiryaki B, Cavkaytar O, Yilmaz EA, Tuncer A, et al. Serum basal tryptase may be a good marker for predicting the risk of anaphylaxis in children with food allergy. Allergy. febrero de 2014;69(2):265-8.
- Lang A, Kubala S, Grieco MC, Mateja A, Pongracic J, Liu Y, et al. Severe food allergy reactions are associated with α-tryptase. J Allergy Clin Immunol. octubre de 2023;152(4):933-9.
- Lyons JJ, Chovanec J, O’Connell MP, Liu Y, Šelb J, Zanotti R, et al. Heritable risk for severe anaphylaxis associated with increased α-tryptase-encoding germline copy number at TPSAB1. J Allergy Clin Immunol. febrero de 2021;147(2):622-32.
- Maun HR, Jackman JK, Choy DF, Loyet KM, Staton TL, Jia G, et al. An Allosteric Anti-tryptase Antibody for the Treatment of Mast Cell-Mediated Severe Asthma. Cell. 3 de octubre de 2019;179(2):417-431.e19.
- Rymut SM, Henderson LM, Poon V, Staton TL, Cai F, Sukumaran S, et al. A mechanistic PK/PD model to enable dose selection of the potent anti-tryptase antibody (MTPS9579A) in patients with moderate-to-severe asthma. Clin Transl Sci. abril de 2023;16(4):694-703.
- Metz M, Kolkhir P, Altrichter S, Siebenhaar F, Levi-Schaffer F, Youngblood BA, et al. Mast cell silencing: A novel therapeutic approach for urticaria and other mast cell-mediated diseases. Allergy. enero de 2024;79(1):37-51.

