Noticias alergia a medicamentos
Anafilaxia en niños y adolescentes
La anafilaxia, como extremo más grave del espectro de las reacciones alérgicas, de afectación sistémica, aguda y potencialmente mortal, representa una patología de especial interés en pediatría.
En Europa, la anafilaxia es un problema común que afecta aproximadamente a 1 de cada 300 habitantes en algún momento de su vida. Según datos de la red europea de reacciones alérgicas graves, el 27% de los casos de anafilaxia se produce en menores de 18 años. Además, se ha descrito un incremento de su incidencia, especialmente en niños y preescolares.
Causas/desencadenantes
La causa más común de anafilaxia en niños son los alimentos (75%), seguida a distancia por los medicamentos (11%). Estudios epidemiológicos de la SEAIC* señalan a la alergia alimentaria como tercer motivo de consulta a los servicios de Alergología en edad pediátrica, con una tendencia al alza. La anafilaxia representa el 7,5% de los casos diagnosticados, siendo la leche de vaca, el huevo, los frutos secos y las frutas, los alimentos implicados más frecuentemente.
Los desencadenantes alimentarios varían según la edad y el área geográfica. En los dos primeros años de vida, la leche de vaca y el huevo son los desencadenantes más habituales; posteriormente, los frutos secos en edad preescolar, siendo el cacahuete el más común en todas las edades. En ciertos países europeos, particularmente en el área mediterránea, el melocotón tiene especial relevancia.
La anafilaxia inducida por ejercicio y dependiente de alimentos también debe ser considerada en los niños. Es un tipo especial de alergia mediada por IgE en la que el ejercicio o el consumo de un alimento causante no inducen síntomas por sí solos, pero el ejercicio tras la ingestión del alimento desencadena anafilaxia.
Por último, los padres con frecuencia expresan su preocupación sobre el riesgo de anafilaxia por vacunas; sin embargo, son una causa excepcional en niños.
Factores de riesgo y casos fatales
Las muertes por anafilaxia son raras. En aquellas relacionadas con alimentos, el 73% son debidas a frutos secos o cacahuete, siendo la leche de vaca responsable del 21% de las muertes en <16 años. El riesgo de muerte por anafilaxia aumenta dos veces entre adolescentes en comparación con los niños de 0-2 años. En general, los factores de riesgo identificados para la anafilaxia fatal por alimentos en niños incluyen asma coexistente, edad >10 años, alergia al cacahuete o frutos secos y la falta o la administración tardía de adrenalina.
Un tercio de los casos de anafilaxia ocurren en casa, el 25% en restaurantes y un 15% en la escuela.
Diagnóstico de anafilaxia
La anafilaxia es un diagnóstico predominantemente clínico, con afectación de varios sistemas y de inicio rápido tras la exposición al desencadenante. En los niños muy pequeños, el diagnóstico puede presentar algunos desafíos por la dificultad para describir ciertos síntomas como el prurito o la opresión faríngea; y ciertos signos, como la irritabilidad y los cambios de comportamiento, pueden ser difíciles de interpretar. La anafilaxia en los lactantes suele afectar a la piel (98%), al sistema respiratorio (59%), al aparato digestivo (56%) y, con menos frecuencia, al sistema cardiovascular. Cuando se produce hipotensión, en niños <10 años se define como una tensión arterial sistólica inferior a <70mmHg + (2 x edad en años) o un descenso >30% respecto a un registro basal.
Los síntomas respiratorios aparecen con frecuencia en los niños, especialmente en aquellos que padecen asma. Por otro lado, la anafilaxia puede suceder sin afectación de la piel, de tal forma que los signos cutáneos están ausentes en 10-20% de las anafilaxias. Este hecho afecta de manera crítica a su diagnóstico y tratamiento precoces.
Manejo
Para el autocuidado temprano de los pacientes con anafilaxia es fundamental educar a los padres, cuidadores y a los niños sobre el riesgo de anafilaxia, el control de las enfermedades concomitantes y sus desencadenantes y el autotratamiento de cualquier recurrencia. Durante la infancia, el cuidado/responsabilidad en la aplicación de medidas de evitación, reconocimiento de reacciones y tratamiento de las mismas recae inicialmente en padres y cuidadores. A medida que el niño crece se le enseña a evitar los desencadenantes, reconocer los síntomas y tratar futuras reacciones. Se ha estimado por encuestas que los niños de 9-11 años podrían reconocer síntomas y utilizar correctamente un AIA*.
A los pacientes se les deben recetar uno o más AIA*. Se recomienda que lleven siempre consigo un plan de acción de emergencia escrito y personalizado que ilustre cómo reconocer los síntomas e instruya sobre cómo inyectar rápidamente la adrenalina. Esta debe ser administrada por vía intramuscular en la parte anterolateral media del muslo manteniendo el AIA durante aproximadamente 3-10 segundos. La administración de adrenalina es el tratamiento de primera línea y no existen contraindicaciones absolutas para su administración. La dosis debe repetirse cada 5-15 minutos si los síntomas persisten y tras su administración se debe solicitar asistencia médica. Estas medidas preparan a los padres y a los niños para afrontar una reacción y evitar que se agrave.
Durante una anafilaxia es crucial evaluar periódicamente las vías respiratorias, la respiración, la circulación, el estado mental y la piel, posicionar al paciente según sus características y simultáneamente llamar a los servicios de emergencia. La mayoría de los niños deben colocarse tumbados boca arriba, a menos que haya dificultad respiratoria, en cuyo caso una posición sentada optimiza el esfuerzo respiratorio; si está inconsciente, el niño puede colocarse en posición de recuperación. Al mismo tiempo, y si es posible, se debe eliminar la exposición al desencadenante (p. ej., suspender la administración de medicamentos/agentes terapéuticos).
El tratamiento de la anafilaxia continúa con el traslado a un entorno de atención sanitaria, idealmente en ambulancia. En niños con anafilaxia y síntomas de broncoespasmo, se pueden administrar agonistas beta-2 de acción corta inhalados (p. ej., salbutamol); sin embargo, en presencia de síntomas persistentes no son alternativa a la administración repetida de adrenalina intramuscular. En caso de obstrucción de las vías respiratorias superiores debe considerarse nebulizar adrenalina. Los medicamentos de segunda línea incluyen agonistas beta2-adrenérgicos, glucocorticoides y antihistamínicos. Es necesario observar a los niños durante varias horas, siendo especialmente importante en reacciones graves y en aquellas que requieren varias dosis de adrenalina.
Conclusiones
La anafilaxia es una patología de especial relevancia en edad pediátrica, siendo los alimentos su causa más común. En los niños, los síntomas respiratorios y la ausencia de afectación cutánea son características que deben ser consideradas en su presentación. El asma, la adolescencia, la alergia al cacahuete o los frutos secos y la falta o la administración tardía de adrenalina son factores asociados a mayor gravedad. La educación periódica de niños y familias, sobre cómo identificar los episodios, responder adecuadamente y emplear el AIA son vitales y deben ser revisados regularmente.
Dr. Carmelo Escudero Díez. Servicio de Alergología Hospital Infantil Universitario Niño Jesús (Madrid). Comité de Alergia Infantil.
*SEAIC: Sociedad Española de Alergología e Inmunología Clínica.
*AIA: Auto-inyector de adrenalina.
Referencias recomendadas
- Turner PJ, Campbell DE, Motosue MS, Campbell RL. Global Trends in Anaphylaxis Epidemiology and Clinical Implications. J Allergy Clin Immunol Pract. 2020;8:1169-76.
- Wang Y, Allen KJ, Suaini NHA, McWilliam V, Peters RL, Koplin JJ. The global incidence and prevalence of anaphylaxis in children in the general population: A systematic review. Allergy. 2019;74:1063-80.
- Ojeda P, Ibáñez MD, Olaguibel JM, Sastre J, Chivato T. Alergológica 2015: A National Survey on Allergic Diseases in the Spanish Pediatric Population. J Investig Allergol Clin Immunol 2018;28(5):321-329. doi: 10.18176/jiaci.0308.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
- MS Shaker, DV Wallace, DBK Golden, J Oppenheimer, JA Bernstein, RL Campbell, et al. Anaphylaxis—a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020;145:1082–1123.
- Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020 Jun;8(6):1854-1864. doi: 10.1016/j.jaip.2020.02.010.
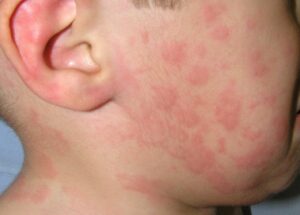
Mi niño tiene urticaria. ¿La urticaria es igual a alergia?
La urticaria es una enfermedad de la piel muy común. Consiste en la aparición de ronchas/habones y/o hinchazón/angioedema, que habitualmente se acompañan de picor. Si dura menos de 6 semanas se clasifica como urticaria aguda y si dura más de 6 semanas como urticaria crónica. Las ronchas aparecen y desaparecen con rapidez, cambian de localización y duran menos de 24 horas y puedes reaparecer en los días siguientes. La hinchazón puede afectar a la cara, las manos, los pies, los genitales y suele ser pruriginoso.
La mayoría de las urticarias en la edad infantil son agudas y no tienen relación con la alergia. La infección parece ser la causa predisponente más frecuente (más del 40%) de urticaria en lactantes y niños en comparación con los adultos. Suelen ser infecciones víricas leves y el niño mantiene buen estado general a pesar de que la urticaria afecte a gran parte de la superficie corporal. Los síntomas de la infección viral pueden estar presentes o no.
¿La urticaria es igual a alergia? En pocas ocasiones la urticaria que dura varios días o semanas es producida por una alergia alimentaria; medicamentosa o por una picadura de insecto. En estos casos, es habitual que la urticaria aparezca antes de que pasen dos horas tras la ingesta del alimento/medicamento o haya antecedente de picadura de insecto en los minutos previos (muy inusual en niños). En ocasiones, pueden asociarse síntomas respiratorios, digestivos, mareos, el niño podría estar mucho más nervioso y afectado. En estos casos, podría tratarse de una reacción alérgica generalizada (anafilaxia) y se debe instaurar tratamiento con adrenalina y solicitar asistencia sanitaria de inmediato.
La urticaria crónica es mucho menos frecuente en niños y en la práctica, la mayoría de los pacientes no tienen una causa identificable. Se clasifica como urticaria crónica espontánea. En un pequeño porcentaje la urticaria crónica en niños se asocia a presencia de anticuerpos autoinmunes. Los medicamentos antiinflamatorios no esteroideos (ibuprofeno, metamizol, paracetamol, etc.) se han identificado como principales factores agravantes de la urticaria crónica espontánea en niños.
En conclusión, la urticaria aguda (<6 semanas de duración) es más frecuente en niños que la urticaria crónica (>6 semanas de duración) y suele ser un proceso benigno, transitorio, y que no se asocia a patología grave subyacente en la la gran mayoría de los casos.
Autora:
Krasimira Baynova, MD. Comité de Alergia Infantil SEAIC. CSUR Angioedema. UGC Alergología. Hospital Universitario Virgen del Rocío. Sevilla.
Bibliografía
1) Meeyong Shin et al. Prevalence and Causes of Childhood Urticaria Allergy Asthma Immunol Res. 2017 May; 9(3): 189–190.
2) Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et all. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018 Jul;73(7):1393-1414. doi: 10.1111/all.13397. PMID: 29336054.
3) Brüske I, Standl M, Weidinger S, et al. Epidemiology of urticaria in infants and young children in Germany–results from German LISAplus and GINIplus Birth Cohort Studies. Pediatr Allergy Immunol 2014;25:36 –42.
4) Cornillier, H., Giraudeau, B., Munck, S., Hacard, F., Jonville-Bera, A.-P., d’ Acremont, G., … Maruani, A. (2018). Chronic spontaneous urticaria in children – a systematic review on interventions and comorbidities. Pediatric Allergy and Immunology, 29(3), 303–310.
Enlace de interés práctico:
https://enfamilia.aeped.es/temas-salud/decalogo-urticaria-infantil
Estudio de alergia a betalactámicos en niños
La sospecha de alergia a betalactámicos es un motivo frecuente de consulta en niños, descartándose en la mayoría de los casos tras el estudio alergológico. Seguir el mismo algoritmo diagnóstico que en el adulto consume tiempo y pruebas que son molestas para el niño. En los últimos años diferentes grupos han investigado el valor de las pruebas cutáneas y serológicas, recomendándose en algunos casos la prueba de exposición oral directa.
El grupo de trabajo de la EAACI ha publicado una revisión valorando el diagnóstico de alergia a betalactámicos en niños. Diferencia las formas clínicas en función del mecanismo inmunológico y la cronología de la reacción:
- Reacciones cutáneas benignas de aparición inmediata mediadas por IgE.
Las más frecuentes son leves con urticaria y/o angioedema, causadas en muchos casos por la infección subyacente. Diferenciarlas es difícil a pesar de la historia clínica, siendo necesario el estudio alergológico mediante pruebas cutáneas, seguidas de una prueba de exposición. Algunos autores proponen realizar la exposición oral sin pruebas cutáneas previas en las reacciones leves. A pesar de los estudios publicados, la evidencia para realizar prueba de exposición directa en niños con reacción inmediata es limitada.
- Reacciones sistémicas de aparición inmediata mediadas por IgE.
Los fármacos son una posible causa de anafilaxia en niños, pero el riesgo de reacción mortal es extremadamente bajo. El diagnóstico precisa un estudio alergológico completo, que incluya pruebas in vitro (IgE específica, prueba de activación de basófilos) y pruebas cutáneas. Cuando estas pruebas son positivas, el riesgo de reacción con la prueba de exposición es alto. En los casos graves esta prueba solo se realizará si no hay alternativa terapéutica segura, comenzando por dosis muy bajas, estando contraindicada si durante la reacción índice se produjo un shock anafiláctico.
- Reacciones no inmediatas leves, urticaria no inmediata/exantema maculopapular.
Las pruebas cutáneas en estos casos tienen muy baja sensibilidad y no están bien estandarizadas, pero el valor predictivo positivo es alto. Por otro lado, para las pruebas in vitro (prueba de transformación de linfocitos) se dispone de una evidencia limitada. Dada su baja sensibilidad, algunos autores realizan una prueba exposición oral directa, confirmando la seguridad del procedimiento. No hay acuerdo en el protocolo a seguir, administrándose generalmente la dosis fraccionada seguida de uno o varios días de administración domiciliaria. Haciendo referencia a un estudio que sugiere que los niños con reacción no inmediata leve podrían superar su alergia, podría indicarse la realización de una prueba de exposición tras al menos un año de la prueba de exposición positiva.
- Enfermedad del suero-like.
Se observa generalmente en niños menores de 5 años, especialmente con cefaclor. El diagnóstico es fundamentalmente clínico. En estos pacientes se debe evaluar la tolerancia a otros betalactámicos que, generalmente, son bien tolerados.
- Reacciones graves no inmediatas.
Incluyen el síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, reacción a fármaco con eosinofilia y síntomas sistémicos, y la pustulosis exantemática aguda generalizada. El diagnóstico es fundamentalmente clínico, junto a pruebas histológicas y analíticas. Se pueden realizar pruebas epicutáneas tras 6 meses de la reacción a pesar de tener una sensibilidad baja. Si estas son negativas, se pueden realizar pruebas intradérmicas, estando contraindicadas si durante la reacción índice hubo riesgo vital. En general, la prueba de exposición se realiza para excluir el diagnóstico de alergia en los casos de baja sospecha.
El grupo de trabajo concluye que hay una amplia variabilidad clínica en las reacciones a betalactámicos en niños, siendo la más común la reacción cutánea leve no inmediata con exantema maculopapular o urticaria tardía. En estos casos se recomienda el diagnóstico mediante la prueba de exposición, existiendo suficiente evidencia para realizarla sin pruebas cutáneas previas. Para poder definir una reacción como leve o de bajo riesgo hay que tener en cuenta la fiabilidad de los datos obtenidos de la historia clínica, la edad del niño, el tiempo transcurrido hasta realizar el estudio y las comorbilidades que pueda presentar el paciente. No hay un protocolo óptimo para la realización de la prueba de exposición ni consenso en su duración, por lo que es imperativo establecer un protocolo unificado.
Con respecto a las reacciones inmediatas leves, es necesario realizar más estudios para poder confirmar la seguridad de realizar la exposición sin pruebas cutáneas previas.
Finalmente, en relación con la posibilidad de que los niños con reacción no inmediata leve puedan superar su alergia, el consenso se recomienda la realización de estudios multicéntricos que incluyan un gran número de niños para investigar la historia natural de la alergia a betalactámicos.
Dos trabajos realizados en nuestro país repiten el estudio con prueba de exposición en niños tras el diagnóstico de alergia a betalactámico con reacción no inmediata leve. En ellos, el 50% y el 80% de los pacientes toleran el betalactámico en la segunda prueba de exposición controlada, realizada al menos 6-12 meses tras una primera prueba de exposición positiva. Todos los pacientes incluidos son menores de 8 años, predominando preescolares en los que en muchos casos un cuadro viral subyacente podría ser la causa de la reacción. Ante estos resultados y dado que los betalactámicos son de primera elección en la mayoría de los procesos infecciosos de origen bacteriano en el niño, se podría proponer repetir la prueba de exposición controlada tras un año de evitación, al menos en los niños de menor edad, siempre que la reacción inicial al betalactámico sea no inmediata y leve.
Candelaria Muñoz Román. Alergología Pediátrica, UGC Pediatría, H. Materno Infantil, Hospital Regional Universitario de Málaga. Comité de Alergia Infantil SEAIC.
Bibliografía
- Blanca-López N, Atanaskovic-Markovid M, Gomes ER, Kidon M, Kuyucu S, Mori F, et al. An EAACI Task Force report on allergy to beta-lactams in children: Clinical entitisand diagnostico procedures. Pediatr Allergy Immunol. 2021; 32: 1426-1436.
- Tonson la Tour A, Michelet M, Eigenmann P, Caubet JC. Natural history of benign nonimmeediate allergy to beta-lactams in children: a prospective study in retreated patiens after a positive and a negative provocation test. J Allergy Clin Immunol Pract. 2018; 6: 1321-1326.
- Berroa F, Callero A, Fuentes-Aparicio V, Infante S, Alonso-Lebrero E, Zapatero L. Rechallenge in Pediatric Patients Diagnosed with delayed hypersensitivity to penicillins. J Investig Allergol Clin Immunol. 2013; 23: 369-370.
- Sánchez de Toro MA, Muñoz Román C, Corzo Higueras JL. Negativización de estudio alérgológico en pacientes en edad pediátrica diagnosticados de reacción alérgica no inmediata frente a amoxicilina. Allergol et Immunopathol Proceedings. 2017; 166. ISSN 2014-9859. 41º Congreso SEICAP.
- Ibáñez MD, Rodríguez del Río P, Lasa EM, Joral A, Ruiz-Hornillos J, Muñoz, C, et al. Prospective assessment of diagnostic tests for pediatric penicillin allergy: From clinical history to challenge tests. Ann Allergy Asthma Immunol. 2018;121(2):235-244.
Caminando hacia la Medicina Personalizada
Cuando un médico necesita prescribir un fármaco debe asumir de entrada dos grandes problemas: muchos fármacos sólo son efectivos en una parte de los pacientes, y algunos de ellos producen efectos indeseados, a veces peligrosos, en algunos pacientes. En la actualidad sabemos que gran parte de las diferencias interindividuales tanto en efecto como en toxicidad son genéticas. La farmacogenética y la farmacogenómica (FG) estudian las interacciones entre los fármacos y los genes. En la era post genoma humano y sabiendo que los genotipos personales difieren en millones de bases (polimorfismos genéticos), la aplicación de la genética para explicar las diferencias interindividuales en la respuesta clínica a un fármaco parece ofrecer una gran promesa. Los genes más estudiados son los implicados en el metabolismo (farmacocinética) y en la acción de los fármacos (farmacodinámica).
En el metabolismo de una gran cantidad de fármacos intervienen enzimas del citocromo p450 (CYP) y la existencia de numerosos polimorfismos en los CYP condiciona la diferente respuesta en cada persona frente estos fármacos. En función de cómo sea este metabolismo, se han descrito diferentes fenotipos: lento, intermedio, rápido y ultrarrápido. En general se puede resumir que el efecto de un fármaco es mayor en los metabolizadores lentos y mucho menor en los metabolizadores rápidos. Con dosis estándares, el fármaco puede no tener efecto en los metabolizadores ultrarápidos, y los metabolizadores lentos pueden tener efectos de sobredosis.
Las reacciones adversas a medicamentos siguen siendo una de las principales causas de morbi-mortalidad, por lo que en la actualidad gran parte de los esfuerzos de la investigación biomédica se centran en optimizar la eficacia de los fármacos y minimizar sus efectos adversos.
En los últimos años se ha producido un aumento significativo en las recomendaciones de dosificación guiadas por FG, no sólo para nuevos medicamentos, sino también para otros más antiguos; sin embargo, la mayor parte de esta información se concentra en los fármacos que son utilizados para tratar a los adultos. La elección de la dosis adecuada de un fármaco puede ser un desafío en el caso de poblaciones pediátricas, donde el conocimiento de los efectos de la maduración (ontogenia) sobre la eficacia de los medicamentos y la práctica basada en la evidencia en este área son limitados.
La dieta, la edad, el estilo de vida, el estado de salud y el medio ambiente influyen en la respuesta de una persona a los medicamentos. Pero si conociésemos además datos acerca de su constitución genética, aumentaríamos la probabilidad de obtener resultados positivos y reduciríamos el riesgo de que se produjesen reacciones adversas graves. Los avances en FG permitirán seleccionar el medicamento y la dosis apropiada para cada paciente, con el objetivo de adaptar el tratamiento según la genética del individuo, lo que se conoce como Medicina Personalizada.
Para saber más: Pediatric pharmacogenomics: challenges and opportunities: on behalf of the Sanford Children’s Genomic Medicine Consortium. Gregornik D, Salyakina D, Brown M, Roiko S, Ramos K. Pharmacogenomics J. 2021 Feb;21(1):8-19.
María Rueda García. Alergóloga, MD, PhD. Servicio de Alergología, Hospital Quironsalud, Barcelona. Miembro del Comité de Alergia Infantil de la SEAIC, grupo de interés en Alergia a Medicamentos.
DESAFÍO DIAGNÓSTICO DE LA ALERGIA A AINE EN NIÑOS
Según Alergológica 2015, un estudio epidemiológico de referencia sobre las enfermedades alérgicas en España la alergia a medicamentos fue el motivo de consulta en el 18,7% de los casos, y en particular en niños en el 9%. En los niños, las enfermedades exantemáticas son frecuentes y muchas veces no se puede discernir que la causa de las lesiones cutáneas sean los fármacos o la propia enfermedad. Siendo los antiinflamatorios no esteroideos (AINE) los segundos medicamentos que más frecuentemente causan reacciones alérgicas en niños. Un alto porcentaje de niños que han presentado alguna reacción donde hubiese implicado un AINE, los evitan sin ningún estudio.
Las reacciones asociadas a los AINE se dividen principalmente en dos tipos: agudas (reacción inmediata o reacción hasta varias horas después de la exposición) y retardadas (más de 24 horas después de la exposición). Las reacciones agudas a los AINE pueden ser selectivas (mecanismo inmunológico) o inducidas por múltiples AINE (reactividad cruzada, no inmunológicas), siendo estas últimas las más comunes en niños.
Hasta la fecha los estudios relacionados con reacciones alérgicas a los AINE en niños son limitados. Como variables predictoras encontramos una reacción sugestiva en los primeros 60 minutos y 2 o más reacciones con distintos AINE implicados. No queda claro si se podría involucrar a la genética como variable: algunos estudios apuntan el antecedente de padres alérgicos a AINE como un factor de riesgo.
En niños, entre los fármacos más frecuentemente implicados se encuentran el Ibuprofeno y derivados del ácido propiónico, junto al Paracetamol por ser los más utilizados. Las reacciones adversas a AINE en lactantes y preescolares son menos frecuentes, lo que se atribuye a su menor consumo.
Para no catalogar a los niños de alérgicos a fármacos que le serán imprescindibles en el futuro es importante realizar un estudio alergológico, en el que la prueba definitiva es la prueba de exposición controlada para determinar el tipo de alergia selectiva o reactividad múltiple, y en caso de confirmarse ésta última probar otros AINE alternativos. Las pruebas cutáneas solo son de utilidad en determinados casos de alergia selectiva.
Recientemente se ha publicado un trabajo interesante que insiste en la importancia de la valoración alergológica, sobre todo de cara a la evolución de la alergia ya que una proporción importante de niños con reacciones por reactividad múltiple tolera los AINE tras ser reevaluados a los 6 años (Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs). Dicha reevaluación es crucial considerando el gran número de niños que podrían estar evitando los AINE. Esto unido a que condiciones comórbidas como infecciones, fiebre o el uso concomitante de otros fármacos podrían causar los síntomas en estos pacientes nos hacen concluir que la historia detallada y las pruebas de provocación farmacológica son fundamentales para un diagnóstico definitivo de alergia a los AINE en niños.
Paula Méndez. Complexo Hospitalario Universitario de Santiago de Compostela. Comité de Alergia Infantil SEAIC
Biliografía:
- Erdem Topal 1, Mehmet Halil Celiksoy, Ferhat Catal, Yekbun Gamze Sayan, Recep Sancak The value of the clinical history for the diagnosis of immediate nonsteroidal anti-inflammatory drug hypersensitivity and safe alternative drugs in children.. Allergy Asthma Proc. Jan-Feb 2016;37(1):57-63. doi: 10.2500/aap.2016.37.3917.
- Yilmaz I. H. Ertoy Karagol A. Bakirtas E. Topal G. E. Celik M. S. Demirsoy I. Turktas Challenge‐proven nonsteroidal anti‐inflammatory drug hypersensitivity in children. Allergy. 2013 Dec;68(12):1555-61. doi: 10.1111/all.12266. Epub 2013 Oct 11.
- Hakan Guvenir 1, Emine Dibek Misirlioglu, Emine Vezir, Muge Toyran, Tayfur Ginis, Ersoy Civelek, Can N Kocabas Nonsteroidal anti-inflammatory drug hypersensitivity among children. Allergy Asthma Proc. Sep-Oct 2015;36(5):386-93. doi: 10.2500/aap.2015.36.3858.
- Sánchez-Borges M, Kidon M.Reactions to nonsteroidal anti-inflammatory drugs in children. J Allergy Clin Immunol Pract. 2018; 6(4):1236-7.
- Kidon M, Blanca-López N, Gomes E, Terreehorst I, et al.EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal antiinflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018; 29(5):469-80
- J Quiralte 1, R Avila-Castellano, S Cimbollek. A phenotype‐based classification of NSAIDs hypersensitivity: new patients, new challenges. Allergy 2014 Jun;69(6):814-5. doi: 10.1111/all.12377
- Inmaculada Doña, Natalia Pérez-Sánchez, Ibon Eguiluz-Gracia, Rosa Muñoz-Cano, Joan Bartra, María José Torres, José Antonio Cornejo-García. Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Allergy. 2020 Mar;75(3):561-575.
Alergia a antibióticos en niños, más que una simple etiqueta
Las reacciones adversas a medicamentos son frecuentes en los niños, con una incidencia mayor en los ingresados (9.53%) con respecto a los que siguen un tratamiento en domicilio (1.46%). De ellas, sólo una minoría se catalogan como graves (12.29%), con un porcentaje bajo de ingresos por esta causa (2.09%). En la actualidad, se considera que son un problema de salud pública.
Basándonos únicamente en las manifestaciones clínicas, a menudo es difícil distinguir entre una reacción causada por un virus o por un medicamento, pero es importante ser conscientes que la principal causa de urticaria en los niños son las infecciones virales.
Dentro del gran espectro de reacciones adversas a medicamentos en los niños, últimamente el foco de atención se está centrando en la evaluación de la alergia a antibióticos, en particular de los beta-lactámicos. La amoxicilina es el fármaco más prescrito en los niños, y por ello, el implicado en la mayoría de las reacciones, aunque sólo una pequeña parte son reacciones alérgicas. Con frecuencia la alergia a antibióticos en los niños está sobrediagnosticada.
Los factores predisponentes son la inmunosupresión, la fibrosis quística, las exposiciones previas al mismo fármaco, la duración extensa del tratamiento y la vía de administración, siendo más sensibilizantes la vía parenteral y la cutánea. Recientemente se ha descrito una fuerte asociación de los genotipos HLA-B, HLA-C y HLA-DRB1 con reacciones inmediatas y tardías con beta-lactámicos en niños. La edad, el género, y la presencia de patología alérgica no parecen ser factores de riesgo.
Para el estudio alergológico, las guías recomiendan la realización de pruebas cutáneas intraepidérmicas e intradérmicas, seguidas de la prueba de provocación oral controlada, si son negativas. Tras la realización del estudio sólo se confirma alergia en el 2-2.5% de los niños. Además, por este motivo, varios grupos de trabajo han propuesto realizar las pruebas de administración oral sin la realización de las pruebas cutáneas previas.
Ser etiquetado de “alérgico a penicilinas” tiene consecuencias adversas en la salud y en la economía. Se asocia a la prescripción de antibióticos alternativos de amplio espectro que tienen un alto riesgo de efectos adversos y aumentan el riesgo de resistencias a antibióticos, precisan ingresos hospitalarios de mayor duración y condicionan un coste de cuidados de salud mucho mayor.
Por ello, en nuestro trabajo como alergólogos es primordial la evaluación de los niños con reacciones por beta-lactámicos, por el beneficio que recibirán en la calidad de sus tratamientos futuros.
Lectura recomendada: Antibiotic Allergy in Children: More than Just a Label. Abrams E, Netchiporouk E, Miedzybrodki B, Ben-Shoshan M. Int Arch Allergy Immunol. 2019;180(2):103-112. doi: 10.1159/000501518.
María Rueda García. Alergóloga, MD, PhD. Servicio de Alergología, Hospital Quirón, Barcelona. Miembro del Comité de Alergia Infantil de la SEAIC, grupo de interés en Alergia a Medicamentos.
Recomendaciones de uso de propofol en pacientes alérgicos a huevo.
El propofol es un medicamento usado ampliamente en procedimientos de anestesia general para la inducción y el mantenimiento de la misma, tanto en niños como en adultos, desde 1977. En su composición, propofol, contiene aceite de soja y proteínas de huevo, por lo que en ficha técnica aparece como contraindicación de uso, la alergia a huevo o soja. Debido a que se ha visto por medio de diferentes estudios, que es extremadamente raro que los pacientes alérgicos a huevo (excepto algún caso de anafilaxia), presenten alguna reacción al administrar propofol, se ha publicado en la revista JIACI, las recomendaciones para el uso de propofol en pacientes alérgicos a huevo que son las siguientes:
-En pacientes con anafilaxia por alergia a huevo: Utilizar otro anestésico general o administrar propofol inicialmente a una dosis pequeña, y si no se produce reacción, ir aumentando la dosis hasta la dosis terapéutica.
-En pacientes alérgicos a huevo no anafilácticos: Utilizar propofol de la misma manera en que se hace a la población no alérgica a huevo.
Para más información:
J Investig Allergol Clin Immunol 2019; Vol. 29(1): 72-74 doi: 10.18176/jiaci.0337
Dra. Sara Martínez Molina. Hospital Universitario de Donostia. Comité de Alergia Infantil SEAIC.
Así se cuela la alergia a los alimentos en las medicinas
La alergia a alimentos afecta en torno al 8% de los menores de 14 años. Cuando se diagnostica a un paciente de alergia a alimentos, se adiestra a los padres en el reconocimiento de los alergenos a los que su hijo/a es alérgico aprendiendo a leer el etiquetado de los diferentes alimentos, pero los alergólogos muchas veces olvidamos advertir a los padres, de la posibilidad, de encontrar alergenos alimentarios, en las medicinas que administramos a nuestros hijos.
El artículo de El País, (artículo completo) comienza relatando el caso clínico de Clara, una paciente con alergia a las proteínas de la leche de vaca. Por eso, lo primero que hicieron sus padres antes de administrarle una ampolla para la anemia, fue leer la composición del medicamento. Como no encontraron ninguna mención a la caseína, leche de vaca, o proteínas lácticas, no dudaron en dárselo, convencidos de estar ayudándola. Pero la reacción anafiláctica, no tardó en llegar. Su error fue no leer el prospecto hasta el final: más abajo, y poco destacado, el texto sí recogía la contraindicación. El fármaco contiene proteína de la leche porque, cuando se añade al hierro, mejora la tolerancia digestiva y el sabor del medicamento, además de favorecer su absorción en el organismo.
Recientemente se publicó en Science Translational Medicine, 13 de marzo de 2019, vol 11, issue 483, un trabajo titulado “Inactive ingredients in oral medications”, llevado a cabo entre los especialistas del Hospital Brigham and Women´s de Boston y el Instituto Tecnológico de Massachusetts. El estudio refiere que solo en los 42.052 medicamentos por vía oral analizados en el trabajo, hay 354.597 ingredientes inactivos, y 38 de esos ingredientes, podría generar algún tipo de reacción adversa. Identificarlos por parte del consumidor, puede ser un problema de primer orden para quienes tienen alguna alergia alimentaria.
Las sustancias que desencadenan la reacción alérgica pueden estar presentes en las dos partes que componen los medicamentos: el principio activo y los excipientes.
El problema para los pacientes con alergia a alimentos, es que, mientras es obligatorio que los fabricantes declaren la composición completa del principio activo en los prospectos y en la ficha técnica de los medicamentos, no existe la misma obligación para los excipientes (y son muchas las sustancias potencialmente alérgicas que forman o pueden formar parte de ellos, como las proteínas lácteas, la lactosa, las proteínas del huevo, el cacahuete…).
La industria farmacéutica, solo debe incluir los alérgenos que figuran en un listado de declaración obligatoria.
La lista de excipientes que los fabricantes deben declarar obligatoriamente y los que no están obligados a hacerlo es muy limitada, y va cambiando según las consideraciones de la Agencia del Medicamento Europea (normalmente va en concordancia con el tipo de ingredientes que más se usan en la elaboración de los medicamentos).
Según la última actualización publicada por el Ministerio de Sanidad, de 2018, estos son los alérgenos que deben incluir y los que no tienen porqué mencionarse en el prospecto y ficha técnica son:
Están incluidos los azúcares, como la glucosa, fructosa, galactosa y lactosa (no las proteínas lácteas), el gluten, algunos aceites, como el de cacahuete, de soja y de sésamo; el almidón de arroz, maíz y patata, así como sus derivados; el almidón de trigo, avena, cebada, centeno y sus derivados, que contienen gluten.
No están incluidos el huevo, proteínas lácticas, el pescado y derivados, el marisco, los frutos de cáscara, la soja, los altramuces, el apio y derivados, la mostaza y derivados.
La jefa del servicio de Alergología del Hospital Universitario de Getafe, Beatriz Rodríguez, confirma que no todos los excipientes son de declaración obligatoria, pero puntualiza que hay excepciones. “En el caso de medicamentos inyectables, oftálmicos y tópicos, la Agencia Española de Medicamentos y Productos Sanitarios establece que se deben declarar todos los excipientes (no solo los de declaración obligatoria). Para el resto de fármacos, los excipientes de declaración obligatoria se van actualizando conforme a los avances científicos y técnicos, y de acuerdo con lo que se establezca en la Unión Europea”, asegura la especialista.
Este problema ya es conocido desde hace tiempo en España y fue denunciado por el comité de Alergia a medicamentos de la Sociedad Española de Alergología e Inmunología Clínica, en 2010, cuando identificó aquellos medicamentos que podían ser más peligrosos para las personas alérgicas en un documento elaborado en colaboración con la Agencia Española de Medicamentos y Productos Sanitarios.
No obstante, el problema no se centra únicamente a los excipientes, pese a que la legislación obliga a los laboratorios a declarar toda la composición del principio activo en el prospecto o la ficha técnica del fármaco, la normativa es un poco tibia, y la información de los alergenos puede pasar desapercibida, si está vagamente indicada al final del prospecto, como les pasó a los padres de Clara.
Un estudio de la Organización de Consumidores y Usuarios del año pasado denunció el caso de la lisozima, que se obtiene mediante una síntesis o extracción de la clara del huevo y que se usa como agente bactericida. El prospecto del fabricante que la comercializaba no mencionaba la posibilidad de una reacción en personas con alergia al huevo, ni tampoco se informaba de que el fármaco provenía de la clara de huevo.
Por tanto, en el momento actual se nos plantea el interrogante de hasta que punto la dispersión en la normativa es peligrosa para los alérgicos, hasta entonces, es fundamental, comentar siempre el historial de alergia previo a una prescripción médica.
Marta Reche.
Servicio de Alergología. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid.
Comité de Alergia Infantil de la SEAIC.
Eficacia y seguridad de la provocación oral durante 5 días para la evaluación de la alergia a la amoxicilina no grave en niños
La alergia a antibióticos betalactámicos es la alergia medicamentosa más frecuente, entre las cuales las aminopenicilinas son causa de erupciones tardías en los niños, particularmente en el contexto de las infecciones virales.
Una proporción significativa de individuos continúa evitando los antibióticos betalactámicos por temor a una reacción alérgica a pesar de tener un estudio negativo frente a ellos.
Efficacy and Safety of 5-Day Challenge for the Evaluation of Nonsevere Amoxicillin Allergy in Children. Labrosse R, Paradis L, Lacombe J, Samaan K, Graham F, Paradis J, Bégin P, Des Roches A.
En este estudio, se comparó la seguridad y la eficacia de la prueba de exposición oral con amoxicilina durante 5 días respecto a la administración de una dosis única de este antibiótico durante la prueba. Asimismo se evaluó la proporción de pacientes que a posteriori utilizaron la amoxicilina una vez confirmada su tolerancia
En el estudio se reclutaron prospectivamente pacientes pediátricos menores de 18 años con historia previa de reacción en el contexto de la administración de amoxicilina. Todos los pacientes siguieron una prueba de exposición frente a este antibiótico, y aquellos con respuesta negativa se sometieron a una prueba oral ambulatoria de 5 días para descartar reacciones no inmediatas. Los pacientes fueron llamados 2 años después de su evaluación inicial para evaluar el uso posterior de amoxicilina y su tolerancia.
Los resultados fueron los siguientes: de los ciento treinta niños con antecedentes de alergia a amoxicilina todos se sometieron a una prueba de exposición oral frente a amoxicilina. 3 pacientes tuvieron una prueba inmediata positiva, otros 3 una prueba positiva no inmediata y en 2 pacientes los resultados fueron ambiguos. De los 122 pacientes con una prueba de exposición negativa, 114 (93,4%) fueron valorados vía telefónica 2 años después de su evaluación inicial: 75 niños habían usado antibióticos con posterioridad, de los cuales solo 1 (1,3%) se había negado a reutilizar amoxicilina por temor a una reacción alérgica . Finalmente, la prueba de exposición oral de 5 días dio como resultado en la prevención futura de la evitación de betalactámicos un 25,4% en comparación con la prueba oral clásica de dosis única (1,3%) realizada durante 1 día en una cohorte histórica p <0,0001).
La provocación oral durante 5 días es una forma segura y efectiva de descartar la alergia a la amoxicilina no inmediata, y garantiza un mejor cumplimiento del uso futuro de la penicilina.
Sara Martínez Molina. Comité de Alergia Infantil SEAIC.
DESENSIBILIZACIONES A MEDICAMENTOS
En los últimos años se ha incrementado el uso de quimioterápicos y de anticuerpos monoclonales para el tratamiento del cáncer, asociando a su vez un mayor número de reacciones de hipersensibilidad debidas a estos fármacos. Las reacciones alérgicas son imprevisibles, potencialmente graves, y pueden conllevar la restricción en el uso de tratamientos de primera línea, y como consecuencia, generar un gran impacto en la supervivencia y en la calidad de vida del paciente.
Las manifestaciones clásicas de las reacciones oscilan desde leves, con afectación cutánea como picor o habones, hasta shock anafiláctico de compromiso vital. Pero la presentación puede ser atípica como ocurre con el dolor asociado a las reacciones por taxanos, o a los escalofríos y la fiebre descritos con oxaliplatino y los anticuerpos monoclonales. Las reacciones tardías tras la quimioterapia, que suelen aparecer tras 24 horas de la infusión, pueden deberse a la vida media prolongada de los anticuerpos monoclonales y a la administración de premedicación.
El término desensibilización se utiliza para describir el proceso mediante el cual se modifica la respuesta inmune del paciente para generar tolerancia temporal, y se basa en modelos in vitro e in vivo que demuestran que mastocitos y basófilos pueden inhibirse mediante el incremento progresivo de dosis de antígeno, desactivando señales de transducción y liberación de mediadores. Los protocolos de desensibilización se han utilizado con éxito con antibióticos, antiquimioterápicos, anticuerpos monoclonales y otros fármacos, en pacientes con reacciones de hipersensibilidad mediadas y no mediadas por IgE.
Debe considerarse en aquellos pacientes cuyas reacciones sugieran un mecanismo tipo I y tipo IV sin terapia alternativa o en aquellos cuya terapia alternativa tenga menor valor o pueda inducir más efectos secundarios. Se pueden realizar desensibilizaciones en pacientes de cualquier edad y en mujeres embarazadas cuando no hay tratamientos alternativos, o cuando retrasar un tratamiento puede acortar la vida. El proceso de desensibilización es seguro, se ha demostrado que las reacciones que ocurren generalmente son leves y menos graves que la reacción inicial del paciente, sin haberse descrito fallecimientos. Deben realizarse por alergólogos entrenados en los protocolos personalizados y en el manejo de las posibles reacciones.
No se debe desensibilizar a los pacientes que hayan presentado reacciones de hipersensibilidad de tipo II y III, reacciones descamativas, síndrome de Stevens–Johnson, necrolisis epidérmica tóxica, porque pequeñas cantidades del fármaco pueden inducir reacciones potencialmente fatales.
Durante los días 1 y 2 de diciembre de 2017 tuvo lugar el Curso de Avances en Desensibilización a Medicamentos (DDIM) en la Universidad Internacional de Catalunya (UIC) en Barcelona. Se trata de un evento anual internacional monográfico en desensibilización a fármacos, que cuenta con expertos de talla mundial como la Profesora Mariana Castells, Catedrática de la Universidad de Harvard.
María Rueda García
Alergóloga
Servicio de Alergología y Neumología, Hospital Quirón, Barcelona