comitéAlergia Infantil
Anafilaxia en niños y adolescentes
La anafilaxia, como extremo más grave del espectro de las reacciones alérgicas, de afectación sistémica, aguda y potencialmente mortal, representa una patología de especial interés en pediatría.
En Europa, la anafilaxia es un problema común que afecta aproximadamente a 1 de cada 300 habitantes en algún momento de su vida. Según datos de la red europea de reacciones alérgicas graves, el 27% de los casos de anafilaxia se produce en menores de 18 años. Además, se ha descrito un incremento de su incidencia, especialmente en niños y preescolares.
Causas/desencadenantes
La causa más común de anafilaxia en niños son los alimentos (75%), seguida a distancia por los medicamentos (11%). Estudios epidemiológicos de la SEAIC* señalan a la alergia alimentaria como tercer motivo de consulta a los servicios de Alergología en edad pediátrica, con una tendencia al alza. La anafilaxia representa el 7,5% de los casos diagnosticados, siendo la leche de vaca, el huevo, los frutos secos y las frutas, los alimentos implicados más frecuentemente.
Los desencadenantes alimentarios varían según la edad y el área geográfica. En los dos primeros años de vida, la leche de vaca y el huevo son los desencadenantes más habituales; posteriormente, los frutos secos en edad preescolar, siendo el cacahuete el más común en todas las edades. En ciertos países europeos, particularmente en el área mediterránea, el melocotón tiene especial relevancia.
La anafilaxia inducida por ejercicio y dependiente de alimentos también debe ser considerada en los niños. Es un tipo especial de alergia mediada por IgE en la que el ejercicio o el consumo de un alimento causante no inducen síntomas por sí solos, pero el ejercicio tras la ingestión del alimento desencadena anafilaxia.
Por último, los padres con frecuencia expresan su preocupación sobre el riesgo de anafilaxia por vacunas; sin embargo, son una causa excepcional en niños.
Factores de riesgo y casos fatales
Las muertes por anafilaxia son raras. En aquellas relacionadas con alimentos, el 73% son debidas a frutos secos o cacahuete, siendo la leche de vaca responsable del 21% de las muertes en <16 años. El riesgo de muerte por anafilaxia aumenta dos veces entre adolescentes en comparación con los niños de 0-2 años. En general, los factores de riesgo identificados para la anafilaxia fatal por alimentos en niños incluyen asma coexistente, edad >10 años, alergia al cacahuete o frutos secos y la falta o la administración tardía de adrenalina.
Un tercio de los casos de anafilaxia ocurren en casa, el 25% en restaurantes y un 15% en la escuela.
Diagnóstico de anafilaxia
La anafilaxia es un diagnóstico predominantemente clínico, con afectación de varios sistemas y de inicio rápido tras la exposición al desencadenante. En los niños muy pequeños, el diagnóstico puede presentar algunos desafíos por la dificultad para describir ciertos síntomas como el prurito o la opresión faríngea; y ciertos signos, como la irritabilidad y los cambios de comportamiento, pueden ser difíciles de interpretar. La anafilaxia en los lactantes suele afectar a la piel (98%), al sistema respiratorio (59%), al aparato digestivo (56%) y, con menos frecuencia, al sistema cardiovascular. Cuando se produce hipotensión, en niños <10 años se define como una tensión arterial sistólica inferior a <70mmHg + (2 x edad en años) o un descenso >30% respecto a un registro basal.
Los síntomas respiratorios aparecen con frecuencia en los niños, especialmente en aquellos que padecen asma. Por otro lado, la anafilaxia puede suceder sin afectación de la piel, de tal forma que los signos cutáneos están ausentes en 10-20% de las anafilaxias. Este hecho afecta de manera crítica a su diagnóstico y tratamiento precoces.
Manejo
Para el autocuidado temprano de los pacientes con anafilaxia es fundamental educar a los padres, cuidadores y a los niños sobre el riesgo de anafilaxia, el control de las enfermedades concomitantes y sus desencadenantes y el autotratamiento de cualquier recurrencia. Durante la infancia, el cuidado/responsabilidad en la aplicación de medidas de evitación, reconocimiento de reacciones y tratamiento de las mismas recae inicialmente en padres y cuidadores. A medida que el niño crece se le enseña a evitar los desencadenantes, reconocer los síntomas y tratar futuras reacciones. Se ha estimado por encuestas que los niños de 9-11 años podrían reconocer síntomas y utilizar correctamente un AIA*.
A los pacientes se les deben recetar uno o más AIA*. Se recomienda que lleven siempre consigo un plan de acción de emergencia escrito y personalizado que ilustre cómo reconocer los síntomas e instruya sobre cómo inyectar rápidamente la adrenalina. Esta debe ser administrada por vía intramuscular en la parte anterolateral media del muslo manteniendo el AIA durante aproximadamente 3-10 segundos. La administración de adrenalina es el tratamiento de primera línea y no existen contraindicaciones absolutas para su administración. La dosis debe repetirse cada 5-15 minutos si los síntomas persisten y tras su administración se debe solicitar asistencia médica. Estas medidas preparan a los padres y a los niños para afrontar una reacción y evitar que se agrave.
Durante una anafilaxia es crucial evaluar periódicamente las vías respiratorias, la respiración, la circulación, el estado mental y la piel, posicionar al paciente según sus características y simultáneamente llamar a los servicios de emergencia. La mayoría de los niños deben colocarse tumbados boca arriba, a menos que haya dificultad respiratoria, en cuyo caso una posición sentada optimiza el esfuerzo respiratorio; si está inconsciente, el niño puede colocarse en posición de recuperación. Al mismo tiempo, y si es posible, se debe eliminar la exposición al desencadenante (p. ej., suspender la administración de medicamentos/agentes terapéuticos).
El tratamiento de la anafilaxia continúa con el traslado a un entorno de atención sanitaria, idealmente en ambulancia. En niños con anafilaxia y síntomas de broncoespasmo, se pueden administrar agonistas beta-2 de acción corta inhalados (p. ej., salbutamol); sin embargo, en presencia de síntomas persistentes no son alternativa a la administración repetida de adrenalina intramuscular. En caso de obstrucción de las vías respiratorias superiores debe considerarse nebulizar adrenalina. Los medicamentos de segunda línea incluyen agonistas beta2-adrenérgicos, glucocorticoides y antihistamínicos. Es necesario observar a los niños durante varias horas, siendo especialmente importante en reacciones graves y en aquellas que requieren varias dosis de adrenalina.
Conclusiones
La anafilaxia es una patología de especial relevancia en edad pediátrica, siendo los alimentos su causa más común. En los niños, los síntomas respiratorios y la ausencia de afectación cutánea son características que deben ser consideradas en su presentación. El asma, la adolescencia, la alergia al cacahuete o los frutos secos y la falta o la administración tardía de adrenalina son factores asociados a mayor gravedad. La educación periódica de niños y familias, sobre cómo identificar los episodios, responder adecuadamente y emplear el AIA son vitales y deben ser revisados regularmente.
Dr. Carmelo Escudero Díez. Servicio de Alergología Hospital Infantil Universitario Niño Jesús (Madrid). Comité de Alergia Infantil.
*SEAIC: Sociedad Española de Alergología e Inmunología Clínica.
*AIA: Auto-inyector de adrenalina.
Referencias recomendadas
- Turner PJ, Campbell DE, Motosue MS, Campbell RL. Global Trends in Anaphylaxis Epidemiology and Clinical Implications. J Allergy Clin Immunol Pract. 2020;8:1169-76.
- Wang Y, Allen KJ, Suaini NHA, McWilliam V, Peters RL, Koplin JJ. The global incidence and prevalence of anaphylaxis in children in the general population: A systematic review. Allergy. 2019;74:1063-80.
- Ojeda P, Ibáñez MD, Olaguibel JM, Sastre J, Chivato T. Alergológica 2015: A National Survey on Allergic Diseases in the Spanish Pediatric Population. J Investig Allergol Clin Immunol 2018;28(5):321-329. doi: 10.18176/jiaci.0308.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
- MS Shaker, DV Wallace, DBK Golden, J Oppenheimer, JA Bernstein, RL Campbell, et al. Anaphylaxis—a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020;145:1082–1123.
- Sicherer SH, Warren CM, Dant C, Gupta RS, Nadeau KC. Food Allergy from Infancy Through Adulthood. J Allergy Clin Immunol Pract. 2020 Jun;8(6):1854-1864. doi: 10.1016/j.jaip.2020.02.010.
MI HIJO ES ALÉRGICO AL MARISCCO ¿PUEDE COMER PESCADO?
INTRODUCCIÓN
La alergia a marisco es una de las alergias alimentarias más frecuentes. Es más frecuente en adultos que en niños y en éstos últimos suele debutar en la infancia tardía o adolescencia. Su prevalencia varía entre países, siendo del 1.3% en Europa en niños entre 2 y 17 años1.
CLASIFICACION TAXONÓMICA
Marisco se define como animal marino invertebrado, por ello es importante conocer su clasificación taxonómica. El marisco se divide en dos reinos: moluscos y artrópodos2-4.
- Los moluscos se dividen a su vez en los subfilos:
- Gastrópoda (abalón, caracol, lapa)
- Bivalvos (almeja, mejillón, vieira, ostra)
- Cefalópodos (pulpo, sepia, calamar)
- Los artrópodos se clasifican en los subfilos:
- Crustáceos (gamba, langosta, bogavante, nécora, cigala, langostino, buey de mar, centollo, santiaguiño)
- Queliceratos (ácaros, arañas)
- Hexópodos (cucaracha)
Los crustáceos producen reacciones alérgicas más frecuentemente que los moluscos y dentro de ellos, la gamba es el crustáceo que con más frecuencia produce reacciones alérgicas2.
REACCIONES ADVERSAS
En cuanto a las reacciones adversas al marisco, hemos de diferenciar las reacciones adversas inmunológicas de las no inmunológicas:
- REACCIONES ADVERSAS INMUNOLÓGICAS:
IgE mediadas: ocurren en las 2 horas siguientes a la ingesta del alimento. Pueden producir desde picor oral (60-95%), ronchas, inflamación facial; síntomas gastrointestinales como náuseas, vómitos, dolor abdominal (20%); síntomas respiratorios como congestión nasal, tos, dificultad para respirar o dificultad para tragar o anafilaxia (21-33%)1,2. La reacción alérgica no sólo ocurre tras la ingesta, sino que también puede desencadenarse con la inhalación de los vapores de cocción. También es importante saber que el ejercicio físico es un cofactor muy frecuente en la anafilaxia por marisco en niños1,2.
La sensibilización puede producirse bien a través de la ingesta o bien a través de la piel (sobre todo en pacientes con dermatitis atópica)2,3.
No IgE-mediadas: El Síndrome de enterocolitis por proteínas de la dieta (FPIES en inglés) por marisco en niños es poco frecuente (0,8% de los casos de FPIES) 5. Los síntomas consisten en vómitos proyectivos, repetidos, entre 1 y 4 horas de la ingesta del alimento, que pueden ir asociados a letargia, hipotensión, palidez y/o diarrea. Los síntomas se repiten cada vez que el niño toma el alimento y se resuelve una vez se retira el alimento implicado de la dieta5-6.
- REACCIONES ADVERSAS NO INMUNOLÓGICAS:
Estos animales invertebrados pueden ingerir toxinas (algas tóxicas), contaminantes o parásitos. Dependiendo de la cantidad de toxina ingerida, los síntomas y duración de la clínica varía. Los síndromes más frecuentes son los síntomas gastrointestinales (náuseas, vómitos, dolor abdominal, diarrea), intoxicación paralítica (hormigueo o adormecimiento de lengua, cuello y dedos, debilidad, dificultad respiratoria), neurotoxicidad (síntomas gastrointestinales y neurológicos, como parálisis y coma), ciguatera (síntomas neurológicos y cardiovasculares) e intoxicación amnésica (síntomas gastrointestinas seguidos de síntomas neurológicos)1.
ALERGENOS DEL MARISCO
Un alérgeno es una sustancia antigénica que induce una reacción alérgica en un organismo. Los alérgenos más importantes del marisco son1,2:
- Tropomiosina: es el principal alergeno de la alergia a gamba, ostra, caracol y calamar. También está en insectos, ácaros, insectos comestibles y anisakis simplex. Es resistente a la temperatura y a la digestión, por lo que no se degrada al cocinarlo ni con el jugo gástrico. El 90-100% de los pacientes alérgicos a un tipo de crustáceo también lo será a otros crustáceos y el 65% también tendrá alergia a moluscos. Hay estudios que demuestran que pacientes con alergia a marisco pueden tener alergia a los ácaros del polvo.
- Arginina-kinasa: también resiste altas temperaturas y es muy volátil, por lo que el vapor producido durante la cocción del marisco puede producir síntomas respiratorios. La arginina-kinasa se encuentra fundamentalmente en el camarón, cangrejo, pulpo y ácaros.
- Otros alérgenos menos relevantes son: cadena ligera de la miosina, proteína de unión al calcio sarcoplásmico, troponina C, etc.
Reactividad cruzada
- Crustáceos-moluscos: El 45% de los alérgicos a crustáceos también tienen alergia a moluscos, sin embargo, la mayoría (70-80%) de las personas alérgicas a moluscos también lo son a crustáceos1,2.
- Ácaros- crustáceos: pacientes alérgicos a ácaros pueden desarrollar alergia a marisco por reactividad cruzada. En ocasiones los síntomas tras ingesta de marisco se limitan al área orofaríngea (picor de boca, de garganta…) debido a la reactividad cruzada entre a tropomiosina de ácaros y marisco; a esto se le llama Síndrome de Alergia Oral ácaros-marisco 1-2
TRATAMIENTO
Los pacientes alérgicos a algún tipo de marisco deben evitar el consumo de todo tipo de marisco hasta que sea estudiado en Alergología1.
ENTONCES, ¿MI HIJO PUEDE COMER PESCADO?
El principal responsable de la alergia al pescado es la parvalbúmina. Es un alérgeno distinto al alérgeno principal del marisco (tropomiosina). Como diría una sabia compañera: “en lo único en que se parece el marisco y el pescado es que ambos viven en el mar”. Por tanto, los pacientes alérgicos a marisco sí pueden comer pescado1.
Dra. Paloma Jaqueti Moreno. Hospital La Mancha Centro, Alcázar de San Juan, Ciudad Real. Comité de Alergia Infantil SEAIC.
BIBLIOGRAFÍA
- IgE-Mediated Shellfish Allergy in Children. Mattia Giovanini, Burcin Beken, Betul Buyuktiryaki, Simona Barni, Giulia Liccioli, Lucrezia Sarti, Lorenzo Lodi, Matteo Pontone, Irene Bartha, Francesca Mori, Cansin Sackesen, George du Toit, Andreas L Lopata, Antonella Muraro. 2023 Jun 11;15(12):2714. doi:10.3390/nu15122714.
- IgE Mediated Shellfish Allergy in Children-A Review. Ariana Giannetti, Andrea Pession, Irene Bettini, Giampaolo Ricci, Giuliana Gianni, Carlo Caffarelli. 2023 Jul 12;15(14):3112. doi: 10.3390/nu1514311
- Food allergy and hypersensitivity reactions in children and adults-A review. Sandra G Tedner, Anna Asarnoj, Helena Thulin, Marit Westman, Jon R Konradsen, Caroline Nilsson. J Intern Med. 2022 Mar;291(3):283-302. doi: 10.1111/joim.13422. Epub 2021 Dec 22
- C. Diéguez Pastor, F. Martín Muñoz, M. Reche Frutos, P.C. Vlaicu. Peculiaridades clínicas de la alergia a los alimentos de origen animal. En: Dávila, I. Jáuregui, I. Olaguibel, J. Zubeldía, J. SEAIC (Sociedad Española de Alergología e Inmunología Clínica). Tratado de Alergología tomo III. 2ª edición. Madrid: Ergon. 2016. Página 1023-1048.
- Infante S, Argiz L, Cabrera-Freitag P, Fernández-de-Alba I, Moya B, Escudero C (2022) Spanish Survey of Food Protein-Induced Enterocolitis Syndrome. J Investig Allergol Clin Immunol 2023; Vol 33(2): 134-136. doi: 10.18176/jiaci.0828
- Infante, S., Marco-Martín, G., Sánchez-Domínguez, M., Rodríguez-Fernández, A., Fuentes-Aparicio, V., Alvarez-Perea, A., … Zapatero, L. (2017). Food protein-induced enterocolitis syndrome by fish: Not necessarily a restricted diet. Allergy, 73(3), 728–732. doi:10.1111/all.13336
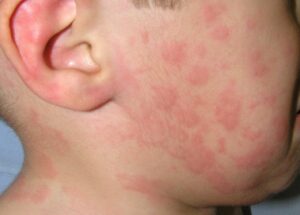
Mi niño tiene urticaria. ¿La urticaria es igual a alergia?
La urticaria es una enfermedad de la piel muy común. Consiste en la aparición de ronchas/habones y/o hinchazón/angioedema, que habitualmente se acompañan de picor. Si dura menos de 6 semanas se clasifica como urticaria aguda y si dura más de 6 semanas como urticaria crónica. Las ronchas aparecen y desaparecen con rapidez, cambian de localización y duran menos de 24 horas y puedes reaparecer en los días siguientes. La hinchazón puede afectar a la cara, las manos, los pies, los genitales y suele ser pruriginoso.
La mayoría de las urticarias en la edad infantil son agudas y no tienen relación con la alergia. La infección parece ser la causa predisponente más frecuente (más del 40%) de urticaria en lactantes y niños en comparación con los adultos. Suelen ser infecciones víricas leves y el niño mantiene buen estado general a pesar de que la urticaria afecte a gran parte de la superficie corporal. Los síntomas de la infección viral pueden estar presentes o no.
¿La urticaria es igual a alergia? En pocas ocasiones la urticaria que dura varios días o semanas es producida por una alergia alimentaria; medicamentosa o por una picadura de insecto. En estos casos, es habitual que la urticaria aparezca antes de que pasen dos horas tras la ingesta del alimento/medicamento o haya antecedente de picadura de insecto en los minutos previos (muy inusual en niños). En ocasiones, pueden asociarse síntomas respiratorios, digestivos, mareos, el niño podría estar mucho más nervioso y afectado. En estos casos, podría tratarse de una reacción alérgica generalizada (anafilaxia) y se debe instaurar tratamiento con adrenalina y solicitar asistencia sanitaria de inmediato.
La urticaria crónica es mucho menos frecuente en niños y en la práctica, la mayoría de los pacientes no tienen una causa identificable. Se clasifica como urticaria crónica espontánea. En un pequeño porcentaje la urticaria crónica en niños se asocia a presencia de anticuerpos autoinmunes. Los medicamentos antiinflamatorios no esteroideos (ibuprofeno, metamizol, paracetamol, etc.) se han identificado como principales factores agravantes de la urticaria crónica espontánea en niños.
En conclusión, la urticaria aguda (<6 semanas de duración) es más frecuente en niños que la urticaria crónica (>6 semanas de duración) y suele ser un proceso benigno, transitorio, y que no se asocia a patología grave subyacente en la la gran mayoría de los casos.
Autora:
Krasimira Baynova, MD. Comité de Alergia Infantil SEAIC. CSUR Angioedema. UGC Alergología. Hospital Universitario Virgen del Rocío. Sevilla.
Bibliografía
1) Meeyong Shin et al. Prevalence and Causes of Childhood Urticaria Allergy Asthma Immunol Res. 2017 May; 9(3): 189–190.
2) Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et all. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018 Jul;73(7):1393-1414. doi: 10.1111/all.13397. PMID: 29336054.
3) Brüske I, Standl M, Weidinger S, et al. Epidemiology of urticaria in infants and young children in Germany–results from German LISAplus and GINIplus Birth Cohort Studies. Pediatr Allergy Immunol 2014;25:36 –42.
4) Cornillier, H., Giraudeau, B., Munck, S., Hacard, F., Jonville-Bera, A.-P., d’ Acremont, G., … Maruani, A. (2018). Chronic spontaneous urticaria in children – a systematic review on interventions and comorbidities. Pediatric Allergy and Immunology, 29(3), 303–310.
Enlace de interés práctico:
https://enfamilia.aeped.es/temas-salud/decalogo-urticaria-infantil
¿Es usted alérgico a la proteína de leche de vaca o intolerante a la lactosa?: La pregunta que salva vidas
Y es que la diferencia es ciertamente importante. Tan importante como que una de ellas puede ser potencialmente mortal. ¿Sabrías decir a cuál de las dos nos referimos?
Comencemos por los términos importantes:
- Leche: según la definición de la RAE:
- Líquido blanco que segregan las mamas de las hembras de los mamíferos para alimento de sus crías.
- Leche de algunos animales que se emplea como alimento de las personas.
- Jugo blanco obtenido de algunas plantas, frutos o semillas.
- Es decir, CUIDADO, la leche puede ser de origen ANIMAL (vaca, oveja, cabra, búfala…) o VEGETAL (soja, arroz, avena, almendra, coco…).
- Lactosa: según la definición de la RAE:
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Presente en leches de mamíferos.
- La lactosa se “destruye” (es decir, se separa en glucosa y galactosa) mediante la acción de una enzima digestiva llamada lactasa.
- Azúcar (disacárido) que contiene la leche, formado por glucosa y galactosa.
- Leche de vaca (composición): agua, proteínas (beta-lactoglobulina, alfa-lactoalbúmina, caseína…), grasas, vitaminas, hidratos de carbono (entre ellos, la lactosa) y minerales.
- Yogures y quesos de origen animal: producto lácteo obtenido al fermentar la leche de animales mediante bacterias que transforman la lactosa en ácido láctico, por tanto, el contenido de lactosa en estos productos es menor. Pero siguen conteniendo lactosa (salvo aquellos específicos sin lactosa) y proteínas de leche de animales.
- Leche/yogures/quesos sin lactosa: leche de animales a los que se ha añadido lactasa de forma artificial (pero siguen conteniendo proteínas de leche).
- Leches/yogures vegetales (composición): NO contienen Contienen proteínas diferentes a las de la leche de animales.
DIFERENCIAS FUNDAMENTALES ENTRE AMBAS (ver cuadro)
La alergia a las proteínas de la leche de vaca:
- Los pacientes pueden tener reacción con leches de otros mamíferos (vaca, cabra, oveja…).
- Reaccionan con pequeñas cantidades (el 50% con menos de 4.1 ml de leche).
- Pueden detectar trazas (menos de 0.1 ml de leche). Los pacientes altamente sensibilizados pueden reaccionar con mínimas cantidades e incluso con contaminaciones indirectas.
- Toleran leches vegetales (excepto si tienen además de su APLV, alergia a alguna de éstas).
- Las reacciones aparecen generalmente en las 2 primeras horas tras la ingesta.
- Los síntomas pueden ser cutáneos (habones, hinchazón de labios…), respiratorios (congestión nasal, dificultad para respirar…), digestivos (dolor abdominal, vómitos, diarrea…) y/o cardiovasculares (mareo, pérdida de conocimiento…).
- Las reacciones pueden ser potencialmente mortales en el caso de afectar a 2 o más órganos o sistemas (ANAFILAXIA).
- Requieren tratamiento urgente específico (por ejemplo, si la afectación es exclusivamente cutánea puede ser tratada con antihistamínicos y corticoides en caso de edema asociado, si los síntomas son respiratorios habrá que utilizar broncodilatadores de rescate y si estamos ante una anafilaxia, el tratamiento de elección será la adrenalina intramuscular).
La intolerancia a lactosa:
- Los pacientes toleran leche sin lactosa.
- Pueden consumir yogures sin lactosa y quesos con bajo contenido en lactosa (queso curado, parmesano, gruyere, mozzarella…). Pero es recomendable preguntar si pueden consumirlo.
- Pueden toleran leche y derivados lácteos con lactosa si toman previamente comprimidos de lactasa.
- Toleran leches vegetales.
- Suelen tener reacciones de tipo digestivo (dolor abdominal, diarrea, flatulencias…).
La cantidad SÍ importa:
3.2 mg de proteína de leche (unos 0.1 ml de leche de vaca) pueden desencadenar una reacción alérgica en al menos el 5% de los pacientes alérgicos a proteínas de leche de vaca. Al menos el 50% reaccionan con 133 mg de proteína de leche (unos 4.1 ml de leche).
EN RESUMEN: el conocimiento es poder. Y en este caso, el uso correcto del lenguaje es de vital importancia.
Grabémonos la pregunta clave:
¿Es usted alérgico a la proteína de la leche de vaca o intolerante a la lactosa?
- Si la respuesta es SOY ALÉRGICO: CUIDADO, pueden tener reacciones alérgicas potencialmente mortales, incluso con trazas, que requieran tratamiento urgente. Tendremos que evitar cualquier contacto con leche de mamíferos y aquellos productos que puedan contenerla.
- Si la respuesta es SOY INTOLERANTE: podemos dar leche y productos lácteos SIN lactosa. Podemos también preguntar por el grado de tolerancia, es decir, si tolera yogures o quesos.
- Si tenemos DUDAS: es mejor SER PRECAVIDOS y EVITAR cualquier contacto con leche de mamíferos o aquellos productos que puedan contenerlos.
Porque hay preguntas que salvan vidas. Usémoslas.
Dra. Laura Argiz Álvarez. Clínica Universidad de Navarra (Madrid).
Bibliografía:
- Turner PJ, d’Art YM, Duca B, et al. Single-dose oral challenges to validate eliciting doses in children with cow’s milk allergy. Pediatr Allergy Immunol. 2021;32(5):1056-1065. doi:10.1111/pai.13482
- Blom WM, Westerhout J, Baumert JL, et al. Updated full range of Eliciting Dose values for Cow’s milk for use in food allergen risk assessment. Food Chem Toxicol. 2022;168:113381. doi:10.1016/j.fct.2022.113381
Microbiota y alergia alimentaria – una nueva herramienta para su tratamiento
Lo primero, ¿Qué es eso de la microbiota intestinal?
La microbiota intestinal se define como la comunidad de microorganismos que habita en nuestro tracto digestivo. Esta comunidad está formada por una gran variedad de bacterias, hongos, virus y otros microorganismos que desempeñan un papel fundamental en la salud humana.
La composición de la microbiota intestinal depende de factores como la genética, la dieta, el modo de nacimiento, el tipo de lactancia y la toma de antibióticos entre otros, sobre todo en los tres primeros años de vida, que es cuando se establece la composición de nuestra microbiota intestinal que tiende a persistir en la vida adulta.
Nuestro estilo de vida urbano e industrializado nos expone a una menor diversidad microbiana y hace que esa exposición microbiana sea frente a una serie ¿concreta? O ¿microorganismos específicos? de microorganismos, lo que se traduce en una menor diversidad de nuestra microbiota intestinal y el desarrollo de una microbiota intestinal ¿específica? concreta que a su vez se ha relacionado con un mayor riesgo de desarrollar una patología alérgica en general y alergia alimentaria en concreto.
En los últimos años, se ha demostrado que la microbiota intestinal juega un papel importante en la alergia alimentaria, lo que hace plantearnos si este papel podría aprovecharse a nuestro favor para prevenir e incluso llegar a tratar la alergia alimentaria.
Pero… ¿y qué es exactamente la alergia alimentaria?
La alergia alimentaria es una reacción exagerada e inapropiada del sistema inmunológico ante la proteína de un alimento específico. Puede producir diferentes síntomas desde los más leves (ej. picor en la boca) hasta las reacciones más graves potencialmente mortales llamadas anafilaxias.
¿Qué relación existe entre la microbiota intestinal y la alergia alimentaria?
Entre las funciones de la microbiota intestinal se encuentra el desarrollo y mantenimiento de un sistema inmunológico saludable.
Cuando se produce la introducción de la alimentación complementaria en los lactantes, la microbiota intestinal juega un papel fundamental en el desarrollo de tolerancia oral a los alimentos. Se trata de un momento crucial en el que una microbiota intestinal alterada puede contribuir a la aparición y desarrollo de la alergia alimentaria. A continuación, resumimos los hallazgos más relevantes obtenidos en estudios observacionales y preclínicos que apuntan al papel de la microbiota intestinal en el desarrollo de alergia alimentaria:
- Determinadas exposiciones microbianas en la primera infancia se asocian a menor o mayor riesgo de desarrollar alergia alimentaria. Así, tener hermanos mayores o perro en domicilio durante el primer año de vida se asocia a un menor riesgo de desarrollar alergia a huevo al año de edad, mientras que nacer mediante cesárea se asocia a un mayor riesgo de tener alergia alimentaria.
- La composición de la microbiota intestinal en los primeros meses de vida, se asocia a riesgo de desarrollar sensibilización alimentaria (el paso previo a una posible alergia alimentaria) en los primeros años de vida.
- La composición de la microbiota intestinal de niños con alergia alimentaria es distinta a la de niños sin alergia alimentaria.
- En niños con alergia alimentaria, la composición de su microbiota intestinal en los primeros meses de vida podría estar asociada a la adquisición de tolerancia espontánea en los siguientes años.
- Modelos murinos han demostrado que: (i) la microbiota intestinal tiene un papel supresor y evita la sensibilización y el desarrollo de alergia alimentaria y que (ii) la susceptibilidad de tener alergia alimentaria se transmite a través de la microbiota fecal.
Los conocimientos adquiridos en estos estudios han sentado las bases para llevar a cabo ensayos clínicos en humanos en los que se emplean probióticos, prebióticos y simbióticos con el fin de manipular la microbiota intestinal existente como herramienta preventiva o terapéutica en la alergia alimentaria. Sin embargo, a día de hoy no existe evidencia científica suficiente que avale el empleo de estas terapias microbianas para prevenir o tratar la alergia alimentaria aunque sin duda es un campo prometedor en el que seguir trabajando.
Para ampliar: video en youtube de la Dra. Venter sobre el papel de la microbiota en la alergia alimentaria: (2023) Youtube.com: https://www.youtube.com/watch?v=IpZXU-iKF9A (Accessed: 14 February 2023).
Dra. Isabel Fernández de Alba Porcel, Hospital HLA Inmaculada, Granada. Comité de Alergia Infantil
Bibliografía
- Azad MB, Konya T, Guttman DS, Field CJ, Sears MR, HayGlass KT, Mandhane PJ, Turvey SE, Subbarao P, Becker AB, Scott JA, Kozyrskyj AL; CHILD Study Investigators. Infant gut microbiota and food sensitization: associations in the first year of life. Clin Exp Allergy. 2015 Mar;45(3):632-43. doi: 10.1111/cea.12487. PMID: 25599982.
- Bager P, Wohlfahrt J, Westergaard T. Caesarean delivery and risk of atopy and allergic disease: meta-analyses. Clin Exp Allergy. 2008 Apr;38(4):634-42. doi: 10.1111/j.1365-2222.2008.02939.x. Epub 2008 Feb 11. PMID: 18266879.
- Bunyavanich S, Berin MC. Food allergy and the microbiome: Current understandings and future directions. J Allergy Clin Immunol. 2019 Dec;144(6):1468-1477
- Bunyavanich S, Shen N, Grishin A, Wood R, Burks W, Dawson P, Jones SM, Leung DYM, Sampson H, Sicherer S, Clemente JC. Early-life gut microbiome composition and milk allergy resolution. J Allergy Clin Immunol. 2016 Oct;138(4):1122-1130. doi: 10.1016/j.jaci.2016.03.041. Epub 2016 May 10. PMID: 27292825; PMCID: PMC5056801.
- Fazlollahi M, Chun Y, Grishin A, Wood RA, Burks AW, Dawson P, Jones SM, Leung DYM, Sampson HA, Sicherer SH, Bunyavanich S. Early-life gut microbiome and egg allergy. Allergy. 2018 Jul;73(7):1515-1524. doi: 10.1111/all.13389. Epub 2018 Mar 15. PMID: 29318631; PMCID: PMC6436531.
- Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, Arshad H, Bahnson HT, Beyer K, Boyle R, du Toit G, Ebisawa M, Eigenmann P, Grimshaw K, Hoest A, Jones C, Lack G, Nadeau K, O’Mahony L, Szajewska H, Venter C, Verhasselt V, Wong GWK, Roberts G; European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021 Jul;32(5):843-858. doi: 10.1111/pai.13496. Epub 2021 Mar 29. PMID: 33710678.
- Jungles KN, Jungles KM, Greenfield L, Mahdavinia M. The Infant Microbiome and Its Impact on Development of Food Allergy. Immunol Allergy Clin North Am. 2021 May;41(2):285-299.
- Koplin JJ, Dharmage SC, Ponsonby AL, Tang ML, Lowe AJ, Gurrin LC, Osborne NJ, Martin PE, Robinson MN, Wake M, Hill DJ, Allen KJ; HealthNuts Investigators. Environmental and demographic risk factors for egg allergy in a population-based study of infants. Allergy. 2012 Nov;67(11):1415-22. doi: 10.1111/all.12015. Epub 2012 Sep 7. PMID: 22957661.
- Noval Rivas M, Burton OT, Wise P, Zhang YQ, Hobson SA, Garcia Lloret M, Chehoud C, Kuczynski J, DeSantis T, Warrington J, Hyde ER, Petrosino JF, Gerber GK, Bry L, Oettgen HC, Mazmanian SK, Chatila TA. A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis. J Allergy Clin Immunol.2013 Jan;131(1):201-12. doi: 10.1016/j.jaci.2012.10.026. Epub 2012 Nov 30. PMID: 23201093; PMCID: PMC3860814.
- Otero, Olalla (2022) El revolucionario mundo de los probióticos: Qué son, cómo funcionan y para qué sirven. Barcelona, Alienta editorial.
- Rachid R, Stephen-Victor E, Chatila TA. The microbial origins of food allergy. J Allergy Clin Immunol. 2021Mar;147(3):808-813. doi: 10.1016/j.jaci.2020.12.624. Epub 2020 Dec 22. PMID: 33347905; PMCID: PMC8096615.
- Savage JH, Lee-Sarwar KA, Sordillo J, Bunyavanich S, Zhou Y, O’Connor G, Sandel M, Bacharier LB, Zeiger R, Sodergren E, Weinstock GM, Gold DR, Weiss ST, Litonjua AA. A prospective microbiome-wide association study of food sensitization and food allergy in early childhood. Allergy. 2018 Jan;73(1):145-152. doi: 10.1111/all.13232. Epub 2017 Aug 2. PMID: 28632934; PMCID: PMC5921051.
Nuevos alimentos, viejos alérgenos
Los insectos forman parte de la cocina de muchos países del mundo y su consumo dentro de Europa va avanzando en últimos años. Aproximadamente dos mil millones de personas en todo el mundo consumen insectos especialmente en países como Asia, América Latina y África1.
El consumo de insectos es en la actualidad una tendencia alimentaria en auge. Desde el 1 de enero de 2018 la legislación europea cataloga a los insectos como “nuevo alimento” y según la Organización para la Agricultura y la Alimentación de las Naciones Unidas (FAO), les considera “el alimento del futuro”.
Hoy en día, son cuatro los insectos autorizados en el mercado europeo: las larvas del gusano de la harina (en forma congelada, desecada y en polvo), la langosta migratoria (en forma congelada, desecada y en polvo), el grillo doméstico (en forma congelada, desecada, en polvo y polvo parcialmente desgrasado) y las larvas del escarabajo del estiércol (en forma congelada, en pasta, desecada y en polvo) 2. Aunque a nivel general este habito de consumo no está muy extendido, en nuestra dieta, consumimos de forma inadvertida el componente “E12” o carmín, una sustancia que se obtiene del insecto cochinilla, que se utiliza para teñir diversos alimentos de confiterías, pasteles y mermeladas, jarabes, yogures, bebidas y carnes.
Además, hay ocho solicitudes pendientes para insectos destinados a ser comercializados en diferentes formas que actualmente están siendo objeto de una evaluación de seguridad2.
Los insectos representan una alternativa a la carne y el pescado para satisfacer la creciente demanda de fuentes sostenibles de nutrición 1.
Desde el punto de vista nutricional, los estudios científicos avalan que los insectos son una fuente de nutrientes muy saludables con alto contenido en proteínas, vitaminas B1, B2 y B3, contienen omega 3 y 6, todos los aminoácidos esenciales y son una fuente importante de minerales como el hierro.
Hay otro factor que debe tenerse en cuenta y que juega a favor del consumo de insectos: el impacto medioambiental. La producción de proteína de insectos supone una importante reducción de gases de efecto invernadero y supone una menor contaminación respecto a otras proteínas de origen animal.
Respecto a la seguridad de su consumo, la Comisión Europea con el reglamento sobre nuevos alimentos, asegura que se disponga de la información alimentaria obligatoria para que sean seguros para los consumidores y estén debidamente etiquetados, incluyendo la identificación correcta de alérgenos.
Al igual que las proteínas de otros alimentos, las contenidas en los insectos, son susceptibles de desencadenar reacciones alérgicas graves. Cada vez son más los pacientes que llegan a nuestras consultas por reacciones alérgicas, incluyendo reacciones anafilácticas, tras la ingestión de insectos.
Se han identificado varios alérgenos implicados en la alergia a insectos, entre ellos la tropomiosina y la arginina quinasa, ambos panalérgenos conocidos por su reactividad cruzada con proteínas homólogas en crustáceos y ácaros del polvo doméstico. Se ha demostrado reactividad cruzada y/o cosensibilización de la tropomiosina de insectos y la arginina quinasa en pacientes alérgicos a los ácaros del polvo doméstico y a los mariscos (p. ej., langostinos, gambas). También se ha demostrado que el procesamiento térmico y la digestión no eliminaron la alergenicidad de las proteínas de insectos1.
Algunos estudios señalan que la proteína de la cutícula de la larva del gusano, podría ser un alérgeno importante en la sensibilización primaria al gusano de la harina. Otros alérgenos, como la actina,insectoo la cadena ligera similar a la miosina, también se identifican como factor de riesgo de reactividad cruzada entre crustáceos y gusanos de la harina 3.
La disponibilidad de este tipo de alimentos en supermercados y su venta on-line, esta haciendo que cada vez su consumo sea más frecuente.
Es importante el papel que juega el alergólogo en este momento en el que el consumo de insectos empieza a instaurarse poco a poco en nuestra dieta para poder asesorar adecuadamente a los pacientes.
Rocío Candón Morillo. Hospital Universitario de Jerez. Comité de Alergia Infantil SEAIC.
Bibliografía
1.-Insect (food) allergy and allergens. Steffie de Gier , Kitty Verhoeckx .Molecular Immunology. Volume 100, August 2018, Pages 82-106
2.- Los insectos como nuevos alimentos: claves para asesorar adecuadamente a la población sobre su consumo. Diario medico.
3.-Mankouri F1, Sereme Y2,3, Michel M2,3, Piarroux R4, Pahus , Chanez P1,6, Vitte J2,3, Gouitaa MJ Investig . Immediate Hypersensitivity to Mealworm and Cricket: Beyond Shrimp and House Dust Mite
Cross-Reactivity. Allergol Clin Immunol 2022; Vol. 32(1): 56-78
Telealergia: ¿vino para quedarse?
Artículo: Teleallergy: Where Have We Been and Where Are We Going? Ramsey A, Chen Wu A, Bender B, Portnoy J. J Allergy Clin Immunol Pract 2023;11:126-31.
La telemedicina se puede definir, como el uso de las tecnologías de la información, por medio de los sistemas telemáticos, para proporcionar asistencia médica, independientemente de la distancia que separa al paciente del profesional médico.
Los primeros datos de telemedicina aplicados al campo de la Alergología son muy escasos a partir de los años 90. Sin embargo, el uso de la telemedicina se incrementa de forma exponencial a partir del año 2020. Este año, queda marcado en la historia por la extensión de la enfermedad provocada por el virus SARS-CoV-2019 (COVID-19), lo que condicionó un cierre de la actividad socioeconómica mundial casi global. Tras declararse la pandemia por la Organización Mundial de la Salud en marzo de 2020, el gobierno español decretó el estado de alarma con el consiguiente confinamiento domiciliario, que se prolongó hasta junio de 2020. Posteriormente se han sucedido diversas olas pandémicas que han ido afectando de forma diversa la asistencia médica.
El modelo de acceso y prestación de la asistencia sanitaria cambió bruscamente, primero en la Atención Primaria, y posteriormente en las diferentes especialidades médicas. El patrón clásico de asistencia presencial, ha sido sustituido por un patrón mixto, en el que las herramientas de telemedicina han desempeñado un papel determinante. Centrándonos en el campo de la Alergología, investigadores norteamericanos dirigidos por Ramsey y cols., han llevado a cabo una revisión sobre el impacto de la telemedicina en la satisfacción de los pacientes alérgicos, en el coste de la asistencia, así como en el entorno normativo que debe regular en el futuro la telemedicina.
1.- Satisfacción del paciente
- Satisfacción del paciente antes de la epidemia COVID:
Hay diversos estudios en los primeros años del siglo XXI. Así, en 2015, Portnoy y cols., compararon las visitas presenciales frente a la teleasistencia, en 169 pacientes pediátricos con asma bronquial. El 90% de los pacientes consideraban satisfactoria la asistencia sanitaria, y un 88% la recomendaría para las revisiones médicas.
- Satisfacción durante la epidemia COVID:
Diversos estudios muestran una opinión favorable. En el estudio de Mustafa y cols., con 251 pacientes alérgicos, la satisfacción fue general para todos los tipos de enfermedades alérgicas, salvo en la alergia a alimentos, donde los pacientes consideraron óptima la visita presencial. En otro estudio dirigido por Emory con 269 pacientes, la satisfacción fue plena con la consulta telemática para el 79% de los pacientes, siendo el dato mas relevante la facilidad para poder asistir a la cita. No obstante, incluso con datos satisfactorios, los investigadores refieren que determinados procedimientos en el campo de la Alergología, como la realización de las pruebas cutáneas o los estudios de pruebas de tolerancia con alimentos o medicamentos requieren de la visita presencial. Otros estudios, sin embargo, muestran una mayor satisfacción con las visitas presenciales, especialmente en pacientes con dermatitis atópica, múltiples alergias a alimentos o pacientes pediátricos con asma bronquial.
2.- Satisfacción del médico
Tradicionalmente los alergólogos no han utilizado la telemedicina, por lo que se les deben facilitar herramientas que permitan su uso. Sin embargo, salvo en algunos países, no se han desarrollado programas de formación para los especialistas ni tampoco la asistencia mediante aplicaciones informáticas.
La principal ventaja de utilizar la telemedicina en la práctica clínica habitual es el ahorro de tiempo que supone para el médico disminuir las horas de consulta dedicadas a labores burocráticas. Este tiempo podría reinvertirse en reducir las listas de espera dedicadas a dar resultados analíticos, resolver dudas a pacientes a cerca de tratamientos de una forma más rápida, así como conseguir una comunicación más fluida con pacientes y médicos de Atención Primaria. De esta manera, se agilizarían procedimientos ordinarios y mejoraría la calidad asistencial del paciente.
3.- Coste socioeconómico de la telemedicina
Por un lado, la telemedicina puede reducir los costes de las enfermedades alérgicas ya que disminuye los gastos en el transporte hasta la consulta médica, así como el absentismo escolar y laboral. Sin embargo, tiene otras desventajas que pueden incrementar el coste como es la falta de acceso directo al profesional sanitario y su supervisión, lo que puede implicar una peor evolución clínica de la enfermedad. Existen pocos estudios durante la pandemia Covid de telemedicina y coste sanitario. En un estudio sobre pacientes pediátricos diagnosticados de asma bronquial, se observó que tras realizar un programa de telemedicina en el primer año de la pandemia Covid, hubo una reducción en las reagudizaciones asmáticas. Este hecho puede ser atribuible no a la telemedicina en si misma, sino a la escolarización en casa durante los primeros meses Covid, así como el uso de la mascarilla, ya que ambas situaciones redujeron la exposición a diferentes virus durante ese periodo de tiempo, lo que puede explicar la reducción en las exacerbaciones asmáticas. Por otro lado, es conocido que la telealergia tiene su mayor potencial de mejora del gasto sanitario en las zonas rurales o áreas que no disponen de alergólogo cercano, por lo que requieren un desplazamiento importante para la asistencia médica. Así, en un estudio alemán hecho con 112 pacientes con rinitis alérgica, la telemedicina generó un ahorro de 60.000 euros por año y redujo en 2.3 los días perdidos de trabajo o escuela, por paciente y año.
4.- Cambios en el marco regulatorio
La introducción y el uso progresivo de la telemedicina aplicado al campo de la Alergología, debe acompañarse de una actualización en el marco legislativo, así como de la cobertura y coste de los seguros de asistencia médica, tanto en la Sanidad Privada como Pública, que deben ir acometiéndose durante los próximos años.
CONCLUSIONES
Tras la pandemia Covid, la telemedicina aplicada al campo de la Alergología es una realidad. Esta herramienta ofrece ventajas, las principales, la reducción de absentismo laboral/escolar y transporte, la mejor adherencia en el seguimiento y la mayor agilidad en las revisiones médicas. Ofrece también una posible mejoría en la educación continuada del paciente alérgico con las diferentes herramientas informáticas, así como en el seguimiento del cumplimiento terapéutico. Sin embargo, pese a estas ventajas, la asistencia presencial seguirá siendo vital en nuestra especialidad, para la realización de muchos de nuestros procedimientos diagnósticos y terapéuticos, así como para aquellos pacientes que requieran un diagnóstico inicial, una valoración directa por parte del alergólogo o cuando la gravedad o el control de la enfermedad así lo requiera.
Marta Reche. Servicio de Alergología. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid. Comité de Alergia Infantil
Alergia al veneno de himenópteros en niños
La picadura de insectos en la población pediátrica es una causa frecuente de búsqueda de asistencia médica en época estival. La alergia al veneno de los himenópteros es una reacción del sistema inmunitario frente al veneno tras la picadura de éstos.
Las picaduras de himenópteros, principalmente de abejas y avispas, son los principales responsables de las reacciones alérgicas tras picadura de insectos en nuestro medio. Según la Guía Alergia al Veneno de los Himenópteros de la EAACI (Academia Europea de Alergia e Inmunología Clínica) las reacciones alérgicas sistémicas a picaduras de estos insectos afectan al 3,4% de los niños. La alergia a su veneno suele aparecer a partir de una segunda picadura, que es cuando el menor habrá quedado sensibilizado a su veneno, por lo que es más frecuente en niños mayores.
Las reacciones que suelen producirse son de dos tipos:
– Locales cuando aparece enrojecimiento, hinchazón y dolor en la zona y puede afectar hasta a dos articulaciones. El tratamiento es la limpieza de la zona con agua y jabón, se puede aplicar amoniaco y frío local, además de antihistamínicos y corticoides orales.
– Sistémicas o generalizadas cuando los síntomas afectan a otras partes del cuerpo, suelen aparecer lesiones habonosas y mucho picor, inflamación en los ojos y la boca, síntomas respiratorios, dificultad para tragar, mareo, bajada de tensión e incluso pérdida de conocimiento. Estaríamos ante una anafilaxia que puede ser peligrosa para la vida si no se trata a tiempo. Por ello hay que administrar de forma rápida adrenalina intramuscular, además de corticoides y antihistamínicos orales y se debe acudir de inmediato a urgencias para una valoración por el equipo médico y completar el tratamiento si fuera necesario.
La alergia al veneno de avispa o de abeja puede diagnosticarse mediante una prueba de punción cutánea y/o con una analítica en sangre de anticuerpos en suero (IgE).
Una vez diagnosticada la alergia a veneno de himenópteros y con antecedentes de reacción anafiláctica, la vacuna con veneno es el único tratamiento existente para prevenir futuros episodios y evitar las reacciones. Además, goza de muy buena reputación entre los pacientes pues claramente mejora su calidad de vida.
Los riesgos de reacción alérgica a picaduras de himenópteros en niños diagnosticados de alergia a su veneno, se incrementan durante los meses de verano debido al mayor tiempo que pasan al aire libre. El campo, la piscina y todos aquellos lugares con mucha vegetación o aguas estancadas son el ambiente ideal para este tipo de insectos.
Para evitar que estas picaduras se produzcan, sobre todo durante el verano, lo aconsejable es evitar en la medida de lo posible la proximidad a los nidos de avispas o abejas. Además, es recomendable que el niño no ande descalzo por el césped, sacudir la ropa antes de ponérsela, comprobar que los asientos, vasos u otros utensilios están limpios de insectos, evitar que lleven ropas llamativas o colonias y cremas muy perfumadas en el campo o tener los cubos de basura bien cerrados en lugares con vegetación.
Dra. Paula Méndez Brea. Médico adjunto del Servicio de Alergología. Complexo hospitalario universitario De Santiago de Compostela. Comité de Alergia Infantil SEAIC
Bibliografía:
Tankersley M, Ledford D. Stinging Insect Allergy: State of the Art 2015. J Allergy Clin Immunol Pract 2015;3(3):315-22.
Krishna M, Ewan P, Diwakar L, et al. Diagnosis and management of hymenoptera venom allergy: British Society for Allergy and Clinical Immunology (BSACI) guidelines. Clin Exp Allergy 2011;41(9):1201-20.
Karabus S. Hypersensitivity to stinging insects. Curr Allergy Clin Im 2012;25(3):132-8.
Nevot Falcó S, Ferré Ybarz L. Hipersensibilidad a veneno de himenópteros. Protoc Diagn Ter Pediatr 2013;1:135-44.
Lange J, Cichocka-Jarosz E, Marczak H, et al. Natural history of Hymenoptera venom allergy in children not treated with immunotherapy. Ann Allergy Asthma Immunol 2016;116(3):225-9.
Bilo MB, Bonifazi F. The natural history and epidemiology of insect venom allergy: Clinical implications. Clin Exp Allergy. 2009;39(10):1467-76.
Sturm GJ, Varga E-M, Roberts G, et al. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy. 2017;00:1–20.
Sturm GJ el al. EAACI guidelines on allergen immunotherapy: Hymenopteravenom allergy. Allergy . 2018;73(4):744-764.
Actualización en Anafilaxia (guía GALAXIA)
Recientemente, se ha presentado en el Congreso de la Sociedad Española de Alergología e Inmunología Clínica, la tercera actualización de la Guía Galaxia, un documento de posicionamiento sobre el diagnóstico y el tratamiento de la anafilaxia, en esta edición se presentan novedades relevantes como la perspectiva del paciente y la implicación de la sociedad para la creación de ambientes seguros.
La anafilaxia es la presentación clínica aguda más grave de una reacción alérgica y puede comprometer la vida del paciente, es una emergencia médica que requiere de una actuación inmediata, con el reconocimiento de la clínica y un tratamiento precoz, y de un manejo a medio y, largo plazo que incluya medidas de educación y prevención, en algunos casos se puede conseguir la curación, como la anafilaxia por veneno de himenópteros, o en algunas alergias alimentarias
Todo paciente que ha sufrido una anafilaxia debe ser derivado a un especialista de Alergología para realizar un estudio completo, confirmar el desencadenante sospechoso, prevenir nuevos episodios, evaluando la posibilidad del paciente de volver a desarrollarlos y recibir información, y un tratamiento adecuado.
El paciente diagnosticado de anafilaxia debe ser valorado por el especialista
por lo menos una vez al año, y en esa consulta se le debe explicar y dar por escrito:
- Normas estrictas de evitación de los alérgenos (sustancias que provoca la reacción alérgica) implicados o sospechosos que incluyan los alergenos específicos y su reactividad cruzada con otros productos, esta información debe ser revisada en cada visita
- Educación para el reconocimiento precoz de los síntomas típicos de la anafilaxia incluyendo un plan de actuación que indique al paciente que tratamiento administrar dependiendo de la clínica que presente en el momento de la reacción, y que le permita una actuación lo más rápida posible, para evitar un desenlace fatal
- Educación y entrenamiento sobre el uso de autoinyectores de adrenalina. En los siguientes casos es necesario llevar dos dispositivos: si hay coexistencia de asma inestable o moderada-grave persistente y alergia a alimentos, si hay coexistencia de enfermedad mastocitaria y/o triptasa basal elevada, falta de acceso rápido a asistencia sanitaria por barreas geográficas o idiomáticas, requerimiento previo de más de una dosis antes de llegar a un hospital, reacción previa casi mortal, dosis del autoinyector inferior a la calculada por peso del paciente. Se deben administrar de forma precoz.
Existe un uso deficiente de los autoinyectores, por escasa información, miedo o aversión al tratamiento intramuscular, dificultades económicas o afectación en la calidad de vida por la dificultad de llevarlo consigo. Los padres, tutores y docentes deben estar entrenados en su uso en el caso de los niños. El alergólogo debe informar de que la adrenalina tiene una vida útil corta, por lo que se debe revisar la fecha de caducidad y la reposición de los dispositivos caducados
- Recibir información sobre las enfermedades o tratamientos (comorbilidades) que pueden provocar una sintomatología más grave, o disminuir la atención del paciente ante los síntomas. El asma mal controlada, las enfermedades cardiovasculares, algunos fármacos como los betabloqueantes, los IECA (inhibidores del enzima convertidor de la angiotensina), ansiolíticos, pueden aumentar el riesgo de desarrollar una anafilaxia fatal
- Medidas de prevención: Tratamientos que pueden curar o mitigar la sensibilización a alérgenos específicos, como la inmunoterapia oral con alimentos en casos seleccionados, desensibilización a fármacos, o inmunoterapia con venenos de himenópteros. Llevar una pulsera o tarjeta de identificación médica en la cartera, recomendar llevar teléfono móvil si el paciente está solo
También es labor de los especialistas, pacientes, y asociaciones de pacientes impulsar medidas de salud pública, como exigir la mejora del etiquetado de los alimentos, exigir planes de acción en colegios, restaurantes ( información disponible y accesible para los ingredientes del alimento no envasado) y centros de ocio ( recomendar espacios alergoprotegidos que dispongan de lo necesario para asistir a una persona que sufra un episodio de anafilaxia ) e intentar conseguir que en edificios públicos, centros de ocio , y comerciales se disponga de autoinyectores de adrenalina, como ahora se dispone de desfibriladores.
Se aconseja al lector visualizar los siguientes videos sobre
Auto inyectores de adrenalina:
Anapen: https://youtu.be/8I-r_ftcUMc
Jext:: https://youtu.be/QDXRhZBNjFw
Altellus: https://www.epinefrina.es/es-es/epinefrinaguide?userstate=public#
Emerade: https://youtu.be/NzyNoUeiu9o
Dra. M.ª Isabel Alvarado Izquierdo. Alergóloga del Complejo Hospitalario Universitario de Cáceres. Miembro del Comité de Alergia Infantil de la SEAIC
CÓMO ENFRENTARSE A UNA EPIDEMIA DE BRONQUIOLITIS Y EL ASMA INFANTIL.
Hemos superado una pandemia en los últimos años de un virus respiratorio que nos ha traído de cabeza y cuando estábamos “descuidados” nos encontramos con que nuestros niños ahora están “en peligro”. ¿Es así?, ¿nos debemos preocupar los padres/madres? ¿Y si nuestros hijos tienen asma?, ¿hay algo que podamos hacer?
Tenemos las UCI pediátricas y los servicios de urgencia saturados con casos de esta enfermedad respiratoria. Se ha estimado que hasta un 40% más que en años anteriores a la pandemia. Entonces: ¿Qué debemos saber?, ¿podemos prevenir esta infección? ¿Si nuestro hijo/a tiene asma, debemos tener especial precaución?
Esto era algo que podíamos prever, pues hemos pasado 2 años en los que los niños han estado con medidas de aislamiento estrictas que han ido desapareciendo, tales como mascarillas y la distancia social, han estado menos expuestos a virus y ahora, se enfrentan de nuevo a los virus típicos de estas fechas: la bronquiolitis, que aunque es una enfermedad epidémica y por tanto, todos los años hay muchos casos, este año parece que se están detectando con mayor frecuencia; la gripe, que se trata de otra enfermedad epidémica y se puede solapar con la anterior y además la Covid-19. Y los 3, pueden solaparse y darse en la misma época.
La bronquiolitis es una enfermedad de la vía respiratoria inferior que suele darse en menores de 2 años y que es causada fundamentalmente por el virus respiratorio sincitial (VRS) aunque también pueden influir otros virus respiratorios. Las pequeñas vías respiratorias bajas llamadas bronquios y bronquiolos se inflaman debido a esta infección, se llenan de moco y esto causa dificultad respiratoria. Suele ocurrir en los meses de invierno pero también puede tener un pico en los meses de primavera. Llamamos “bronquiolitis” al primer episodio y el resto ya serían episodios de “bronquitis”.
Lo primero que debemos saber es que no debemos alarmarnos a priori. Nos preocuparían sobre todo los niño/as más pequeñitos, fundamentalmente entre 2 y 6 meses o aquellos con algún factor de riesgo (inmunodeprimidos, prematuros, enfermedades cardiológicas, asma no controlada…) pero debemos ser conscientes, que aunque no existe un tratamiento específico, podemos tomar ciertas medidas para “prevenir” o tratar de la forma más adecuada. Generalmente en niños mayores y adultos, el cuadro suele pasarse como un simple cuadro catarral leve con mucosidad.
Ya que no existe un tratamiento específico, pues sobre todo en lactantes muy pequeños, los broncodilatadores no son eficaces, y no se trata con antibióticos, puede ser que estos niños precisen de oxigenoterapia y tengan que acudir a urgencias y que ingresar en el hospital. De ahí el “colapso” de urgencias y la atención hospitalaria. La buena noticia es que recientemente la Comisión Europea acaba de aprobar un anticuerpo monoclonal, llamado nirsevimab, que ha demostrado eficacia y seguridad en la prevención de enfermedad e ingreso por VRS para toda la población de recién nacidos y lactantes sanos o con enfermedades previas, aunque todavía no es de uso generalizado y habrá que esperar, por el momento, en la mayoría de casos.
Debemos estar atentos a las señales de alarma: decaimiento, falta de apetito, adormecimiento, fiebre de varios días que no cede (aunque no siempre tiene que haber fiebre) que puede significar una sobreinfección bacteriana, respiración superficial con taquipnea y tiraje subcostal (respiración rápida, podemos ver como las costillas suben y el abdomen sube y baja) y ante éstas, acudir a nuestro pediatra o médico especialista, y establecer las medidas de confort más adecuadas (tenerlos nutridos e hidratados, antitérmicos en caso de fiebre, etc).
Para prevenir estas infecciones podemos realizar lavado frecuente de manos, evitar el contacto con personas que presenten síntomas de catarro (no visitar o coger a niños de riesgo o bebés muy pequeños si tenemos un leve catarro aunque sea con síntomas leves) o evitar espacios con humo de tabaco, entre otras.
El 50% de los niños que tienen un episodio de bronquiolitis tiene más probabilidades de sufrir nuevos episodios de bronquitis y tener bronquitis de repetición, aunque normalmente conforme van creciendo y sobre todo a partir de los 3 años estos cuadros se reducen y dejan de ocurrir. Esto no quiere decir que todos vayan a ser asmáticos con el tiempo, pero evidentemente, habrá que vigilar y seguir su curso para ver evolución, pues un pequeño porcentaje de estos niños podrán desarrollar un asma infantil en el futuro.
En el caso de niños con episodios de broncoespasmos de repetición y/o asma debemos tener la precaución de mantener su tratamiento de base en el caso de que lo tengan, bien con inhaladores u otros fármacos, seguir las instrucciones en cuanto al tratamiento del pediatra o especialista (alergólogo, neumólogo) que les trate y establecer las medidas anteriormente descritas.
En definitiva, mucho ánimo a esos padres y madres que se enfrentan a esta época de virus; recomendando información veraz y actualizada y trabajo en equipo, padres/madres y personal sanitario.
Margarita Tomás Pérez. Médico adjunto de Alergología. Hospital Universitario La Paz. Comité de Alergia Infantil. SEAIC
1-. Susana Rodríguez M. Bronchiolitis in the year of COVID-19. Arch Argent Pediatr.2020;118(3):222-223.
2-. Gómez C, Alarcón G, Cifuentes L. Beta-2 agonists for the treatment of bronchiolitis. Beta-2 agonistas para el tratamiento de bronquiolitis. Medwave. 2020;20(8):e7945. Published 2020 Sep 3. doi:10.5867/medwave.2020.08.7947.
3-. Hammitt LL, Dagan R, Yuan Y, Baca Cots M, Bosheva M, Madhi SA, et al;MELODY Study Group. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022;386(9):837-846.
4-. Garcia-Garcia ML, Calvo Rey C, Rabes T. Pediatric Asthma and viral infection. Arch Bronconeumol. 2016; 52(5): 269–273.
Más allá de la piel
La dermatitis atópica es una condición dermatológica cuya cronicidad afecta la calidad de vida de pacientes pediátricos y de sus cuidadores.
A menudo nuestros esfuerzos terapéuticos se centran en tratar lo más visible, olvidándonos o subestimando las heridas y cicatrices más profundas e invisibles.
El artículo “Skin Disease in Children: Effects on Quality of Life, Stigmatization, Bullying, and Suicide Risk in Pediatric Acne, Atopic Dermatitis, and Psoriasis Patients” se centra en investigar las consecuencias emocionales que pueden desencadenaralgunas patologías dermatológicas crónicas, entre ellas la dermatitis atópica.
El peso emocional de la dermatitis atópica es más extenso que el prurito que puede manifestar. La carga emocional producida por la percepción negativa de la propia imagen corporal dificulta las relaciones sociales con otros coetáneos o incluso con los familiares más cercanos.
Los padres u otros familiares manifiestan a menudo sensación de frustración, agotamiento, culpabilidad e impotencia que inconscientemente puede repercutir en la relación con el menor y alterar las dinámicas familiares.
Se ha observado que pacientes los pediátricos con dermatitis atópica sufren alteraciones del comportamiento (mayor dependencia, aflicción, trastornos del sueño) similares a las que pueden padecer los pacientes pediátricos con otras enfermedades crónicas de mayor afectación sistémica.
El prurito les limita no sólo en sus casas, sino también fuera, en las actividades de ocio y extraescolares. Les exponen a actos de bulling que a veces conllevan a estados de ansiedad e incluso depresión que, en ocasiones, por suerte raras, pueden conducir a ideas autolíticas e intento de suicidio.
Para frenar esa deriva es necesario implantar herramientas para aquellas figuras que a todos los niveles son referencia en la vida del menor:
- A los padres, cuidadores principales, hay que educarles sobre los diferentes aspectos de la enfermedad y ofrecerles herramientas saludables para saber resolver conflictos y asegurar una armonía familiar.
- A los educadores hay que instruirles para que sean capaces de desarrollar un ambiente escolar que ofrezca apoyo al menor. Programas escolares dirigidos a entrenar al profesorado a reconocer precozmente actos de bulling y favorecer la inclusión y relación entre compañeros.
- A los médicos para que seamos capaces de tratar el paciente de manera global y no sólo las lesiones físicas de la enfermedad. Para que no nos limitemos en la apariencia del cuadro cutáneo, sino investigando también componentes emocionales, derivar a otros especialistas si fuera necesario, o poniendo en contacto al paciente y la familia con otros pacientes que sufran o haya sufrido de la misma condición. Además de intentar una decisión compartida médico-paciente de la mejor línea terapéutica que tenga en cuenta las prioridades del paciente, y así fortalecer la relación médico-paciente.
Concluyendo, la dermatitis atópica es una patología con gran impacto en todos los niveles de la vida del paciente, tanto físico como psicológicos. Se necesita de una visión multidisciplinar que incluya a todas las figuras capaces de mejorar la calidad de vida del paciente y limitar las afecciones de la dermatitis atópica, que va “mas allá de la piel”.
Nicola Giangrande, Hospital público da Mariña, Burela, Lugo. Comité de Alergia Infantil. SEAIC.
Reacciones adversas a vacunas en la era COVID-19
Las vacunas son elementos fundamentales en las estrategias de salud pública, pues ayudan a reducir la expansión, morbilidad y mortalidad asociadas a las enfermedades infecciosas. La vacunación es importante no sólo a nivel individual, sino también a nivel poblacional. Los programas de vacunación COVID-19 son un ejemplo del gran valor de esta estrategia de salud pública a todos los niveles.
Se administran millones de dosis de vacunas al año en todo el mundo, siendo el riesgo de reacciones adversas bajo y, en el caso de reacciones alérgicas graves como la anafilaxia, el riesgo es aún menor. Esta baja incidencia de reacciones adversas observadas, incluso en las nuevas vacunas COVID-19, es otra de las razones para no retrasar o cancelar la administración de posteriores dosis.
Las reacciones a vacunas pueden ser de tipo alérgico o no alérgico, y ser debidas tanto al agente infeccioso que contienen como a alguno de los componentes utilizados en el proceso de fabricación de esa vacuna.
El estudio alergológico sólo es necesario en aquellas personas con historia de alergia a uno de los componentes de la vacuna que se desea administrar o que hayan presentado reacción alérgica con una vacuna en el pasado. El análisis detallado de la composición y el estudio alergológico adecuado, pueden ayudar a identificar el alérgeno responsable y el riesgo individual de sufrir una reacción posterior.
Recientemente hemos publicado una revisión donde se recogen los tipos y riesgos de reacciones adversas asociados con las vacunas anti-infecciosas, incluidas las nuevas vacunas COVID-19. Nuestro estudio también proporciona pautas para el diagnóstico preciso de estas reacciones e indicaciones para la administración controlada de nuevas dosis.
El objetivo final es mejorar la seguridad individual, asegurar la vacunación del mayor número posible de personas y que las personas con alergia puedan ser vacunadas en la misma medida que el resto de la población, ofreciéndoles alternativas si es necesario.
Todos estos enfoques podrían ayudar a eliminar barreras a la vacunación en personas con reacciones adversas a vacunas y a planificar su administración de manera segura.
Acceso al artículo completo en el siguiente enlace: https://link.springer.com/article/10.1007/s40521-022-00311-8
Dra. Patricia Prieto Montaño. Facultativo Especialista Alergología. Hospital General Universitario Albacete. Comité de Alergia Infantil SEAIC
Actualización de la “Hipótesis de la exposición dual al alérgeno”
La prevalencia de la alergia alimentaria ha aumentado dramáticamente en las últimas dos décadas a nivel mundial, lo que indica que los factores ambientales pueden estar impulsando la progresión de la enfermedad.
Actualmente sabemos que factores como el estilo de vida, los hábitos dietéticos y las interacciones materno-neonatales juegan un papel fundamental en el desencadenamiento de la alergia alimentaria, incluida la composición cualitativa y cuantitativa de la microbiota. Estos factores parecen tener una mayor influencia en las primeras etapas de la vida, observación que ha llevado a la generación de diversas hipótesis para explicar la epidemia de alergia alimentaria en la que nos vemos actualmente inmersos y que incluye la “hipótesis de la exposición dual al alérgeno”.
Clásicamente, se creía que la alergia alimentaria se originaba en el intestino, a través de un fallo en los mecanismos de tolerancia oral. Sin embargo, la observación de que la mayoría de los alérgicos a cacahuete reaccionaban durante la primera exposición oral, llevó a los investigadores a plantear que la sensibilización podría producirse por vías distintas a la vía oral.
La ruta de sensibilización cutánea a alérgenos alimentarios se ha establecido con fuerza en la última década y, actualmente, se está proponiendo la vía respiratoria como otra interesante y potencial ruta de sensibilización a los alérgenos alimentarios.
La “hipótesis de la exposición dual al alérgeno” (a través de la piel y el intestino) se basa en la observación de que los bebés con eczema tienen un alto riesgo de desarrollar alergia alimentaria mediada por IgE. Esta hipótesis establece que el contacto con alérgenos a través de la piel eccematosa puede causar sensibilización alérgica, mientras que es más probable que la exposición a través del tracto gastrointestinal induzca tolerancia inmunológica.
Esta hipótesis evolucionó al profundizar en el conocimiento de la alergia al cacahuete. De esta manera, se determinó que la exposición oral a los alérgenos del cacahuete conduce a tolerancia oral, mientras que la exposición a través de la piel, en ausencia de exposición oral previa, conduce a alergia.
Un ensayo clínico histórico, LEAP (N Engl J Med 2015), demostró claramente que la administración oral temprana y regular de proteínas de cacahuete, en bebés sensibilizados de alto riesgo y no sensibilizados, redujo drásticamente la incidencia de alergia a cacahuete en niños de 5 años, en comparación con bebés que evitaron la ingestión de cacahuete.
Estos hallazgos respaldan la “hipótesis de la exposición dual al alérgeno” y enfatizan la importancia de la exposición oral temprana al cacahuete antes de que pueda ocurrir la sensibilización a través de rutas alternativas.
Años más tarde, los mismos autores (JACI 2018) concluyen, en un nuevo estudio, que el consumo temprano de cacahuete en lactantes con alto riesgo de alergia al cacahuete es alérgeno específico y no previene el desarrollo de otras enfermedades alérgicas ni la sensibilización a otros alérgenos alimentarios o aeroalérgenos, y que el consumo de cacahuete no acelera la resolución del eczema o la alergia al huevo.
Kulis y cols (JACI 2021) proponen una actualización de la “hipótesis de la exposición dual”, con la vía respiratoria como otra potencial ruta de sensibilización a los alérgenos alimentarios. Así, las células dendríticas tanto de la vía respiratoria como de la piel atópica, migran a los ganglios linfáticos regionales donde presentan el alérgeno alimentario a las células T (CD4+) vírgenes que, en un ambiente rico en citocinas innatas, se diferenciarán a TH2 con la producción de citocinas específicas que activarán a los linfocitos B para producir IgE específica de antígeno, mientras que, por el contrario, cuando la exposición inicial se produce por vía oral, las células dendríticas presentan el antígeno alimentario a los linfocitos T (CD4+) vírgenes en los ganglios linfáticos mesentéricos, en un ambiente tolerogénico característico del tracto gastrointestinal, que hará que se diferencien en linfocitos T reguladores, favoreciendo así la tolerancia alimentaria.
En los países en los que la alergia a cacahuete es muy prevalente, y donde el consumo es frecuente, parece que existe una fuente ambiental de cacahuete en el polvo doméstico, así como también en comedores y aulas escolares, donde los niños pasan la mayor parte del tiempo, pudiendo ser inhaladas. Las proteínas de cacahuete dentro del polvo parecen estar estructuralmente intactas y se ha demostrado que contienen epítopos de unión a IgE. Estos autores han demostrado, mediante estudios realizados en ratones y en células humanas, que la vía aérea es una vía factible de sensibilización a alérgenos alimentarios.
No obstante, en la actualidad se desconoce si la sensibilización ocurre exclusivamente a través de una ruta o una combinación de rutas, aunque los autores propugnan que esto difiere entre individuos. Además, no está claro si la exposición por ruta no oral al cacahuete ambiental puede promover la tolerancia en algunas personas. De hecho, los estudios en animales han demostrado que, tanto en la vía respiratoria como en la cutánea, la exposición a antígenos en condiciones no inflamatorias puede inducir tolerancia, y la inmunoterapia epicutánea se está investigando como tratamiento para la alergia al cacahuete.
Los autores defienden que los estudios futuros deben centrarse en el papel de la exposición de las vías respiratorias y la sensibilización a otros alimentos, ya que también se han detectado otras proteínas alimentarias como proteínas de leche y huevo en el polvo doméstico.
Además, no debemos olvidar que, otros factores ambientales como los contaminantes del aire, pueden desempeñar un papel en la sensibilización de las vías respiratorias, dado que las tasas urbanas de alergia alimentaria son más altas que las tasas en las zonas rurales.
Por lo tanto, los autores demuestran, mediante estudios realizados en ratones y en células humanas, que la vía respiratoria puede tener un papel en la “hipótesis de la exposición dual al alérgeno”, al igual que la ruta cutánea. Por último, alientan al desarrollo de nuevas investigaciones, ya que quedan muchas preguntas por resolver, y defienden que la modulación de los componentes ambientales (microbioma, proteoma, metaboloma del entorno doméstico), incluida la eliminación del cacahuete del medio ambiente antes de la exposición oral, podría conducir a la prevención de la alergia alimentaria.
Angélica Feliú Vila. Hospital del Tajo, Aranjuez, Madrid. Comité de Alergia Infantil SEAIC
BIBLIOGRAFÍA
1.- Heine RG. Food Allergy Prevention and Treatment by Targeted Nutrition. Ann Nutr Metab. 2018;72 Suppl 3:33-45. doi: 10.1159/000487380. Epub 2018 Apr 9. PMID: 29631274.
2.- Renz H, Allen KJ, Sicherer SH, Sampson HA, Lack G, Beyer K, Oettgen HC. Food allergy. Nat Rev Dis Primers. 2018;4:17098. doi: 10.1038/nrdp.2017.98. PMID: 29300005.
3.- Wang S, Wei Y, Liu L, Li Z. Association Between Breastmilk Microbiota and Food Allergy in Infants. Front Cell Infect Microbiol. 2022;11:770913. doi: 10.3389/fcimb.2021.770913. PMID: 35096637; PMCID: PMC8790183.
4.- Du Toit G, Roberts G, Sayre PH, Bahnson HT, Radulovic S, Santos AF, Brough HA, Phippard D, Basting M, Feeney M, Turcanu V, Sever ML, Gomez Lorenzo M, Plaut M, Lack G; LEAP Study Team. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med. 2015;372(9):803-13. doi: 10.1056/NEJMoa1414850. Epub 2015 Feb 23. Erratum in: N Engl J Med. 2016 Jul 28;375(4):398. PMID: 25705822; PMCID: PMC4416404.
5.- Du Toit G, Sayre PH, Roberts G, Lawson K, Sever ML, Bahnson HT, Fisher HR, Feeney M, Radulovic S, Basting M, Plaut M, Lack G; Immune Tolerance Network Learning Early About Peanut Allergy study team. Allergen specificity of early peanut consumption and effect on development of allergic disease in the Learning Early About Peanut Allergy study cohort. J Allergy Clin Immunol. 2018;141(4):1343-53. doi: 10.1016/j.jaci.2017.09.034. Epub 2017 Oct 31. PMID: 29097103; PMCID: PMC5889963.
6.- Michael D. Kulis, Johanna M. Smeekens, Robert M. Immormino, Timothy P. Moran. The airway as a route of sensitization to peanut: An update to the dual allergen exposure hypothesis. Journal of Allergy and Clinical Immunology. 2021. 148(3);689-693.
7.- McGowan EC, Bloomberg GR, Gergen PJ, Visness CM, Jaffee KF, Sandel M, O’Connor G, Kattan M, Gern J, Wood RA. Influence of early-life exposures on food sensitization and food allergy in an inner-city birth cohort. J Allergy Clin Immunol. 2015;135(1):171-8. doi: 10.1016/j.jaci.2014.06.033. Epub 2014 Aug 13. PMID: 25129677; PMCID: PMC4440482.
ESOFAGITIS EOSINOFÍLICA EN PACIENTES PEDIÁTRICOS
La esofagitis eosinofílica (EoE) se considera una enfermedad crónica emergente; en la actualidad, ha pasado a ser una de las condiciones más comunes en la valoración y diagnóstico de problemas alimentarios en niños así como en la evaluación de disfagia y/o impactación en la edad adulta.
Se ha estudiado más extensamente en países occidentales, pero, aunque existen datos de prevalencia, se precisan estudios más amplios para consensuar datos epidemiológicos reales. Una revisión sistemática reciente mostró que la prevalencia poblacional de esofagitis eosinofílica en niños es 19,1 casos por 100.000 niños/año (1), con gran variabilidad de los datos según la localización geográfica y, probablemente, de otros factores como el diseño del estudio, los criterios diagnósticos utilizados, etc.
Fisiopatogénicamente se caracteriza por una inflamación Th2 en la que intervienen mecanismos mixtos mediados y/o no mediados por IgE dando lugar a una inflamación eosinofílica en el epitelio esofágico que origina una disfunción del mismo, dando lugar a los síntomas clínicos característicos.
En la población pediátrica los síntomas más prevalentes son los vómitos, dolor abdominal, disfagia, odinofagia e impactación del bolo alimenticio. Estas características clínicas difieren también según la edad del niño, siendo en niños más pequeños (2-8 años) más frecuente: el fallo de medro, rechazo del alimento, dolor abdominal, vómitos, trastornos del sueño, etc. En niños mayores y adolescentes los síntomas se asemejan más a los adultos, presentando disfagia, impactación, odinofagia, regurgitación, etc.
La prueba de oro para el diagnóstico es la toma de biopsias tanto de esófago proximal como distal (aumentando así el rendimiento del estudio) mediante una endoscopia digestiva. Esta técnica precisa de la sedación del paciente, lo que supone un “inconveniente” sobre todo en población pediátrica. Por ello se están estudiando otras técnicas menos invasivas como:
– Prueba del hilo esofágico (EST: esophageal string test), técnica basada en cápsulas que capturan las proteínas asociadas a los eosinófilos de la luz esofágica.
–Citoesponja: tecnología basada también en cápsulas, diseñada originalmente para la evaluación de la mucosa esofágica en el esófago de Barrett.
– Endoscopia transnasal sin sedación.
Estas técnicas y algunas otras en estudio también, podrían tener un papel importante en el control regular de la esofagitis, pero es muy poco probable que reemplacen la confirmación de un diagnóstico dudoso y/o actos terapéuticos realizables durante una endoscopia convencional como una dilatación.
Las opciones terapéuticas, ambas consideradas de primera línea son: tratamiento dietético y farmacológico:
– Terapias dietéticas: la fórmula de aminoácidos se describe como una terapia eficaz en niños con EoE, lo que indica la implicación de antígenos dietéticos en su patogenia. Se han descrito diversos enfoques dietéticos: dieta elemental, dieta dirigida según sensibilización alergénica, dietas empíricas, etc. La dieta de eliminación es una opción no farmacológica de primera línea para el manejo de la EoE; sin embargo, el orden y el número de antígenos específicos a evitar, así como su posterior reintroducción sigue siendo un área activa de investigación.
– Corticoides tópicos: este tipo de fármaco actúa a diversos niveles en esta patología: vías/genes inducidos por IL-13, reducción de la eosinofilia esofágica e infiltración mastocitaria, regulación a la baja de los genes de los mastocitos, reducción de células T y citocinas proinflamatorias como el factor de necrosis tumoral (TNF), etc. Los metanálisis realizados utilizando fluticasona o budesonida demuestran la superioridad de los corticoides frente a placebo para la eosinofilia esofágica, los hallazgos endoscópicos y los síntomas tanto en pacientes adultos como pediátricos. No están exentos de efectos adversos como puede ser la candidiasis, insuficiencia suprarrenal, etc. Los estudios abogan por una terapia que debe ser mantenida a largo plazo por la alta tasa de recaídas tras su retirada. Sigue en estudio la dosis y duración óptima de cada terapia.
– Tratamiento con inhibidores de la bomba de protones (IBP): la tasa de respuesta varía ampliamente desde un 30 a un 70%.Están en estudio las posibles diferencias fisiopatológicas entre la EoE sensible y/o resistente a los IBP. Algunos ejemplos incluyen:
– Técnicas de biología molecular demuestran que la expresión del transcrito para el canal de potasio Kir2.1 (gen KCNJ2) es menor en los pacientes que responden a los IBP. Si se valida, esto podría proporcionar una detección potencial para terapias personalizadas.
– Los pacientes con rinitis alérgica y metabolizadores rápidos CYP2C19 tienen un mayor riesgo de pérdida del control de la EoE a pesar de la terapia continua con IBP.
– Dilatación esofágica: destinada a aliviar complicaciones como la estenosis; técnica destinada a modificar cambios estructurales sin alivio histológico.
– Terapias emergentes:
* Nuevas formulaciones de esteroides: budesonida viscosa, budesonida en comprimidos bucodispersables, etc.
* Tratamientos biológicos: ANTICUERPOS MONOCLONALES
Anti-L5: benralizumab, mepolizumab, reslizumab. Se están realizando estudios para valorar la mejoría tanto clínica como histológica de estos tratamientos, por la involucración de la IL-5 en la infiltración y supervivencia del eosinófilo, sin resultados científicamente concluyentes aún.
Anti-IL13: la IL-13 es un mediador claramente implicado en la patogénesis de la EoE, mediante la activación y quimiotaxis de los eosinófilos a través del aumento de los niveles de eotaxina-3 y periostina. El anticuerpo QAX576 parece reducir los síntomas pero no se ha demostrado efecto significativo en la actividad clínica de la enfermedad; mientras que RPC4046 consigue una reducción significativa de la eosinofilia esofágica y la actividad de la enfermedad endoscópica así como en la reducción de síntomas.
Anti-IL4 y Anti-IL-13: Dupilumab (aprobado por la FDA en > 12 años). Se están llevando a cabo ensayos que parecen demostrar mejoría sintomática, endoscópica e histológica significativa.
Anti-IgE (omalizumab) y Anti-TNF (infliximab). No existe ningún ensayo clínico con evidencia científica que apoye su uso en la EoE.
*Otras dianas moleculares en estudio: Integrina α4β7, Siglec 8, TSLP, TGFβ, canales de calcio, IL- 9, 15 y 33, receptor de eotaxina anti CCR3.
Dra. Guacimara Hernández Santana, Hospital Universitario Nuestra Señora de la Candelaria en Santa Cruz de Tenerife. Comité de Alergia Infantil SEAIC
BIBLIOGRAFÍA:
- Arias A, Perez-Martinez I, Tenias JM, Lucendo AJ. Systematic review with meta-analysis: the incidence and prevalence of eosinophilicesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2016; 43(1): 3-15.
- Alfredo J Lucendo (2019): Pharmacological treatments for eosinophilic esophagitis: current options and emerging therapies, Expert Review of Clinical Immunology, DOI:10.1080/1744666X.2019.1705784
- Nirmala P. Gonsalves, Seema S. Aceves. Diagnosis and Treatment of Eosinophilic Esophagitis. J Allergy Clin Immunol. 2020 January ; 145(1): 1–7.
- Thomas Greuter, Ikuo Hirano, Evan S. Dellon. Emerging therapies for eosinophilic esophagitis. J Allergy Clin Immunol. 2020 January ; 145(1): 38–45.
- Arianna De Matteis et al. Eosinophilic Esophagitis in Children: Clinical Findings and Diagnostic Approach.Current Pediatric Reviews, 2020, 16, 206-214.
¡Tengo alergia al sol!
¡Cuántas veces escuchamos esta frase en esta época del año en la que nuestra exposición solar ha sido máxima! Son muchos los pacientes que ante reacciones cutáneas coincidiendo con la exposición solar se refieren a ellas como “alergia al sol”. Aunque es un término científicamente incorrecto, se refiere a aquellas fotodermatosis (reacciones anormales o adversas de la piel a la luz ultravioleta o la radiación visible) en las que subyace un mecanismo inmunológico.
Entre ellas, la erupción polimorfa lumínica es la entidad más frecuente, afectando al 10-20% de la población occidental. Aparece sobre todo en mujeres jóvenes y es más típico en las primeras exposiciones solares del año (primavera), mejorando a medida que la estación soleada avanza (tras exposiciones repetidas al sol y la progresiva melanización de la piel).
Se caracteriza por brotes repetidos de lesiones cutáneas pruriginosas con localización predominante en aquellas zonas de mayor exposición solar: cara, cuello, zona alta del tórax, caras laterales de antebrazos y cara anterior de las piernas.
Las lesiones pueden ser de distinto tipo (de ahí el término polimorfismo): pápulas, pápulo-vesículas, eccema, placas, erosiones o costras; aunque, en un paciente individual, las lesiones son normalmente monomórficas y simétricas, apareciendo habitualmente a las pocas horas de exposición al sol.
Las reacciones agudas requerirán el tratamiento sintomático acorde con la gravedad del cuadro. Los antihistamínicos ayudarán a controlar el prurito; aunque, en ocasiones, puede ser necesario el uso de corticoides sistémicos. Sin embargo, lo más importante es prevenir la aparición de la erupción mediante fotoprotección adecuada (ropa, protección solar UVA y UVB). Si con ello no se consigue evitar la aparición de los brotes, se puede llevar a cabo una terapia de “desensibilización mediante fototerapia” con radiación UVB de banda estrecha (UVB-BE) para conseguir el endurecimiento (hardening) de la piel. Se basa en ir acostumbrando poco a poco a nuestra piel a la exposición al sol (fototolerancia), mediante la aplicación de cursos cortos de UVB-BE desde principios de la primavera y durante varias semanas, hasta alcanzar niveles que permitan al paciente tolerar exposiciones solares diarias de 15-20min de duración. Además, en adultos jóvenes, que viajan de vacaciones a zonas soleadas, se ha comprobado que la realización de ciclos cortos (6-7 días) de corticoides sistémicos (prednisona 0,6-0,8 mg/kg/día) es útil en la prevención de aparición de brotes.
Entre las fotodermatosis que afectan con más frecuencia a población infantil, se encuentra la erupción primaveral juvenil, considerada una variedad localizada de la erupción polimorfa lumínica, de origen desconocido y que afecta más frecuentemente a varones entre 5 y 12 años. Cursa con pápulas eritematosas pruriginosas que aparecen típicamente durante la primavera en el hélix de las orejas que no está cubierto por pelo. Pueden evolucionar a vesículas y costras sin dejar lesiones residuales o solo mínimas cicatrices.
También el hidroa vacciniforme, aunque es una afección rara, se suele dar en niños menores de 10 años, mejorando hacia la edad adulta. Algunos autores consideran que se trata de una variante cicatricial de la erupción polimorfa lúminica. Consiste en brotes recurrentes de lesiones vesiculosas, de contenido viscoso, seroso o hemorrágico, que evolucionan a costras y escaras negruzcas que se desprenden, dejando lesiones cicatriciales varioliformes, deprimidas e hipopigmentadas. Suelen darse cada verano en las partes descubiertas del cuerpo tras la exposición a la luz solar. Su localización más frecuente es en orejas, nariz, dedos, mejillas, dorso de manos o antebrazos y, a veces, puede afectar también a ojos y cuero cabelludo, con efectos adversos importantes sobre la calidad de vida de los niños. Se desconoce la patogenia, aunque se ha asociado a infecciones por virus de Epstein-Barr, y puede evolucionar a linfoma.
Otras fotodermatosis menos frecuentes en niños son el prurigo actínico, la dermatitis actínica crónica o la urticaria solar.
Todas ellas se engloban dentro de este grupo de fotodermatosis inmunológicamente mediadas conocido coloquial- y erróneamente bajo el único nombre de “alergia solar”. Sin embargo la patogenia y clínica de cada una de ellas es diferente y por tanto su tratamiento. Por ello es importante acudir al especialista quien establecerá un diagnóstico preciso y con ello el tratamiento más adecuado.
Dra. Paula Cabrera Freitag, Hospital Universitario Gregorio Marañón de Madrid. Comité de Alergia Infantil SEIAC
Bibiliografía:
- Barceló JM, Rosillo MR, Muñoz C. Fotodermatosis. En IJ Dávila, I Jáuregui, JM Olaguibel y JM Zubeldia, eds. Tratado de Alergología. 2ª ed. Madrid: Ergon, 2016, 889-912.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses. Part 1: pathophysiology and technical aspects of photobiologic studies. Actas Dermosifiliogr. 2014 Mar;105(2):112-21.
- De Argila D, Aguilera J, Sánchez J, García-Díez A. Study of idiopathic, exogenous photodermatoses, part II: photobiologic testing. Actas Dermosifiliogr. 2014 Apr;105(3):233-42.
- Gruber-Wackernagel A, Byrne SN, Wolf P. Polymorphous light eruption: clinic aspects and pathogenesis. Dermatol Clin. 2014 Jul;32(3):315-34
EL CONSUMO DE CARNES “EXÓTICAS” PUEDE SER PELIGROSO EN PACIENTES CON ALERGIA A PESCADO
Los múltiples beneficios del pescado han generado un ascenso en su consumo en los últimos años. Este incremento se ha acompañado a su vez de un aumento de la prevalencia de alergia a este alimento, estimándose que afecta al 3% de la población, aunque con diferencias geográficas relacionadas con los hábitos de consumo. La alergia aparece en la primera infancia en la mayoría de estos casos y puede persistir hasta la edad adulta.
Los pescados se dividen en dos grandes grupos: cartilaginosos y óseos. Dentro de este último grupo existen más de 32.400 especies. Las identificadas hasta el momento se clasifican en los órdenes: clupeiforme, cypriniforme, gadiforme, perciforme, salmoniforme, siluriforme y pleuronectiforme.
El principal alérgeno del pescado es la parvalbúmina que contiene dos isoformas: β-parvalbúmina (mayores concentraciones en pescados óseos) y α-parvalbúmina (mayores concentraciones en pescados cartilaginosos). También se han caracterizado otros alérgenos como las enolasas, aldolasas, colágeno, tropomiosina y vitelogenina, aunque con menor relevancia alergénica en la mayoría de los casos.
Basados en la prevalencia de sensibilización a β-parvalbúmina (IgE específica detectable en el 95% de los pacientes alérgicos a pescado), la recomendación habitual es la evitación del consumo de todas las especies, lo que desencadena importantes restricciones dietéticas. Afortunadamente, la capacidad de un pescado de generar una reacción alérgica es específica de su especie y del individuo afectado. Es así como se han descrito casos de mono sensibilización a especies de pescados, ej. Pacientes que reaccionan tras consumo de bacalao pero toleran atún y/o salmón. Pacientes alérgicos a más de una especie, toleraran en muchos casos túnidos en conserva.
Considerando todas las variantes de la alergia a pescado y la dificultad en predecir estas múltiples posibilidades diagnósticas, el estudio alergológico dirigido por el especialista es fundamental. Este estudio contará con pruebas cutáneas y serológicas que servirán para guiar a las pruebas de provocación oral. Las pruebas de provocación oral tendrán la finalidad de confirmar tolerancia a otras especies dependiendo de las preferencias de consumo individuales.
La comparación de secuencias de aminoácidos de la β-parvalbúmina de más de 4.000 vertebrados sugiere que existe un alto porcentaje de reactividad cruzada entre pescado, cocodrilo, serpientes, lagartos y sapos. Así mismo, se ha descrito reactividad cruzada entre el pescado y la carne de pollo en pacientes no sensibilizados a huevo (síndrome pescado-pollo), en estos se ha detectado sensibilización a alérgenos “menores”: enolasas y aldolasas además de parvalbumina.
La reactividad cruzada entre cocodrilo y pescado es de 60% y es secundaria principalmente a α-parvalbúmina. En 2022, Ruethers et al, publicaron una casuística de pacientes alérgicos a pescados con reacciones graves a cocodrilo en los que se detectaban ambas isoformas de la parvalbúmina (α y β). Concluyen que esta proteína se encuentra en la carne de cocodrilo a suficiente concentración como para provocar reacciones, en ocasiones graves, en aquellos pacientes previamente sensibilizados a pescado. Con el incremento de los viajes y la globalización, cada vez más individuos consumen carnes antes consideradas “exóticas”. En este sentido, los pacientes con alergia a pescados deben proceder con precaución a la hora de consumir estas carnes y en los casos de síntomas graves tras consumo de pescado, consultar al alergólogo previamente.
Andreina Marques-Mejias
Hospital Universitario La Paz, Madrid. Comité de Alergia Infantil SEAIC
Department of Women and Children’s Health – Paediatric Allergy, School of Life Course Sciences, Faculty of Life Sciences and Medicine, King’s College London. Children’s Allergy Service, Evelina London, Guy’s and St Thomas’ Hospital, London, UK.
Referencias
- Buyuktiryaki B, Masini M, Mori F, Barni S, Liccioli G, Sarti L, Lodi L, Giovannini M, du Toit G, Lopata AL, Marques-Mejias MA. IgE-Mediated Fish Allergy in Children. Medicina (Kaunas). 2021 Jan 18;57(1):76.
- Kuehn A, Swoboda I, Arumugam K, Hilger C, Hentges F. Fish allergens at a glance: variable allergenicity of parvalbumins, the major fish allergens. Front Immunol. 2014;5:179.)
- Mourad AA, Bahna SL. Fish-allergic patients may be able to eat fish. Expert Rev Clin Immunol. 2015;11:419-430.
- Sicherer, Scott H., and Hugh A. Sampson. “Food allergy.” Journal of allergy and clinical immunology 125.2 (2010): S116-S125.
- Lopata, A.L.; O’Hehir, R.E.; Lehrer, S.B. Shellfish allergy. Clin. Exp. Allergy 2010, 40, 850–858.
- Kuehn A, Swoboda I, Arumugam K, Hilger C, Hentges F. Fish allergens at a glance: variable allergenicity of parvalbumins, the major fish allergens. Front Immunol. 2014;5:179)
- Hilger C, Thill L, Grigioni F, et al. IgE antibodies of fish allergic patients cross-react with frog parvalbumin. Allergy. 2004;59:653-660
- Hamada Y, Nagashima Y, Shiomi K. Reactivity of serum immunoglobulin E to bullfrog Rana catesbeiana parvalbumins in fish-allergic patients. Fish Sci. 2004;70:1137-1143.
- Kuehn A, Codreanu-Morel F, Lehners-Weber C, Doyen V, Gomez-André SA, Bienvenu F, Fischer J, Ballardini N, van Hage M, Perotin JM, Silcret-Grieu S, Chabane H, Hentges F, Ollert M, Hilger C, Morisset M. Cross-reactivity to fish and chicken meat – a new clinical syndrome. Allergy. 2016 Dec;71(12):1772-1781.
- Ruethers T, Nugraha R, Taki AC, et al. The first reptilian allergen and major allergen for fish-allergic patients: Crocodile β-parvalbumin. Pediatr Allergy Immunol. 2022;33:e13781.
- Severe anaphylaxis due to crocodile-meat allergy exhibiting wide cross-reactivity with fish allergens. Haroun-Díaz E, Blanca-López N, et al. J Allergy Clin Immunol Pract.2017 Sep 8. pii: S2213-2198(17)30540-8. doi: 10.1016/j.jaip.2017.07.015
- Anaphylactic Reactions to Novel Foods: Case Report of a Child With Severe Crocodile Meat Allergy. Ballardini N, Nopp A,et al. 2017;139(4): e2016140.
Mapa de inmunoterapia con alimentos en Europa
La relevancia tanto en términos de prevalencia, como en impacto socioeconómico de la alergia a alimentos está creciendo no solo en España, sino en todo el mundo, afectando a millones de pacientes. Hasta hace apenas dos décadas, la única solución para este problema era la identificación del agente causal, su evitación y la aplicación del tratamiento adecuado en caso de producirse un contacto accidental.
Sin embargo, en las últimas décadas, la comunidad científica ha puesto mucho esfuerzo en el desarrollo de terapias activas para tratar a los pacientes con alergia alimentaria, siendo la más relevante la inmunoterapia con alimentos. Estos esfuerzos han sido liderados mediante proyectos de investigación y ensayos clínicos que, a medida que iban publicándose, se aplicaban en la práctica clínica diaria de algunos centros europeos.
Actualmente la inmunoterapia con alimentos, especialmente la inmunoterapia por ruta oral, se ha consolidado como un tratamiento eficaz y ya se incluye en las guías de la EAACI como tratamiento indicado en pacientes con alergia persistente a leche, huevo o cacahuete en centros con experiencia. Este paso adelante se ha visto reforzado por la reciente comercialización en Estados Unidos del primer producto para tratar la alergia a cacahuete con inmunoterapia oral. Sin embargo, el tratamiento, aunque eficaz, sigue siendo objeto de debate debido a su controvertido perfil de seguridad y su implementación en la práctica clínica diaria aún plantea ciertos dilemas.
En este contexto, desde el Board of Pediatrics de la EAACI se puso en marcha un grupo de trabajo con el objetivo de saber el nivel de implementación del tratamiento en Europa, y poder hacer una valoración del grado de experiencia que atesora el continente ante la probable alta expansión que sufrirá la aplicación del tratamiento fuera del ensayo clínico en los próximos años.
La metodología consistió en identificar a través de abstracts a congresos europeos y nacionales de los últimos 5 años, centros en los que se practicase la inmunoterapia, además de identificar autores en la literatura. Adicionalmente, se enviaron 3 rondas de emails desde la secretaría de la EAACI a todos los miembros, para intentar identificar más centros con experiencia. Los voluntarios participaron rellenando una encuesta extensa sobre la práctica general de la inmunoterapia, y más específica sobre la práctica de la inmunoterapia con leche, huevo y cacahuete.
Un total de 102 centros en 18 países en toda Europa participaron en el proyecto. El primer dato llamativo es la gran disparidad en la distribución por todo el territorio, siendo España el país con un mayor número de centros (n=39), seguido de Francia (n=16) e Italia (n=7), y con una escasísima representación en países con una gran población como por ejemplo Alemania, con un solo centro. Se indagó sobre la experiencia en el tratamiento de alergia a alimentos menos estudiados habitualmente, y se encontró un interesante patrón geográfico marcado por los hábitos de consumo. En el sur de Europa, se trataba con frecuencia la alergia a melocotón, en el centro de Europa la alergia a la avellana, y en el norte la alergia a pescados. La experiencia acumulada estimada de pacientes tratados para todos los alimentos identificados es 24,875 pacientes, lo que se puede considerar una cifra muy baja, teniendo en cuenta la prevalencia global de la alergia a alimentos.
El perfil de un centro “medio” europeo que realiza inmunoterapia con alimentos es un servicio que trabaja en la sanidad pública (80,4% de los centros identificados), que lleva 9 años realizando el tratamiento y ha tratado aproximadamente a 100 pacientes en total, por ruta oral eminentemente. El tratamiento se aplica de rutina en la práctica clínica habitual en el 80,4% de los centros, principalmente en hospitales terciarios (77,5%). El número de médicos medio por centro es de 3 alergólogos/pediatras y 2 enfermeras con todo el equipo médico necesario para atender eventuales reacciones. El 98% de los centros realizan pruebas de exposición oral previa al inicio de la inmunoterapia, y evaluaciones alternativas relevantes de la eficacia, como son el estudio de la calidad de vida o la tolerancia mantenida (sustained unresponsiveness) solo se realizan en el 20,6% y 54,9% de los centros, respectivamente. Las alergias alimentarias más frecuentemente tratadas en los centros son alergia a leche y huevo (91,2% y 78,4%, respectivamente), mientras que la implementación de la inmunoterapia con cacahuete no llega a la mitad de los centros (46,1%).
En conclusión, más allá de la disparidad de procedimientos, entornos y experiencia de los centros identificados, y teniendo en cuenta que no todos los centros europeos han participado en el proyecto, debemos reflexionar sobre si los recursos sanitarios están preparados para asumir la alta demanda de tratamiento prevista en los próximos años.
Por último, querría agradecer profundamente a todos los centros españoles que colaboraron en este estudio y que dedicaron tiempo a completar la encuesta. Muchas gracias a todos vosotros.
Pablo Rodríguez del Río, Facultativo especialista de área en Alergia Hospital Niño Jesús, Madrid, España. Comité de Alergia Infantil
REFERENCIAS RELEVANTES:
.- Hossny E, Ebisawa M, El-Gamal Y, et al. Challenges of managing food allergy in the developing world. World Allergy Organ J. 2019;12(11):100089.
.- Pajno GB, Fernández-Rivas M, Arasi S, et al. EAACI Guidelines on allergen immunotherapy: IgE-mediated food allergy. Allergy.2018;73(4):799-815
.- Chu KD, Wood RA, French S et al. Oral immunotherapy for peanut allergy (PACE): a systematic review and meta-analysis of efficacy and safety. Lancet. 2019 Jun 1;393(10187): 2222-2232
.- Rodríguez del Río P, Álvarez-Perea A, Blumchen K, et al. Food immunotherapy practice: Nation differences across Europe, The FIND project. Allergy. 2021; 00:1–13. https://doi.org/10.1111/all.15016
¿Y entonces qué hacemos con el perro?
Actualmente, más de la mitad de los hogares europeos conviven con al menos una mascota; durante la pandemia SARS CoV2 se observó un incremento del censo de animales domésticos en los países desarrollados, siendo los perros, junto a los gatos, los animales que más conviven dentro del hogar.
 En el caso de los perros, su función de cuidador o ayudante en el trabajo diario ha cambiado a la de ser un miembro más de la familia, con el que se establecen vínculos emocionales y de dependencia; no en vano las mascotas son reconocidas en España con un estatuto jurídico desde enero de 2022 como “seres vivos dotados de sensibilidad”, garantizándoles el derecho a cuidados y bienestar (1).
En el caso de los perros, su función de cuidador o ayudante en el trabajo diario ha cambiado a la de ser un miembro más de la familia, con el que se establecen vínculos emocionales y de dependencia; no en vano las mascotas son reconocidas en España con un estatuto jurídico desde enero de 2022 como “seres vivos dotados de sensibilidad”, garantizándoles el derecho a cuidados y bienestar (1).
Según Alergológica 2015, los epitelios ocupan el tercer lugar en orden de frecuencia como causa de rinoconjuntivitis alérgica, siendo el perro (9,9%), tras el gato (12,5%), el agente etiológico más común en la población española estudiada. Se describe además, que el porcentaje de alérgicos a ácaros y/o pólenes es superior en los pacientes que conviven con animales con respecto a los pacientes que no tienen un animal en su domicilio. En la población pediátrica de ese estudio, un 36,2% de los niños convivían con animales domésticos, el 24,3% de ellos con perros, y mostraron un aumento en la prevalencia de la rinitis alérgica por epitelios con respecto a los estudios previos – Alergológica 2005 – por lo que es probable que la exposición sea un factor precipitante de este incremento (2).
Los síntomas habituales de la alergia a animales suelen ser los que afectan a las vías respiratorias; sin embargo, los animales pueden producir síntomas cutáneos asociados tras contacto directo con el animal por alérgenos de su epitelio, caspa, glándulas linguales y parótida (saliva), y próstata (orina). Los alérgenos del perro son muy ubicuos, pudiendo estar presentes no solo en el domicilio donde habitan, sino en lugares muy diversos tales como áreas comunes, oficinas, autobuses, metro, aviones etc., debido, probablemente, a su transporte por personas que conviven con ellos a través de su ropa y accesorios.
Los alérgenos del perro más estudiados son (3,4):
- Lipocalinas: Can f 1 (alérgeno mayoritario y especifico de sensibilización primaria), Can f 2, Can f 4 y Can f 6. Son proteínas estables con una gran reactividad cruzada entre ellas, cuya función es el transporte de ligandos lipofílicos como: hormonas, vitaminas, ácidos grasos y feromonas, permitiendo su unión a receptores de superficie celular.
- Albúmina (Can f 3): proteínas con gran homología entre diferentes especies animales, por lo cual tienen una alta reactividad cruzada entre ellas; se ha descrito que la sensibilización inicial a Can f3 puede estar relacionada en la progresión a polisensibilización a otros animales.
- Calicreína prostática (Can f 5): es considerado un alérgeno mayoritario, siendo una arginina-esterasa relacionada con la producción prostática, exclusiva de perros machos. Posee reactividad cruzada con el antígeno seminal prostático humano (PSA) con el que comparte una homología mayor al 50%, y se ha relacionado con alergia a líquido seminal humano pudiendo tener a su vez un papel importante en los casos de infertilidad.
- Proteína secretora epididimal (Can f 7): relacionada con proteínas NCP2 (Niemman Pick tipo 2),se ha implicado en el reconocimiento de lípidos de patógenos y transporte intracelular de colesterol. Su función exacta en los perros sigue sin estar clara.
- Cistatinas (Can f 8): actúa como inhibidor de cistein-proteasas.
La frecuencia de sensibilización a los alérgenos mayoritarios (Can f1 – Can f5) varía según las diferentes regiones geográficas y, aunque puede haber diferencias entre razas, todos los perros producen proteínas alergénicas. Los perros hipoalergénicos, o que se publicitan como tales, suelen considerarse así porque mudan menos pelo o son criados para producir menor cantidad de Can f 1; sin embargo, no eliminan la posibilidad de exposición a saliva y otros alérgenos menores no relacionados con los epitelios, por lo cual la disponibilidad de que una raza de perro sea realmente hipoalergénica es cuestionable (5).
Es muy frecuente la sensibilización simultánea con otros animales (principalmente el gato). En efecto, un 75% de los pacientes sensibilizados a una mascota tiene hasta 14 veces más de probabilidad de sensibilizarse a otra, lo que puede deberse a la homología y/o similitud estructural, como sucede con las albúminas y lipocalinas del perro y el gato, motivo de la reactividad cruzada entre ambos animales y otros como los roedores, los equinos, incluso con las aves. (5)
 El diagnóstico molecular en la alergia a animales ha permitido un conocimiento individualizado del perfil de sensibilización, lo que ha traído múltiples beneficios como mejorar la presunción diagnóstica, distinguiendo la reactividad cruzada de la co-sensibilización, permitir el reconocimiento de biomarcadores de riesgo en cuanto a gravedad de los síntomas y optimizar la indicación de inmunoterapia, posibilitando también reconocer componentes asociados a reacciones adversas durante la misma, e incluso llegar a predecir su efectividad. (6)
El diagnóstico molecular en la alergia a animales ha permitido un conocimiento individualizado del perfil de sensibilización, lo que ha traído múltiples beneficios como mejorar la presunción diagnóstica, distinguiendo la reactividad cruzada de la co-sensibilización, permitir el reconocimiento de biomarcadores de riesgo en cuanto a gravedad de los síntomas y optimizar la indicación de inmunoterapia, posibilitando también reconocer componentes asociados a reacciones adversas durante la misma, e incluso llegar a predecir su efectividad. (6)
Uriarte y cols., (6) demostraron que la sensibilización a 2 o más alérgenos de perro se asociaba a asma grave, y la sensibilización a Can f 1 y Can f 5 a rinitis persistente. Estos datos son similares a los reportados por Dávila y cols., (7), quienes también observaron que los pacientes con asma o rinitis aisladas causada por epitelios son escasos, y que al mismo tiempo un tercio de ellos tenían no solo urticaria de contacto, sino también un alto porcentaje de co-sensibilización a pólenes y ácaros.
 Sin embargo, en la actualidad hay datos que sugieren que la exposición temprana (durante el primer año de vida) a perros y/o a gatos, puede asociarse a una disminución del riesgo de asma alérgica, mientras que si la exposición se da tras ese periodo puede incrementar el riesgo a desarrollarla; estas observaciones parecen solo estar relacionadas con perro y gatos, y no se ha visto con otros animales como los roedores, cuya exposición temprana parece que puede incluso incrementar el riesgo a asma no alérgica. (5,8). Tampoco hay suficiente evidencia para predecir si la sensibilización a perros está asociada a alergia clínica; no obstante, la sensibilización a Can f1 asociada al Feld1 de gatos sí se ha asociado a un mayor riesgo de alergia posterior a ambos.
Sin embargo, en la actualidad hay datos que sugieren que la exposición temprana (durante el primer año de vida) a perros y/o a gatos, puede asociarse a una disminución del riesgo de asma alérgica, mientras que si la exposición se da tras ese periodo puede incrementar el riesgo a desarrollarla; estas observaciones parecen solo estar relacionadas con perro y gatos, y no se ha visto con otros animales como los roedores, cuya exposición temprana parece que puede incluso incrementar el riesgo a asma no alérgica. (5,8). Tampoco hay suficiente evidencia para predecir si la sensibilización a perros está asociada a alergia clínica; no obstante, la sensibilización a Can f1 asociada al Feld1 de gatos sí se ha asociado a un mayor riesgo de alergia posterior a ambos.
En cuanto a la dermatitis atópica no es posible establecer conclusiones. Algunos estudios hablan de un incremento en la gravedad de la dermatitis, no solo asociados a la exposición al perro, sino también tras el estrés psicológico que puede ocasionar el deshacerse de la mascota. Al igual que con la rinitis y el asma, también se ha descrito que la exposición a perros desde el nacimiento podría disminuir hasta en un 25% el riesgo de padecer dermatitis atópica, asociándolo a que, al ser miembro de la familia, los perros pueden compartir microbiota intestinal con sus convivientes, lo que podría alterar desde temprana edad la microbiota intestinal de los niños, sirviendo de medida protectora para el desarrollo de eczemas; sin embargo los datos actuales en cuanto a la implicación en la dermatitis en los niños expuestos son bastante contradictorios. (5,9)
Algunos estudios demuestran una disminución de los niveles de IgE específica frente a perro tras su retirada del domicilio, pero sin cambios significativos con respecto a la intensidad de los síntomas tras nuevos contactos también se ha descrito que algunos pacientes pueden presentan una menor respuesta clínica tras la exposición continua a los alérgenos del perro. Por otra parte, sigue sin estar claro si la sensibilización a perros es un factor de riesgo para sensibilización a otro neumoalérgenos, aunque en un estudio Park et al (10) describen un mayor riesgo de alergia a ácaros en paciente adultos que tienen o han tenido un perro en la infancia, sobre todo para el género de Dermatophagoides.
 El manejo de los pacientes con alergia a epitelios incluye la posibilidad de retirar la fuente alergénica (perro) del hogar, siendo ésta la medida que ha mostrado más beneficio, pero para su efectividad, al igual que la administración de lociones tópicas en el pelaje del perro, debe realizarse de manera combinada con la evitación del alérgeno y de manera sostenida en el tiempo; esto es difícil debido a la ubicuidad de los alérgenos del animal y no aseguran un beneficio clínico en la progresión de la enfermedad. Además, no debemos menospreciar el impacto emocional de retirar el animal del domicilio, lo que puede hacer en la mayoría de los casos inviable esta medida. Asimismo, aunque con evidencia poco consistente, se ha descrito que en pacientes monosensibilizados a Can f 5 la esterilización de perros machos puede aportar algún beneficio. (5,11)
El manejo de los pacientes con alergia a epitelios incluye la posibilidad de retirar la fuente alergénica (perro) del hogar, siendo ésta la medida que ha mostrado más beneficio, pero para su efectividad, al igual que la administración de lociones tópicas en el pelaje del perro, debe realizarse de manera combinada con la evitación del alérgeno y de manera sostenida en el tiempo; esto es difícil debido a la ubicuidad de los alérgenos del animal y no aseguran un beneficio clínico en la progresión de la enfermedad. Además, no debemos menospreciar el impacto emocional de retirar el animal del domicilio, lo que puede hacer en la mayoría de los casos inviable esta medida. Asimismo, aunque con evidencia poco consistente, se ha descrito que en pacientes monosensibilizados a Can f 5 la esterilización de perros machos puede aportar algún beneficio. (5,11)
Otra herramienta en el tratamiento es la inmunoterapia alérgeno específica (principalmente por vía subcutánea) que, en estudios limitados en pacientes con rinitis y asma, ha demostrado en pacientes con alergia a perro: mejoría de los síntomas y puntuación en los cuestionarios de la calidad de vida, reducción del tamaño de las pruebas cutáneas y aumento de los valores de FEV1 e IgG4 específicas, además de la disminución del uso de medicación de rescate. Sin embargo, es de resaltar que la eficacia clínica está limitada a la calidad de los extractos, a la variabilidad y complejidad del perfil alergénico de muchos pacientes y al gran porcentaje de co-sensibilización a otros alérgenos como pólenes, ácaros e incluso otros animales, constituyendo dichos factores una desventaja en el manejo actual de esta patología. (5,12)
Hilda Rianec Hernández Suárez. Hospital Universitario de Gran Canaria Dr. Negrín. Comité de Alergia Infantil
Bibliografía
- Jefatura del Estado. Ley 17/2021, de 15 de diciembre, de modificación del Código Civil, la Ley Hipotecaria y la Ley de Enjuiciamiento Civil, sobre el régimen jurídico de los animales [Internet]. Sec. 1, Ley 17/2021 dic 16, 2021 p. 154134-43. Disponible en: https://www.boe.es/eli/es/l/2021/12/15/17
- SEAIC. Alergologica 2015 [Internet]. Draft Grupo de Comunicación Healthcare; Disponible en: https://www.seaic.org/inicio/en-portada/alergologica-2015.html
- Alergias a gatos y perros [Internet]. Alliance Allergy. Disponible en: https://allianceallergy.com/diagnosticos-resueltos-por-componentes-para-la-enfermedad-alergica/alergias-a-gatos-y-perros/?lang=es
- Chan SK, Leung DYM. Dog and Cat Allergies: Current State of Diagnostic Approaches and Challenges. Allergy Asthma Immunol Res. marzo de 2018;10(2):97-105.
- Dávila I, Domínguez-Ortega J, Navarro-Pulido A, Alonso A, Antolín-Amerigo D, González-Mancebo E, et al. Consensus document on dog and cat allergy. Allergy. 2018;73(6):1206-22.
- Uriarte SA, Sastre J. Clinical relevance of molecular diagnosis in pet allergy. Allergy. 2016;71(7):1066-8.
- Dávila I, Isidoro-García, María. Perfiles clínicos y de sensibilización molecular en la alergia al epitelio de perro. 2017;11.
- Al-Tamprouri C, Malin B, Bill H, Lennart B, Anna S. Cat and dog ownership during/after the first year of life and risk for sensitization and reported allergy symptoms at age 13. Immun Inflamm Dis. 2019;7(4):250-7.
- Song SJ, Lauber C, Costello EK, Lozupone CA, Humphrey G, Berg-Lyons D, et al. Cohabiting family members share microbiota with one another and with their dogs. Weigel D, editor. eLife. 16 de abril de 2013;2:e00458.
- Park Y-B, Mo E-K, Lee J-Y, Kim J-H, Kim C-H, Hyun I-G, et al. Association Between Pet Ownership and the Sensitization to Pet Allergens in Adults With Various Allergic Diseases. Allergy Asthma Immunol Res. septiembre de 2013;5(5):295-300.
- Uriarte S, Sastre J. Subcutaneous Immunotherapy With High-Dose Cat and Dog Extracts: A Real-life Study. J Investig Allergol Clin Immunol. 18 de junio de 2020;30(3):169-74.
- Uriarte S, Grönlund H, Wintersand A, Bronge J, Sastre J. Clinical and immunologic changes due to subcutaneous immunotherapy with cat and dog extracts using an ultrarush up-dosing phase: a real-life study. J Investig Allergol Clin Immunol. Disponible en: http://www.jiaci.org/ahead-of-print/clinical-and-immunologic-changes-due-to-subcutaneous-immunotherapy-with-cat-and-dog-extracts-using-an-ultrarush-up-dosing-phase–a-real-life–study
Ventajas del diagnóstico molecular frente a Ses i 1 y test de activación de basófilos en el diagnóstico de alergia a sésamo.
La prevalencia de alergia a sésamo (Sesamum indicum) se está incrementado a nivel mundial, en buena parte debido al uso cada vez mayor de esta semilla como parte de la dieta Mediterránea.
Se estima que la incidencia de alergia a sésamo en EEUU es del 0,2% (1). En 2021 se hizo pública una actualización legislativa referente a la declaración del sésamo como alérgeno y a la obligatoriedad de etiquetarlo en los productos que se exporten a EE.UU.
Además de las semillas de sésamo, en alimentación se emplea su aceite como saborizante y decorativo de las comidas preparadas. Puede encontrarse sésamo en margarinas, productos de panadería y bollería, chips, galletas y otros productos de aperitivo, comidas preparadas, etc. Además, la exposición a sésamo puede pasar inadvertida en la medida en que se utiliza también para la elaboración de perfumes, cosméticos, lubricantes, insecticidas o fungicidas.
El aceite de sésamo se ha empleado incluso como disolvente para inyecciones intramusculares, fomentos, emulsiones, suspensiones farmacológicas y preparaciones oftálmicas (3).
En 2005 se aprobó en nuestro país el Real Decreto 2220/2004 en el que se obligaba a que en el etiquetado de los alimentos se informase de la presencia de 12 alérgenos, ampliado a 14 en 2006. El actual reglamento Europeo, en vigor desde el 13 de diciembre de 2014, obliga a que no solo los productos envasados informen de la presencia de alérgenos, sino también los distribuidos en bares, hospitales, restaurantes, colegios y los vendidos a granel y a distancia.
La legislación actual debería contribuir a reducir el potencial riesgo de reacciones anafilácticas tras exposiciones inadvertidas a sésamo y al mismo tiempo incrementar las pruebas de detección de trazas del mismo en los alimentos.
Por tanto, el incremento en el consumo de productos derivados de sésamo y la frecuencia de reactividad cruzada de esta semilla con frutos secos, hace que sea fundamental diferenciar entre individuos sensibilizados, pero tolerantes, de los verdaderamente alérgicos.
Goldberg y cols. (2) evaluaron las ventajas del uso combinado del diagnóstico molecular (IgE frente a Ses i 1, albumina 2S, alérgeno mayoritario del sésamo) y del test de activación de basófilos (TAB) en una cohorte de 42 pacientes con sospecha de alergia a sésamo, con el fin de minimizar el número de pruebas de exposición oral .
Estas pruebas diagnósticas fueron validadas mediante prueba de exposición oral en todos los pacientes excepto en 1 que había presentado una reacción anafiláctica que requirió ingreso hospitalario en los 9 meses previos al estudio alergológico.
Se realizaron pruebas cutáneas con un extracto de sésamo de alta concentración proteica (100 mg/mL), determinaciones de IgE sérica específica frente a extracto completo de sésamo y frente a Ses i 1 (ImmunoCAP, Thermo Fisher Scientific) (niveles por debajo de 0,1 KU/L se consideraban negativos). Para el TAB se utilizaron CPA anti CD63 para detectar activación de basófilos (pacientes con menos del 10% de basófilos expresando CD63 en su superficie eran considerados no respondedores).
El 64% (27/42) de los pacientes fueran considerados alérgicos a sésamo, bien por una prueba de exposición oral controlada positiva (26), o por el antecedente de una reacción grave documentada tras su ingestión (1). La dosis umbral para la prueba de exposición fue de 120 mg de media de proteína de sésamo. Los síntomas mayoritariamente referidos fueron gastrointestinales (56%), respiratorios (41%) y cutáneos (37%). El tratamiento con adrenalina fue necesario en el 15% (4/26) de los pacientes. Respecto a la gravedad de la reacción, el 41% experimentaron una reacción grado 1, el 7% grado 2 y el 52% grado 3, sin que se hubiese ninguna reacción grado 4.
Se evaluó la precisión de las 4 pruebas (IgE frente a Ses i 1, IgE frente al extracto completo de sésamo, TAB y prick test con un extracto altamente concentrado de sésamo), para el diagnóstico de alergia a sésamo. La media de IgE frente a Ses i 1 de los pacientes alérgicos fue de 6,8 kUA/L (1,8-39) vs 0,85 kUA/L (0-1,2) en los no alérgicos (p=0,0001). El TAB-CD63 fue del 56% vs 1,6% (p=0,0001) y el prick test fue de 11 mm (10-15 mm) vs 6 (4,5-11) (p=0,0008) para los alérgicos comparado con los no alérgicos respectivamente.
El análisis de la curva ROC de cada una de estas pruebas proporcionó unos niveles de precisión diagnóstica (AUC) de 0,87+/- 0,07 para el TAB, 0,88+/-0,05 para la IgE frente a Ses i 1; 0,84+/-0,06 para la IgE frente al extracto completo de sésamo y 0,82+/-0,07 para el prick test.
El uso INDIVIDUAL de la IgE frente a Ses i 1 utilizando el punto de corte de 2,01 KU/L (valor predictivo positivo (VPP) del 95%) condujo al diagnóstico en 21 de los 42 pacientes, con 1 falso positivo. Un abordaje dual clasificando al paciente como alérgico (punto de corte > 2,01 KU/L, con un VPP del 95%) y no alérgico (punto de corte < 0,27 KU/L correspondiente a una sensibilidad del 100%), permitía clasificar correctamente a 20 pacientes en alérgicos (verdadero positivo) y 6 no alérgicos (verdadero negativo). Quince pacientes no pudieron ser clasificados en base a este abordaje.
Entre los pacientes alérgicos, la determinación de IgE frente a Ses i 1 se correlacionaba con los resultados del TAB pero no con los del prick. Por tanto, los autores estudiaron un abordaje conjunto de ambas pruebas utilizando el punto de corte del 95% de sensibilidad para cada una de ellas y clasificando a los pacientes como alérgicos si tenían las 2 pruebas positivas y no alérgicos si tenían las 2 negativas. En caso de disparidad entre ambas, los pacientes eran sometido a una prueba de exposición.
Utilizando ambas pruebas, se obtuvo una clasificación correcta para 25 de los 27 pacientes alérgicos con un VPP del 93%.
A pesar de las limitaciones del estudio, el uso conjunto de la determinación serológica de Ses i 1 y el TAB podría ser útil para el diagnóstico de alergia a sésamo, obviando la prueba de exposición y los riesgos que ésta conlleva en un alto porcentaje de pacientes. No obstante, antes de su incorporación en la práctica clínica, deberían realizarse estudios prospectivos con un mayor número de pacientes para validar estos hallazgos en diferentes poblaciones.
Sandra Blanco Bermejo. Hospital Universitario Infanta Elena (Valdemoro). Comité de Alergia Infantil
Bibliografía:
- JB Ziegler et al. Sesame: an increasingly popular Word and common food allergen. J Allergy Clin Immunol Pract 2020;8(5):1689-1691.
- MR Golberg et al. Combinatorial advantage of Ses i 1-specific IgE and basophil activation for diagnosis of sesame food allergy. Pediatr Allergy Immunol 2021:32:1482-1489.
- Steinman H. Legumes, Nuts and Seeds. Allergy, which allergens? ImmunoCAP Phadia 2008.
Consejos para disfrutar de las navidades a pesar de la alergia alimentarias
Como sabemos, la temporada navideña suele estar llena de alegrías e ilusiones, pero puede resultar una época estresante y un desafío si su hijo padece de alergias alimentarias, ya que representa un momento especialmente crítico al aumentar el riesgo de sufrir una reacción alérgica. Los motivos pueden ser diversos:
- Celebraciones fuera del hogar, que conllevan un menor control sobre la manipulación y preparación de los alimentos.
- Menús navideños que incluyen alimentos que causan con frecuencia reacciones alérgicas como el huevo, la leche, frutos secos, pescados, mariscos y frutas, presentes en muchos platos y productos consumidos durante las fiestas, por lo que el riesgo de ingestión accidental por parte de los niños es mayor.
- No disponer de un etiquetado con la información completa y detallada de los alérgenos que contienen los productos que se consumen.
- En esta época se ingieren alimentos que no se toman de forma habitual en la dieta el resto del año, por lo que los niños tendrán contacto por primera vez con ellos.
- En la mesa se sirve una amplia variedad de platos, lo cual aumenta el riesgo de contaminación cruzada cuando existe una alergia alimentaria.
Por todas estas circunstancias, es necesario extremar las precauciones que se deben seguir y adaptar los platos que se preparen a las necesidades de los niños para evitar reacciones alérgicas. Con la intención de que los padres se sientan más seguros y preparados para minimizar los riesgos durante las Navidades, recopilamos las siguientes recomendaciones:
- Si han decidido viajar, deben tener muy en cuenta una serie de factores como la gastronomía, el medio de transporte, el idioma y la atención sanitaria del país de destino.
- Si deciden acudir a un restaurante, deben leer con atención la carta de alérgenos e informar a su camarero sobre las alergias alimentarias. Si lo considera necesario, solicite hablar con el gerente y/o el cocinero para que no tenga ninguna duda de que la cocina ha sido informada y resolver cualquier inquietud.
- Si es en tu casa: aunque implique mayor esfuerzo, ganarás en seguridad y tranquilidad, ya que decidirás el menú y tendrás el control en la elección de los ingredientes, preparación y manipulación de los alimentos que se servirán.
- Si os invitan a comer fuera, comuníquese con anticipación con el anfitrión, es importante que la persona que organiza la comida conozca las alergias de su hijo, así como las medidas de prevención necesarias en la manipulación y preparación de los alimentos.
- Ofrézcase a colaborar con el anfitrión en la creación y adaptación de un menú seguro, incluyendo preferiblemente recetas que no contengan los alimentos implicados, garantizando de esta manera que no se produce su ingestión accidental. Las asociaciones de pacientes con alergias alimentarias ofrecen en sus páginas web recetas alternativas para satisfacer necesidades dietéticas específicas o por categorías libres del alérgeno alimentario.
- Debe leer correctamente los etiquetados: es importante conocer la composición detallada de todos los productos que se van a consumir para identificar los alérgenos que contienen.
- Evitar la exposición por inhalación: algunos niños con alergia alimentaria pueden presentar síntomas cuando respiran los vapores que desprenden algunos alimentos durante su cocción.
- Conocer las medidas de prevención en la preparación de las comidas tales como lavarse las manos antes y después de manipular alimentos, limpiar la superficie de preparación, utilizar recipientes y utensilios diferentes para evitar su contaminación cruzada.
- Al preparar la mesa, mantener los alimentos libres de alérgenos en una ubicación diferente, recuerde usar utensilios para servir por separado cada plato y no usar fuentes compartidas con la intención de evitar contaminación cruzada.
- Controlar los alimentos que se comen por primera vez. En estas fechas se prueban algunos alimentos potencialmente alergénicos y con mucha frecuencia encubiertos.
- Es importante proporcionar al niño con alergia alimentaria un entorno lo más inclusivo posible, brindándole una experiencia que le permita desarrollar más autonomía y ampliar sus habilidades sociales. Las restricciones excesivas (ej: aislamiento a la hora de las comidas o limitar la participación del niño en las celebraciones) podrían resultar en un aislamiento social y sentimientos asociados de depresión o ansiedad.
Por último, además de todas las precauciones anteriores es imprescindible tener en cuenta las siguientes consideraciones generales:
- Es muy importante que sepan reconocer los síntomas de una reacción alérgica y valorar su gravedad, con el fin de instaurar de forma precoz el tratamiento más adecuado.
- Siempre deben disponer del tratamiento para una reacción alérgica como son la adrenalina autoinyectable, antihistamínicos y/o corticoides pautados por su alergólogo.
- Tanto los padres como el niño deben saber reconocer qué alimentos están implicados y deben evitar. La educación del niño sobre su alergia alimentaria es esencial para conseguir evitar reacciones no deseadas.
Las fechas navideñas se acercan, no son pocas las tentaciones que nos empujan a celebrar unas fiestas como las de toda la vida, pero por segundo año consecutivo continúan condicionadas por la pandemia de Coronavirus. Ahora más que nunca, debemos respetar y cumplir las recomendaciones y restricciones en vigor dadas por las autoridades sanitarias frente al COVID 19. Con ello, evitaremos poner en riesgo a nuestras familias y a los demás, ayudándonos a mantenernos seguros mientras disfrutamos de las Navidades.
Dorimar Brugaletta Matheus. Hospital del Vinalopó, Elche, Alicante. Comité de Alergia Infantil SEAIC.
BIBLIOGRAFIA.
- Muraro A, Agache I, Clark A, Sheikh A, Roberts G, Akdis CA, et al. European Academy of Allergy and Clinical Immunology. EAACI food allergy and anaphylaxis guidelines. 2014 Oct: 69(10): 1428. PMID: 24905609. doi: 10.1111/all.12441. Epub 2014 Jun 18.